함양산양삼과 열매 복합물의 항산화 및 항염증 효능에 대한 연구
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
The purpose of this study is to examine the antioxidant effect of hamyang wild-simulated ginseng and ginseng berry complex(HGC) and to investigate the mechanism of anti-inflammatory effect on macrophage cell line (RAW264.7 cells). For antioxidant activity of HGC was measured by total polyphenol contents were estimated with folin-ciocalteu method, and total flavonoid contents were estimated with aluminum chloride methods. And, assessed with 2,2-diphenyl-1-picrylhydrazyl (DPPH) and 2,2'-azino-bis-3-ethylbenzothiazoline-6-sulphonic acid (ABTS) radical scavenging activity assay. MTT assay was performed to determine the effect of HGC on cell viability in RAW264.7 cells. In addition, anti-inflammatory effect of HGC was investigated in RAW264.7 cells. RAW 264.7 cells, in which an inflammatory response was induced by lipopolysarccharide (LPS), were treated with HGC, and nitric oxide production was measured by griess assay. And protein expression level of inflammatory cytokine and phosphorylation of MAPK signaling pathways were confirmed by western blot analysis. Total polyphenols and flavonoids contents in HGC were quantified, and increased DPPH and ABTS radical scavenging activity in a concentration-dependent manner was confirmed. In addition, HGC was significantly inhibited nitric oxide (NO) production and inflammatory cytokine (iNOS, IL-1β, IL-6, and TNF-α) expression in LPS-stimulated RAW264.7 cells. Also, HGC was significantly inhibited the phosphorylation of MAPK signaling pathways. These results suggest that HGC can be used as effective herbal medicine extract for antioxidant and anti-inflammatory effect. As a result, it is thought that HCG can be used as a functional material effective for antioxidant and anti-inflammatory effects. And it will be possible to promote industrialization using hamyang wild-simulated ginseng and ginseng berry, and to increase high-value-added.
Keywords:
Hamyang wild-simulated ginseng, Ginseng berry, RAW264.7, Antioxidant, Anti-inflammatory서 론
모든 세포는 에너지를 생산하기 위해 산화 및 환원과정이 필수적이며, 이를 통해 자유 라디컬이 생성되어 세포 손상을 유도하고 정상적인 세포는 자유 라디컬을 조절하는 항산화능을 갖고있다1,2). 그러나 비정상적인 세포는 이러한 항산화능이 감소되고 산화과정에서 발생된 자유 라디컬을 제거할 수 없어 산화적 손상이 발생한다1,3). 최근 연구를 통해 산화적 손상은 염증 반응과 관련이 있으며, 염증 반응이 당뇨병, 암, 심혈관 질환, 눈 질환, 비만, 자가면역 질환 등을 포함한 다양한 만성 질환의 주요 요인이라는 것이 밝혀졌다4,5).
이러한 염증 반응은 병원체 및 바이러스 등의 침입으로 인해 발생되는 세포 내 생리학적 반응이며, 과정과 기전에 따라 급성 염증과 만성 염증으로 분류할 수 있다5). 급성 염증은 수분에서 수일 내로 지속되는 비교적 짧은 반응으로 활성화된 면역세포에서 cytokine 및 chemokine과 같은 다양한 면역조절인자들을 분비하여 염증 반응을 지속한다6,7). 이러한 cytokine 및 chemokine이 과도하게 분비되고 조절이 되지 않으면 만성 염증으로 발전되어 관절염, 간염, 천식 등을 초래한다8,9). 이렇듯 항산화 기능을 강화하고 염증 반응의 조절하는 것이 중요한 문제이며, 이를 해결하기 위해 항산화 및 항염증 효능이 우수한 천연물을 찾기 위해 다양한 연구들이 진행되고 있다2,6,8).
산양삼(wild-simulated ginseng)이란 두릅나무과(Araliaceae)에 속하는 인삼(Panax ginseng C.A. Meyer)의 씨앗이나 어린 뿌리 모종을 인위적으로 산지에 파종하여 인위적인 시설 없이 자연 그대로의 상태로 재배한 삼을 말하며, 학명은 인삼의 학명과 같다10). 산양삼은 임업진흥법에 의거하여 산지관리법 제2조 제1호의 산지에서 재배하고 제18조의 4에 따른 품질을 관리하는 특별관리 임산물로 분류 되어있다10,11). 산양삼은 재배 인삼에 비하여 진세노사이드(ginsenoside) 함량이 높아 보다 우수한 효능을 인정받고 있으나, 인삼에 비하여 가격이 높고 재배 방법이 어렵기 때문에 약재로만 사용되어 왔으며, 산양삼을 사용한 산업화는 다양하게 이루어지지 못하였다12). 하지만 최근 들어 산양삼에 대한 해외의 관심이 높아지고 산양삼을 통한 가공 산업화 요구가 증가되고 있어 이에 대한 다양한 연구가 필요한 실정이다13).
이에 따라 본 연구에서는 함양산양삼과 열매 복합물을 제작하고 이를 사용하여 총 폴리페놀 및 플라보노이드 함량과 DPPH 및 ABTS 라디컬 소거능을 측정하여 항산화 효능을 확인하였으며, lipopolysaccharides(LPS)로 염증반응이 유도된 RAW 264.7 세포에 복합물을 처리하여 nitric oxide 생성량과 염증성 단백질 발현량을 분석하여 항염증 효능을 확인하였다. 이를 바탕으로 함양산양삼과 산양삼 열매의 산업화 및 고부가가치 제고를 위한 기초 자료를 제공하고자 한다.
재료 및 방법
1. 시료 제작
본 연구에 사용된 함양산양삼과 열매는 농업회사법인 (주)함양산양삼에서 공급받았으며, 함양산양삼과 열매 복합물(Hamyang wild-simulated ginseng and ginseng berry complex, 이하 HGC로 표기)을 제작하기 위해 함양산양삼 100 g과 열매 20 g에 1 L의 증류수를 추가하여 85℃에서 3시간동안 추출하였다. 추출한 추출물은 여과지를 사용하여 여과하였으며, 여과한 추출물은 rotary vacuum evaporator(EYELA, Japan)를 사용하여 감압농축하고 freeze dryer(ilShinbiobase, Korea)를 사용하여 동결건조를 진행하였다. 동결건조 완료 후, 27.81 g(수득률 : 23.18%)의 분말을 획득하였으며, 분말은 –20℃에 보관하면서 실험 당일 소분하고 증류수에 용해시켜 사용하였다.
2. 총 폴리페놀 함량 측정
1 mg/mL 농도의 HGC 1 mL에 50% Folin-Ciocalteu's phenol reagent(Merck Millipore, USA) 0.5 mL를 추가하여 실온에서 3분간 반응시켰으며, 반응 용액에 sodium carbonate(Sigma-Aldrich, USA) 포화용액 1 mL와 증류수 7.5 mL를 차례로 혼합하여 30분간 반응시켰다. 반응시킨 후, micro plate reader(Molecular Devices, USA)의 760 nm 파장에서 흡광도를 측정하였으며, 총 폴리페놀 함량은 gallic acid(Sigma-Aldrich, USA)를 이용하여 작성한 검량선을 바탕으로 정량하였다.
3. 총 플라보노이드함량 측정
1 mg/mL 농도의 HGC 0.1 mL에 80% ethanol(Merck Millipore, USA) 0.9 mL을 혼합하고 10% aluminium nitrate(Sigma-Aldrich, USA)와 1 M potassium acetate(Sigma-Aldrich, USA)를 각각 0.2 mL, 80% ethanol 8.6 ㎖을 추가하여 실온에서 40분간 반응시켰다. 반응시킨 후, micro plate reader의 415 nm 파장에서 흡광도를 측정하였으며, 총 플라보노이드 함량은 quercetin(Sigma-Aldrich, USA)을 이용하여 작성한 검량선을 바탕으로 정량하였다.
4. DPPH 라디컬 소거능 측정
HGC의 농도가 1, 10, 100, 1000 μg/mL가 되도록 희석하였으며, 80% ethanol에 용해시킨 0.2 mM DPPH(2,2-diphenyl-1-picrylhydrazyl; Sigma-Aldrich, USA) 용액 150 μL와 준비한 시료를 100 μL씩 혼합하고 37℃에서 30분간 반응시켰다. 반응시킨 후, micro plate reader의 517 nm 파장에서 흡광도를 측정하였으며, DPPH 라디컬 소거능은 아래의 식을 바탕으로 계산하였다.
5. ABTS 라디컬 소거능 측정
HGC의 농도가 1, 10, 100, 1000 μg/mL가 되도록 희석하였으며, 2.6 mM potassium persulfate(Sigma-Aldrich, USA) 수용액에 용해시킨 0.5 mM ABTS(2,2–azino–bis-(3-ethylbenzothiazoline-6-sulfonic acid); Sigma-Aldrich, USA) 180 μL와 준비한 시료를 20 μL씩 혼합하여 실온에서 10분간 반응시켰다. 반응시킨 후, micro plate reader의 732 nm 파장에서 흡광도를 측정하였으며, ABTS 라디컬 소거능은 아래의 식을 바탕으로 계산하였다.
6. 세포 배양
생쥐 유래 대식세포인 RAW264.7 cell은 한국 세포주은행(Korean Cell Line Bank; KCLB)에서 구입하고 배양하여 사용하였다. RAW264.7 cell의 배양에는 10%의 fetal bovine serum(FBS; Welgene, Korea)와 100 U/mL의 penicillin-streptomycin(Welgene, Korea)이 추가된 dulbecco′s modified eagle′s medium(DMEM; Welgene, Korea) 배지를 사용하였으며, 배양 온도는 37℃, CO2 농도는 5%로 유지되는 세포배양기(Sanyo, Japan)에서 배양하였다.
7. 세포 생존율 측정
48 well plate에 RAW264.7 cell을 2×104 cells/well로 분주하여 배양하였으며, 24시간 후, HGC를 다양한 농도(100, 200, 400, 800 μg/mL)로 처리하여 다시 24시간 배양하였다. 모든 배양이 종료된 후, EZ-Cytox(DoGenBio, Korea)에 포함된 용액을 각 well당 20 μL씩 추가하고 세포배양기에서 30분간 반응시켰다. 반응 후 micro plate reader의 450 nm에서 흡광도를 측정하였으며, 대조군에 대한 백분율로 세포생존율을 표시하였다.
8. Nitric oxide 생성량 측정
48 well plate에 RAW264.7 cell을 2×104 cells/well로 분주하여 배양하였으며, 24시간 후, HGC를 100, 200, 400 μg/mL로 처리하고 lipopolysaccharides(LPS; Sigma-Aldrich, USA)를 500 ng/mL로 추가하여 24시간 동안 배양하였다. 모든 배양이 종료된 후 nitric oxide assay kit(DoGenBio, Korea)에 포함된 griess reagent A를 각 well당 100 μL씩 추가하여 상온에서 10분간 반응시켰으며, 반응 후 griess reagent B를 100 ㎕를 추가하여 상온에서 10분간 반응시켰다. 모든 반응이 종료된 후, micro plate reader의 540 nm에서 흡광도를 측정하였으며, LPS군에 대한 백분율로 nitric oxide 생성량을 표시하였다.
9. 단백질 발현량 측정
6 well plate에 RAW264.7 cell을 2×105 cells/well로 분주하여 배양하였으며, 24시간 후, HGC를 100, 200, 400 μg/mL로 처리하고 LPS를 500 ng/mL로 추가하여 24시간 동안 배양하였다. 배양이 종료된 후, 원심분리하여 세포를 분리하였고 분리된 세포에 protease 및 phosphatase inhibitor(Sigma-Aldrich, USA)가 포함된 RIPA lysis buffer(Thermo Fisher Scientific, USA)를 넣어 단백질을 추출하였다. 추출한 단백질은 BCA protein assay kit(Thermo Fisher Scientific, USA)로 정량하였으며, sample loading buffer와 혼합하고 95℃에서 5분간 반응시켜 준비하였다. 준비된 단백질은 12% acrylamide gel에 전기영동하여 단백질을 분리하였고 이를 PVDF membrane에 이동시켰다. 단백질이 옮겨진 membrane을 3% bovine serum albumin(BSA; Thermo Fisher Scientific, USA) 용액에 담가 상온에서 2시간동안 반응시켜 blocking을 진행하였으며, TBST buffer로 세척하고 각 primary antibody(Cell Signaling Technology, USA)와 4℃에서 16시간동안 반응시켰다. Primary antibody와 반응시킨 membrane은 다시 TBST buffer로 세척하고 secondary antibody(Jackson ImmunoResearch, USA)와 상온에서 1시간동안 반응시켰으며, 이를 다시 세척하여 ECL solution(iNtRON Biotechnology, Korea)으로 단백질을 발색시켰다. 발색 후, chemidoc fusion FX(VILBER, France)를 통해 iNOS, IL-1β, IL-6, TNF-α, phospho ERK, total ERK, phospho JNK, total JNK, phospho p38, total p38 단백질 발현량을 분석하였다.
10. 통계처리
연구 결과는 mean±standard error of mean으로 나타내었으며, SPSS Statistics Version 21.0(IBM, USA)을 이용하였으며, 먼저 두 그룹 간의 통계적 비교는 independent sample t-test를 사용하여 수행하였고 Tukey’s HSD test를 통해 유의수준 0.05로 설정하여 유의성을 검정하였으며, p<0.05, p<0.01 및 p<0.001의 3가지 유의수준으로 나누어 표기하였다.
결 과
1. 총 폴리페놀 및 플라보노이드 함량
Galic acid를 표준물질로 하여 HGC에 존재하는 총 폴리페놀 함량을 측정한 결과, 42.84±0.26 mg GAE/g으로 나타났으며, quercetin을 표준물질로 하여 HGC에 존재하는 총 플라보노이드 함량을 측정한 결과, 9.91±1.28 mg QE/g으로 나타났다(Table 2).
2. DPPH 및 ABTS 라디컬 소거능
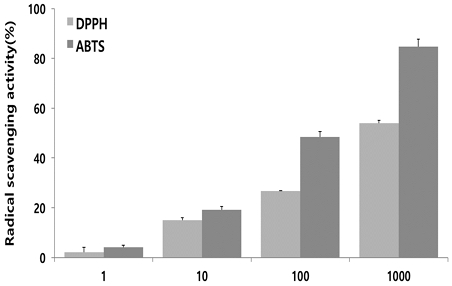
DPPH 및 ABTS 라디컬 소거능을 측정한 결과, HGC는 DPPH 및 ABTS 라디컬 소거능을 농도 의존적으로 증가시켰다(Fig. 1).
3. 세포생존율
RAW264.7 세포에 HGC을 24시간 처리 후 세포 생존율을 측정한 결과, HGC는 400 μg/mL 이하의 농도에서는 대조군에 비해 세포생존율이 감소하지 않았으나 800 μg/mL 농도에서는 대조군에 비해 11% 감소한 세포생존율이 나타났다(Fig. 2). 따라서 이후 실험은 세포에 대한 독성이 나타나지 않은 400 μg/mL 이하의 농도로 진행하였다.
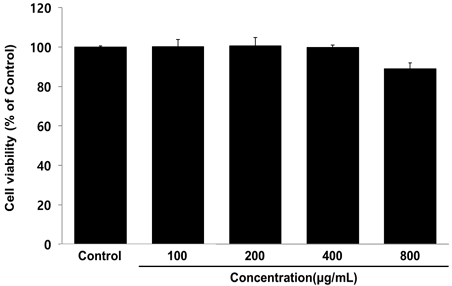
Cell viability of HGC in RAW264.7 cells. RAW264.7 cells were treated by 50, 100, 200, and 400 μg/mL of HGC for 24 h. Treated cells were reacted with EZ-Cytox for 30 min and then, absorbance were measured at 450 nm using micro plate reader. The cell viability were calculated as percentage relative to control group. The results were presented by the mean±standard error of mean from three independent experiments.
3. Nitric oxide 생성량
LPS로 염증 반응이 유도된 대식세포에서 염증 반응에 대표적인 바이오마커인 nitric oxide(NO) 생성량을 측정한 결과, HGC는 100 ㎍/㎖ 이상의 농도에서 농도 의존적이고 LPS군에 비해 유의성 있는 감소가 나타났다(Fig. 3).
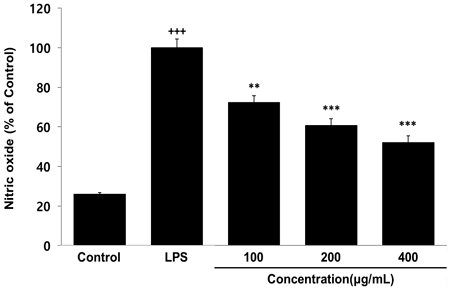
Effects of HGC on nitric oxide level in RAW264.7 cells. RAW264.7 cells were treated by 100, 200 and 400 μg/mL of HGC with 500 ng/mL of LPS for 24 h. The nitric oxide level were measured using an assay kit. The results were presented by the mean±standard error of mean from three independent experiments (Significance of results, +++ : p<0.001 compared to control, ** ; p<0.01, *** ; p<0.001 compared to LPS).
4. 염증성 단백질 발현량
LPS로 염증 반응이 유도된 대식세포에서 발현이 증가하는 iNOS, IL-1β, IL-6, TNF-α 단백질 발현량을 측정한 결과, HGC는 100 μg/mL 이상의 농도에서 iNOS, IL-1β, IL-6 단백질 발현량을 대조군에 비해 농도 의존적이고 유의성 있게 감소시켰으며, 200 μg/mL 이상의 농도에서는 TNF-α 단백질 발현량을 대조군에 비해 농도 의존적이고 유의성 있게 감소시켰다(Fig. 4).
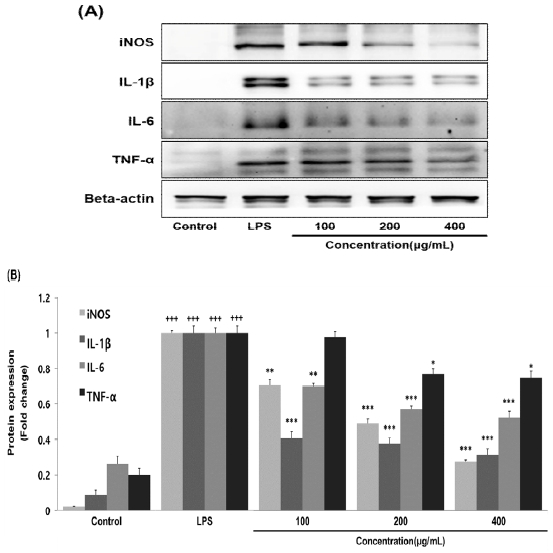
Effects of HGC on protein expression level in RAW264.7 cells. RAW264.7 cells were treated by 100, 200 and 400 μg/mL of HGC with 500 ng/mL of LPS for 24 h. The protein expression level were measured using a western blot assay. The results were presented by the mean±standard error of mean from three independent experiments (Significance of results, +++ : p<0.001 compared to control, * ; p<0.05, ** ; p<0.01, *** ; p<0.001 compared to LPS). (A); protein expression level (B); graph image
5. 신호 전달 단백질 인산화
LPS로 염증 반응이 유도된 대식세포에서 외부 자극으로부터 반응하여 다양한 세포의 기능을 조절하는 mitogen-activated protein kinases(MAPKs)의 인산화를 측정한 결과, HGC는 200 μg/mL 이상의 농도에서 ERK와 p38의 인산화를 대조군에 비해 농도 의존적이고 유의성 있게 감소시켰으며, 400 μg/mL 농도에서 JNK의 인산화를 대조군에 비해 유의성 있게 감소시켰다(Fig. 5).
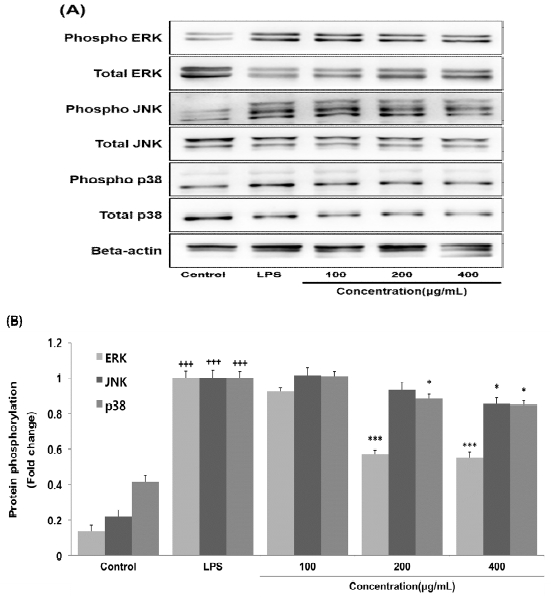
Effects of HGC on protein phosphorylation level in RAW264.7 cells. RAW264.7 cells were treated by 100, 200 and 400 μg/mL of HGC with 500 ng/mL of LPS for 24 h. The protein phosphorylation level were measured using a western blot assay. The results were presented by the mean±standard error of mean from three independent experiments (Significance of results, +++ : p<0.001 compared to control, * ; p<0.05, *** ; p<0.001 compared to LPS). (A); protein phosphorylation level (B); graph image
고 찰
염증 반응은 다양한 요인에 의해 세포 및 조직에 손상이 발생하는 반응이며, 세포가 생장하고 정상적인 상태로 지속되기 위해 적당한 염증 반응은 필요하지만 과도하게 반응이 일어나거나 오랜 기간 반응이 지속되면 조직의 손상 및 기능 상실이 유도된다14,15). 염증 반응의 진행은 NF-κB(nuclear factor kappa B), MAPK(mitogen-activated protein kinase) 및 JAK-STAT 등 다양한 신호 조절 경로들을 통해 진행되며, nitric oxide(NO), tumor necrosis factor-α(TNF-α), interleukin과 같은 염증 유도 물질들이 생산되어 진행된다16,17).
이러한 염증 반응과 산화적 스트레스는 체내 다양한 생리학적 과정에서 밀접하게 관련되어 있으며, 다양한 연구들을 통해 이러한 연관성이 과학적으로 입증되었다18-20). 또한 인삼 열매가 인삼에 비하여 진세노사이드 함량과 항산화 효능이 우수하다는 연구결과들21-23)에 착안하여 함양산양삼의 고부가가치 제고를 위해 함양산양삼과 산양삼 열매 복합물을 제작하였다. 이에 따라 본 연구에서는 복합물의 항산화 효능(total polyphenol, total flavonoid, DPPH 및 ABTS 라디컬 소거능)을 분석하여 산화적 스트레스를 개선할 수 있는 지 확인하였으며, 이와 연관되어있는 염증성 사이토카인(NO, IL-1β, IL-6, TNF-α)의 생성량 및 발현량을 분석하고 이들을 조절하는 신호 조절 경로인 MAPKs의 인산화를 분석하였다.
폴리페놀과 플라보노이드는 과일과 채소를 비롯한 다양한 천연물들에서 발견되어 생리활성을 갖는 화학물질을 말한다21,22). 이러한 폴리페놀과 플라보노이드는 다양한 연구들을 통해 염증 반응을 개선시킬 수 있음이 확인되었으며, 이와 더불어 면역 조절, 심혈관 보호, 항암 작용 등 체내에서 긍정적인 영향을 미친다고 알려져 있다22-26). 본 연구를 통해 함양산양삼과 산양삼 열매 복합물에는 많은 양의 폴리페놀과 플라보노이드가 확인되었으며(Table 2), DPPH 및 ABTS 라디컬 소거능이 농도 의존적으로 증가되었다(Fig. 1). 이러한 라디컬 소거능의 증가는 폴리페놀과 플라보노이드의 강력한 항산화 효과 때문에 증가되었으며, 따라서 함양산양삼과 산양삼 열매 복합물이 산화적 스트레스와 관련된 다양한 질병을 예방하거나 개선시키는데 도움이 될 수 있을 것이라 사료된다.
또한 항염증 효능을 확인하기 위해 생쥐 유래 대식세포인 RAW264.7 세포로 실험을 진행하였으며, 이와 같은 대식세포는 염증 반응을 관여하는 세포 중 하나로서 lipopolysaccharides(LPS)와 같은 염증 유도 물질들에 의해 활성화되어 체내에서 다양한 염증성 물질들을 생성하여 염증 반응을 조절하는데 중요한 역할을 한다27,28). 따라서 활성화된 대식세포에서 염증성 물질들의 생성을 억제하는 것은 염증 반응을 개선시키는데 빠르고 효과적인 방법이라 생각된다. 이에 본 연구를 통해 RAW264.7 세포에서 함양산양삼과 산양삼 열매 복합물의 독성이 나타나지 않는 농도를 확인하고 확인된 농도에서 실험을 진행하였으며(Fig. 2), 함양산양삼과 산양삼 열매 복합물은 염증 반응에서 가장 먼저 반응하는 nitric oxide(NO) 생성량을 농도 의존적이고 LPS 처리군에 비해 유의성 있게 감소시켰다(Fig. 3). 또한 염증 반응을 진행시키는 염증성 물질인 inducible nitric oxide synthase (iNOS), IL-1β, IL-6, TNF-α 단백질 발현량도 농도 의존적이고 LPS 처리군에 비해 유의성 있게 감소시켰다(Fig. 4). 따라서 함양산양삼과 산양삼 열매 복합물이 염증 반응을 개선할 수 있음을 확인하였다.
마지막으로 염증 반응을 조절하는 신호 전달 경로 중 MAPK 경로는 extracellular signal-regulated kinases(ERK), c-Jun N-terminal kinases(JNK), p38 mitogen-activated protein kinases(p38)로 구성되어 있으며, 일반적으로 ERK는 세포의 성장과 관련되어 있고, JNK와 p38은 세포 내 스트레스 및 염증 반응에 관련되어 있다29,30). 본 연구에서는 함양산양삼과 산양삼 열매 복합물이 MAPK 인산화를 유의적으로 감소시켰음을 확인하였으며(Fig. 5), 이는 함양산양삼과 산양삼 열매 복합물이 MAPK 신호 전달 경로를 억제하여 염증성 물질들의 생성을 조절한다는 것을 입증해주는 결과라고 사료된다.
이상의 결과를 종합해 볼 때 함양산양삼과 산양삼 열매 복합물은 항산화 및 항염증 효능이 세포실험을 통해 과학적으로 입증되었다. 따라서 동물실험 실험결과가 뒷받침 된다면 항산화 및 항염증에 효과가 있는 기능성 소재로써 사용이 가능 할 것이라 생각되며, 이를 통해 함양산양삼과 산양삼 열매를 사용한 산업화의 촉진과 고부가가치를 제고할 수 있을 것이라 사료된다.
결 론
본 연구에서는 함양산양삼과 산양삼 열매 복합물에 존재하는 폴리페놀과 플라보노이드를 정량하였고 DPPH 및 ABTS 라디컬 소거능을 농도 의존적으로 증가시키는 항산화 효능을 확인하였다. 또한 함양산양삼과 산양삼 열매 복합물이 염증 반응이 유도된 RAW264.7 세포에서 nitric oxide(NO) 생성량과 염증성 염증성 물질인 iNOS, IL-1β, IL-6, TNF-α 단백질 발현량을 유의적으로 억제하고 MAPK 신호 전달 경로를 유의적으로 억제함을 통해 항염증 효능을 과학적으로 증명하였다. 이러한 결과들을 통해 함양산양삼과 산양삼 열매는 항산화 및 항염증에 효과가 있는 기능성 소재로써 사용이 가능 할 것이라 사료된다.
Acknowledgments
본 연구는 산림청(한국임업진흥원) 산림과학기술 연구개발사업(2021370A00-2123-BD02)의 지원에 의하여 이루어진 것입니다.
References
-
Shirley R, Ord EN, Work LM. Oxidative stress and the use of antioxidants in stroke. Antioxidants. 2014;3(3):472-501.
[https://doi.org/10.3390/antiox3030472]

-
Kim H, Park J, Jung J, Hwang D. Anti-oxidative and anti-inflammatory Activities of polysaccharide isolated from Korean-style soy sauce. Biomedical Science Letters. 2020;26(1):51-6.
[https://doi.org/10.15616/BSL.2020.26.1.51]

-
Dore CMG, Azevedo TC, de Souza MC, Rego LA, de Dantas JC, Silva FR, et al. Antiinflammatory, antioxidant and cytotoxic actions of β-glucan-rich extract from Geastrum saccatum mushroom. International immunopharmacology. 2007;7(9):1160-9.
[https://doi.org/10.1016/j.intimp.2007.04.010]

-
Attiq A, Jalil J, Husain K, Ahmad W. Raging the war against inflammation with natural products. Frontiers in pharmacology. 2018;9:976.
[https://doi.org/10.3389/fphar.2018.00976]

-
Arulselvan P, Fard MT, Tan WS, Gothai S, Fakurazi S, Norhaizan ME, et al. Role of antioxidants and natural products in inflammation. Oxidative medicine and cellular longevity. 2016;2016.
[https://doi.org/10.1155/2016/5276130]

- Jin JH, Kwon HO, Ha Y, Heo SH, Lee J. Anti-inflammatory and anti-oxidative effect of Pinus koraiensis cone shell extracts. Journal of the Korean Society of Food Science and Nutrition. 2017;46(9):1053-60.
-
Markiewski MM, Lambris JD. The role of complement in inflammatory diseases from behind the scenes into the spotlight. The American journal of pathology. 2007;171(3):715-27.
[https://doi.org/10.2353/ajpath.2007.070166]

- Lee S, Han H, Yoo J, Nam MS, Kim K. Anti-oxidant and anti-inflammatory effect of Allium Hookeri water extracts in RAW 264.7 cells. The Korea Journal of Herbology. 2020;35(4):37-43.
-
Jung S-H, Kim SJ, Jun B-G, Lee K-T, Hong S-P, Oh MS, et al. α-Cyperone, isolated from the rhizomes of Cyperus rotundus, inhibits LPS-induced COX-2 expression and PGE2 production through the negative regulation of NFκB signalling in RAW 264.7 cells. Journal of ethnopharmacology. 2013;147(1):208-14.
[https://doi.org/10.1016/j.jep.2013.02.034]

- Kim K, Um Y, Jeong D-H, Kim H-J, Kim M-J, Jeon K-S. The correlation between growth characteristics and location environment of wild-simulated ginseng (Panax ginseng CA Meyer). Korean Journal of Plant Resources. 2019;32(5):463-70.
- Jeon K, Um Y, Jung C, Park H, Kim M. Standard cultivation manual of wild-simulated ginseng. National Institute of Forest Science, Seoul, Korea. 2018:15-20.
- Hong J-Y, Shin S-R, Bae M-J, Bae J-S, Lee I-C, Kwon O-J, et al. Pancreatic lipase inhibitors isolated from the leaves of cultivated mountain ginseng (Panax ginseng). Korean Journal of Food Preservation. 2010;17(5):727-32.
-
Gil J, Um Y, Byun JK, Chung JW, Lee Y, Chung CM. Genetic diversity analysis of wood-cultivated ginseng using simple sequence repeat Markers. Korean Journal of Medicinal Crop Science. 2017;25(6):389-96.
[https://doi.org/10.7783/KJMCS.2017.25.6.389]

-
Zhang H, Shan Y, Wu Y, Xu C, Yu X, Zhao J, et al. Berberine suppresses LPS-induced inflammation through modulating Sirt1/NF-κB signaling pathway in RAW264. 7 cells. International immunopharmacology. 2017;52:93-100.
[https://doi.org/10.1016/j.intimp.2017.08.032]

-
Jiangjiang Q, Wei W, Zhang R. Novel natural product therapeutics targeting both inflammation and cancer. Chinese journal of natural medicines. 2017;15(6):401-16.
[https://doi.org/10.1016/S1875-5364(17)30062-6]

-
Xu X, Yin P, Wan C, Chong X, Liu M, Cheng P, et al. Punicalagin inhibits inflammation in LPS-induced RAW264. 7 macrophages via the suppression of TLR4-mediated MAPKs and NF-κB activation. Inflammation. 2014;37:956-65.
[https://doi.org/10.1007/s10753-014-9816-2]

-
Chen L, Deng H, Cui H, Fang J, Zuo Z, Deng J, et al. Inflammatory responses and inflammation-associated diseases in organs. Oncotarget. 2018;9(6):7204.
[https://doi.org/10.18632/oncotarget.23208]

-
Biswas SK. Does the interdependence between oxidative stress and inflammation explain the antioxidant paradox? Oxidative medicine and cellular longevity. 2016;2016.
[https://doi.org/10.1155/2016/5698931]

-
Tan BL, Norhaizan ME, Liew W-P-P, Sulaiman Rahman H. Antioxidant and oxidative stress: a mutual interplay in age-related diseases. Frontiers in pharmacology. 2018;9:1162.
[https://doi.org/10.3389/fphar.2018.01162]

-
Liu Z, Zhou T, Ziegler AC, Dimitrion P, Zuo L. Oxidative stress in neurodegenerative diseases: from molecular mechanisms to clinical applications. Oxidative medicine and cellular longevity. 2017;2017.
[https://doi.org/10.1155/2017/2525967]

-
Kim YK, Yoo DS, Xu H, Park NI, Kim HH, Choi JE, et al. Ginsenoside content of berries and roots of three typical Korean ginseng (Panax ginseng) cultivars. Natural Product Communications. 2009;4(7):1934578X0900400704.
[https://doi.org/10.1177/1934578X0900400704]

- Hyun TK, Jang K-I. Are berries useless by-products of ginseng? Recent research on the potential health benefits of ginseng berry. EXCLI journal. 2017;16:780-4.
-
Park J-E, Kim H, Kim J, Choi S-J, Ham J, Nho CW, et al. A comparative study of ginseng berry production in a vertical farm and an open field. Industrial Crops and Products. 2019;140:111612.
[https://doi.org/10.1016/j.indcrop.2019.111612]

-
González R, Ballester I, López-Posadas R, Suárez M, Zarzuelo A, Martínez-Augustin O, et al. Effects of flavonoids and other polyphenols on inflammation. Critical reviews in food science and nutrition. 2011;51(4):331-62.
[https://doi.org/10.1080/10408390903584094]

-
Yahfoufi N, Alsadi N, Jambi M, Matar C. The immunomodulatory and anti-inflammatory role of polyphenols. Nutrients. 2018;10(11):1618.
[https://doi.org/10.3390/nu10111618]

-
Essafi-Benkhadir K, Refai A, Riahi I, Fattouch S, Karoui H, Essafi M. Quince (Cydonia oblonga Miller) peel polyphenols modulate LPS-induced inflammation in human THP-1-derived macrophages through NF-κB, p38MAPK and Akt inhibition. Biochemical and biophysical research communications. 2012;418(1):180-5.
[https://doi.org/10.1016/j.bbrc.2012.01.003]

-
Yang J, Yang X, Li M. Baicalin, a natural compound, promotes regulatory T cell differentiation. BMC complementary and alternative medicine. 2012;12(1):1-7.
[https://doi.org/10.1186/1472-6882-12-64]

-
Wang H-K, Yeh C-H, Iwamoto T, Satsu H, Shimizu M, Totsuka M. Dietary flavonoid naringenin induces regulatory T cells via an aryl hydrocarbon receptor mediated pathway. Journal of Agricultural and Food Chemistry. 2012;60(9):2171-8.
[https://doi.org/10.1021/jf204625y]

-
Maleki SJ, Crespo JF, Cabanillas B. Anti-inflammatory effects of flavonoids. Food chemistry. 2019;299:125124.
[https://doi.org/10.1016/j.foodchem.2019.125124]

-
Elia D, Madhala D, Ardon E, Reshef R, Halevy O. Sonic hedgehog promotes proliferation and differentiation of adult muscle cells: Involvement of MAPK/ERK and PI3K/Akt pathways. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research. 2007;1773(9):1438-46.
[https://doi.org/10.1016/j.bbamcr.2007.06.006]

-
Ren J, Su D, Li L, Cai H, Zhang M, Zhai J, et al. Anti-inflammatory effects of Aureusidin in LPS-stimulated RAW264. 7 macrophages via suppressing NF-κB and activating ROS-and MAPKs-dependent Nrf2/HO-1 signaling pathways. Toxicology and Applied Pharmacology. 2020;387:114846.
[https://doi.org/10.1016/j.taap.2019.114846]

-
Yu J, Sun X, Goie JYG, Zhang Y. Regulation of host immune responses against influenza A virus infection by mitogen-activated protein kinases (MAPKs). Microorganisms. 2020;8(7):1067.
[https://doi.org/10.3390/microorganisms8071067]

-
Koo HJ, Yoon W-J, Sohn E-H, Ham Y-M, Jang S-A, Kwon J-E, et al. The analgesic and anti-inflammatory effects of Litsea japonica fruit are mediated via suppression of NF-κB and JNK/p38 MAPK activation. international Immunopharmacology. 2014;22(1):84-97.
[https://doi.org/10.1016/j.intimp.2014.06.007]