피지선세포에서 SREBP-1 활성에 의한 우방자추출물의 지질 생성 촉진 작용
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Arctii Lappa Fructus has the numerous health benefits, including antioxidant, anti-inflammatory, and anti-carcinogenic properties. Skin lipids are one of several factors that maintain epidermal barrier function. This study was to explore the lipogenic effect by ethanol extract of Arctii Lappa Fructus (EAF) in sebocytes. First, it was confirmed that EAF exhibited high antioxidant activity and collagenase activity inhibition. We found that cholesterol and triglyceride levels of cells by EAF were increased significantly in a dose-dependent manner. Moreover, EAF increased the expression of transcription factor sterol regulatory element-binding protein-1 (SREBP-1) in the cells. These results suggest that EAF induces lipogenesis in cells through the activation of SREBP-1.
Keywords:
Arctii Lappa Fructus, Cholesterol, Triglyceride, SREBP-1, Sebocyte서 론
피부는 체내의 수분을 유지하고 외부 이물질의 체내 침입을 막아주는 보호막으로 필수적인 장벽 기능을 수행하고 있다. 최근 피부장벽(skin barrier)은 기능에 따라 피부각질층으로 구성된 물리적 장벽과 지질, 산, 리소좀, 항균펩타이드로 구성된 화학적/생화학적 장벽, 감염성질환에 대한 면역 장벽의 개념이 제시되고 있다1-3).
피부의 지질은 피부장벽 기능을 유지하는 요소 중 하나이며, 이는 각질형성세포(keratinocyte)의 lamellar body에 형성되어 각질층(S. corneum)에서 세포사이로 분비되는 Epidermal lipid와 피지선세포(sebocyte)에서 생성되어 모낭을 통해 분비되는 Sebaceous lipid로 구성되어 있다4). 이러한 지질 구성성분의 변화는 장벽기능의 이상을 유발하여 여러 가지 피부질환을 초래하는데, 건조피부는 아토피 피부에서 기본적으로 나타나는 임상양상 중의 하나이다. 따라서 피부장벽 기능의 회복이 건조피부 개선에 중요한 핵심으로 피부와 같은 lipid formulation이나 ceramide supplement를 처리하여 왔으며, 세라마이드와 콜레스테롤, 지방산을 처리했을 때 아토피 환자의 수분손실이 줄어든다는 연구결과가 보고되었다5,6).
피지선은 항균활성이 있는 지질을 생성할 뿐만 아니라 cutaneous steroidogenesis, local androgen synthesis, neuropeptides와 상호작용, pro-inflammatory 및 anti-inflammatory 특성을 발현하는 등 다양한 기능이 보고되고 있다.7,8). 또한 sterol regulatory-element binding proteins(SREBPs)는 지질의 항상성 및 대사를 조절하는 전사인자로 내인성 콜레스테롤, 지방산, 트리아실글리세롤 및 인지질 합성에 필요한 효소의 발현을 조절하는 것으로 알려져 있다9-11).
우방자(Arctii Fructus)는 국화과(Compositae)에 속하는 2년생 초본식물인 우엉(Arctium lappa Linn)의 성숙한 과실로 오실(惡實), 대력자(大力子), 초우방(炒牛蒡) 등으로 불리어지고 있으며, 한국, 중국 등 아시아에 널리 분포하고 있다. 우방자는 제풍선폐기(除風宣肺氣) 거담지해(祛痰止咳), 소산풍열(疎散風熱), 청열해독(淸熱解毒) 등의 효능이 있고, 약리작용으로 항균, 항암, 혈당강하 작용 등이 보고되었다12,13). 주요 성분으로는 15∼21.5%의 arctiin이 함유되어 있으며 arctigenin, isoarctigenin, 25∼30%의 지방유, 지방산 등이 있다. 지방산의 주요성분은 arachidic acid이며 소량의 stearic acid, palmitic acid, linolic acid 등이 있다12,14). 우방자에 대한 선행연구로는 혈관 이완 작용, 아토피 피부염 개선 작용, 알러지 염증반응 억제효과, 안면 피부 개선효과 등이 보고되었으며, 우방자로부터 추출한 arctigenin의 미백효과가 보고되었다15-18).
본 연구에서 아토피 피부염 개선 효과와 알러지 염증반응 억제 효과가 보고된 우방자를 이용하여 피지선세포의 지질 합성 촉진작용을 확인하였고 지질대사를 조절하는 전사인자 SREBP-1의 발현에 미치는 영향을 조사하였다.
재료 및 방법
1. 시료
본 실험에 사용된 우방자는 ㈜휴먼허브사(Seoul, Korea)에서 구입하여 사용하였다. 우방자 500g에 100% 에탄올 1.5L를 가하여 실온에서 초음파 분쇄시킨 후 3일간 추출하였다. 거즈로 여과하고 여과지(No. 2)를 사용하여 진공펌프로 여과한 후 rotary evaporator로 감압 농축하여 8.23g(수득율 1.65%)의 건조된 추출물을 얻었다. 시료는 DMSO에 녹여 사용하였고 DMSO는 최종 0.01% 이하의 농도 범위에서 사용하였다.
2. 1,1-diphenyl-2-picryl hydrazy(DPPH) free radical 소거능 측정
시료의 항산화 활성은 DPPH free radical 소거능 측정 방법19)을 이용하여 측정하였다. 시료를 1 mg/mL로 녹여 serial dilution 한 시료액 100 μL 와 0.4 μM DPPH 용액 100 μL를 혼합하고 37°C에서 암실에서 30분 반응 후 517 nm에서 흡광도를 측정하였다. 전자공여능(%)은 다음 식으로 나타내었다.
3. Collagenase 활성 측정
EnzCheck Gelatinase/Collagenase assay kit(Invitrogen, CA, USA)를 사용하여 collagenase 활성 억제 효능을 평가하였다. 기질로는 DQ™ gelatin from pig skin, fluorescein conjugate를 이용하여 측정하였다. 96 well plate에 reaction buffer를 150 μl, 시료 20 μl, collagenase(10 μg/ml) 20 μl, gelatin(100 μg/ml) 10 μl를 처리하고 37℃ 암실에서 1시간 동안 반응시킨 후 fluorescence micro plate reader(Bio-tek, VT, USA)를 사용해 495/515 nm에서 측정하였다.
4. 세포배양
사람 피지선세포는 독일의 베를린대학에서 기증받았으며 10% fetal bovine serum(FBS)가 첨가된 Dulbecco's modified eagle medium(DMEM)/F12(1:1)을 사용하여 CO2 incubator(37℃, 5% CO2)에서 배양하였다. 그리고 48시간 주기로 배양액을 교체하여 배양하였다.
5. 지질추출 및 단백질정량
세포를 10 cm dish에 1×10⁵개씩 분주하고 24시간 부착하였다. 시료를 처리하고 5일간 배양한 후 lysis buffer(EDTA 10 μl, 100 mM SPB 용액, PMSF 1 μl, Triton X-100 10 μl)를 처리하여 초음파로 분쇄한 뒤 Bradford 방법을 이용하여 단백질을 정량하였다. 세포용해액에 chloroform : methanol (2:1) 용액을 첨가하여 혼합하고 원심분리(2000 rpm, 15분)하여 하층액을 취하고 남은 용액에 2차로 chloroform : methanol (2:1) 용액을 첨가하여 동일한 방법으로 하층액을 분리하고 N2 gas로 농축시켰다.
6. Cholesterol 및 Triglyceride 측정
시료의 지질에 ethanol 300 μl를 넣어 녹인 후 cholesterol과 triglyceride는 각각 total cholesterol kit(AM 202-K, Asan Parm. Co., Seoul, Korea)와 triglycerides kit(GPO-PAP, YD Diagnostic, Yongin, Korea)를 이용하여 측정하였다. 1 ml의 효소시액에 100 μl의 시료를 첨가하고 혼합하여 37℃에서 5분 동안 배양 후 cholesterol은 500 nm의 파장에서 측정하였으며, triglyceride는 546 nm의 파장에서 ELISA reader로 흡광도를 측정하였다. 표준액의 cholesterol과 triglyceride는 3 ml의 효소시액에 20 μl의 표준액을 넣어 3 mg/ml 값으로 하였다.
7. Western blot
10cm 배양용기에 1.2×106 세포/dish의 밀도로 분주하여 부착시키고 시료를 3일간 처리하였다. 배양된 세포를 모두 수거하여 lysis buffer로 4℃에서 30분간 용해시킨 후, 15,000 rpm에서 30분간 원심분리 하여 얻은 세포 용해액은 Bradford 방법을 이용하여 단백질정량을 하였다. 세포용해액은 2×sample buffer와 혼합하여 95℃에서 5분간 끓인 후 7.5% SDS-polyacrylamide gel에 전기영동하여 단백질을 분리하였다. 전기영동이 끝난 후 polyvinylidene difluoride membrane(Millipore, MA, USA)에 전이시켰다. Membrane은 5% skim milk-TBST(20 mM Tris-HCl, pH 7.5, 150 mM NaCl, 0.05% Tween 20)에서 1시간 동안 blocking하였다. SREBP-1 항체에 4℃에서 16시간 반응시키고, TBST로 세척한 후 HRP-conjugated secondary antibody와 1시간 반응시킨 후 WEST- ZOLⓇ(plus) Western blot detection system(iNtRON, Singnam, Korea)을 사용하여 ChemiDoc으로 band의 사진을 촬영하였다. 양성 대조군으로 linoleic acid(100 μM)을 사용하였다.
8. 통계학적 분석
실험 결과는 mean ± S.D로 표시하였다. 각 군 간의 통계적 유의성에 대한 검증은 one-way ANOVA test를 이용하여 p-value를 구하여 유의성을 검증하였다. P값이 0.01 이하인 경우 유의성을 인정하였다.
결 과
1. 항산화 및 collagenase 활성 억제 작용
본 실험에서 안면 피부 주름개선 효과가 보고된 우방자 추출물의 항산화능과 collagsnase 활성에 미치는 영향을 확인하였다. DPPH free radical 소거능 측정은 hydrazyl의 질소 원자가 불안정한 상태로 쉽게 수소원자를 받아들이는 성질을 가지고 있어 항산화성 물질과 반응하여 항산화활성을 측정할 수 있는 방법이다. 실험결과, 우방자 추출물 12.5, 50, 100 μg/ml 농도에서 각각 89.3%, 92.6% 96.0%의 DPPH 라디칼 소거능을 보였다(Fig. 1). 양성대조군으로 아스코르브산(AC)을 사용하였다.
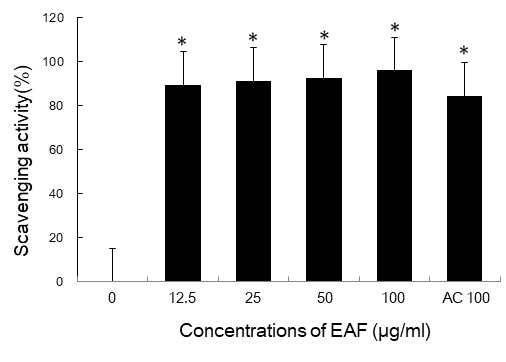
DPPH radical scavenging activities of EAF extracts by various concentrations. DPPH radicals were generated as described in materials and methods. Ascorbic acid (AC 100 μM) was used as a positive control. The values are means ± SD of triplicate. *p<0.01 versus untreated group.
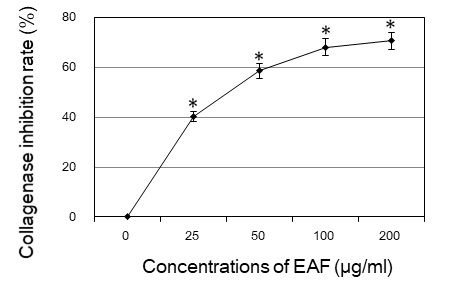
또한 collagen을 분해하여 피부의 주름생성을 촉진시키는 collagenase의 활성에 대한 우방자 추출물의 효과를 조사한 결과, collagenase 활성 억제 효과는 우방자 25, 50, 100, 200 μg/ml 농도에서 각각 40%, 58%, 68%, 71%로 농도의존적으로 증가하였다(Fig. 2).
2. Cholesterol 생성에 미치는 영향
지질 합성에 미치는 우방자의 효과를 분석하기 위하여 피지선세포의 cholesterol의 변화를 조사하였다. 우방자 추출물을 25와 50 μg/ml의 농도로 처리하고 5일 배양 후 cholesterol을 정량하였다. 대조군의 cholesterol은 0.64 ± 0.02 mg/ml이었으며, 우방자 25와 50 μg/ml 농도에서는 각각 0.84 ± 0.03 mg/ml, 1.19 ± 0.05 mg/ml로 대조군에 비하여 cholesterol이 증가하였다(Fig. 3). 다중불포화지방산인 linoleic acid는 peroxisome proliferator-activated receptor(PPAR)의 리간드로서 지질의 생성을 촉진하므로 양성대조군으로 사용하였으며, cholesterol은 0.86 ± 0.03 mg/ml로 우방자 50 μg/ml 농도보다 낮았다.
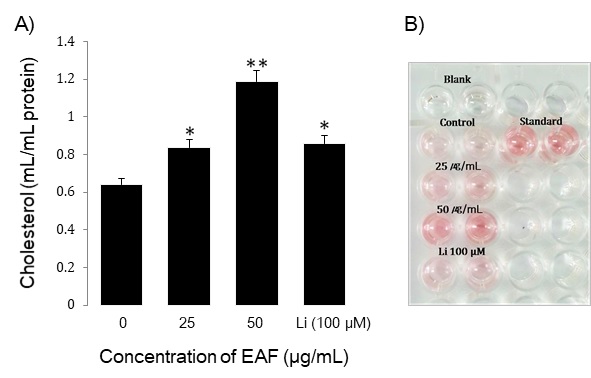
Effect of EAF extracts on cholesterol content in sebocytes. The cells were plated at 1 × 105 cells/dish and incubated in media containing 25 μg/mL or 50 μg/mL of EAF and Linoleicacid (Li) 100 μM for 5 days. Data are means ± S.D three experiments performed in triplicate. *p<0.05, **p<0.01 vs. untreated group.
3. Triglyceride 생성에 미치는 영향
중성지방의 변화에 미치는 우방자의 효과를 조사하기 위하여 25와 50 μg/ml의 농도로 처리하여 5일 배양 후 triglyceride를 정량하였다. 대조군의 triglyceride은 0.82 ± 0.02 mg/ml였으며, 우방자 25와 50 μg/ml 농도에서 각각 1.29 ± 0.04 mg/ml, 1.53 ± 0.06 mg/ml로 대조군에 비하여 triglyceride이 증가하였다(Fig. 4). Linoleic acid(100 μM)의 triglycerol은 1.19 ± 0.04 mg/ml로 우방자 50 μg/ml 농도보다 낮았다.
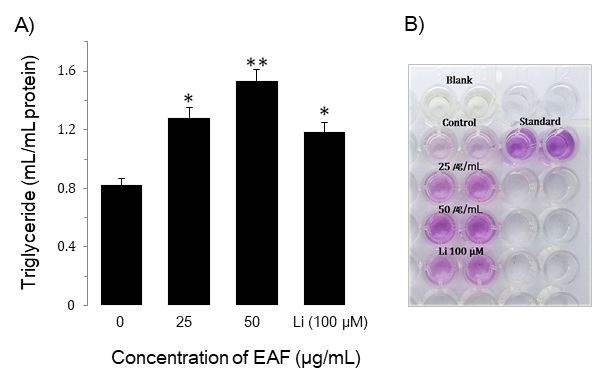
Effect of EAF extracts on triglyceride content in sebocytes. The cells were plated at 1 × 105 cells/dish and incubated in media containing 25 μg/mL or 50 μg/mL of EAF and Linoleic acid (Li) 100 μM for 5 days. Data are means ± S.D three experiments performed in triplicate. *p<0.05, **p<0.01 vs. untreated group.
4. 전사인자 SREBP-1 발현 촉진 작용
SREBPs는 지방산과 cholesterol 합성 경로에 관련된 효소들을 활성화하는 중요한 전사활성인자로서 세 가지 종류(SREBP 1a, 1c, 2)가 알려있다. 따라서 지질합성이 일어나는 동안 SREBP-1과 FAS 같은 지질생성 관련 유전자의 발현이 증가한다9-11). 이에 cholesterol과 triglyceride의 생성을 촉진하는 것으로 확인된 우방자가 전사인자 SREBP-1의 발현에 관여하는지 조사하였다. 우방자 25와 50 μg/ml의 농도에서 전구형 및 활성형 SREBP-1 단백질 발현이 각각 대조군의 2.52배, 2.75배 증가하였으며, linoleic acid는 대조군의 1.26배 증가하였다(Fig. 5).
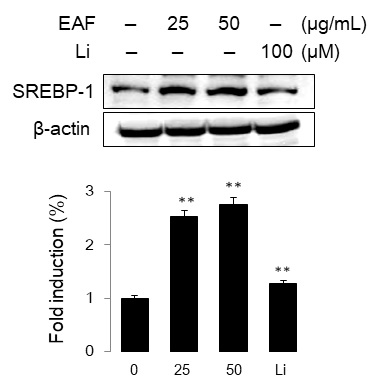
Effect of EAF extracts on SREBP-1 expression in sebocytes. The cells were treated with EAF (25 or 50 μg/mL) for 48 h. Cells lysates were analyzed by Western blot using SREBP-1 specific antibody. Data are representative of more than three independent experiment(mean ± S.D). **p<0.01 vs. untreated group.
또한 시간에 따른 SREBP-1 발현을 분석한 결과, 전구형 SREBP-1(125 kDa)은 6, 12, 24, 48, 72 시간에 1.5배, 1.4배, 2.5배, 3.4배, 5.1배 증가하였고, 활성형(68 kDa)도 각각 1.2배, 1.3배, 1.5배, 2.2배, 2.4배 증가하였다(Fig. 6). 따라서 우방자는 피지선세포의 지질 합성 관련 전사인자 SREBP-1의 발현을 촉진하였다.
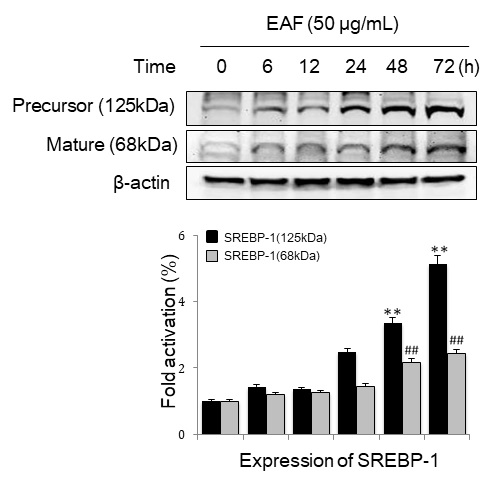
SREBP-1 expression pattern over time in EAF-treated sebocytes. Cells were treated with 50 μg/mL of EAF for the indicated time. Cell lysates were analyzed by Western blot using SREBP-1 specific antibody. Data are representative of more than three independent experiment(mean ± S.D). **p<0.01, ##p<0.01 vs. time zero.
고 찰
우방자는 명의별록(名醫別錄)에 수록된 이래 疎散風熱, 宣肺透疹의 효능으로 사용되어 왔으며, 주로 斑疹不透, 風疹瘙瘍, 瘡痒腫毒 등의 증상을 치료하는데 응용되고 있다12,13). 우방자의 피부에 대한 연구로는 성인 여성의 안면에 4% 우방자 추출물을 함유한 크림을 4주 간 도포하였을 때 피부주름이 4.85% 개선되었고, 황 등은 arctiin > diarctigenin > matairesinol > arctigenin 순으로 collagen 분해효소인 matrix metalloproteinase(MMP-1) 활성을 억제 한다고 보고하였다17,20). 본 실험에서도 우방자의 높은 항산화능과 우수한 collagenase 활성 억제작용을 확인하였다. 따라서 우방자의 안면 피부주름 개선효과는 collagen 분해를 억제하는 우방자의 작용과 높은 항산화력에 기인할 것으로 판단된다.
피부표면지질(skin surface lipid)은 피부의 건조를 막고, 외부로부터 유해물질의 흡수를 차단하며, 미생물의 성장과, 자외선을 차단하는 등 중요한 역할을 하고 있다21). 피지선은 free fatty acid, wax esters, squalene 외에도 triglyceride, cholesterol, cholesterol ester 등 많은 지질성분들을 분비하고 있으며, 특히 단불포화지방산은 살균제의 특성을 가지고 있다22,23). 본 실험에서 우방자 추출물이 피지선세포의 지질합성에 미치는 영향을 조사한 결과 우방자 25와 50 μg/ml 농도에서 cholesterol과 triglyceride 합성을 촉진한 것으로 나타났다. 양성 대조군으로 사용한 linoleic acid는 피지선세포에서 PPAR의 리간드로 작용하여 지질 생성을 촉진하는 것으로 알려져 있고24), 본 연구 결과에서도 linoleic acid는 지질의 생성을 증가시켰다.
남성호르몬에 의해 유발된 피지분비 증가는 여드름의 주요 병인 중의 하나이며, 장벽 기능 이상이 면포 형성 과정에 관련이 있는 것으로 알려져 있다. 피지 분비가 활발하게 일어나면 세포막 구성 지질인 cholesterol, cholesterol ester, linoleic acid의 비율이 감소하고 이는 모낭 과각화증을 초래하는 것으로 보고 있다25,26). 특히 linoleic acid는 외부로부터 섭취해야하는 필수 지방산으로서 장기간 결핍 시 표피의 이상 증식과 심각한 수분 손실을 초래하였으며, 여드름환자에서 linoleic acid의 국소도포가 면포용해 작용이 있음이 보고되었다27,28). 한편 조 등은 우방자에서 항염작용이 있는 유효 지방산을 검색하였고, 우방자의 지방산 함량을 측정한 결과 linoleic acid가 주성분(5.8872 μl/g)임을 확인하였다29). 이는 우방자에 의한 피지선세포의 지질합성 촉진이 피지 내 지질성분의 변화에 의한 부작용을 상쇄하고 있을 것으로 판단된다.
SREBP는 fatty acid synthase(FAS), long-chain fatty acyl elongase, stearoyl CoA desaturase, HMG CoA synthase, HMG CoA reductase, squalene synthase 등과 같이 지질 생합성에 관여하는 효소들의 활성을 조절하는 전사인자이다. SREBP는 1a, 1c 및 2의 세 종류의 isoform이 있으며, 그 중 SREBP1a는 빠르게 성장하는 세포의 지질합성을 강력하게 활성화시키고, SREBP1c는 간과 같은 지방 생합성 기관에서 fatty acid와 triglyceride의 생성을 조절한다. 한편, SREBP2는 모든 조직에서 sterol 합성에 관여한다9-11). 특히 피부에서 cholesterol과 지질의 합성은 표피장벽기능, 모낭의 형성과 유지에 필수적으로 SREBPs에 의해 조절되고 있음이 보고되고 있다9-11). 피부에서 cholesterol과 지질의 합성은 백 등은 태음조위탕가감방이 비만과 2형 당뇨가 유발된 db/db 마우스에서 간조직의 지질대사에 미치는 영향을 조사한 바, 혈중 cholesterol과 triglyceride는 유의성 있게 변화하지 않았으나, 간조직의 SREBP1의 mRNA 발현이 감소되었으며 간조직의 지방축적이 감소되었음을 보고하였다30). 저자들의 선행연구에서 지실 추출물이 SREBP-1, FAS의 활성과 더불어 세포내 지방소적 형성을 촉진하고 있음을 확인하였다31). 따라서 지질의 생성을 촉진하는 것으로 확인된 우방자 추출물이 전사인자 SREBP1의 조절에 관여하는지 조사한 결과, 전구형 및 활성형 SREBP1 단백질의 발현이 모두 증가함을 관찰하였다.
이상의 연구결과, 우방자는 우수한 항산화능과 collagenase 활성 억제작용을 나타냈으며, 피지선세포의 cholesterol과 triglyceride 생성을 촉진하였고, 우방자의 지질합성 촉진 작용은 전사인자 SREBP1을 경유할 것으로 판단된다.
결 론
본 연구에서는 피부질환을 개선하기 위한 한방소재 탐색의 일환으로 인체 피지선세포를 이용하여 우방자 추출물이 지질 합성에 미치는 영향을 조사하였다. 우방자 추출물은 12.5~50 μg/ml 농도구간에서 높은 항산화능과 우수한 collagenase 활성 억제작용을 보였으며, 피지선세포의 cholesterol 및 triglyceride의 생성을 촉진하였다. 또한 지질 생합성에 관련된 전사인자 SREBP1의 발현이 증가되었다. 따라서 우방자 추출물은 피지선의 기능이 저하된 경우 이를 정상화시킬 수 있는 소재로 이용될 가능성이 높은 것으로 사료된다.
Acknowledgments
본 연구는 2018년 원광대학교 교비 지원에 의해 수행되었음.
References
-
De Benedetto A, Rafaels NM, McGirt LY, Ivanov AI, Georas SN, Cheadle C, et al. Tight junction defects in patients with atopic dermatitis. J Allergy Clin Immunol. 2011;127:773-86.
[https://doi.org/10.1016/j.jaci.2010.10.018]

-
Kubo A, Naga K, Amagai M. Epidermal barrier dysfunction and cutaneous sensitization in atopic diseases. Clin Invest. 2012;122:440-7.
[https://doi.org/10.1172/JCI57416]

-
Kim H, Shin JU, Lee KH. Atopic dermatitis and skin barrier dysfunction. Allergy Asthma Respir Dis. 2013;1(1):20-8.
[https://doi.org/10.4168/aard.2013.1.1.20]

-
Pelle E, McCarthy J, Seltmann H, Huang X, Mammone T, Zouboulis CC, Maes D. Identification of histamine receptors and reduction of squalene levels by an antihistamine in sebocytes. J Invest Dermatol. 2008;128(5):1280-5.
[https://doi.org/10.1038/sj.jid.5701160]

- Robinson M, Visscher M, Laruffa A, Wickett R. Natural moisturizing factors (NMF) in the stratum corneum (SC). I. Effects of lipid extraction and soaking. J Cosmet Sci. 2010;61(1):13-22.
-
Elias PM, Hatano Y, Williams ML. Basis for the barrier abnormality in atopic dermatitis: outside-inside-outside pathogenic mechanisms. J Allergy Clin Immunol. 2008;121(6):1337-43.
[https://doi.org/10.1016/j.jaci.2008.01.022]

-
Komine M. Analysis of the mechanism for the development of allergic skin inflammation and the application for its treatment:keratinocytes in atopic dermatitis - their pathogenic involvement. J Pharmacol Sci. 2009;110(3):260-4.
[https://doi.org/10.1254/jphs.09R06FM]

-
Makrantonaki E, Ganceviciene R, Zouboulis C. An update on the role of the sebaceous gland in the pathogenesis of acne. Dermatoendocrinol. 2011;3(1):41-9.
[https://doi.org/10.4161/derm.3.1.13900]

-
Tontonoz P, Kim JB, Graves RA, Spiegelman BM. ADD1: a novel helix-loop-helix transcription factor associated with adipocyte determination and differentiation. Mol Cell Biol. 1993;13:4753-9.
[https://doi.org/10.1128/MCB.13.8.4753]

-
Horton JD. Sterol regulatory element-binding proteins: transcriptional activators of lipid synthesis. Biochem Soc Trans. 2002;30:1091-5.
[https://doi.org/10.1042/bst0301091]

- Lee W, Seo YK. SREBP as a Global Regulator for Lipid Metabolism. J Life Science. 2018;28(10):1233-43.
- Kim CM, Sin MG, An DG, Lee KS, et al. Dictionary of Traditional Chinese Materia Medics. Seoul: Jeongdam; 1997. Vol 7. p. 3221-5.
- Lee SJ. Bonchogangmok. Beijing: Renmin weisheng chubanshe; 1999. p. 891-4.
- Kim CM, Sin MG, An DG, Lee KS. Dictionary of Traditional Chinese Materia Medics. Seoul: Jeongdam; 1998. p. 4163-7.
- Han KC, Lee JY, Kim DG. Effects of Arctii Fructus on the Atopic dermatitis. J Korean Oriental Pediatrics. 2004;18(2):107-17.
- Jang SC, Song CH. Study on anti-allergic effects of Arctii Fructus herbal acupuncture. J Meridian & Acupoint. 2008;25(1):197-211.
- Jun HJ, Kim SY, Son JH. The Effect of Cream Containing Arctii fructus Extracts on the Improvement of Facial Skin. Kor J Aesthet Cosmetol. 2014;12(6):885-90.
-
Kim TH, Park JK, Jeong NH. Whitening Effects of Arctigenin Extracted from the Arctii Fructus, J Korean Oil Chemists Soc. 2015;32(3):505-11.
[https://doi.org/10.12925/jkocs.2015.32.3.505]

-
Wang KJ, Zhang YJ, Yang CR. Antioxidant phenolic compounds from rhizomes of Polygonum paleaceum. J Ethnopharmacol. 2005;96(3):483-7.
[https://doi.org/10.1016/j.jep.2004.09.036]

-
Hwang JY, Park TS, Kim DH, Hwang EY, Lee JN, Lee JY, et al. Anti-wrinkle Compounds Isolated from the Seeds of Arctium lappa L. J Life Science. 2012;22(8):1092-8.
[https://doi.org/10.5352/JLS.2012.22.8.1092]

-
Oudshoorn MH, Rissmann R, Coelen D, Hennink WE, Ponec M, Bouwstra JA. Effect of synthetic vernix biofilms on barrier recovery of damaged mouse skin. Exp Dermatol. 2009;18(8):695-703.
[https://doi.org/10.1111/j.1600-0625.2009.00858.x]

-
Thiboutot D. Regulation of human sebaceous glands. J Invest Dermatol. 2004;123(1):1-12.
[https://doi.org/10.1111/j.1523-1747.2004.t01-2-.x]

-
Ge L, Gordon JS, Hsuan C, Stenn K, Prouty SM. Identification of the delta-6 desaturase of human sebaceous glands: expression and enzyme activity. J Invest Dermatol. 2003;120(5):707-14.
[https://doi.org/10.1046/j.1523-1747.2003.12123.x]

-
Daoud G, Simoneau L, Masse A, Rassart E, Lafond J. Expression of cFABP and PPAR in trophoblast cells: effect of PPAR ligands on linoleic acid uptake and differentiation. Biochim Biophys Acta. 2005;1687(1-3):181-94.
[https://doi.org/10.1016/j.bbalip.2004.11.017]

-
Yamamoto A, Takenouchi K, Ito M. Impaired water barrier function in acne vulgaris. Arch Dermatol Res. 1995;287:214-8.
[https://doi.org/10.1007/BF01262335]

-
Letawe C, Boone M, Pierard GE. Digital image analysis ofthe effect of topically applied linoleic acid on acne microcomedones. Clin Exp Dermatol. 1998;23:56-8.
[https://doi.org/10.1046/j.1365-2230.1998.00315.x]

- Lee SE, Jeong SK, Youm JK, Lee SH. Effect of topically applied multi-lamellar emulsion containing linoleic acid on experimentally induced comedones. Korean J Dermatol. 2007;45(3):249-54.
- Burr GO, Burr MM. A new deficiency disease produced by the rigid exclusion of fat from the diet. J Biol Chem. 1992;82:345-67.
- Cho Y, Seong K, Lee EJ, Ahn DK, Park SK. Analysis of linoleic acid on the extraction method of Arctii Fructus. Korean J Herbology. 2002;17(2):11-7.
- Baek JW, Jeong MK, Ko SG, Jun CY, Park JH, Choi YK. Effects of Taeeumjowuitanggagam-bang on the expression of edipocytokines and SREBPs in liver of db/db mouse. Korean J Oriental Physiology & Pathology. 2010;24(6):989-95.
- Kim DS, Jeon BK, Mun YJ, Lee GT, Lee KK, Woo WH. Ponciri Fructus extract induces lipogenesis through transcription factor SREBP-1 activation. Yakhak Hoeji. 2012;56(4):268-73.