대사적 관점에서 肝主風에 관한 小考
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
The liver is a major organ in human metabolism and is responsible for systemic circulation and metabolism. The traditional concepts of wind related to the nervous and motor system have limitations in explaining the role of the liver in human metabolism. To overcome these limitations, it is necessary to focus on the physiological activity and pivotal role of bioactive gases in the metabolism of gas flow. Additionally, the action of bioactive gases occurs in the presence of chromoprotein, such as heme protein, which acts as a photoreceptor between the eyes and the liver, ultimately involved in the circadian cycle and metabolism. This series of processes demonstrates that the unique theories of Korean medicine—where the liver governs the wind and the eyes—are accurately aligned from a metabolic perspective, suggesting that Korean medicine physiology can be integrated and appreciated from a modern medical standpoint.
Keywords:
Liver, Wind(風), Bioactive gases, Metabolism, Korean medicine, Circadian cycle서 론
風熱濕燥寒火의 六氣는 자연계의 정상적인 기후변화이기도 하지만, 인체의 생리병리와 질병을 분석하는 한의학의 독특한 이론체계이기도 하다. 이는 만물의 생성과 변화에 필수적이며, 인체도 이에 의존하여 자연에서 생존이 가능하다1). 이 중 '풍(風)'은 인체에 병을 일으키는 주요 원인 중 하나로, 다양한 질환의 발병과 깊이 관련된 개념으로 자리잡고 있다2). 전통적으로 '풍'은 외부에서 침입하여 신체의 균형을 깨뜨리는 외부 병인으로 인식되었으며, 그 성질이 好動流注하여 주로 갑작스럽게 발생하는 증상, 이동성, 변화무쌍한 성격을 특징으로 한다. 특히, 中風, 歪斜風 등의 운동성마비와 驚風, 破傷風, 臍風 등의 경련성 운동항진을 포함하는 주로 운동성 장애에서 風의 작용이 중요하게 고려되었다3).
그러나 현대 사회로 접어들면서 생활 환경과 질병 양상은 과거와 크게 달라졌고, 이에 따라 전통적 '風'의 개념을 현대적 시각에서 재해석할 필요성이 대두되고 있다. 현대 의학의 발달로 질병의 병태생리학적 이해가 심화되었고, 새로운 진단 기술과 치료법이 개발됨에 따라, '風'의 개념을 현대 의학적 관점에서 어떻게 해석하고 적용할 수 있을지에 대한 논의가 요구되고 있다. 뿐만 아니라, 기존의 신경계, 운동기계 관련 개념만으로는 代謝의 핵심 장기인 肝의 역할과 肝의 五官인 目과의 상관성을 설명하는 데 있어 한계점이 있다.
본 연구의 목적은 한의학에서의 '風' 개념을 현대적 시각에서 재해석함으로써, 이를 현대 의학의 질병 분류 체계와 치료 접근에 통합할 수 있는 가능성을 모색하는 것이다. 특히, '風'이 人體代謝에서 어떤 역할을 담당하고 있는지, 또 현대 의학적 개념과는 어떤 연관성이 있는지를 재조명하고, 이를 통해 한의학과 현대 의학과의 융합 가능성의 제고를 목표로 한다. 이와 같은 융합적 사고를 위해 여기서는 肝을 한의학적 개념의 유기능적이고 포괄적인 개념이 아닌, 해부학적 장기로서의 肝의 역할로 축소해서 파악하고자 한다.
본 론
1. 風의 개념
風은 작용은 있으나 형체가 없는 것으로 氣流를 일으켜 木의 發生之氣를 生한다고 하였으며, 肝은 風木의 왕성한 運動·發生之氣를 가지고 있어 전신 대사·순환의 條達·舒暢을 주관하게 된다3). 병리적인 '風'은 외부의 病因으로, 주로 기후 변화나 환경적인 요인에 의해 발생하는 것으로 여겨진다. 전통적으로 風은 '六淫' 중 하나로, 寒, 熱, 濕, 燥, 火와 함께 신체에 침입하여 다양한 병증을 일으킨다4). 風의 가장 큰 특징은 빠르고 갑작스럽게 발생하며, 이동성과 변화무쌍한 성격을 지니고 있다는 것이다. 이는 바람의 속성과 유사한데, 한의학에서는 이러한 특성을 가진 風이 인체의 표면(피부, 근육)이나 경락을 따라 신체에 침입하여, 주로 상부나 외부에 증상을 일으킨다고 본다5).
風은 흔히 급성 질환의 원인으로 간주되며, 『素問·至眞要大論』에 "諸風掉眩皆屬于肝" 이란 내용이나, 風上攻 또는 肝風內動으로 두통, 현기증, 발열, 오한, 피부 발진, 경련, 마비 등의 증상을 유발할 수 있다. 예를 들어, 風寒은 외부의 찬 바람에 노출되었을 때 발생하는 감기와 같은 증상을 설명하며, 風熱은 발열과 같은 열성 증상을 동반한 질환을 나타낸다. 또한, 風은 흔히 이동성과 변화성을 지닌 병증과 관련되므로, "風善行而數變"이라 하여, 바람처럼 자주 변하고 움직이는 성질을 강조한다6).
『內經』에서의 風病의 개념은 歸屬物類의 바탕 속에 風의 속성을 지닌 질환, 虛風에 의한 질환, 風과 다른 邪氣(寒, 濕 등)와의 합병에 의한 질환으로 구분할 수 있다. 이후 風病의 병인병리와 관련한 다양한 주장들이 있어 왔으나, 대체로 宋代 이전 학자들은 外感風邪說을 위주로 外因性 風病 발생설이 주류를 이루었다3).
金元代 이후의 학자들은 內因性 風病발생설을 주장하게 되는데, 이는 風의 개념이 단순히 외부에서 발생하는 병인에 국한되지 않으며, 내부적 요인과도 관련될 수 있다는 것이다. '內風'은 인체 내부에서 발생하는 바람으로, 주로 肝의 기능 이상과 관련이 깊다. 肝의 陽亢이나 血虛와 같은 상태가 발생하면, 內風이 일어나면서 경련, 떨림, 어지러움 등의 증상을 유발할 수 있다. 특히, 淸代末 葉桂의 '肝陽偏亢, 肝風內動'이라는 개념은 이러한 內風의 작용을 설명하는 대표적인 예로, 신경계 이상이나 뇌혈관 질환과 관련된 증상들로 해석될 수 있다3). 현재 風病이라 하면 운동 및 감각장애를 나타내는 병증으로 인식되고 있는데, 이는 모두 內風의 병인병리에 기인한 것이다7).
문헌에서 '風'자가 붙은 병증은 무려 300여 종에 이를 정도로 많다. 이 중 신경학적 장애를 거의 일으키지 않는 外風邪에 의한 병증(ex; 太陽經病에서의 中風)은 일부에 지나지 않고, 대부분 신경계 이상 또는 근운동장애를 주증으로 표현하는 병증이 다수이다3).
현대 의학에서는 전통적인 風의 개념이 신경계, 면역계, 또는 자율신경계의 이상과 관련된 질환으로 해석될 수 있다. 예를 들어, 한의학에서 風으로 설명되는 증상 중 많은 부분이 알레르기, 자가면역 질환, 신경계 질환(예: 중풍, 파킨슨병, 편두통)과 연관될 수 있다. 특히, 급성으로 발생하는 감염성 질환이나 신경계 증상들이 '風'의 특성과 일치하는 경우가 많다. 또한, 風은 자율신경계 불균형이나 스트레스성 질환과도 연관될 수 있다. 바람처럼 예측할 수 없는 변화와 이동성은 스트레스에 따른 자율신경계의 불안정한 반응과 유사하다. 이와 같이, 風은 한의학과 현대 의학을 연결하는 다리 역할을 할 수 있는 중요한 개념으로 평가될 수 있다5).
최근에는 이러한 風의 개념이 암으로까지 확장되어, 간에서 유래한 內風이 악성 종양의 원인 중 하나일 뿐만 아니라 전이 형성의 주요 원인으로 설명하고 있다. 암 환자에게는 痰(Phlegm), 毒熱火(Toxic Heat-Fire) 및 風寒으로 인한 氣 정체(Wind-Cold causing Qi stagnation)의 세 가지 주요 패턴이 나타나며, 이는 각각 과형성(hyperplasia), 신생물(neoplasia) 및 전이(metastasis)에 영향을 미치게 된다. 종양 형성에는 內風이 수반되며, 이는 肝風을 도와 혈액 정체, 痰, 내장 독소를 유발하여 폐, 간, 뇌, 림프계, 뼈 또는 피부에 전이가 형성되게 된다8).
결론적으로, 한의학에서의 風 개념은 단순한 병인의 하나를 넘어, 인체의 다양한 기능적 불균형을 설명할 수 있는 광범위한 개념으로 자리 잡고 있다. 이러한 風의 전통적 개념을 현대 의학의 질병 분류와 연결 지어 재해석함으로써, 통합적이고 총체적인 접근이 가능할 것이다.
2. 바이오 활성가스와 風
風인 바람의 정의는 공기의 흐름으로 대기를 이루는 가스 물질의 흐름을 일컫는 말이다9). 인체 내에서도 변화되는 외부 환경에 대해 항상성을 유지하고 생리활성을 일으키는 가스가 있다. 바이오 활성가스(bioactive gases)는 인체 내에서 다양한 생리적, 병리적 과정에 관여하는 소분자 가스를 지칭하며, 산소(O)와 경쟁적으로 작용하는 일산화질소(nitric oxide, NO), 일산화탄소(carbon monoxide, CO), 황화수소(hydrogen sulfide, H₂S) 등이 대표적이다. 이러한 가스들의 가장 중요한 역할은 산소의 조절에 있으며, 신경 전달, 혈관 확장, 면역 조절 등의 중요한 생체 기능을 조절하는 데 핵심적인 역할을 한다. 최근 연구에 따르면, 이들 가스는 인체의 항상성 유지와 스트레스 반응 조절에 중요한 영향을 미치며, 각종 질환과 연관되어 있다는 점에서 주목받고 있다10).
1938년 오파린이 제시한 원시대기에서 여러 유기화합물이 만들어진다는 생명의 기원 가설은 해럴드 유리와 스탠리 밀러의 유리 방전 실험을 통해 실험적으로 확인되었고, 1953년에 타임지에 실릴 정도로 그 파급효과는 엄청났다고 할 수 있다. 그러나, 유리와 밀러가 사용한 가스는 메탄, 암모니아 및 수소가스의 환원형으로 실제 원시대기는 환원형이라기보다는 중성에 가까운 질소와 이산화탄소, 일산화탄소, 황화수소 등으로 이루어졌다는 것이 정설이다. 이러한 원시대기의 조성은 실제 인체 내 대사와 생리활성을 일으키는 바이오 활성가스의 구성과 유사하다11).
한편, 한의학에서 風은 전통적으로 외부의 바람, 즉 기후적 변화나 환경적 요인으로 인해 인체에 발생하는 병리적 상태를 설명하는 중요한 개념으로 자리 잡고 있다. 風은 신체의 급격한 변화, 이동성, 불안정성을 유발하며, 이러한 특징은 바이오 활성가스의 작용과 유사한 면이 있다. 특히, 風이 유발하는 증상들은 자율신경계 불균형, 면역계 이상, 또는 신경계 질환과 관련된 것들이 많아, 바이오 활성가스의 작용과 연계될 수 있는 가능성을 시사한다5).
3. 바이오 활성가스의 생리적 기능
바이오 활성가스의 생리적 기능이 밝혀진 것은 생명과학의 역사에서 비교적 최근의 일이다. 1980년대 중반까지만 해도 일산화질소, 황화수소, 이산화황 등의 물질들은 대기오염물로만 여겨졌으나, 이러한 기체 분자들이 신경계, 심혈관계, 소화기계, 신진대사 체계에서 광범위한 생리 병리 과정에 관여한다는 사실이 점차 밝혀지게 되었다12). 다양한 바이오 활성가스가 생체 내 신호전달에 필수적이라는 사실이 점차 밝혀지기 시작하면서, '기체 전달물질(gaseous transmitter 또는 gasotransmitter)', '기체수용체(gasoreceptor)'와 같은 용어들도 사용되기 시작하였다13). NO는 다양한 생물학적 활성을 가진 내인성 가스로 처음 입증되었으며 CO와 최근에는 H₂S의 발견으로 이어졌다. 이러한 기체 분자 각각은 생화학적으로 특성화된 내인성 효소에 의해 자연적으로 합성되며, 각각은 잘 확립된 분자 표적을 통해 유사한 생물학적 효과를 생성한다14).
NO는 혈관 확장, 혈압 조절, 면역 반응, 신경 전달 조절 등 다양한 생리적 과정에 관여하는 중요한 신호 분자이다. 아르기닌을 시트룰린으로 변화시키는 과정에서 만들어지며, 산소와 결합하여 세균의 살상 무기가 된다. Ignarro 등은 NO가 내피세포에서 생성되어 혈관 평활근을 이완시켜 혈류를 증가시키며, 심혈관 확장 작용을 통하여 협심증 등의 심혈관 질환에 치료 효과가 있음을 밝혀내어 1998년 노벨의학상을 수상하였다. NO는 신경계에서는 신경전달물질로 작용하여 신경 신호의 전도를 조절한다. 또한, 면역계에서는 대식세포의 활성화를 통해 병원체 제거에 기여하는 등 다양한 기능을 수행한다15-17).
NO는 또한 생체 시계의 구성 요소인 REV-ERB18), CLOCK19) 등과 상호작용한다. 일산화질소 합성효소가 결여된 초파리는 어둠 자극이 지속되는 경우 생체 시계 유전자는 정상이더라도 불규칙한 행동을 나타내게 된다. 저자들은 혈뇌장벽을 형성하고 있는 교세포 중 신경주위 교세포(perineural glia)가 초파리의 일주기 운동 출력을 조절하는 NO의 중요한 공급원임을 확인하였다20). 한편, 내피세포에 의하여 합성되는 NO는 심혈관계 항상성에 중요한 기능을 한다. 포유류의 내피세포에서 일산화질소 합성효소의 기능 차단은 생체 시계 유전자의 발현 손상으로 이어지며, 이는 하루 주기에 따른 혈압 조절 기능의 감퇴로도 이어진다.21)
CO는 주로 헤모글로빈의 분해 과정에서 생성된다. CO를 만드는 효소는 신경세포와 뇌에 혈액을 운반하는 혈관내피세포에 주로 존재하여, 혈관 확장, 항염증, 세포 보호 등의 역할을 한다. CO는 세포 내 신호전달 경로를 조절하여 항산화 효과를 나타내며, 스트레스 반응에서 세포 손상을 줄이는 데 기여한다22,23).
CO 또한 생체 시계의 구성 요소 REV-ERB18), CLOCK19) 등과 상호작용하는 것으로 밝혀져 있다. 쥐에서 복강내 hemoCD1 주사로 체내 CO의 양을 감소시키면 간에서 NPAS2와 CLOCK의 DNA E-box 결합이 촉진되며, E-box에 의하여 발현되는 생체 시계 유전자(Per1, Per2, Cry1, Cry2, Rev-erbα) 등의 양이 증가하는 것이 확인되었다. 3시간 후에는 간에서 헴-산화효소-1(heme-oxygenase, HO-1)의 발현이 유도되어 내인성 CO 생성이 증가하였으며, 그로 인하여 NPAS와 CLOCK는 E-box로부터 분리되고, E-box에 의하여 발현되는 생체 시계 유전자의 발현량 또한 감소하였다24). 이처럼 CO 또한 일주기 리듬 조절에 관여한다는 사실이 밝혀지고 있으며, 적정 농도에서는 신경 보호 효과를 나타내기도 하여 신경계 질환의 예방 및 치료에 활용될 수 있는 가능성이 제시되고 있다22,23).
물과 화학적으로 가장 비슷한 구조를 가지고 있고, 탄소가 아닌 에너지원으로 유일한 것이 황화수소다. 황화수소는 시스테인 대사 과정에서 만들어지며, 신경 보호, 혈관 확장, 항염증 작용을 하는 생리적 가스로, 최근 다양한 질환에서의 치료 가능성에 대해 연구가 활발히 진행되고 있다. H₂S는 내인성 환원제로 기능함으로써 세포 내 산화환원 상태에 영향을 줄 수 있다. H₂S는 신경계에서 신경세포의 세포 사멸을 예방함으로써 신경 퇴행성 질환의 진행을 억제할 수 있으며, 또한 세포의 항산화 방어 체계를 강화하여 염증 반응을 줄이는 데 중요한 역할을 한다14,24).
H₂S 또한 일주기 변동을 나타내며, 생체 시계 유전자와 상호작용한다. 혈장 내 H₂S 및 H₂S를 생산하는 효소인 3‐mercaptopyruvate sulfurtransferase (MPST) 활성은 일주기 변동을 나타낸다는 것이 쥐 실험을 통해 밝혀졌다25). 또한, 실험적으로 H₂S를 활용하여 분리된 간세포에서 점차 발현 수준과 리듬이 감소하는 Clock, Per2, Bmal1, Rev-erbα 등의 일주기 유전자들의 발현과 진폭을 회복시키고, 일주기 리듬을 유지할 수 있음이 확인되었다26). 쥐의 심근세포를 활용한 실험에서도 H₂S를 처리하면 Bmal1의 발현 수준이 증가하고, 시계 유전자의 리듬이 유지되는 것이 밝혀졌다27). 생쥐의 심근세포는 노화에 따라 산화스트레스가 증가하고 H₂S 수준은 감소하며 이는 심장의 기능 감소와 관련이 있는데, 황화 수소 나트륨(sodium hydrogen sulfide, NaHS)을 공급하면 산화스트레스가 감소하고, 심장 기능의 일주기성이 회복된다28). 이처럼 기존에는 H₂S가 대기오염 물질로만 여겨졌으나, 최근에는 생체 내에서 중요한 기능을 하는 기체 분자임이 밝혀지고 있어, 허혈성 심질환 뿐 아니라 간섬유화, 간암, 지방간, 간의 허혈 재관류 손상 등과 관련되는 다양한 간 질환의 예방 및 치료에 활용될 수 있는 가능성이 제시되고 있다29).
4. 바이오 활성가스와 대사 (Metabolism)
물질대사에서 가장 기본이 되는 것은 철(Fe)과 헴(heme)이 포함된 대사 과정이라고 할 수 있다. 바이오 활성가스는 중요한 세포 내 대사 조절 물질로, 바이오 활성가스의 독성과 활성은 모두 헴 속의 철과 결합할 수 있는 화학적 특성에 기인한다. 또한, 바이오 활성가스를 만들어내는 효소들은 모두 헴을 가지고 있거나, 최소한 헴과 결합해야만 한다. 대사는 전자의 이동에 의한 산화·환원반응이라 할 수 있는데, 헴은 이러한 전자를 전달하고, 거의 모든 생명체에 필요할 뿐만 아니라 세포대사의 중심에 있기에, 헴과 밀접한 관련이 있는 바이오 활성가스는 다양한 영역의 대사 과정에서 핵심적인 역할을 담당하게 된다(Table 1)30).
헴은 세포의 내인성 일주기 리듬 조절자인 CLOCK, REV-ERB와 상호작용하여 대사 리듬의 일주기 조절에도 영향을 미치는 것으로 밝혀져 있다. Freeman 등은 사람의 CLOCK에서 헴 구조와 상호작용하는 PER-ARNT-SIM(PAS)-A 및 PAS-B 도메인을 확인하였다. 헴은 CLOCK이 E-box에 결합하는 것을 저해하여 CLOCK에 의한 전사 조절에 영향을 미친다19). 헴은 또한 일주기 리듬 조절에 있어 중요한 전사 억제자인 REV-ERBα 및 REV-ERBβ의 리간드로도 작용한다. Pardee 등에 의하면 헴이 REV-ERB에 가역적으로 결합하는 리간드 결합 도메인은 C-말단에 존재한다18).
헴은 다양한 바이오 활성가스와 결합하여 작용할 수 있는데, CLOCK, REV-ERB 등에 의한 전사 조절에 있어서도 그러하다. CO가 헴에 결합하면 CLOCK의 헴 주머니의 구조가 변화하는 것으로 여겨진다. 이러한 구조 변화가 생물학적으로 어떠한 결과로 이어지는지는 아직 구체적으로 밝혀져 있지 않다19). REV-ERB의 경우, 리간드 결합 도메인에 헴 뿐 아니라 NO, CO가 결합할 수 있으며, 그 결과 여러 가지 다양한 구조 상태가 야기될 수 있다18). 큰 틀에서 보면, 헴이 결합하면 REV-ERB의 전사 공동 억제 단백질들이 동원되어 REV-ERB의 표적 유전자들의 발현 억제로 이어진다31). 한편, REV-ERBβ의 리간드 결합 도메인은 Fe2+-헴에 비해 Fe3+-헴에 약 220배 정도 더 강한 친화력으로 결합하는 데 반해 CO나 NO와 같은 바이오 활성가스 분자들은 Fe2+-헴과 더 안정적으로 결합한다. CO 및 NO는 Fe3+-헴의 환원을 일으켜 Fe2+-헴 상태로의 전환을 유도하기 때문에, 세포 내의 CO 및 NO의 농도에 따라 Fe3+-REV-ERBβ의 활성이 조절된다. 이처럼 헴과 CO와 NO 등의 바이오 활성가스가 일주기 리듬의 조절에 있어 중요한 기능을 한다는 사실이 점차 밝혀지고 있으나, 그 분자적 기전은 이제 밝혀지기 시작하는 단계에 있다32).
5. 포르피린과 目
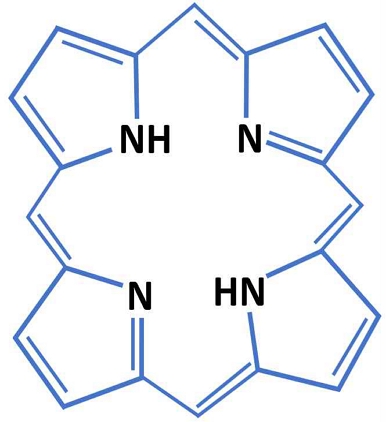
피롤(pyrrole)은 C4H5N의 분자식을 가진 오각형 모양의 비대칭 고리 구조의 방향족 유기화합물로, 포르피린(porphyrin)은 이러한 피롤 구조 4개가 일렬로 또는 고리 모양으로 연결된 테트라피롤(Tetrapyrrole) 화합물이다(Fig. 1). 이 분자는 기본적으로 24개의 원소로 이루어진 환상구조로 이루어져 있으며 가운데 질소 4개가 철 또는 마그네슘과 결합하게 되면, 헤모글로빈과 엽록소가 된다. 이러한 테트라피롤 구조는 세포 내 산화환원 반응을 주재하는 금속을 중앙에 가지고 있어, 빛을 흡수하고, 전자를 전달하고, 산소를 결합시키는 최적화된 구조라 할 수 있다. 따라서, 전자의 이동에 의한 산화환원 반응인 대사 반응에 있어서 포르피린은 핵심적인 역할을 담당하게 된다10).
자연계에서 빛을 화학물질로 전환시키는 능력만큼 특별한 것은 없다. 식물의 색소는 광자를 흡수하는데 유리한 구조로 되어있고, 질소가 없는 색소는 카로티노이드(carotenoid)와 퀴논(quinone)이 대표적이고, 질소를 지닌 색소는 테트라피롤, 인디고이드(indigoid), 플라빈(flavin) 등이 있다. 이러한 색소와 유관한 색소단백질(chromoprotein)은 색소 보결분자단(a pigmented prosthetic group)을 포함하는 복합 단백질로서, 산소화된 혈액을 붉게 보이게 만드는 헴단백질, 사이토크롬(cytochromes), 파이토색소단백질(phytochromes), 플라보단백질(flavoproteins) 등이 있다33).
인체 내에서도 빛에 반응하여 색을 인식하고 세포 활동을 유도하는 광수용체가 있다. 이러한 광수용체는 두 가지 유형이 있으며, 각각 크립토크롬(cryptochrome)과 사이토크롬(cytochrome)으로 腦와 肝에 내재화된다34,35). 눈은 더 진화된 광수용체인 옵신(opsin)을 활용하여, 로돕신(rhodopsin), 포톱신(photopsin), 멜라놉신(melanopsin)의 세 가지 종류가 있다. 앞의 두 옵신은 가쪽무릎핵(lateral geniculate nucleus, LGN)에서 시각 경로를 던지는 시각 형성 과정에 관여하고, 멜라놉신은 동공 반사 및 일주기 회로(circadian cycle)와 같은 시교차상핵(suprachiasmatic nucleus, SCN)의 비시각 형성 과정을 담당한다36,37).
간에 내재화된 광수용체인 사이토크롬은 미토콘드리아에서 에너지대사에 중요한 역할을 담당하게 되고, 눈을 통해 뇌에 내재화된 광수용체인 크립토크롬은 SCN을 통해 일주기 회로를 돌게 된다38). 동물계에는 두 종류의 크립토크롬이 존재한다. 그중 초파리-유사 크립토크롬(drosophila-like CRYs)은 청색광에 직접적으로 반응하여, 외부 빛 자극에 따른 일주기 리듬을 재조절하는 기능을 하는 데 필수적이며, 대사가 활발하게 일어나는 조직에서도 많이 발현되며 중성지방 대사에 관여한다39). 한편, 척추동물-유사 크립토크롬(vertebrate-like CRYs)은 외부 빛 자극과는 독립적으로 세포 내 중심 시계의 일부로 기능함으로써 일주기 리듬 생성에 중요한 역할을 하며, 그 외에도 세포 내 항상성 유지 및 DNA 손상에 대한 조절 반응, 글루코코르티코이드 신호 조절을 통한 일주기 및 대사 조절에 관여하며, 자기수용체(magnetoreceptors)로 기능하기도 한다40). 사람에서 크립토크롬은 자기수용체로 기능하여 자기 자극에 따라 산화-환원 반응을 나타내며 활성산소를 조절하는 기능을 하기도 한다41). 또한, 최근에는 인간 또한 지구의 자기장을 감지하여 방향을 찾는 능력이 있다는 사실이 밝혀지고 있는데, 이러한 감지 기능은 특히 크립토크롬이 반응하는 400~500 nm 파장의 청색광에 의존적으로 재현되는 것으로 나타났다42).
결 론
肝은 인체 대사의 핵심 장기로 전신 대사·순환의 條達·舒暢을 주관한다43). 전통적 風의 개념인 신경계와 운동기계 관련 개념만으로는 인체 대사에서의 風의 역할을 설명하는 데는 한계가 있다. 이러한 한계를 극복하기 위해, 바람은 가스 물질의 흐름으로 바이오 활성가스의 생리적 활성과 대사에서의 중추적 역할에 주목할 필요가 있다. 또, 바이오 활성가스의 작용은 헴단백과 같은 색소단백의 존재하에서 이루어지게 되고, 색소단백은 눈과 간의 광수용체로 일주기 회로와 최종경로로 대사에 관여하게 된다. 이와 같은 일련의 과정들은 肝主風, 肝主目의 한의학 고유이론이 대사적 관점에서도 정확히 부합됨을 알 수 있고, 한의생리학이 현대 의학적 관점에서도 수용과 융합이 가능하리라 사료된다.
References
-
Kim MH, Kim BS. Study on the concept and its structure of visceral system in current traditional Korean medicine. J Physiol Pathol Korean Med. 2017;31(6):305-12.
[https://doi.org/10.15188/kjopp.2017.12.31.6.305]

- Zhenguao W, Peiping X, Ping C. History and development of traditional Chinese medicine (advanced traditional Chinese medicine series). Amsterdam: IOS Press; 2000.
- Professors of Hepatology of Korean Medicine, Nationwide Colleges of Korean Medicine. Hepatology in Korean Medicine, 7th Edition. Seoul: Woori Medical Books; 2024. p. 9-10, 409-411.
- Noh EJ. Herbal Clinical Clues. Seoul: Bareun Herbal Medicine Publisher; 2018. p. 16, 592.
-
Dashtdar M, Dashtdar MR, Dashtdar B, Kardi K, Shirazi MK. The Concept of Wind in Traditional Chinese Medicine. J Pharmacopuncture. 2016;19(4):293-302.
[https://doi.org/10.3831/KPI.2016.19.030]

- Dashtdar M. Textbook of acupuncture. Riga: VDM Verlag Dr. Muller; 2010.
- Huang PX, Liu MC. Stroke and Parkinson’s disease: the clinical practice of Chinese medicine. Washington D.C.: People’s Medical Publishing House; 2007.
- Walters R. The alternative cancer therapy book. New York: Avery Publishing Group; 1992.
- Wikipedia. “Wind.” Last modified September 4, 2024. Available from: https://en.wikipedia.org/wiki/Wind, .
- Kim, HP. Oxygen and Its Competitors. Seoul: JJisikeul Mandeuneun Jisik, 2013. p. 12-14, 57, 72, 83, 95, 173, 197.
-
Miller SL. A production of amino acids under possible primitive earth conditions. Science. 1953;117(3046):528-9.
[https://doi.org/10.1126/science.117.3046.528]

-
Qi W, Man L, Suguro S, Zhao Y, Quan H, Huang C, et al. Endocrine effects of three common gas signaling molecules in humans: A literature review. Front Endocrinol. 2022;13:1074638.
[https://doi.org/10.3389/fendo.2022.1074638]

-
Anbalagan S. Oxygen is an essential gasotransmitter directly sensed via protein gasoreceptors. Anim Models Exp Med. 2024;7(2):189-93.
[https://doi.org/10.1002/ame2.12400]

-
Wang R. Physiological implications of hydrogen sulfide: a whiff exploration that blossomed. Physiol Rev. 2012;92(2):791-896.
[https://doi.org/10.1152/physrev.00017.2011]

-
Moncada S, Higgs A. The L-arginine-nitric oxide pathway. N Engl J Med. 1993;329(27):2002-12.
[https://doi.org/10.1056/NEJM199312303292706]

-
Förstermann U, Sessa WC. Nitric oxide synthases: regulation and function. Eur Heart J. 2012;33(7):829-37.
[https://doi.org/10.1093/eurheartj/ehr304]

-
Ignarro LJ, Buga GM, Wood KS, Byrns RE, Chaudhuri G. Endothelium-derived relaxing factor produced and released from artery and vein is nitric oxide. Proc Natl Acad Sci USA. 1987;84(24):9265-9.
[https://doi.org/10.1073/pnas.84.24.9265]

-
Pardee KI, Xu X, Reinking J, Schuetz A, Dong A, Liu S, et al. The structural basis of gas-responsive transcription by the human nuclear hormone receptor REV-ERBβ. PLoS Biol. 2009;7(2):e1000043.
[https://doi.org/10.1371/journal.pbio.1000043]

-
Freeman SL, Kwon H, Portolano N, Parkin G, Venkatraman Girija U, Basran J, et al. Heme binding to human CLOCK affects interactions with the E-box. Proc Natl Acad Sci USA. 2019;116(40):19911-6.
[https://doi.org/10.1073/pnas.1905216116]

-
Kozlov A, Koch R, Nagoshi E. Nitric oxide mediates neuro-glial interaction that shapes Drosophila circadian behavior. PLoS Genet. 2020;16(6):e1008312.
[https://doi.org/10.1371/journal.pgen.1008312]

-
Kunieda T, Minamino T, Miura K, Katsuno T, Tateno K, Miyauchi H, et al. Reduced nitric oxide causes age-associated impairment of circadian rhythmicity. Circ Res. 2008;102(5):607-14.
[https://doi.org/10.1161/CIRCRESAHA.107.162230]

-
Ryter SW, Alam J, Choi AM. Heme oxygenase-1/carbon monoxide: from basic science to therapeutic applications. Physiol Rev. 2006;86(2):583-650.
[https://doi.org/10.1152/physrev.00011.2005]

-
Motterlini R, Otterbein LE. The therapeutic potential of carbon monoxide. Nat Rev Drug Discov. 2010;9(9):728-43.
[https://doi.org/10.1038/nrd3228]

-
Minegishi S, Sagami I, Negi S, Kano K, Kitagishi H. Circadian clock disruption by selective removal of endogenous carbon monoxide. Sci Rep. 2018;8(1):11996.
[https://doi.org/10.1038/s41598-018-30425-6]

-
Jin S, Tan B, Teng X, Meng R, Jiao X, Tian D, et al. Diurnal fluctuations in plasma hydrogen sulfide of the mice. Front Pharmacol. 2017;8:682.
[https://doi.org/10.3389/fphar.2017.00682]

-
Shang Z, Lu C, Chen S, Hua L, Qian R. Effect of H 2 S on the circadian rhythm of mouse hepatocytes. Lipids Health Dis. 2012;11:1-7.
[https://doi.org/10.1186/1476-511X-11-23]

-
Hu J, Xue Y, Tang K, Fan J, Du J, Li W, et al. The protective effects of hydrogen sulfide on the myocardial ischemia via regulating Bmal1. Biomed Pharmacother. 2019;120:109540.
[https://doi.org/10.1016/j.biopha.2019.109540]

-
Zhang H, Dai J, Tian D, Xiao L, Xue H, Guo Q, et al. Hydrogen sulfide restored the diurnal variation in cardiac function of aging mice. Oxid Med Cell Longev. 2021;2021(1):8841575.
[https://doi.org/10.1155/2021/8841575]

-
Wu DD, Wang DY, Li HM, Guo JC, Duan SF, Ji XY. Hydrogen sulfide as a novel regulatory factor in liver health and disease. Oxid Med Cell Longev. 2019;2019(1):3831713.
[https://doi.org/10.1155/2019/3831713]

-
Kajimura M, Nakanishi T, Takenouchi T, Morikawa T, Hishiki T, Yukutake Y, et al. Gas biology: tiny molecules controlling metabolic systems. Respir Physiol Neurobiol. 2012;184(2):139-48.
[https://doi.org/10.1016/j.resp.2012.03.016]

-
Griffett K, Hayes ME, Boeckman MP, Burris TP. The role of REV-ERB in NASH. Acta Pharmacol Sin. 2022;43(5):1133-40.
[https://doi.org/10.1038/s41401-022-00883-w]

-
Sarkar A, Carter EL, Harland JB, Speelman AL, Lehnert N, Ragsdale SW. Ferric heme as a CO/NO sensor in the nuclear receptor Rev-Erbß by coupling gas binding to electron transfer. Proc Natl Acad Sci USA. 2021;118(3):e2016717118.
[https://doi.org/10.1073/pnas.2016717118]

- Wikipedia. “Chromoprotein.” Last modified December 3, 2023. Available from: https://en.wikipedia.org/wiki/Chromoprotein, .
-
Blackshaw S, Snyder SH. Encephalopsin: a novel mammalian extraretinal opsin discretely localized in the brain. J Neurosci. 1999;19(10):3681-90.
[https://doi.org/10.1523/JNEUROSCI.19-10-03681.1999]

-
Halford S, Freedman MS, Bellingham J, Inglis SL, Poopalasundaram S, Soni BG, et al. Characterization of a novel human opsin gene with wide tissue expression and identification of embedded and flanking genes on chromosome 1q43. Genomics. 2001;72(2):203-8.
[https://doi.org/10.1006/geno.2001.6469]

-
Tsin A, Betts-Obregon B, Grigsby J. Visual cycle proteins: Structure, function, and roles in human retinal disease. J Biol Chem. 2018;293(34):13016-21.
[https://doi.org/10.1074/jbc.AW118.003228]

- Tosini G, Ferguson I, Tsubota K. Effects of blue light on the circadian system and eye physiology. Mol Vis. 2016;22:61-72.
-
Marcheva B, Ramsey KM, Peek CB, Affinati A, Maury E, Bass J 2013. Circadian clocks and metabolism. Handb Exp Pharmacol 217:127-55
[https://doi.org/10.1007/978-3-642-25950-0_6]

-
Gopalakrishnan S, Yadav SR, Kannan NN. A role for the circadian photoreceptor CRYPTOCHROME in regulating triglyceride metabolism in Drosophila. G3: Genes Genomes Genet. 2024:jkae220.
[https://doi.org/10.1093/g3journal/jkae220]

-
Michael AK, Fribourgh JL, Van Gelder RN, Partch CL. Animal cryptochromes: divergent roles in light perception, circadian timekeeping and beyond. Photochem Photobiol. 2017;93(1):128-40.
[https://doi.org/10.1111/php.12677]

-
Sherrard RM, Morellini N, Jourdan N, El-Esawi M, Arthaut LD, Niessner C, Rouyer F, Klarsfeld A, Doulazmi M, Witczak J, d’Harlingue A. Low-intensity electromagnetic fields induce human cryptochrome to modulate intracellular reactive oxygen species. PLoS Biol. 2018;16(10):e2006229.
[https://doi.org/10.1371/journal.pbio.2006229]

-
Chae KS, Oh IT, Lee SH, Kim SC. Blue light-dependent human magnetoreception in geomagnetic food orientation. PLoS One. 2019;14(2):e0211826.
[https://doi.org/10.1371/journal.pone.0211826]

-
Rui L. Energy metabolism in the liver. Compr Physiol. 2014;4(1):177-97.
[https://doi.org/10.1002/cphy.c130024]