산림자원을 가미한 생맥산 3종의 면역 증진 효능 비교분석
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
With infectious diseases and an aging population on the rise worldwide, there is a growing interest in boosting immunity to combat them. We aim to identify forest resources that can enhance immune function and scientifically prove their efficacy. We examined three different types of gami-saengmaeksan can increase the immune function in cyclophosphamide-induced immunosuppression mice. First, we injected cyclophosphamide (50 mg/kg) twice to induce immunosuppression. Then, three different types of gami-saengmaeksan (Prunus davidiana Carrière gami-saengmaeksan; PDS, Chaenomeles sinensis Koehne gami-saengmaeksan; CSS, Pyrus pyrifolia Nakai gami-saengmaeksan; PPS) 200 mg/kg/day were oral administered for 14 days. In order to confirm the immune-enhancing effect three different types of gami-saengmaeksan, we analyzed body weight chagne, the number of immune cells in blood, cytokines, and immunoglobulins levels in serum. Cyclophosphamide was decreased the mice body weight and the number of immune cells in blood. However, PDS and PPS have significantly increased the body weight, white blood cell, neutrophil, lymphocyte and monocyte count. Also, they were increased immune-related cytokines (IFN-γ, IL-2, IL-4, IL-6, IL-10, and TNF-α) and immunoglobulins (IgA, IgG, and IgM) levels in serum. But, CSS were slightly increased body weight, immune cells, cytokines, and immunoglobulins levels, non-significance was observed. The results suggest that the three types of gami-saengmaeksan can be used as ingredients in dietary supplements to immune enhancing.
Keywords:
Prunus davidiana Carrière, Pyrus pyrifolia Nakai, Forest resources, Immune enhancing, Cyclophosphamide서 론
면역 체계를 구성하는 다양한 면역 세포들 중 대식세포(macrophage), 자연 살해 세포(NK cell, natural killer cell), 수지상 세포(dendritic cell)와 같은 선천 면역 세포는 병원체에 반응하여 활성화되고 활성화된 세포는 감염된 세포를 직접 파괴한다1). 또한 항원 특이적 면역 반응을 담당하는 T 림프구와 B 림프구를 활성화하는 사이토카인의 생성을 촉진하며, 이렇듯 체내 면역 체계는 항원 자극에 의해 방출되는 사이토카인과 면역 세포의 복잡한 상호 작용을 통해 엄격하게 조절된다1).
최근 전 세계적으로 코로나바이러스감염증-19(COVID-19)을 비롯한 전염병의 발병이 증가됨에 따라 면역력을 증가시켜 신체를 보호하는 것이 가장 중요한 전략 중 하나로 대두되고 있다2). 이로 인해 면역력 증진은 현대 사회에서 건강 유지와 질병 예방을 위해 필수적인 요소로 인식되고 있으며, 면역력을 강화시킬 수 있는 방법과 소재에 대한 연구가 다양한 분야에서 진행되고 있다3).
한약재를 비롯한 천연물 소재는 수세기 동안 면역 증강 효과를 위해 사용되어 왔으며, 최근에는 이러한 소재들의 효능을 과학적으로 규명하고 검증하고자 하는 연구들이 진행되고 있다. 특히, 생맥산(生脈散)은 맥문동, 인삼, 오미자로 구성된 한의학적 처방으로 피로 회복, 체력 증진, 면역력 강화 등의 효능으로 여름철에 주로 사용되며, 구성 약재 및 성분이 면역 체계를 강화할 수 있는 효능이 여러 연구들을 통해 확인되었다4-8).
본 연구에 사용하고자 하는 산림자원인 개복숭아(Prunus davidiana Carrière), 모과(Chaenomeles sinensis Koehne), 돌배(Pyrus pyrifolia Nakai)는 모두 국내에 자생하고 있는 산림 수종의 과실이며, 이들 개별 소재에 대한 항산화 및 항염증에 대한 효과9-12)는 과학적으로 규명이 되었으나 개별 소재나 복합소재의 면역력 증진에 대한 연구는 진행된 바가 없다. 이러한 산림자원들의 사용 가능성에 대한 연구들이 지속적으로 요구되고 있으며, 본 연구를 통해 산림자원인 개복숭아, 모과, 돌배의 사용 가능성을 입증하고 기능성 식품에 산림자원의 활용을 증가시키고자 한다. 이에 따라 면역력 증진에 대한 효능이 확인된 한의학적 처방인 생맥산에 이러한 산림자원들을 추가하여 새로운 복합물을 제작하고 면역력 증진에 대한 효능을 비교 및 분석하고자 한다.
이에 본 연구에서는 면역억제제인 cyclophosphamide (CTX)를 실험동물의 복강 내로 주사하여 면역력 저하 모델을 제작하고 생맥산에 산림자원을 가미한 처방 3종을 경구투여하여 체중, 혈액 내 면역 세포 수, 혈청 내 면역글로불린 및 사이토카인 농도의 변화들을 비교 및 분석하였다. 이를 통해 생맥산의 활용 가능성을 증가시키고 산림자원을 가미한 생맥산을 활용한 면역력 증진 기능성 식품 소재로써의 개발 가능성을 평가하고자 한다.
재료 및 방법
1. 시료추출
본 연구에 사용된 생맥산의 구성 약재들은 한약재 유통업체인 (주)옴니허브(Korea)에서 검수된 한약재를 구입하여 사용하였다. 그리고 생맥산에 가미한 개복숭아(전남 나주), 모과(경북 청도), 산돌배(전남 광양)는 모두 국내에서 재배된 소재를 사용하였고 대전한약국(Korea)을 통해 공급받았다. 생맥산 가미방 3종은 생맥산 기본방에 개복숭아, 모과, 산돌배를 각각 추가하여 구성하였고 그 내용은 Table 1과 같다. 각 처방 구성에 500 mL의 증류수를 넣고 100℃에서 3시간동안 추출하였으며, 여과지를 사용하여 추출물을 여과하였다. 여과된 추출물은 rotary vacuum evaporator (Buchi AG, Switzerland)를 사용하여 감압농축하고 freeze dryer (Ilshin Biobase, Korea)를 사용하여 동결건조를 진행하였다. 동결건조 완료 후 획득한 분말은 –20℃에 보관하면서 실험 당일 소분하고 증류수에 용해시켜 사용하였다.
2. 실험동물
실험에 사용한 5주령의 수컷 ICR mouse는 라온바이오(Korea)에서 분양받아 사용하였다. 실험동물은 2주간의 안정기를 가지면서 순화를 시켰으며, 안정기 및 실험기간에 모든 실험동물에는 rodent diet (Envigo, U.K.)를 자유식이 하며 물을 충분히 공급하였다. 동물 사육실의 조건은 conventional system으로 22±2℃, 1일 중 12시간은 200-300 Lux로 조명하고, 12시간은 모든 빛을 차단하였다. 본 실험은 대전대학교 동물실험윤리 위원회의 승인(승인번호 DJUARB2023-019)을 받아 동물윤리준칙에 의거하여 실험하였다.
3. 면역억제 동물 모델 제작 및 시료 투여
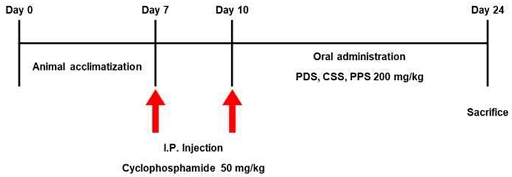
실험은 면역억제를 유도하지 않은 정상군(Control), 면역억제를 유도하고 증류수를 투여하는 면역억제군(CTX), 면역억제 후, 개복숭아 가미 생맥산을 투여하는 실험군(CTX+PDS), 모과 가미 생맥산을 투여하는 실험군(CTX+CSS), 산돌배 가미 생맥산을 투여하는 실험군(CTX+PPS)으로 분류하였으며, 각 그룹은 8수씩 무작위로 배정하였다. 1주일간의 동물적응기를 거친 후, 면역억제 동물모델 제작을 위해 면역억제제인 cyclophosphamide (CTX; Sigma-Aldrich, U.S.A.)를 50 mg/kg으로 실험 시작일과 3일차에 복강 내 주사하였다. CTX 주사가 종료된 후, 14일간 PDS, CSS, PPS를 200 mg/kg으로 1일 1회, 오전 10시에 경구투여 하였다(Fig. 1).
4. 실험동물 희생
실험동물을 희생하기 전에 체중을 측정하고 3% isoflurane (HANA PHARM, Korea)를 사용하여 마취하였다. 마취 후, 심장 채혈법을 통해 동물의 혈액을 채혈하였고 즉시 EDTA tube (Becton Dickinson, U.S.A.)와 microcentrifuge tube에 나누어 보관하였다.
5. 면역 세포 수 분석
EDTA tube에 보관되어있는 혈액은 hematology system ADVIA 2120i (Siemens, Germany)를 이용하여 백혈구(white blood cell), 호중구(Neutrophil), 림프구(lymphocyte), 단핵구(monocyte) 수를 분석하였다.
6. 바이오마커 분석
Microcentrifuge tube에 보관되어있는 혈액을 상온에서 30분간 응고시킨 후, 3000 rpm으로 10분 동안 원심분리하여 혈청을 분리하였다. 분리한 혈청은 MILLIPLEX® multiplex assays kit (Millipore, U.S.A.)와 Luminex 200 System (Luminex, U.S.A.)를 이용하여 면역글로불린A (immunoglubulin A; IgA), 면역글로불린G (IgG), 면역글로불린M (IgM), 인터페론-γ (interferon gamma; IFN-γ), 인터류킨-2 (interleukin-2; IL-2), 인터류킨-4 (IL-4), 인터류킨-6 (IL-6), 인터류킨-10 (IL-10), 종양괴사인자-α (tumor necrosis factor alpha; TNF-α) 수준을 분석하였다.
7. 통계 분석
연구 결과는 SPSS Statistics Version 21.0 (IBM, U.S.A.)을 이용하여 mean±standard deviation으로 나타내었으며, 그룹간의 통계적 유의성은 one-way analysis of variance (ANOVA)를 사용하여 분석하였다. 이 후 Tukey’s HSD test를 통해 유의수준 0.05로 설정하여 유의성을 사후 검정하였으며, p<0.05, p<0.01 및 p<0.001의 3가지 유의수준으로 나누어 표기하였다.
결 과
1. 혈액검사
실험 시작 전과 후의 동물의 체중 변화를 확인한 결과, Control 그룹은 26.90±1.49 g에서 30.52±2.35 g으로 나타났으며, 24일간 3.62 g의 체중 증가가 확인되었다. 그러나 면역억제제인 CTX를 투여한 면역억제 그룹(CTX)은 27.13±1.28 g에서 23.93±1.78 g으로 3.20 g의 체중 감소가 나타났다. 면역억제 모델에 개복숭아 가미 생맥산을 투여한 그룹(CTX+PDS)은 0.35 g 증가, 모과 가미 생맥산 투여 그룹(CTX+CSS)은 2.58 g 감소, 돌배 가미 생맥산 투여 그룹(CTX+PPS)은 1.45 g 증가가 나타났다(Fig. 2).
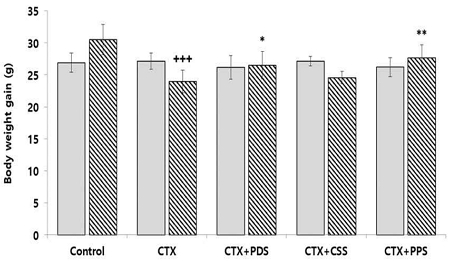
Effects of three different types of gami-saengmaeksan on body weight change in CTX-induced immunosuppressed mice. The data are shown as mean±standard deviation (n=8/group). (+++p<0.001 compared to Control, and *p<0.05, **p<0.01 compared to CTX). Control; non-immunosuppression mice, CTX; immunosuppression mice, CTX+PDS; Prunus davidiana Carrière gami-saengmaeksan 200 mg/kg treated immunosuppression mice, CTX+CSS; Chaenomeles sinensis Koehne gami-saengmaeksan 200 mg/kg treated immunosuppression mice, CTX+PPS; Pyrus pyrifolia Nakai gami-saengmaeksan 200 mg/kg treated immunosuppression mice.
2. 면역 세포 수
백혈구 수를 확인한 결과, Control 그룹은 2.47±0.11×103 cells/μL로 나타났고 CTX 그룹은 1.57±0.15×103 cells/μL로 나타나 CTX로 인해 백혈구 수가 유의적으로 감소하였다. CTX+PDS 그룹은 1.73±0.15×103 cells/μL, CTX+CSS 그룹은 1.65±0.12×103 cells/μL, CTX+PPS 그룹은 1.85±0.11×103 cells/μL로 나타나, 개복숭아와 돌배를 가미한 생맥산을 투여한 그룹에서 CTX 그룹에 비해 유의적인 증가가 나타났다(Fig. 3A). 그리고 호중구 수를 확인한 결과, Control 그룹은 63.60±3.60%로 나타났고 CTX 그룹은 34.12±2.54%로 나타나 CTX로 인해 호중구 수가 유의적으로 감소하였다. CTX+PDS 그룹은 43.43±6.15%, CTX+CSS 그룹은 34.96±3.34%, CTX+PPS 그룹은 46.31±5.69%로 나타나, 개복숭아와 돌배를 가미한 생맥산을 투여한 그룹에서 CTX 그룹에 비해 유의적인 증가가 나타났다(Fig. 3B). 또한 림프구 수를 확인한 결과, Control 그룹은 44.86±2.83%로 나타났고 CTX 그룹은 21.70±1.99%로 나타나 CTX로 인해 림프구 수가 유의적으로 감소하였다. CTX+PDS 그룹은 33.94±3.54%, CTX+CSS 그룹은 26.38±2.88%, CTX+PPS 그룹은 34.68±4.57%로 나타나, 개복숭아, 모과, 돌배를 가미한 생맥산을 투여한 그룹에서 CTX 그룹에 비해 유의적인 증가가 나타났다(Fig. 3C). 마지막으로 단핵구 수를 확인한 결과, Control 그룹은 4.20±0.19%로 나타났고 CTX 그룹은 2.67±0.26%로 나타나 CTX로 인해 단핵구 수가 유의적으로 감소하였다. CTX+PDS 그룹은 2.98±0.18%, CTX+CSS 그룹은 2.81±0.20%, CTX+PPS 그룹은 3.35±0.23%로 나타나, 개복숭아와 돌배를 가미한 생맥산을 투여한 그룹에서 CTX 그룹에 비해 유의적인 증가가 나타났다(Fig. 3D).
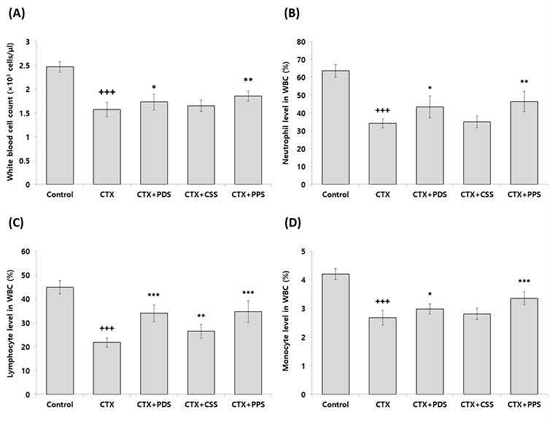
Effects of three different types of gami-saengmaeksan on immune cell count in CTX-induced immunosuppressed mice. The data are shown as mean±standard deviation (n=8/group). (+++p<0.001 compared to Control, and *p<0.05, **p<0.01, ***p<0.001 compared to CTX). (A); white blood cell, (B); neutrophil, (C); lymphocyte, (D); monocyte.
3. 혈청 내 면역글로불린 농도
혈청 내 면역글로불린A 수준을 확인한 결과, Control 그룹은 259.93±13.12 ng/mL로 나타났고 CTX 그룹은 166.20±14.21 ng/mL로 나타나 CTX로 인해 혈청 내 면역글로불린A 농도가 유의적으로 감소하였다. CTX+PDS 그룹은 203.74±14.41 ng/mL, CTX+CSS 그룹은 190.26±23.78 ng/mL, CTX+PPS 그룹은 221.81±19.86 ng/mL로 나타나, 개복숭아와 돌배를 가미한 생맥산을 투여한 그룹에서 CTX 그룹에 비해 유의적인 증가가 나타났다(Fig. 4A). 그리고 면역글로불린G 수준을 확인한 결과, Control 그룹은 199.91±6.75 ng/mL로 나타났고 CTX 그룹은 102.53±4.90 ng/mL로 나타나 CTX로 인해 혈청 내 면역글로불린G 농도가 유의적으로 감소하였다. CTX+PDS 그룹은 127.94±5.62 ng/mL, CTX+CSS 그룹은 108.86±6.74 ng/mL, CTX+PPS 그룹은 150.00±9.49 ng/mL로 나타나, 개복숭아와 돌배를 가미한 생맥산을 투여한 그룹에서 CTX 그룹에 비해 유의적인 증가가 나타났다(Fig. 4B). 마지막으로 면역글로불린M 수준을 확인한 결과, Control 그룹은 508.73±30.80 ng/mL로 나타났고 CTX 그룹은 283.36±25.72 ng/mL로 나타나 CTX로 인해 혈청 내 면역글로불린M 농도가 유의적으로 감소하였다. CTX+PDS 그룹은 326.91±28.23 ng/mL, CTX+CSS 그룹은 281.48±22.78 ng/mL, CTX+PPS 그룹은 351.63±35.26 ng/mL로 나타나, 개복숭아와 돌배를 가미한 생맥산을 투여한 그룹에서 CTX 그룹에 비해 유의적인 증가가 나타났다(Fig. 4C).
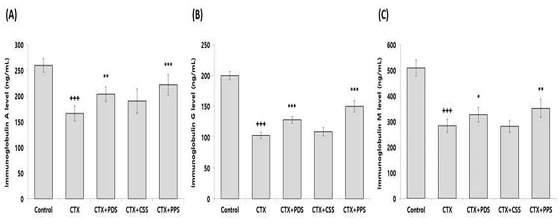
Effect of three different types of gami-saengmaeksan on immunoglobulin level in CTX-induced immunosuppressed mice. The data are shown as mean±standard deviation (n=8/group). (+++p<0.001 compared to Control, and *p<0.05, **p<0.01, ***p<0.001 compared to CTX). (A); immunoglobulin A, (B); immunoglobulin G, (C); immunoglobulin M.
4. 혈청 내 사이토카인 농도
혈청 내 사이토카인 수준을 확인한 결과, CTX 그룹은 CTX로 인해 혈청 내 인터페론-γ (interferon gamma; IFN-γ), 인터류킨-2 (interleukin-2; IL-2), 인터류킨-4 (IL-4), 인터류킨-6 (IL-6), 인터류킨-10 (IL-10), 종양괴사인자-α (tumor necrosis factor alpha; TNF-α) 농도가 Control 그룹에 비해 유의적으로 감소하였다. 그러나 개복숭아와 돌배를 가미한 생맥산을 투여한 그룹에서 CTX 그룹에 비해 모든 사이토카인의 수준이 유의적으로 증가하였으며, 모과를 가미한 생맥산은 IFN-γ, IL-4, IL-6 수준에서만 유의적인 증가가 나타났다(Fig. 5).
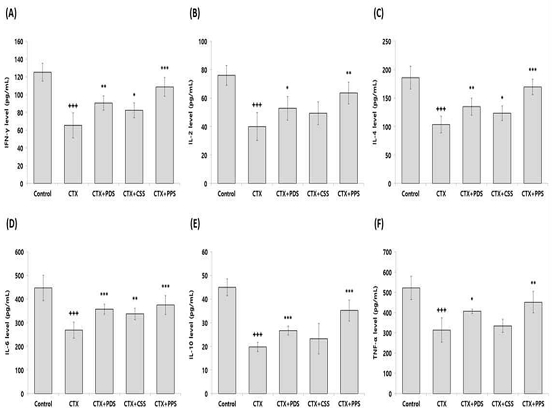
Effect of three different types of gami-saengmaeksan on cytokine level in CTX-induced immunosuppressed mice. The data are shown as mean±standard deviation (n=8/group). (+++p<0.001 compared to Control, and *p<0.05, **p<0.01, ***p<0.001 compared to CTX). (A); interferon gamma, (B); interleukin-2, (C); interleukin-4, (D); interleukin-6, (E); interleukin-10, (F); tumor necrosis factor alpha.
고 찰
면역 기능은 외부로부터 침입하는 바이러스, 박테리아, 기생충 등과 같은 항원에 의해 발생하는 감염 및 손상에 대해 신체를 방어하는 체계적인 시스템이다13). 전세계적으로 전염병과 노화가 증가함에 따라 이를 극복하기 위해 면역력 증가에 대한 관심이 증가하고 있으며, 면역 기능을 강화할 수 있고 부작용이 없어 안전한 천연물 소재에 대한 연구가 계속되고 있다2,3,5).
국내 산림에 자생하고 있는 유용식물자원은 총 2,104종으로, 토질과 기후에 따라 각기 다른 약리 효능을 나타내기에 건강기능성식품 및 천연물 신약 등 고부가가치 바이오소재로써 개발 가능성이 높게 평가되고 있다14). 이러한 산림자원들의 활용 가능성을 제고하기 위해 산림자원의 다양한 효능에 대한 연구가 진행되고 있다15-17). 이에 본 저자는 한의학적 처방인 생맥산에 산림자원 3종을 가미한 새로운 복합물을 개발하였고, 이를 면역력이 억제된 동물 모델에 투여하여 면역력 증진에 대한 미치는 영향을 비교 및 분석하고자 하였다.
면역력을 억제하기 위해 주사한 cyclophosphamide (CTX)는 종양 치료에 사용되는 항암제로, 비특이적 세포사멸을 유도하여 급성 및 만성 백혈병, 림프종, 자가면역 질환 등의 치료에 사용된다18,19). 그러나 CTX는 면역 세포 수와 면역글로불린(immunoglobulin) 생성을 감소시켜 체내 면역 기능을 저하시키는 부작용을 야기하며, 이러한 부작용 때문에 면역 증진 효과를 평가하기 위한 면역 억제 모델 제작에 사용된다20-22). 이전의 연구들23,24)의 결과에 따르면, CTX로 인해 면역력이 저하된 동물 모델에서 체중이 유의적으로 감소하였으며, 본 연구에서도 동일하게 유의적인 감소가 나타났다. 그러나 산림자원을 가미한 생맥산 3종을 경구 투여한 그룹 중 개복숭아와 돌배를 가미한 생맥산 투여 그룹에서는 면역 억제를 유도한 실험군에 비해 유의적인 체중의 증가가 나타났으며, 모과를 가미한 생맥산 투여 그룹은 체중이 약간 증가하였으나 유의성은 나타나지 않았다(Fig. 2). 이러한 결과는 산림자원을 가미한 생맥산 3종이 CTX로 인해 감소된 체중을 다시 증가시킬 수 있음을 나타낸다.
또한 CTX는 체내 면역 세포 수와 면역글로불린 생성을 감소시키는 부작용이 있으며, 본 연구에서도 이전 연구들3,20,23)과 동일하게 면역 세포 수와 면역글로불린 수치가 면역 억제를 유도한 실험군에 비해 유의적인 감소가 나타났다. 산림자원을 가미한 생맥산 3종을 경구 투여한 그룹 중 개복숭아와 돌배를 가미한 생맥산 그룹에서는 면역 억제를 유도한 실험군에 비해 백혈구, 호중구, 림프구, 단핵구 등의 면역 세포 수의 유의적인 증가가 나타났으며(Fig. 3), 면역글로불린A, G, M 세가지 모두 유의적으로 증가시켰다(Fig. 4). 그러나 모과를 가미한 생맥산 투여 그룹은 면역 세포 수와 면역글로불린을 증가시켰으나 유의성은 나타나지 않았다. 이러한 결과는 산림자원을 가미한 생맥산 3종이 세균 및 바이러스와 같은 외부 물질과 결합하여 이를 무력화하는 면역글로불린을 증가시켜 체내 면역력을 증가시킬 수 있음을 시사한다.
T 세포 및 B 세포와 대식세포 같은 면역 세포들은 다양한 사이토카인들을 분비하여 체내 면역 기능을 조절하며, 특히 T 세포는 크게 4가지 종류로 나뉘어 항원에 대한 정보를 저장하고 B 세포에 전달하여 항원 특이적 항체를 빠르게 생성할 수 있게 도와주는 역할을 한다25,26). 4가지 T 세포 중, 도움 T 세포(helper T cell; Th cell)는 분비할 수 있는 사이토카인의 종류에 따라 Th1, Th2, Th17, Treg 등으로 다시 나뉘며, 이들은 항원에 대한 적응 면역 반응을 담당한다27,28). Th1 세포는 주로 인터페론-γ(IFN-γ), 인터루킨-2(IL-2), 종양괴사인자-α(TNF-α)등을 생성하여 세포 내 바이러스와 박테리아의 감염에 대한 보호 면역 반응을 담당하며, Th2 세포는 인터루킨-4(IL-4), IL-5, IL-6, IL-10등을 생성하여 선충과 같은 기생충 제거와 종양의 성장 및 전이를 조절한다29,30). 면역 기능에 중요한 역할을 담당하는 사이토카인들은 CTX에 의해 발현이 억제되었음이 이전 연구들2,3,20,22,23)을 통해 확인되었으며, 본 연구에서도 이전의 연구들과 동일하게 CTX로 인해 혈청 내 IFN-γ, IL-2, IL-4, IL-6, IL-10, TNF-α 농도가 유의적으로 감소하였다. 그러나 개복숭아와 돌배를 가미한 생맥산 투여 그룹에서 면역 억제를 유도한 실험군에 비해 모든 사이토카인의 수준이 유의적으로 증가하였으며, 모과를 가미한 생맥산은 IFN-γ, IL-4, IL-6 농도만 유의적인 증가가 나타났다(Fig. 5). 이와 같은 결과는 산림자원을 가미한 생맥산 3종은 면역 기능을 조절하는 T 세포와 B 세포를 모두 활성화시키며, Th1 및 Th2 세포 면역 반응을 증가시킬 수 있음이 확인되었다.
모든 결과들을 종합해볼 때, 개복숭아, 모과, 돌배를 가미한 생맥산 3종은 cyclophosphamide로 인해 감소된 체중을 증가시켰으며, 감소된 혈액 내 면역 세포 수, 면역 관련 사이토카인 및 면역글로불린 생성을 유도하여 체내 면역 기능을 증가시킬 수 있음이 과학적으로 확인되었다. 이는 산림자원을 가미한 생맥산 3종이 면역력 증진을 위한 건강기능성 식품의 소재로써 사용 가능함을 나타내며, 본 연구 결과를 바탕으로 후속 연구에 대한 발판을 마련할 수 있고 임상 결과가 보완된다면 새로운 면역 기능 강화에 대한 기능성 식품이 개발될 수 있을 것이라고 생각된다.
Acknowledgments
본 연구는 산림청(한국임업진흥원) 산림과학기술 연구개발사업 '(2021370A00-2123-BD02)'의 지원에 의하여 이루어진 것입니다.
References
-
Belardelli F, Ferrantini M. Cytokines as a link between innate and adaptive antitumor immunity. Trends in immunology. 2002;23(4):201-8.
[https://doi.org/10.1016/S1471-4906(02)02195-6]

-
Jeong J, Lim MK, Han EH, Lee SH, Lee S. Immune-enhancement effects of Angelica gigas Nakai extracts via MAPK/NF-ƙB signaling pathways in cyclophosphamide-induced immunosuppressed mice. Food Science and Biotechnology. 2023;32(11):1573-84.
[https://doi.org/10.1007/s10068-023-01281-6]

-
Hong DH, Joo IH, Park JM, Han SH, Lee SB, Gwak SG, et al. Immune-enhancing effects of Phellinus linteus fruit body and mycelium cultured in Cudrania tricuspidata. Journal of Physiology & Pathology in Korean Medicine. 2019;33(5):275-81.
[https://doi.org/10.15188/kjopp.2019.10.33.5.275]

-
Kim DC, Hwang WI, In MJ, Lee SD. Effects of lipid soluble ginseng extract on immune response. Journal of Ginseng Research. 2008;32(1):19-25.
[https://doi.org/10.5142/JGR.2008.32.1.019]

- Kang NR, Hwang DS, Lee JM, Lee CH, Jang JB. The effects of Liriopis tuber water extract on innate immune activation and anti-inflammation. The Journal of Korean Obstetrics and Gynecology. 2021;34(3):15-28.
-
Gu YR, Hong JH. Physicochemical characteristics and physiological activities of mixture extracts from Liriope platyphylla, Schizandra chinensis, and Panax ginseng CA Meyer. Food Science and Preservation. 2017;24(3):431-9.
[https://doi.org/10.11002/kjfp.2017.24.3.431]

- Kwon G, Jo H. The effect of Sang-maek-san supplementation on the body composition and immune cells in obese middle-aged women. Korean J Sports Sci. 2009;18:1053-63.
- Kim CH, Kwon MC, Kim HS, Ahn JH, Chio GP, Choi YB, et al. Enhancement of immune activities of Kadsura japonica Dunal. through conventional fermentation process. Korean journal of medicinal crop science. 2007;15(3):162-9.
-
Kim WB, Park SH, Hwang HS, Woo JY, Lee HR, Hwang DY, et al. Antioxidative activities and whitening effects of solvent fraction from Prunus davidiana (Carriere) Franch. fruit. Journal of the Korean Society of Food Science and Nutrition. 2012;41(10):1363-70.
[https://doi.org/10.3746/jkfn.2012.41.10.1363]

-
Kim DH, Subedi L, Kim HR, Choi SU, Kim SY, Kim CS. Phenolic constituents of chinese quince twigs (Chaenomeles sinensis Koehne) and their anti-neuroinflammatory, neurotrophic, and cytotoxic activities. Antioxidants. 2021;10(4):551.
[https://doi.org/10.3390/antiox10040551]

-
Choi JJ, Yim SH, Choi JH, Park JH, Nam SH, Lee HC. Antioxidant activity of Pyrus pyrifolia fruit in different cultivars and parts. Korean Journal of Food Preservation. 2013;20(2):222-6.
[https://doi.org/10.11002/kjfp.2013.20.2.222]

- Park JC, Lee JI, Ahn SD. Study on the constituents in the fruit of Chaenomeles sinensis Koehne. Korean Journal of Pharmacognosy. 1989;20(1):10-2.
-
Brodin P, Davis MM. Human immune system variation. Nature reviews immunology. 2017;17(1):21-9.
[https://doi.org/10.1038/nri.2016.125]

-
Min K. The Status Analysis of Using Forest Bioresource in the Korean Bioindustry. Korean Forest Economics Society. 2022;29(1):37-49.
[https://doi.org/10.31541/KJFE.29.1.4]

-
Sim WS, Lee JS, Lee S, Choi SI, Cho BY, Choi SH, et al. Antioxidant effect of extracts from 9 species of forest plants in Korea. Journal of Food Hygiene and Safety. 2019;34(4):404-11.
[https://doi.org/10.13103/JFHS.2019.34.4.404]

-
Choi SI, Lee JS, Lee S, Lee HJ, Yeo J, Cho BY, et al. Effects of extracts of five species of Korean native forest plants on lipid accumulation and reactive oxygen species production during differentiation of 3T3-L1 preadipocytes. Journal of The Korean Society of Food Science and Nutrition. 2017;46(4):523-8.
[https://doi.org/10.3746/jkfn.2017.46.4.523]

-
Cho M, Lee JS, Lee S, Son YK, Bae CH, Yeo J, et al. Antioxidant activity of 11 species in Korean native forest plants. The Korean Journal of Food And Nutrition. 2015;28(6):1098-106.
[https://doi.org/10.9799/ksfan.2015.28.6.1098]

-
Sevko A, Sade-Feldman M, Kanterman J, Michels T, Falk CS, Umansky L, et al. Cyclophosphamide Promotes Chronic Inflammation–Dependent Immunosuppression and Prevents Antitumor Response in Melanoma. Journal of Investigative Dermatology. 2013;133(6):1610-9.
[https://doi.org/10.1038/jid.2012.444]

-
Hughes E, Scurr M, Campbell E, Jones E, Godkin A, Gallimore A. T‐cell modulation by cyclophosphamide for tumour therapy. Immunology. 2018;154(1):62-8.
[https://doi.org/10.1111/imm.12913]

-
Park HE, Lee WK. Immune enhancing effects of Weissella cibaria JW15 on BALB/c mice immunosuppressed by cyclophosphamide. Journal of Functional Foods. 2018;49:518-25.
[https://doi.org/10.1016/j.jff.2018.09.003]

-
Yoo J, Jung Y, Ahn JH, Choi YJ, Lee KH, Hur S. Incidence and clinical course of septic shock in neutropenic patients during chemotherapy for gynecological cancers. Journal of Gynecologic Oncology. 2020;31(5).
[https://doi.org/10.3802/jgo.2020.31.e62]

-
Fan KJ, Li YW, Wu J, Li J, Zhang J, Wang QS, et al. The traditional Chinese medicine Fufang Shatai Heji (STHJ) enhances immune function in cyclophosphamide-treated mice. Evidence‐Based Complementary and Alternative Medicine. 2020;2020(1):3849847.
[https://doi.org/10.1155/2020/3849847]

-
Seo Bc, Kim SJ. The Effect of Angelica gigas Nakai on Immune Enhancement in Cyclophosphamide-induced Immune-suppressed Mice. Biomedical Science Letters. 2022;28(2):120-6.
[https://doi.org/10.15616/BSL.2022.28.2.120]

-
Xiang X, Wang R, Chen L, Chen Y, Zheng B, Deng S, et al. Immunomodulatory activity of a water-soluble polysaccharide extracted from mussel on cyclophosphamide-induced immunosuppressive mice models. npj Science of Food. 2022;6(1):26.
[https://doi.org/10.1038/s41538-022-00140-8]

- Pae M, Meydani SN, Wu D. The role of nutrition in enhancing immunity in aging. Aging and disease. 2012;3(1):91.
-
Jiang MH, Zhu L, Jiang JG. Immunoregulatory actions of polysaccharides from Chinese herbal medicine. Expert opinion on therapeutic targets. 2010;14(12):1367-402.
[https://doi.org/10.1517/14728222.2010.531010]

-
Zhou L, Chong MM, Littman DR. Plasticity of CD4+ T cell lineage differentiation. Immunity. 2009;30(5):646-55.
[https://doi.org/10.1016/j.immuni.2009.05.001]

-
Liu YJ, Soumelis V, Watanabe N, Ito T, Wang YH, de Waal Malefyt R, et al. TSLP: an epithelial cell cytokine that regulates T cell differentiation by conditioning dendritic cell maturation. Annu Rev Immunol. 2007;25(1):193-219.
[https://doi.org/10.1146/annurev.immunol.25.022106.141718]

-
Budhu A, Forgues M, Ye QH, Jia HL, He P, Zanetti KA, et al. Prediction of venous metastases, recurrence, and prognosis in hepatocellular carcinoma based on a unique immune response signature of the liver microenvironment. Cancer cell. 2006;10(2):99-111.
[https://doi.org/10.1016/j.ccr.2006.06.016]

-
Mantovani A, Allavena P, Sica A, Balkwill F. Cancer-related inflammation. nature. 2008;454(7203):436-44.
[https://doi.org/10.1038/nature07205]