고려홍삼의 조사포닌이 Di(2-ethylexyl phthalate에 의해 유발된 호흡기독성에 미치는 영향
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Phthalates are used as plasticizers in plastics and other products, including household goods, and enter the human body mainly through oral, inhalation, and skin. Saponins in Korean red ginseng are known to have immune enhancement, central nervous system protection, anticancer, and anti-inflammatory properties. Therefore, the present study aimed to investigate the protective effects of Crude-saponin administration against DEHP-induced respiratory toxicity. A DEHP-induced respiratory toxicity model was performed using prepubertal 4-week-old SD rats, and the inflammatory response of blood and tissues obtained through autopsy was analyzed to determine the toxicity of DEHP and the protective effect of Crude-saponins against it. The results showed that MUC5AC and CCR3 were consistently increased in the DEHP-treated model, as well as the expression of key respiratory mucins. The inflammatory cytokines IL-13 and IL-5 increased, and TARC, which is responsible for Th2 migration, also tended to increase. However, the above phenomena gradually decreased in a concentration-dependent manner in the Crude-saponin-treated group. These results confirm that Crude-saponins are involved in gene protein expression inhibition and stress-induced mechanisms in respiratory injury. The expression of key respiratory mucins was consistently increased in the DEHP treatment model. As DEHP-induced impairment of NF-κB/MAPK signaling has been reported, further in vitro studies are needed to investigate the mechanisms involved in upstream signaling.
Keywords:
Crude saponin, Di(2-ethylhexyl) phthalate, Respiratory, TARC서 론
프탈레이트는 고분자 소재의 유연성과 가공성을 향상시키기 위해 가소제로 흔히 사용되며, 그 중에서도 di(2-ethylhexyl)phthalate (DEHP)는 polyvinyl chloride (PVC) 플라스틱 가소제로 유연성을 부여하며, 식품 포장, 생활 필수품, 의료장비 및 기타 제품에 사용된다1,2). 이는 현대사회에 필수적으로 이용되고 있으며, 종종 첨가제로 사용되기도 한다고 알려져 있다. 국립환경과학원에 따르면 21년도 유해물질 노출에 대한 조사결과 플라스틱 가소제로 사용되는 프탈레이트 대사체인 MEHHP, MEOHP, MECPP, MnBP 등의 성분이 모든 연령대에서 미국보다 높게 나타나는 것으로 보고되고 있다. 특히, 우리나라 영·유아, 초등학생이 미국의 영·유아, 초등학생보다 2배 이상 높은 것으로 분석되었다. 이와 같은 프탈레이트는 주로 경구나 흡입 그리고 피부를 통해 체내 침투하는 것으로 보고되고 있으며, 최근 실내먼지를 통한 프탈레이트 노출 우려가 커지고 있는 실정이다3). 분자량이 상대적으로 작아 주로 기체상으로 존재하는 DMP(dimethyl phthalate), DEP (diethyl phthalate), DBP (di-n-butyl phthalate) 등과 달리, 분자량이 큰 DEHP (di(2-ethylhexyl)phthalate)의 경우 먼지를 통한 노출 기여도가 높은 것으로 알려져 현대인이 일상에서 프탈레이트 노출을 피하기 어려워 위험성이 커지고 있다4). 최근에는, 먼지에 포함된 DEHP의 존재와 이에 노출된 어린이의 천식 발병 사이의 연관성이 제시되었다5). DEHP를 포함한 프탈레이트는 코에서 원위부의 2~3mm 이하의 작은 기도까지의 염증에 기여 할 수 있으며, 이로 인한 비염·천식·상기도 염증 사이의 연관성이 보고되고 있다. 또한, DEHP는 PPARs 핵 수용체 집단과 상호작용하여 비정상적인 폐포 성숙을 유발할 수 있다고 보고되고 있다6).
본 연구에서는 이러한 비정상적인 폐 성숙증의 유발을 잠재울 수 있는 건강기능식품으로 홍삼의 유효성분인 조사포닌을 선택하여 실험에 사용하였다. 홍삼이란, 인삼(Panax ginseng C.A. Meyer)을 증기나 그 밖의 방법으로 쪄서 익혀 말린 것으로서 담적갈색, 담황갈색, 다갈색 또는 농다갈색의 색상을 띠는 것으로서7) 수삼을 찌고 말리는 과정에서 수삼보다 ginsenoside의 함량이 높아지고 새로운 ginsenoside도 생성되면서 각종 약리 효능을 갖게 되는 것으로 알려져있다8). 홍삼의 생리활성 물질 중 조사포닌은 면역강화를 포함하여 중추신경계 보호, 항암, 항 당뇨, 항 염증, 항 산화 등의 효능들이 알려져 있으며9), 이외에도 20 (R)-ginsenoside Rg2, Rg3, Rh1, Rh2 등의 유효성분을 포함하고 있다10). 최근에는 홍삼이 바이러스 감염으로 인해 떨어지는 선천면역을 보호해 폐렴을 예방한다는 연구도 이어지고 있어 호흡기계 독성 완화 물질로서의 가능성을 예측할 수 있다.
이에 본 연구는 고려홍삼의 조사포닌을 이용하여 DEHP 유도 호흡기 독성 모델의 폐, 기관지 손상에 대한 보호 효과를 보고자 하였으며, 이를 위해 일반 혈액학적 실험, 혈액생화학적 실험, 병리조직학적 실험, 면역조직화학적 변화, 염증성 사이토카인 정량 분석을 통해 호흡기 기능 보호제로서 조사포닌의 기대효과를 확인하고자 한다.
재료 및 방법
1. 실험 동물 및 사육
실험동물은 라온바이오(경기도)에서 4주령 Sprague-Dawley계 수컷 흰쥐를 1주간 적응시킨 뒤 체중 120 ± 10.0 g의 상태에서 실험에 사용하였다. 사육실 온도는 23±2℃, 상대습도는 0±5 %, 환기 횟수는 10회/시간, 전배기 방식 및 조명 시간은 12시간씩(7:00~19:00), 조도는 150~300 lux를 유지하였다. 고형사료(퓨리나 쥐 사료, Purina) 및 물은 충분히 공급하였다. 본 동물 실험에 관련된 모든 실험 과정과 절차는 대전대학교 동물 실험 위원회의 사전심의와 윤리 규정을 준수하여 수행하였다(DJUARB2021-023).
2. 실험물질 Crude-saponin 조제
Crude-saponin은 KT&G(서울, 대한민국)에서 제공받아 사용하였다. 조사포닌을 얻기 위해서 먼저, 수삼 10 Kg을 얇게 썰은 다음 70 % MeOH 20리터에 담가 실온에서 7일 추출하였다. 이후 메탄올 추출물은 농축하여 유기용매를 제거한 다음 Diaion HP-20(Mitsubishi Kasei Chroma-tography 10리터에 통과시킴으로서 사포닌을 흡착시켰다. 흡착되지 않은 유리당과 수용성 화합물은 증류수 40리터로 수지를 세척함으로서 제거하였으며, 흡착된 사포닌에 대하여는 100 % 메탄올 40리터로 용출, 농축하여 조사포닌 분말(100 g)을 획득하여 연구에 사용하였다.
3. 동물군의 분리 및 약물 투여
실험동물은 군당 7마리씩 5그룹으로 나누어 총 35마리로 실험을 진행하였다. 정상대조군을 제외한 모든 시험군에 DEHP 1000 mg/kg/b.w를 경구투여 하였다. 일주일 후 정상대조군과 유발군에는 0.85 % saline을 0.2 mL씩 복강투여하였으며, 시험물질 투여군에는 사포닌 추출물을 각각 10/20/40 mg/kg/b.w의 저/중/고의 농도로 0.85 % saline에 녹여 0.2 mL씩 복강 투여하였다. DEHP와 조사포닌 병행 투여를 3주 동안 진행한 후 isoflurane (JSK, Korea)으로 흡입 마취를 한 뒤, 개복하여 복대 동맥에서 채혈하고 폐, 기관지 등 호흡기 평가 관련 조직을 적출하였다.
4. 일반혈액학적 검사
일반혈액학적 검사를 위하여 복대동맥으로부터 얻은 혈액을 항응고제가 들어 있는 ethylenediaminetetraaceticacid tube (EDTA tube, BD, USA)에 옮긴 후 clinical and laboratory standards Institute (CLSI, USA, 2017) 기준에 따라 6~8회 위아래로 혼합하였다. 이후 자동혈액 분석기(ADVIA 2120i, SIEMENS, Germany)를 이용하여 적혈구 수(Red blood cell, RBC), 헤모글로빈(hemoglobin, Hgb), 헤마토크릿(hematocrit, HCT)를 포함한 적혈구 지표와 혈소판 수(Platelet, PLT)를 분석하였다.
5. H&E 염색
폐, 기관지의 육안 병변을 관찰한 후 통상적인 조직 표본 제작과정을 거쳐 병리 조직학적 검사를 수행하였다. 절취한 신장 조직을 10% 중성 포르말린에 고정한 후 병리 조직학적 검사를 위한 통상적인 방법을 사용하여 파라핀 포매 후, 4㎛ 두께로 절편 하여 haematoxylin & eosin (H&E) 염색을 하여 병리 조직학적 검사를 수행하였다. 슬라이드는 영구보존을 위해 봉입(Permount, Fisher scientific, USA)하였다. 조직의 일반적 구조 관찰 및 염증 정도를 평가하기 위해 광학현미경(BX43, Olympus co., Japan)으로 검경하여 image J program(Wayne rasband, National institutes of health, bethesada, MD, USA)을 이용해 분석하였다.
6. 면역조직화학(IHC) 염색
두께 4 ㎛의 슬라이드를 탈파라핀하여 Antigen retrieval를 Microwave에서 10분 동안 P100모드 1분 30초, P30 모드 8분 30초로 고강도로 끓인 후 전자레인지 안에서 20분간 식혔다. 뜨거운 수돗물로 1분간 세척한 후 PBS로 3분간 2회 세척하였다. PBS로 3분간 2회 세척 후 Protein blocking reagent로 5분 실온 방치하였다. PBS로 1회 세척 후 Primary antibody를 분주하고 냉장고에 하루 동안 넣어 놨다. 2 일차는 PBS로 3분간 2회 세척 후 2차 항체를 실온에 10분간 방치하였다. PBS로 3분간 2회 세척 후 Streptavidin peroxidase를 10분간 분주하였다. PBS로 3분간 1회 세척 후 DAB mixture 10분간 방치하였다. PBS로 3분간 2회 세척한 후 Hematoxylin 염색을 1분간 진행하였다. Tap water wash를 7-8번 한 후 탈수 투명 봉입하였다.
7. 기관지폐포 세척액(BALF) 회수
Van Hoecke11) 등의 방법에 따라 좌측 폐로 연결되는 기관지 부위를 봉합사로 묶고 기관을 통해 도관(Insyte, BD)을 삽입하여 우측 폐로부터 기관지폐포세척액(bronchoalveolar lavage fluid, BALF)을 얻었다.
8. 염증성 cytokine 측정
혈청 IL-5, IL-13, MUS5AC, CCR3, TARC는 Endogen사의 Human ELISA kit을 사용하여 효소면역법으로 측정하였다. well 당 standard 100 μl와 sample을 첨가한 후 37℃에서 2시간 동안 배양을 진행하였으며, Biotin-antibody(1x) 100 μl를 추가하여 37℃에서 1시간 동안 배양해주었다. Wash Buffer(200 μl)를 이용하여 세척 후 각 웰에 HRP-avidin(1x) 100 μl를 넣어준 뒤, 37℃에서 1시간 동안 배양하였다. 이후 세척을 진행하고, 빛이 차단된 상태에서 각 웰에 TMB Substrate 90 μl를 추가한 뒤, 37℃에서 15-30분 동안 배양하였다. 마지막으로, 각 웰에 stop solution 50 μl를 넣고 혼합시켜준 뒤, Microplate Reader (Multiscan Go, Thermo SCIENTIFIC, USA)를 이용하여 660nm의 흡광도로 측정하였다.
9. 이미지 분석 및 통계 처리
조직화학적 및 면역조직화학적 분석 결과를 정량화하기 위해 Image J 소프트웨어 (Wayne Rasband, National Institutes of Health, Bethesada, MD, USA)을 이용하여 이미지 분석을 수행했다. 모든 데이터는 평균 ± SD로 표시되며, 그룹 간의 차이는 Ducan의 다중 범위 테스트를 사용하여 분석하였다. 모든 실험 결과는 평균치와 표준오차로 나타내고, 각 군 간의 차이는 ducan’s multiple range test을 사용하여 p<0.05일 때 통계적으로 유의성이 있다고 판정하였다.
결 과
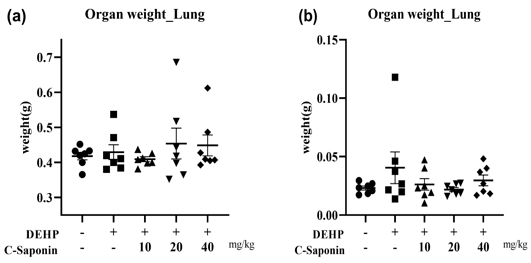
1. 동물 장기무게 변화
DEHP 투여군 대비 각 그룹의 폐, 기관지 장기 무게 변화를 확인한 결과, 정상대조군은 각각 0.42±0.03 g, 0.02±0.00 g을 보였으며, DEHP를 단독 투여한 군에서 0.43±0.06 g, 0.04±0.04 g으로 증가하는 것을 볼 수 있었다. 반면, 조사포닌 추출물 투여에 따른 장기 무게 변화를 확인한 결과, 저농도군에서 0.41±0.02 g, 0.03±0.03 g, 중농도군에서 0.45±0.12 g, 0.02±0.00 g으로 나타났다. 조사포닌의 저농도 투여군에서는 폐와 기관지 무게의 감소를 볼 수 있었으며, 조사포닌 저, 중, 고농도에서 기관지 무게의 감소를 관찰할 수 있었다(Fig. 1a, 1b).
2. 일반혈액검사에 미치는 영향
DEHP 투여와 조사포닌 추출물 투여에 대한 적혈구 및 혈소판 지표에 미치는 영향을 평가하기 위해 동물의 혈액에서 적혈구 수, 헤모글로빈, 헤마토크릿, 혈소판 수치를 분석하였다.
적혈구의 수치 변화는 정상대조군 8.01 ± 0.37 X106/㎕과 비교 시 DEHP를 단독 투여한 군에서 감소하였다. 또한 DEHP와 조사포닌 투여 군을 비교해 보았을 때 중농도 투여 군에서 7.64 ± 0.50 X 106/㎕ 증가하는 결과를 나타내었다.
헤모글로빈 수치의 경우 정상대조군 15.4 ± 0.97 g/dL과 비교 시 DEHP를 단톡 투여한 군에서 유의하게 감소하였다(p<0.05). 조사포닌 고농도 투여군에서는 14.09 ± 1.87 g/dL 감소하여 유의한 결과를 나타내었다(p<0.05).
혈소판 수치는 정상대조군 733.8 ± 475.1 X103/㎕과 비교 시 DEHP를 투여한 군에서 증가하였다. 한편, 조사포닌을 투여한 군을 비교하였을 때 중농도 투여군에서 814.3 ± 554.3 X103/㎕으로 감소한 결과를 나타내었다(Table 1).
3. 폐,기관지 내 염증에 미치는 영향
Hematoxylin & eosin (H&E) 염색을 통해 정상대조군 대비 DEHP 투여군의 폐 조직에서 폐포 강 내 출혈이 관찰되고 염증성 세포의 침윤이 보였으며 모세혈관 확장 소견이 관찰되었다. 반면, 조사포닌 고농도 투여군에서 alveola의 균일한 형태가 거의 정상군과 유사하게 나타났으며, 염증세포의 침윤도 완화되는 것을 볼 수 있었다(Fig. 2. 위).
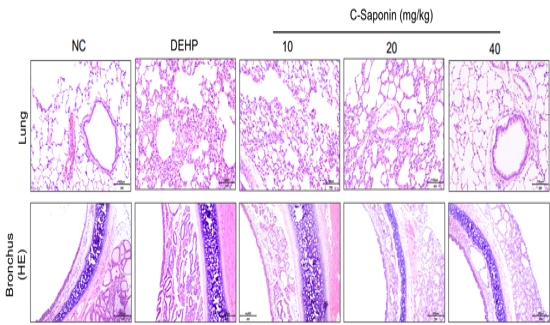
Effects of Saponin on histological changes by Bronchus H-E staininig in Respiratory toxicity induced SD rat (x20). At the end of experiment, Bronchus tissues were obtained, fixed 10% nuetral buffer formalin (NBF) solution, paraffin embedded, sectioned at a thickness of 4 μm for cell observation and H&E for histopathological stain. Examination of the optical microscope for x200. Notes on group designation at the same as in Figure. 1. Data are shown as mean±SD(n=7). The scale bar length is 100㎛.
기관지 변화에 대해 보았을 때, 정상대조군 대비 DEHP 투여군에서 급성 기관지염에 의한 점액 과다 생성 및 섬모 소실이 나타났으며, 증가된 점액으로 인한 기관지 벽 파괴 소견이 관찰되었다. 이러한 소견은 조사포닌 고농도 투여군에서 완화되는 것을 볼 수 있었다(Fig. 2. 아래).
4. 기관지폐포 세척액 분석
폐 내 총 세포 수 분포에서 정상대조군 대비 DEHP 단독 투여군 및 조사포닌 병행 투여 군에서 모두 증가하였다. 반면, 조사포닌을 투여한 군에서는 조사포닌의 농도에 따라 감소하는 경향을 보였다(Fig. 3a). DEHP 투여 시 정상대조군 대비 대식세포의 감소 및 호중구(21.71 ± 13.45 %), 호산구 수(11.57 ± 5.88 %)의 증가가 유의한 변화를 나타내었다(p<0.05). 반면, 조사포닌을 투여하였을 때, 호중구, 호산구 수 각각 저, 중, 고 농도에서 20.43 ± 12.30 %, 12.71 ± 7.59 %, 11.29 ± 5.25 %, 5.57 ± 2.23 %, 5.57 ± 5.16 %, 4.71 ± 6.70 %로 농도 의존적으로 감소하였으며, 호산구 수의 경우 유의한 변화를 나타내었다(p<0.05)(Fig. 3b, 3c). 대식세포(Macrophage)는 DEHP 대비 조사포닌 저, 중, 고 농도 투여군에서 61.57 ± 15.57 %, 72.29 ± 13.52 %, 76.14 ± 12.51 %로 농도 의존적으로 증가하였으며 유의한(p<0.05) 변화가 관찰되었다(Fig. 3d). 림프구 수의 경우 정상대조군 대비 DEHP 단독 투여군 및 조사포닌 병행 투여군에서 모두 증가하였다. 반면, 조사포닌을 투여한 군에서는 조사포닌 투여 농도에 따라 감소하는 경향을 나타내었다(Fig. 3e).

Total and differential cell counts in bronchoalverolar lavage fluid (BALF). Lung and BALF were harvested 24 h after the last ovalbumin challenge. Total inflammatory cells (a), netrophils (b), eosinophils (c), macrophage (d) and lymphocyte (e) number in BALF. Total and differential cell count were performed on a minimum of 200 cells. Data are expressed as the mean ± SE (n=7). Differenced between the five groups were validated by Duncan’s multi-range test after analysis with one way ANOVA. Groups with different significance were classified by different letters. Values followed by the same letter (a,b,c) are not significantly different (p<0.05) by Duncan’s multiple range test. (b) a<b,c<b, (c) b<a, (d) b<c<b,c<a significantly different between each group. Normal control; DEHP, Di(2-ethylhexyl) phthalate; Crude-Saponin.
5. 염증성 싸이토카인 측정
DEHP와 조사포닌 투여에 의한 폐, 기관지 조직의 염증 지표에 미치는 영향을 평가하기 위하여 MUC5AC, CCR3, 인터루킨 13(interleukin-13, IL-13), 인터루킨 5(interleukin-5, IL-5), TARC를 측정한 결과, IL-13, TARC 측정 지표를 제외하고 유의성이 관찰되었다(P<0.05). MUC5AC 치는 정상대조군 대비 DEHP를 단톡 투여한 군에서 488.54 ± 230.93 pg/mL가 증가하였고, DEHP 군 대비 고농도 조사포닌을 투여한 군에서 148.86 ± 82.65 pg/mL로 농도로 감소하였다. CCR3 치는 정상대조군 대비 DEHP 단독 투여군에서 1.63 ± 0.11 ng/mL로 증가하였고, DEHP 군 대비 고농도 조사포닌을 투여한 군에서 1.28±0.23 ng/mL로 감소하였다. IL-5 치는 정상대조군 대비 DEHP를 단독 투여한 군에서 63.77 ± 14.58 pg/mL로 증가하였고, DEHP 군 대비 고농도 조사포닌을 투여한 군에서 42.81 ± 20.31 pg/mL로 감소하였다(Table 2). 또한, 유의성은 관찰되지 않았지만, IL-13, TARC 역시 DEHP 단독투여군에서 증가하였으며, 조사포닌 투여시 농도의존적으로 감소하는 것을 확인할 수 있었다(Table 2).
6. 면역조직화학염색 결과
IHC를 통해 조직 내에서의 염증 인자 발현량을 조사하였다. 정상 대조군(27.1%±6.8 %)에서는 CXCL-2 발현이 낮았지만, DEHP 투여군에서는 56.2±10.2 %로 증가하였다. 한편, 조사포닌을 저농도 투여한 군에서의 양성비율은 31.5±4.0 %으로 DEHP 대비 양성 발현률이 유의하게 감소하였다(p<0.05) (Fig. 4. 위). MCP1 검사 결과, 정상 대조군 대비 DEHP를 투여한 군(47.6±1.4 %)에서 증가하였다. 한편, DEHP 투여군 대비 조사포닌 중, 고농도 투여군에서 감소하는 경향을 나타내었다(Fig. 4. 아래).
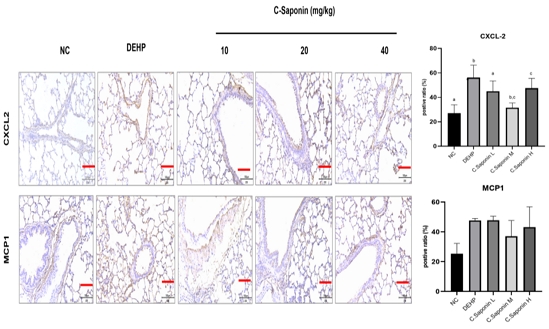
Effect of Saponin on histologic changes by CXCL-2, MCP-1 staining in bronchi of respiratory toxicity induced SD rats (x20). Notes on group designation at the same as in Table 1. Data are shown as mean±SE(n=7). The scale bar length is 100㎛. Differenced between the five groups were validated by Duncan’s multi-range test after analysis with one way ANOVA. Groups with different significance were classified by different letters. Values followed by the same letter (a,b,c) are not significantly different (p<0.05) by Duncan’s multiple range test. a<b,c<c<b significantly different between each group.
고 찰
최근 미세먼지 등 환경유해인자가 실외 및 실내 대기질에 영향을 미침에 따라 DEHP에 의한 섭취 및 흡입 독성에 대한 관심이 증가하고 있으며, 일상생활에서 광범위하게 사용됨에 따라 건강 영향에 대한 우려가 높아지고 있다12). 본 연구에서는 DEHP 흡입 노출로 인해 발생되는 호흡기 독성에 대한 문제를 해결하기 위해 조사포닌을 사용하여 폐, 기관지 손상에 대한 보호 효과가 있는지 알아보고자 하였다.
독성 반응을 평가할 때, 약물 투여 및 질병 유발에 따라 동물모델에서 현미경적 변화와 함께 장기 중량의 변화를 관찰하는 것이 중요하다13). 본 연구에서 장기 중량의 변화를 보았을 때, 정상대조군 대비 DEHP 투여군에서는 폐와 기관지 무게가 모두 증가하였고, 반면 조사포닌을 투여한 군에서 감소하는 경향을 볼 수 있었으며, 저농도 투여군에서 가장 큰 변화를 볼 수 있었다. 또한, 현미경적 변화를 관찰하였을 때, DEHP를 처리한 폐 조직 내에서는 폐포 강 내 출혈 및 염증성 세포의 침윤이 나타나는 것을 볼 수 있었으며, 기관지 상피 탈락과 점액량 증가 현상을 관찰할 수 있었다. 이는 급성 폐손상으로 인해 나타났을 것으로 보이며14), 이를 입증하듯 기관지 세척액을 분석하였을 때 대식세포 수의 감소와 호산구, 호중구 수 증가가 관찰되었다. 이는 이경열10)의 논문과 같이 독성물질에 노출된 군에서는 기관 및 기관지의 상피가 탈락되고 폐포내 폐포대식세포 수의 감소가 나타나는 것과 일치하는 결과이며, 조사포닌 고농도 투여 시 장기 무게가 감소하는 것은 홍삼 조사포닌의 항산화능에 의한 것으로 보이며, 이는 전태원15)의 연구와 같은 결과를 보였다. 또한, 조사포닌 투여 시 폐의 조직병리학적 변화 및 기관지 세척액 내에서 염증세포 침윤이 감소하는 것을 볼 수 있었다. 이는 기존에 알려진 바와 같이 추출물을 투여 시 혈액에서 기도 내로 침윤하는 총 염증세포 수의 증가가 크게 완화되고 호산구의 침윤을 조절한 역할이라고 판단할 수 있다16).
이 밖에도 동물의 혈액 검사 결과, 총 적혈구 수치, 헤모글로빈은 정상 대조군 대비 DEHP 물질 투여군에서 감소하는 결과를 나타내었다. 이는 내분비 교란 물질인 DEHP가 EDCs로 작용하여 세포사멸과 산화적 스트레스를 유발함으로써 조혈 기능 장애를 나타낸 것으로 보여진다17). 특히, 혈소판 수치의 경우 DEHP 투여군에서 증가하고, 조사포닌 중농도 투여군에서 감소하는 결과를 보였는데, 이는 황석연18)의 연구에 따르면 사포닌은 스테로이드 골격을 가지고 있으므로 생리활성은 주로 호르몬 유사작용 기인할 것에 의해 혈소판 수를 조사포닌이 감소시킨다는 보고와 일치한다.
장기무게, 조직 및 기관지 세척액 내 염증성 변화, 혈액 조혈장애 등을 유도하는 DEHP의 산화적 스트레스 및 세포 사멸 관련 신호 전달 기전을 연구하였다. 본 연구에서 DEHP에 의해 IL-13, IL-5, TARC 발현이 증가하고, 조사포닌 투여 시 감소하는 경향을 보였다. 이는 김혜인의 연구 결과에 따르면 사포닌이 면역세포에서 IL-5. IL-13의 발현을 억제하여 호산구와 Th2 세포로의 분화를 억제하는 것으로 볼 수 있다19). 또한, 기관지 상피와 점막 밑 샘에서 생성되는 주요 호흡기 점액이며 기도 점액 과다분비와 연관되어있는 MUC5AC20), 기도상피세포 염증 시 발현되는 CCR3는 정상대조군 대비 DEHP를 투여한 군에서 증가하였고, DEHP를 투여한 군 대비 조사포닌을 투여한 군에서 농도 의존적으로 감소하는 경향을 보였다. 이는 MUC5AC는 주로 TNF-α에 의해 발현이 유도되며 기도 상피세포에 작용하여 mucin의 분비를 증가시키는데21), 조사포닌 투여시 감소되는 현상은 TNF-α 유도 신호에 관여한 것으로 사료된다. 이를 입증하듯 DEHP 투여군 대비 조사포닌 투여 시 CXCL-2, MCP-1이 감소하는 경향을 보였다. MCP-1은 TNF-α에 의해 MCP-1 mRNA 발현이 활성화되는 특징을 가지고 있으며22), 호중구나 단핵구 등의 염증세포를 동원하여 조직 손상을 유발할 수 있음을 의미한다23). 즉, DEHP 단독 투여군 대비 조사포닌 투여군에서 보이는 MCP-1을 비롯한 호중구 수 감소, 염증 반응 완화 효과는 TNF-α에 의해 매개되는 MCP-1 생성을 전사 단계에서부터 저해하고 있음을 시사할 수 있었다22). 이로 인한 내용을 보충하기 위해 각 군에서 TNF-α의 mRNA 수준이나 분비양을 PCR 분석으로 확인한다면 더 논리적인 연구가 될 수 있을 것으로 사료된다. 또한, CXCL-2는 ASMC 이동의 매개에 관여하며, 단핵구 및 대식세포에 의해 분비하는 호중구 화학물질로 염증 반응 초기 과정을 수행하는 인자로 알려져 있다24). DEHP를 단독 투여한 군 대비 조사포닌 투여시 모든 군에서 감소하는 경향을 나타냈으나, 고농도 투여군에서는 증가하는 현상을 보였다. 이는 발현된 비율은 증가하였으나, DEHP 투여군과 같이 다핵 염증세포의 침윤 및 핵이 염색된 세포는 발견되지 않았으며, 폐포관 주변으로 미만성으로 퍼진 양성률을 보이는 특징을 나타내었다. 또한, 면역조직화학염색을 실시한 결과가 혈청으로 분석한 염증성 사이토카인의 발현과는 차이가 있었는데, 이는 염증세포 침윤의 범위, 염증세포의 핵에서의 발현 강도, 면역조직화학검사법의 예민도와 특이도 등과 연관된 현상으로 생각되어 종합적으로 판단할 필요가 있다고 생각된다. 이에, 현재 폐암세포주인 A549와 기관지상피세포인 H292 cell line을 활용하여 in vitro 연구를 진행하고 있으며, 분리한 단백질을 이용하여 western blot을 진행함으로써 염증 관련 신호 전달 기전을 분석하고자 계획하고 있다. 향후 이같은 연구결과가 보완된다면, in vivo와 in vitro 결과의 상관성 분석 및 염증 신호전달 기전에 있어 조사포닌의 효과를 명확히 규명할 수 있을 것으로 기대된다.
결 론
본 연구는 DEHP로 유도한 호흡기 독성 모델을 이용하여 홍삼의 유효성분인 조사포닌을 저, 중, 고농도로 4주간 병행 투여를 진행하면서 효능을 알아보고자 하였으며, 이를 위해 혈액학적 검사, 조직병리학적 검사, 동물의 혈청 및 균질액을 이용한 염증성 cytokine 분석 등을 시행하였다. 그 결과, 폐, 기관지 조직 및 기관지 세척액 내 염증성 세포 침윤 완화, 섬모 소실 완화 및 점액량 감소 효과를 확인할 수 있었다. 본 결과는 DEHP에 의해 유도되는 TNF-α의 활성화에 따른 MCP-1 mRNA 발현 증가가 영향을 끼쳐, 호중구나 단핵구 등의 염증세포를 동원함으로써, 기도상피세포 염증 및 점액 분비에 관여하는 CCR3, MUC5AC 발현을 증진시킨 결과로 보여지며, Th2 사이토카인 활성화로 IL-13, IL-5의 활성을 유도한 것으로 나타난다. 반면, 조사포닌 투여 시 이러한 증상이 완화되는 것은 TNF-α에 의해 매개되는 MCP-1 생성을 전사 단계에서부터 저해하고 있음을 시사할 수 있다. 향후에는 조사포닌의 TNF-α 활성 차단 및 MCP-1 전사 단계에 관여하는 신호전달 기전에 대한 추가 분석이 이루어져야 할 것으로 보이며, in vitro 연구를 통한 세포독성 보호 효과를 확인하기 위해 지속적 연구가 이루어져야 할 것으로 판단된다.
References
-
Ziqiao Z, Renzhi R, Zhenyuan Z, Jinfeng C, Wenlong J, Fukun B et al. Research progress on removal of phthalates pollutants from environment. J Mol Liq. 2022 Mar; 355(1):118-930.
[https://doi.org/10.1016/j.molliq.2022.118930]

-
Yiyun L, Zhiling G, Ruihong Z, Dongzhi G, Pan-Pan J, De-Sheng P. An insight into sex-specific neurotoxicity and molecular mechanisms of DEHP: A critical review. Environmental Pollution. 2023 Jan; 316(2):120673.
[https://doi.org/10.1016/j.envpol.2022.120673]

-
Kim W.I, Gye M.C, Maleficent Effects of Phthalates and Current States of Their Alternatives : A Review. Korean J. Environ. Biol. 2017 Jan; 35(1):21-36.
[https://doi.org/10.11626/KJEB.2017.35.1.021]

-
Jeon S.H, Kim K.H, Choi J.W. Concentrations and Exposure Levels via Intake of Phthalates in Dust Deposits in Indoor Children’s Living Areas: Focusing on DEHP. J Environ Health Sci. 2022 Feb; 48(1):52-8.
[https://doi.org/10.5668/JEHS.2022.48.1.52]

-
Tom D, Rudolf R, Werner B, Birger H, Tilman K, Herbert R. A Controlled Challenge Study on Di(2-ethylhexyl) Phthalate (DEHP) in House Dust and the Immune Response in Human Nasal Mucosa of Allergic Subjects. Journal of Health and pollution. 2008 Nov; 116(11):1487-93.
[https://doi.org/10.1289/ehp.11474]

-
Park J.B, Kim J.Y, Sung J.H, Kim Y.U, Lee S.J. Di (2-ethylhexyl) Phthalate Induces the Apoptotic Cell Death Mediated by Production of Reactive Oxygen Species in Human Keratinocyte. Journal of Environmental Science International. 2020 Mar; 29(3):249-55.
[https://doi.org/10.5322/JESI.2020.29.3.249]

-
Hynu J.K, Kwon O.J, Lee J.Y, Roh S.S, Seu Y.B. Preventive effect of fermented red ginseng on cisplatin-induced nephrotoxicity mouse. J Appl Biol Chem. 2016 Jan; 59(2): 113-24.
[https://doi.org/10.3839/jabc.2016.021]

-
Nam K.Y, The Comparative Understanding between Red Ginseng andWhite Ginsengs. Processed Ginsengs (Panax ginseng C.A. Meyer). J Ginseng Res. 2005 Jan; 29:1-18.
[https://doi.org/10.5142/JGR.2005.29.1.001]

-
Lee J.M. The study of physicochemical properties and composition of ginsenosides in red ginseng extract by subcritical water extraction. Korean J. Food Sci Technol. 2015 Dec; 47(6):757-64.
[https://doi.org/10.9721/KJFST.2015.47.6.757]

- Lee K.Y, Park I.K, Park M.S, Song C.W, Lee M.Y, Kim H.Y. Respiratory tissue changes in rats inhaling Na₂CrO₄-4H₂O. Korean J Vet Res. 2003 Jun; 43(2):171-80.
- Lien V.H, Emma R.J, Xavier S, Kenny R. Bronchoalveolar Lavage of Murine Lungs to Analyze Inflammatory Cell Infiltration. J Vis Exp. 2017 May; (123): 55398.
- Kim N.J, Oh E.H, Suh H.S, Chung K.B, Yoon C.H. Characteristics of Percutaneous Absorption of Phthalate as Plasticizer. J. of the Korean Society for Environmental Analysis. 2013 Mar; 16(1):35-41.
- Park U.K. Anti-Inflammatory Effects of Liripoe Platyphylla Extract on Ovalbumin-Induced Asthma BALB/c Mouse Model. [dissertation]. [Daejeon]: Daejeon University; Daejeon; 2021. 1-103 p.
- Vadas, P, Browning, J, Edelson, J, Pruzanski. W. Extracellular phospholipase A2 expression and inflammation. Journal of Lipid Mediators. 1993 Aug ;8(1):1-30.
- Jeon T.W, Lee S.I, Yoon J.K. Effect of Cyclohexnae on the Lung Toxicity in Rats. Korean J. Biomed. Lab. 2000 Dec; 6(4):245-51.
-
Kim S.H, Lim H.B, Antiasthmatic Effects on Scutellaria baicalensis Georgi Extracts Against Airway Inflammation and Hyperresponsiveness Induced by Diesel Exhaust Particles with Ovalbumin Sensitization. Korean. J. Herbology. 2012 Jul; 28(1):65-71.
[https://doi.org/10.6116/kjh.2013.28.1.65]

- Shin H.S, Wi J.H, Lee S.H, Choi S.M, Jung E.M. Effects of Endocrine Disrupting Chemicals on the Nervous System. Journal of Life Science. 2022 Dec; 32(1):70-7.
- Hwang S.Y, Wee J.J, Yang J.B, Song T.W, Nam K.Y, Effect of Crude Ginseng Saponin on Clinical Pathological Parameters of the Female Adult Guinea Pigs Exposed to 2,3,7,8-Tetrachlorodibenzo-p-dioxin. J. Biomed. Lab. 2001 Dec; 7(4):197-203.
-
Kim H.I, Kim J.K, Kim J.Y, Han M.J, Kim D.H. Fermented red ginseng and ginsenoside Rd alleviate ovalbumin-induced allergic rhinitis in mice by suppressing IgE, interleukin-4, and interleukin-5 expression. J Ginseng Res. 2019 Oct; 43(4):635-44.
[https://doi.org/10.1016/j.jgr.2019.02.006]

-
Sung Y.Y, Kim S.H, Yuk H.J, Yang W.K, Lee Y.M, Son E.J. Kim D.S. Siraitia grosvenorii residual extract attenuates ovalbumin-induced lung inflammation by down-regulating IL-4, IL-5, IL-13, IL-17, and MUC5AC expression in mice, ternational. J. phymed. 2019 Aug; 61: 152835.
[https://doi.org/10.1016/j.phymed.2019.152835]

-
Guzman K, Gray T.E, Yoon J.H, Nettesheim P, Quantitation of mucin RNA by PCR reveals induction of both MUC2 and MUC5AC mRNA levels by retinoids. American Journal of physiology. 1996 Dec; 6(1):1023-8.
[https://doi.org/10.1152/ajplung.1996.271.6.L1023]

- Kim K.C, Lee C.H. The Effect of Betulinic Acid on TNF-α induced MCP-1 Expression in HL-60 Cells. Yakhak Hoeji. 2008 Jul; 52(1):37-42.
- Choi Y.S, Kim S.H. Non-Steroidal Anti-Inflammatory Drugs Change Various Inflammatory Mediator-Related Gene Expression In Aβ1-42 Activated Mouse Microglial Cell. J Korean Geriatr Soc. 2007 Feb; 11(3):130-8.
-
Katia D.F, Anne D, Mike H, Emma N, Nico V.R, Karin H, Mast cell and macrophage chemokines CXCL1/CXCL2 control the early stage of neutrophil recruitment during tissue inflammation. blood. 2013 Jun; 121(24):4930-7.
[https://doi.org/10.1182/blood-2013-02-486217]