벌사상자의 위염 치료 적용에 대한 네트워크 약리학적 분석
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
The purpose of this study was to identify the applicability, main compounds, and target genes of Cnidii Fructus (CF) in the treatment of gastritis using network pharmacology. The compounds in CF were searched in Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform (TCMSP) and a database of medicinal materials and chemical compounds in Northeast Asian traditional medicine (TM-MC). The target gene information of the compounds was collected from pubchem and cross-compared with the gastritis-related target gene information collected from Genecard to derive the target genes. Gene ontology (GO) analysis and Kyoto Encyclopedia of Genes and Genomes (KEGG) analysis were performed on the derived target genes. Afterwards, network analysis between compounds and disease target genes was performed using cytoscape. We identified 121 active compounds and 139 target genes associated with gastritis. Pathways derived from the GO biological process and KEGG pathway DB primarily focus on target genes related to inflammation (IL-6, IL-8, TNF production, NF-κB transcription factor activity, and NF-κB signaling pathway) and cell death (PI3K-Akt, FoxO). Major targets for CF treatment of gastritis include TP53, TNF, BCL2, EGFR, NFKB1, ABCB1, PPARG, PTGS2, IL6, IL1B, and SOD1, along with major compounds such as coumarin, osthol, hexadecanoic acid, oleic acid, linoleic acid, and stigmasterol. This study provided CF’s applicability for gastritis, related compounds, and target information. Evaluating CF’s effectiveness in a preclinical gastritis model suggests its potential use in clinical practice for digestive system diseases.
Keywords:
Traditional korean medicine, Cnidii Fructus, Cnidium monnieri, Gastritis, Network pharmacology서 론
한약은 국내외에서 오랜 역사를 가지고 임상에서 질환 치료에 사용되었을 뿐 아니라, 효능 및 안전성에 대한 과학적인 규명을 위한 여러 연구들도 꾸준히 누적되어 오고 있다. 한약은 단일 약재의 경우에도 다양한 성분을 포함하고 있는 복합물의 형태이기 때문에, 약리 작용 또한 다양하게 나타나게 된다. 기존의 one compound-one target 방식의 연구 역시 여러 성과가 있었으나 대부분의 효과적인 약물들은 다중 타겟을 조절함으로써 작용하는 경우가 많아 기존 연구만으로는 약재의 효능에 대해 완전히 파악하는 데는 한계가 있다1). 이를 보완할 수 있는 네트워크 약리학적 접근은 기존 다양한 연구들의 누적으로 형성된 데이터베이스들을 활용하여 실험적인 연구를 진행하기 전 미리 주요 활성 성분 및 타겟, 약리학적 기전 등을 예측할 수 있게 해 연구 효율을 높여주는 것으로 보고되어 있다2). 그동안 전통적인 사용례를 바탕으로 한약을 활용한 임상이나 연구가 진행되는 경우가 많았으나, 다른 차원의 접근을 통해 새로운 분야에 대한 치료 효과를 발견하고, 활용도를 높이려는 시도에도 도움이 될 것으로 생각된다.
위염 및 위궤양은 위산 등의 위 점막 공격인자 증가 및 위점액 등 위점막 방어인자의 감소로 인해 위장 점막의 손상이 발생하여 나타나는 질환으로3), 속쓰림과 함께 동반되는 통증으로 삶의 질을 저하시킬 뿐 아니라 적절히 치료되지 않으면 위장관 출혈 및 천공 등을 유발할 수 있다. 한국에서 위염 및 십이지장염은 2022년 기준 외래 환자 수 5,089,238명으로 다빈도 질병 순위 9위에 해당하는 질병이며, 최근 계속해서 환자 수가 증가하고 있다4,5). 위염의 치료제로는 P-CAB, PPI 등 주로 공격인자인 위산 분비를 억제하는 의약품이 사용되고 있으나, 장기간 사용 시 골다공증, 고가스트린혈증 등 부작용이 나타나는 경우가 보고되어 상대적으로 안전한 위점막 방어를 주 기전으로 하는 약물 개발에 대한 연구가 계속해서 진행되고 있다6).
한의학에서 사상자(蛇床子)는 보양약(補陽藥)으로 분류되어 온신조양(溫腎助陽), 거풍조습(祛風燥濕), 살충(殺蟲) 등의 효능으로 남성 발기부전(陽痿), 여성 관련 질환(女子帶下陰痒, 子宮寒冷不孕) 치료 등에 전통적으로 사용되어 왔다7,8). 임상에서도 사상자의 보양약(補陽藥)으로써의 효능과 연관된 증상, 질병 치료에 주로 이용되어 왔기 때문에 타 증상, 질병 치료에의 응용은 부족한 편이다. 특히 현재까지 사상자가 소화기계에 미치는 영향에 대한 연구는 상대적으로 미미한 실정이다. 사상자(蛇床子)의 기원식물로 중국, 일본 등에서는 벌사상자(Cnidium monnieri (L.) Cusson)의 열매를 공정서에 기원으로 수재하고 있으며, 국내에서는 벌사상자와 함께 사상자(Torilis japonica (Houtt.) DC.)의 열매를 기원으로 수재하고 있어 국가별로 기원식물이 상이한 부분이 있다9). 본 연구에서는 그 중 3개국 공정서에 기원식물로 공동으로 수재 된 벌사상자를 기준으로 위염에 대한 치료 효과와 그 기전, 그리고 이에 관계되는 구성 성분을 네트워크 약리학을 바탕으로 예측하고자 하였다.
재료 및 방법
1. 연구 대상 약재의 구성 성분 수집
중의학 시스템 약리학 연구 데이터베이스인 Traditional Chinese Medicine Systems Pharmacology (TCMSP)와 한국한의학연구원의 연구팀에서 구축한 성분 분석 문헌 기반의 성분 데이터베이스인 TM-MC를 활용하여 벌사상자의 성분을 조사, 구축하였다.
2. 벌사상자 구성 성분의 항염증 타겟 분석
TCMSP와 TM-MC를 이용하여 구축된 한약재 성분의 단백질 타겟은 PubChem의 Chemical-Target Interactions 정보를 활용하여 수집하였다. 이후 수집된 타겟 정보가 연구 대상으로 하는 질환인 위염(gastritis)과 상호 작용할 수 있는 타겟 정보를 GeneCard DB를 활용하여 선별하였다. 질환과 상호 작용할 것으로 예측되는 타겟을 대상으로 GO enrichment analysis와 KEGG pathway analysis를 수행하였으며, 여기에는 유전자 주석, 시각화 및 통합 검색을 위한 데이터베이스인 DAVID (version 2023q3)를 활용하여 분석하였다. GO enrichment analysis는 biological processes (BP) 범주를 대상으로 하였다. 이후 성분과 질환 타겟의 네트워크 분석을 위하여 먼저 STRING 데이터베이스 (http://www.string-db.org/)를 사용하여 타겟 간 상호작용 네트워크 데이터를 추가 수집한 이후 Cytoscape (version 3.10.1)을 사용하여 성분-타겟 사이의 네트워크를 구축하고 분석하였다.
결 과
1. TCMSP와 TM-MC 데이터베이스를 활용한 벌사상자의 유효 성분 구축
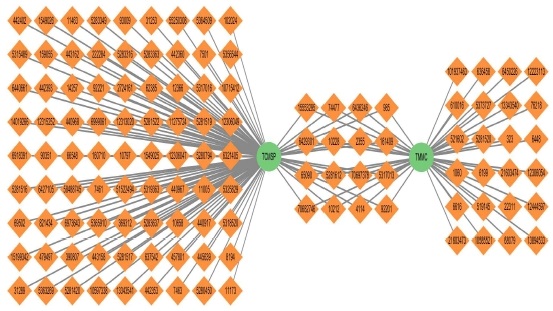
벌사상자의 구성 성분으로 TCMSP 데이터베이스에서 총 114개의 성분, TM-MC 데이터베이스에서 144개의 성분이 수집되었으며, 중복을 제거하고 CID가 매핑되는 성분으로 제한한 결과 총 121개의 성분을 도출하였다(Table 1). 이 중 16개의 성분은 TCMSP와 TM-MC에 공통적으로 존재하는 성분으로 확인되었다(Fig. 2).
2. target gene 도출
앞선 database 분석을 통해 도출된 121개의 성분을 대상으로 PubChem에서 Chemical-Target Interactions 정보를 수집하였다. 그 결과 37개 성분에 대해 상호작용하는 5052개 타겟 정보를 수집할 수 있었으며, 그중 32개 성분, 3513개 타겟이 인간(Homo sapiens) 관련 유전자 타겟으로 확인되었다.
수집된 3513개 타겟 중 중복을 제거하고 2409개 타겟이 남았으며 이를 GeneCard를 통해 수집된 위염 관련 타겟 1767개와 교차 비교하여 relevance score가 1.0 이상인 타겟만 선별 수집하여 최종적으로 TCMSP와 TM-MC에서 도출된 사상자에서 활성이 예상되는 성분과 상호 작용할 것으로 보고된 위염 관련 유전자 타겟 139개를 확인할 수 있었다(Table 2).
3. GO enrichment 및 KEGG pathway 분석을 통한 작용기전 분석
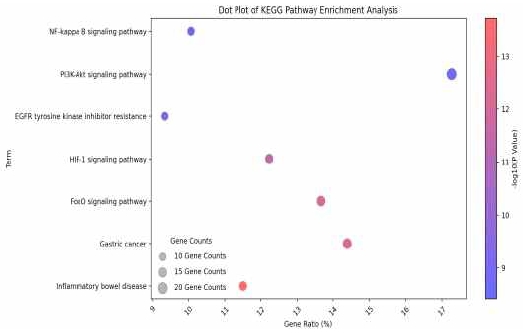
위염에 대한 활성이 예상되는 139개의 타겟 유전자를 대상으로 DAVID (version 2023q3)를 활용하여 GO enrichment 분석과 KEGG Pathway 분석을 시행하였다. 그 결과 사상자의 구성 성분이 위염 관련 타겟에 작용할 것으로 예측되는 기전은 negative regulation of apoptotic process, inflammatory response, response to ethanol, positive regulation of interleukin-8 production, positive regulation of interleukin-6 production, positive regulation of NF-kappaB transcription factor activity, positive regulation of tumor necrosis factor production 등으로 예측되었다 (Table 3, Fig. 3). 또한 이러한 타겟과 관련된 생물학적 경로를 예측한 결과 주로 Inflammatory bowel disease, Gastric cancer, FoxO signaling pathway, HIF-1 signaling pathway, EGFR tyrosine kinase inhibitor resistance, PI3K-Akt signaling pathway, NF-kappa B signaling pathway 등이 관여할 것으로 예측되었다(Table 4, Fig. 4).
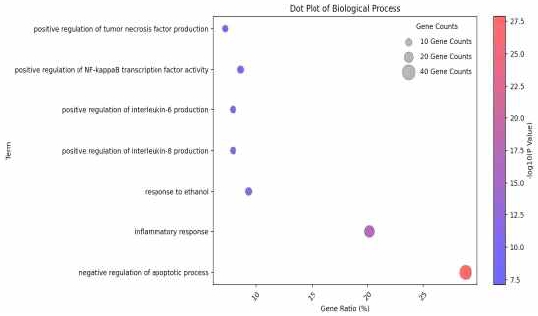
Dot plot for Biological processes related to targets of Cnidii Fructus using David GO enrichment analysis.
4. 사상자의 위염 활성 기전에 관여하는 성분과 표적에 대한 네트워크 분석(Network Analysis)
성분-타겟 네트워크 중 타겟 간 상호작용 네트워크 분석을 위해 STRING-DB를 통하여 타겟 간 상호 작용 데이터를 추가 수집, 구축하여 분석하였다. 그 결과 총 165개의 타겟 및 성분 노드가 2915개의 연결을 보였으며, 평균 이웃 수는 35.33개로 나타났다(Fig. 5a). 또한 매개 중심성 (Betweenness Centrality)을 기준으로 중요한 역할을 할 것으로 기대되는 주요한 성분으로는 coumarin, hexadecanoic acid, oleic acid, linoleic acid, stigmasterol, xanthotoxin, osthol, psoralen, diosmetin 등이 있었으며, 타겟으로는 TP53, TNF, BCL2, EGFR, NFKB1, ABCB1, STAT3, PPARG, PTGS2, IL6, PTEN, IL1B, GSR, SOD1 등이 있었다(Table 5, 6). 벌사상자의 주요 성분과 상호작용하는 타겟의 네트워크 분석에서는 IL1B, IL6, TNF, MMP2, FAS, NOS2, CAT, NFKB1, BCL2 등이 공통적으로 관계되는 마커로 확인되었다.
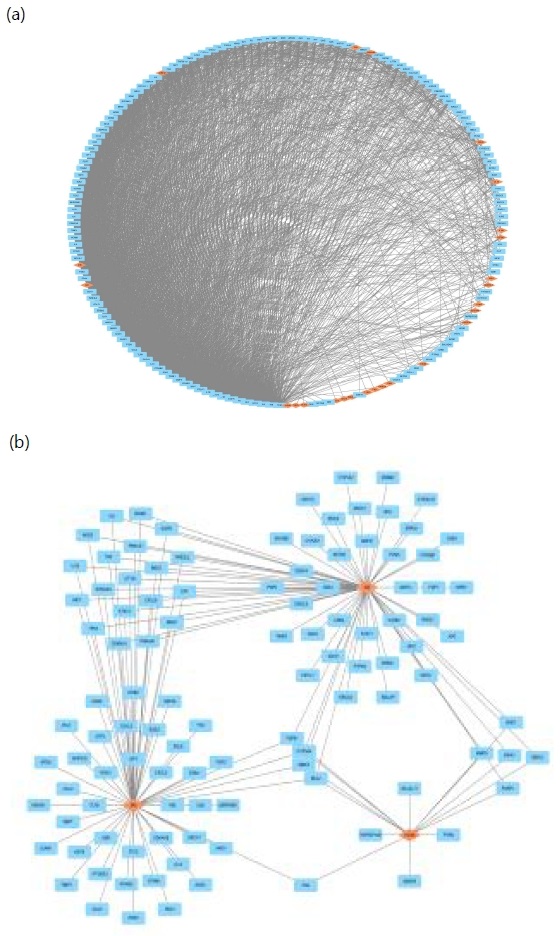
Compound-Target Network of compounds in Cnidii Fructus for gastritis. (a) Total Network (165 nodes, 2915 edges), (b) Compound-Target Network of representative compounds in Cnidii Fructus
고 찰
본 연구에서 TCMSP와 TM-MC database를 통해 벌사상자의 구성성분을 확인한 후 pubchem의 CID가 매핑되는 성분 121개를 도출하였다. 도출된 성분을 기반으로 pubchem의 chemical-target interactions 정보를 수집한 후 genecard를 통해 확보한 위염 관련 타겟과 교차 비교하여 최종적으로 벌사상자 함유 성분의 위염 관련 타겟 유전자 139개를 확인할 수 있었다. 이후 타겟 유전자를 대상으로 벌사상자의 위염에 대한 효능에 관여하는 기전을 예측하기 위해 GO enrichment 분석과 KEGG Pathway 분석을 시행하였다. Go enrichment 분석에서는 “negative regulation of apoptotic process”, “inflammatory response”, “response to ethanol”, “positive regulation of interleukin-8 production”, “positive regulation of interleukin-6 production”, “positive regulation of NF-kappaB transcription factor activity”, “positive regulation of tumor necrosis factor production” 등이 관계되는 것으로 예측되었고, “Inflammatory bowel disease”, “Gastric cancer”, “FoxO signaling pathway”, “HIF-1 signaling pathway”, “EGFR tyrosine kinase inhibitor resistance”, “PI3K-Akt signaling pathway”, “NF-kappa B signaling pathway” 등의 경로가 관여하는 것을 확인할 수 있었다. 분석에서 도출된 경로들은 주로 염증(IL-6, IL-8, TNF production, NF-kappaB transcription factor activity, NF-kappa B signaling pathway)10), 세포 사멸(PI3K-Akt, FoxO)11)과 관련된 타겟과 경로가 주를 이루고 있었다. 이외에 HIF-1α은 위암의 주요 표적 중 하나로 보고되고 있는 마커이며12), 일부 연구에서는 NSAIDs에 의한 위점막 손상시 조직 허혈을 반영하는 인자 중 하나로 언급된 바 있다13). EGFR은 헬리코박터 파일로리의 위암 발병시 활성화 되는 것으로 보고된 마커이다14).
네트워크 분석을 통해 확인된 주요 타겟에서도 기전과 관련된 타겟들이 확인되었다. 가장 높은 매개중심성이 나타난 TP53 유전자의 경우 중요한 암억제 유전자 중 하나로 TP53 유전자의 변화가 위식도의 암 발생에 관계된다고 보고되었으며15), IL2, PTGS2, TNF에 의한 TP53의 하향조절은 위궤양 환자에서 일어나는 주요 과정으로 보고된 바 있다16). 주요 기전 중 하나인 항염증과 관련된 TNF, NFKB1, PPARG, PTGS2, IL6, IL1B 등도 주요 타겟으로 확인되었다. 이외에 항산화와 관련된 타겟인 GSR, SOD1 등도 확인할 수 있었다. ABCB1은 ATP 결합 카세트 수송체(ATP-binding cassette (ABC) transporters)와 관련된 유전자로 염증성 장질환과 관계가 있는 것으로 보고되었다17).
본 연구에서 위염에 가장 높게 관여할 것으로 예측된 벌사상자의 성분은 coumarin이었다. coumarin은 다른 노드 연결에 얼마나 역할을 하는지를 나타내는 매개중심성(betweenness centrality)이 가장 높게 나타났다. 이외에도 네트워크 분석에서 위염과 관련될 것으로 예측된 osthol, xanthotoxin, psoralen, bergapten 등도 coumarin 계열 성분으로 벌사상자의 위염 관련 기전에 coumarin 계열 성분이 주로 관여할 수 있음을 확인할 수 있었다. 벌사상자의 coumarin 성분 중 가장 많은 연구가 보고된 성분은 osthol (=osthole)이다18). osthol은 성숙한 벌사상자 열매가 1% 이상 함유하고 있는 대표 성분으로 항산화, 항염증, 면역 조절 등이 주요 작용으로 보고되어 있다. osthol은 염증 과정에 관여하는 중요한 효소인 5-lipoxygenase와 cyclooxygenase (COX)-1을 선택적으로 억제하는 것으로 알려져 진통이나 염증에 대한 효과가 보고되어 있다19). 소화기계와 관련하여 osthol은 DSS로 유도된 궤양성대장염 mouse에서 궤양성대장염의 질병 활동 지수(disease activity index, DAI)를 유의하게 개선하였으며, 짧아진 결장의 길이도 증가시켰다. 주요 기전으로는 염증에 관여하는 cytokine인 TNF-α의 발현을 억제하고, cytokine 생성에 관여하는 NF-κB p65, IκBα, and p-IκBα 등 NF-κB pathway의 활성을 억제하여 염증 억제 효과를 나타내는 것으로 확인되었다20). 그 밖에 osthol은 카라기난 유도 족부 부종 모델에서 염증에 관여하는 prostaglandin, NO, MDA 등의 생성을 억제하거나, 요추 추간판 탈출로 유도된 좌골신경통 동물 모델의 등쪽뿌리신경절에서 COX-2, NOS 발현을 억제하는 등 다양한 동물 모델에서 염증을 완화하는 효과를 나타내었다19). coumarin 계열 성분 이외에는 지방산이 벌사상자의 위염 관련 효능에 중심성이 높게 관여하는 것으로 확인되었다. 그 예로 hexadecanoic acid (=palmitic acid)와 같은 포화지방산과 oleic acid, linoleic acid, myristic acid 등 불포화지방산이 도출되었다. 지방산 중 oleic acid, linoleic acid는 taurocholic acid, aspirin 등으로 위점막 손상을 유발한 흰쥐 모델에서 용량의존적으로 위점막의 손상을 억제하는 효능이 보고되었다21). 이처럼 네트워크 분석을 통해 도출된 벌사상자의 성분이 항염증, 항산화, 세포 사멸 억제 등에 관련된 타겟과 기전으로 위염 예방 및 치료 효능을 나타낼 가능성을 선행 연구에서도 확인할 수 있었다.
결 론
벌사상자 구성 성분과 위염 관련 표적의 데이터베이스 정보를 바탕으로 네트워크 분석을 통해 위염에 작용할 수 있는 성분과 그 세부 기전을 다음과 같이 확인하였다.
벌사상자의 구성 성분 중 위염과 관계된 성분 121개와 그 성분의 활성이 예상되는 타겟 139개를 도출할 수 있었다.
벌사상자의 타겟을 기반으로 위염과 관련된 기전은 Go biological process DB에서 “negative regulation of apoptotic process”, “inflammatory response”, “response to ethanol”, “positive regulation of interleukin-8 production”, “positive regulation of interleukin-6 production”, “positive regulation of NF-kappaB transcription factor activity”, “positive regulation of tumor necrosis factor production” 등이 확인되었고, KEGG pathway DB에서는 “Inflammatory bowel disease”, “Gastric cancer”, “FoxO signaling pathway”, “HIF-1 signaling pathway”, “EGFR tyrosine kinase inhibitor resistance”, “PI3K-Akt signaling pathway”, “NF-kappa B signaling pathway” 등으로 확인되었다.
벌사상자의 위염 관련 주요 타겟으로 TP53, TNF, BCL2, EGFR, NFKB1, ABCB1, PPARG, PTGS2, IL6, IL1B, SOD1 등이 예측되었고, 관련 주요 성분으로 coumarin, osthol, hexadecanoic acid, oleic acid, linoleic acid, stigmasterol 등이 예측되었다.
위의 결과를 통해 벌사상자의 위염에 대한 활용 가능성을 예측할 수 있었으며, 본 연구진은 관련 전임상 연구를 통해 이를 후속 검증할 계획이다. 이를 통해 위염에서의 유효성이 확인된다면 향후 임상에서 소화기계 질환에 대한 사상자의 활용이 기대된다.
Acknowledgments
이 논문은 2021년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(No.2021R1I1A3059594)
References
-
Han SY, Kim YK. New approach for herbal formula research : network pharmacology. J. Physiol & Pathol Korean Med. 2016;30(6):385-96.
[https://doi.org/10.15188/kjopp.2016.12.30.6.385]

-
Moncrieff J. Research on a “drug-centred” approach to psychiatric drug treatment: assessing the impact of mental and behavioural alterations produced by psychiatric drugs. Epidemiol Psychiatr Sci. 2018;27(2):133-40.
[https://doi.org/10.1017/S2045796017000555]

- Shay H, Komarov S, Fels S, Meranze D, Gruenstein M, Siplet H. A simple method for the uniform production of gastric ulceration in the rat. Gastroenterol. 1945;5:43-61.
-
Kim SG, Kim JG, Shin SK, Kim HS, Seol SY Guidelines of diagnosis for peptic ulcer disease. Korean J Gastroenterol. 2009;54:279–84.
[https://doi.org/10.4166/kjg.2009.54.5.279]

- Health Insurance Review & Assessment Service. Healthcare Bigdata Hub. 2015 [cited 2024 Jan 10]. Available from. URL . http.//opendata.hira.or.kr/, )
-
Kim YS, Nam YS, Song JB, Kim HC. Gastroprotective and healing effects of Polygonum cuspidatum root on experimentally induced gastric ulcers in rats. Nutrients. 2020;12(8):2241.
[https://doi.org/10.3390/nu12082241]

- Herbology Editorial Committee of Korean Medicine School. Korean herbology (Boncho-hak). Seoul : Younglimsa. 2010.
-
Li YM, Jia M, Li HQ, Zhang ND, Wen X, Rahman K, Zhang QY, Qin LP. Cnidium monnieri: A review of traditional uses, phytochemical and ethnopharmacological properties. Am J Chin Med. 2015;43(5):835-77.
[https://doi.org/10.1142/S0192415X15500500]

- Korea Institute of Oriental Medicine. Defining dictionary for medicinal herbs [Korean, 'Hanyak giwon sajeon'](2024). Published on the Internet; https://oasis.kiom.re.kr/herblib/hminfo/hbmcod/hbmcodList.do, (accessed 2024-01-03).
-
Liu T, Zhang L, Joo D, Sun SC. NF-κB signaling in inflammation. Signal Transduct Target Ther. 2017;2:17023.
[https://doi.org/10.1038/sigtrans.2017.23]

-
Tong Y, Wang R, Liu X, Tian M, Wang Y, Cui Y, Zou W, Zhao Y. Zuojin pill ameliorates chronic atrophic gastritis induced by MNNG through TGF-β1/PI3K/Akt axis. J Ethnopharmacol. 2021;271:113893.
[https://doi.org/10.1016/j.jep.2021.113893]

-
Ucaryilmaz Metin C, Ozcan G. The HIF-1α as a potent inducer of the hallmarks in gastric cancer. Cancers (Basel). 2022;14(11):2711.
[https://doi.org/10.3390/cancers14112711]

-
Ito M, Tanaka S, Kim S, Kuwai T, Matsutani N, Kamada T, Kitadai Y, Sumii M, Yoshihara M, Haruma K, Chayama K. The specific expression of hypoxia inducible factor-1alpha in human gastric mucosa induced by nonsteroidal anti-inflammatory drugs. Aliment Pharmacol Ther. 2003;18 (Suppl. 3):90-2.
[https://doi.org/10.1046/j.1365-2036.18.s1.10.x]

-
Crabtree JE, Jeremy AH, Duval C, Dixon MF, Danjo K, Carr IM, Pritchard DM, Robinson PA. Effects of EGFR inhibitor on Helicobacter pylori Induced gastric epithelial pathology in vivo. Pathogens. 2013;2(4):571-90.
[https://doi.org/10.3390/pathogens2040571]

-
Bellini MF, Cadamuro AC, Succi M, Proenca MA, Silva AE. Alterations of the TP53 gene in gastric and esophageal carcinogenesis. J Biomed Biotechnol. 2012;2012:891961.
[https://doi.org/10.1155/2012/891961]

- Vafaee R, Jahani Sherafat S, Rezaei Tavirani M, Ahmadi N. Down-regulation of TP53 is a highlighted molecular event in gastric ulcer. Gastroenterol Hepatol Bed Bench. 2022;15(3):249-55.
-
Petryszyn PW, Wiela-Hojeńska A. The importance of the polymorphisms of the ABCB1 gene in disease susceptibility, behavior and response to treatment in inflammatory bowel disease: A literature review. Adv Clin Exp Med. 2018;27(10):1459-63.
[https://doi.org/10.17219/acem/92936]

-
Sun Y, Yang AWH, Lenon GB. Phytochemistry, ethnopharmacology, pharmacokinetics and toxicology of Cnidium monnieri (L.) Cusson. Int J Mol Sci. 2020;21(3):1006.
[https://doi.org/10.3390/ijms21031006]

-
Zhang ZR, Leung WN, Cheung HY, Chan CW. Osthole: A review on its bioactivities, pharmacological properties, and potential as alternative medicine. Evid Based Complement Alternat Med. 2015;2015:919616.
[https://doi.org/10.1155/2015/919616]

-
Fan H, Gao Z, Ji K, Li X, Wu J, Liu Y, Wang X, Liang H, Liu Y, Li X, Liu P, Chen D, Zhao F. The in vitro and in vivo anti-inflammatory effect of osthole, the major natural coumarin from Cnidium monnieri (L.) Cuss, via the blocking of the activation of the NF-κB and MAPK/p38 pathways. Phytomedicine. 2019;58:152864.
[https://doi.org/10.1016/j.phymed.2019.152864]

-
Mandel KG, Bertram TA, Eichhold MK, Pepple SC, Doyle MJ. Fatty acid-mediated gastroprotection does not correlate with prostaglandin elevation in rats exposed to various chemical insults. Vet Pathol. 1994;31(6):679-88.
[https://doi.org/10.1177/030098589403100608]