
모링가:두충 2:1 (g:g) 복합 조성물의 in vitro 항산화 및 항염 효능 연구
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
The purpose of study is to evaluate in vitro anti-oxidant and anti-inflammatory effects of Moringa Folium and Eucommiae Cortex 2:1 (g/g) mixtures (MEMix). HaCaT and human normal dermal fibroblast were treated with 0.01-1 mg/mL of MEMix to monitor cytotoxicity. Radical scavenging activities of MEMix were examined by DPPH assay. To explore anti-inflammatory effect, Raw 264.7 cells were pretreated with MEMix for 1h and subsequently exposed to LPS for 18h. NO release and cytotoxicity of Raw 264.7 cells were measured by adding Griess and MTT reagents, respectively. TNF-α, IL-1β, IL-6, and PGE2 productions were examined by ELISA. Immunoblot analysis was conducted to examine COX-2 expression in MEMix pretreated Raw 264.7 cells. Up to 1 mg/mL concentration, treatment of MEMix for 24 h did not affect normal dermal fibroblast viability and significantly reduced cell viability of HaCaT cells with no concentration dependency. MEMix increased DPPH radical scavenging activity with concentration dependency. Radical scavenging activities by 1 mg/mL of MEMix was comparable with 30 μM of trolox. Pretreatment of MEMix did not change the reduction of Raw 264.7 cell viability. Exposure of LPS in Raw 264.7 cells significantly increased NO, TNF-α, IL-1β, IL-6, and PGE2 productions, and MEMix pretreatment attenuated these productions by LPS concentration dependently. However, pretreatment with MEMix did not change COX-2 expression by LPS in Raw 264.7 cells. MEMix showed in vitro anti-oxidant and anti-inflammatory activities. MEMix would be useful candidate agent against inflammation.
Keywords:
Moringa Folium, Eucommiae Cortex, Moringa Folium and Eucommiae Cortex 2:1 (g/g) mixtures, DPPH radical scavenging activity, Anti-inflammatory effect서 론
염증은 물리적, 화학적, 생물학적 손상으로부터 인체를 보호하고 항상성을 유지하는데 필수적인 과정이지만 과도한 염증은 정상조직의 파괴를 포함한 다양한 부작용을 야기할 수 있다1). 치주질환은 대표적인 만성 염증질환2,3)으로 치주 관련 결합 조직의 파괴, 치조골 소실, 백혈구 유주 등이 나타난다4,5). 특히 치주염은 성인에서 치아손실을 유발하는 가장 대표적인 질환으로서 부분적인 치조골 소실과 더불어 다양한 세균 증식과 관련된 염증이 강력한 병인으로 알려져 있다6). 세균에 의하여 조직이 파괴되는 정도는 숙주의 염증반응에 좌우되기 때문에 치주염 치료시에는 항균을 비롯하여 숙주의 염증반응을 조절하는 것도 필요하다. 따라서 치주질환의 치료방법 중 염증반응의 파괴적인 측면을 줄여 조직 파괴를 감소시키고 치주조직을 유지, 재생하는 측면에 초점을 맞추는 Host Modulation Therapy (HMT)가 제시된 바 있다7-9). 따라서 염증을 조절하는 것은 치주질환의 치료 및 예방에 있어 중요한 약물 표적 중 하나로서 임상에서 활용 가능한 효과적인 물질을 발굴하기 위해 다양한 천연물에 대한 연구가 활발하게 진행되고 있다10-13).
모링가 (Moringa oleifera Lam.)는 열대 지역에 널리 분포하는 관상용 나무로서 단백질과 비타민이 풍부하게 포함되어 영양가가 높다. 어린 잎, 꽃, 녹색 꼬투리는 식용으로 활용되고, 의학적으로는 씨앗을 포함한 나무의 각 부분이 통증 및 염증과 관련된 다양한 질병 치료 목적으로 사용된다14). 모링가잎 (MF; Moringa Folium)은 다량의 피토케미칼이 함유되어 있으며 항산화 및 항비만 활성15), 항당뇨, 항염증, 숙취 해소 효과, 간세포 보호 효과16), 콜레스테롤 제거, 간 손상 방지와 염증, 심장병 등의 치료효과가 보고되었다17,18). 두충 (EC; Eucommiae Cortex, Stem bark parts of Eucommia ulmoides Oliver)은 간과 신장의 기능을 개선하고 근육과 폐를 강화하며 혈압을 낮추는 등의 효능이 알려져 있다19). 약리학적으로는 항산화20), 항균, 항염증21) 과 신경보호작용22), 조골세포의 활성화와 파골세포의 억제23) 등이 보고되었다.
치아 경부 결찰 래트 치주질환 모델을 이용하여 천연물 14종의 치주염 및 치조골 손상 개선 효능을 평가한 연구에서 MF와 EC를 단독으로 투여한 경우와 1:1, 1:2, 1:4, 1:6, 1:8, 2:1, 4:1, 6:1, 8:1의 비율로 복합하여 투여한 경우를 비교했을 때 2:1로 투여한 경우 (MEMix)가 치주염 및 치조골 손상 개선의 측면에서 최적의 효능을 나타내는 조합으로 조사되었다. MEMix 투여군에서 치은 조직내 IL-1β, TNF-α, 지질과산화 지표인 MDA 함량의 감소가 가장 유의하게 (p<0.01) 나타났고, 치주질환 유도에 의해 증가된 파골세포의 수를 전체 투여군 중 가장 많이 감소시켰으며, 가장 유의한 치주골량의 증가 (p<0.01)와 구강협부 총 호기성 생균수의 감소가 (p<0.01) 나타났다24).
따라서, 본 연구에서는 치주질환의 치료 및 예방 후보물질로서 MF와 EC를 2:1로 복합한 조성물인 MEMix의 in vitro 항산화 및 항염 효능을 평가하였다.
재료 및 방법
1. 세포배양
인체 유래 HaCaT 세포, 인체 정상 피부 섬유아세포 (human normal dermal fibroblast), 마우스 유래 대식세포인 Raw 264.7 세포는 ATCC (Rockville, MD, USA)에서 공급받았다. 모든 세포는 10% FBS, 50 units/mL penicillin, 50 μg/mL streptomycin이 포함된 DMEM 배지를 이용하여 37℃, 5% CO2 조건에서 배양하였다.
2. MEMix 제조
MF와 EC는 이전 연구24)의 방법대로 추출한 것을 HL SCIENCE Co., Ltd. (Uiwang, Korea)에서 공급받았다. 670 mg의 MF와 330 mg의 EC를 10 mL의 물에 용해하고, 0.2 μm syringe filter (Nalgene, NY, USA)로 여과하여 MEMix를 제조하였다. Trolox (30 mM)와 liquiritigenin (LQ; 30 mM)는 dimethyl sulfoxide에 용해하였고, 모든 시험물질은 사용 전까지 -20℃ 냉동고에 보관하였다.
3. DPPH 라디칼 소거능 측정
DPPH 라디칼 소거능은 기존 보고된 김 등25)의 방법에 따라 측정하였다. 에탄올에 150 μM의 농도로 희석된 DPPH 용액을 0.03-1 mg/mL의 MEMix 또는 30 μM의 trolox 용액과 상온에서 30 분간 반응시키고 automated microplate reader (Infinite 200 PRO, Tecan, Männedorf, Switzerland)를 이용하여 570 nm의 파장에서 흡광도를 측정하였다.
4. 세포생존율 측정
HaCaT와 피부 유래 섬유아세포를 0.5×104의 농도로 48-well plate에 배양하고, 3시간 동안 혈청 결핍 (serum starvation)시킨 후 0.01-1 mg/mL의 MEMix를 24시간 동안 처치하였다. NO 생성량 변화가 Raw 264.7 세포에 대한 MEMix의 세포독성에서 기인하는지를 확인하기 위해 Raw 264.7 세포에 0.1-1 mg/mL의 MEMix를 1시간 동안 전처치한 후 1 μg/mL LPS를 18시간 동안 처치하였다. 이후 0.1 μg/mL의 MTT 용액을 4시간 반응시켜 생성된 formazan 결정을 200 μL dimethylsulfoxide에 용해하고, automated microplate reader (Tecan)를 이용하여 570 nm에서 흡광도를 측정하여 세포 생존율을 계산하였다.
5. NO 생성량 측정
Raw 264.7 세포에 0.1-1 mg/mL의 MEMix를 1시간 동안 전처치한 후, 1 μg/mL의 LPS를 18시간 동안 처치하여 회수한 배양액에 동량의 Griess reagent를 가하고 automated microplate reader를 이용하여 540 nm에서 흡광도를 측정하였다. 30 μM의 LQ를 양성 대조약물로 이용하였다. DMEM에 희석된 MEMix는 Griess reagent와 반응시 540 nm의 흡광도를 증가시켰으므로 이 값을 보정하여 NO 생성량을 계산하였다.
6. TNF-α, IL-1β, IL-6, PGE2 생성량 측정
Raw 264.7 세포에 0.1-1 mg/mL의 MEMix를 1시간 동안 전처치 후, 1 μg/mL의 LPS를 18시간 동안 처치하고 회수한 배양액에서 전염증성 싸이토카인인 TNF-α, IL-1β, IL-6 와 PGE2 생성량을 ELISA 법으로 측정하였다. 30 μM의 LQ를 양성 대조약물로 이용하였다. TNF-α, IL-1β, IL-6의 생성량은 BD OptEIATM ELISA Set (BD Biosciences, San Diego, CA, USA)을 이용하여 제조사의 방법에 따라 측정하였다. Maxisorp 96 well plate를 각 전염증성 싸이토카인에 대한 capture antibody로 코팅한 후, 10%의 FBS가 포함된 PBS로 blocking 하였다. 희석된 conditioned media를 첨가하여 반응시킨 후, streptoavidin-conjuaged horseradish pereoxidase와 detection antibody와 반응시켰다. 반응이 완료된 plate에 TMB substrate solution (BD)을 넣어 준 후 2N 황산용액으로 반응을 종료시켰다. 450 nm 및 570 nm에서 측정된 흡광도를 이용하여 전염증성 싸이토카인의 생성량을 계산하였다. MEMix가 COX-2 발현 억제를 통하여 PGE2 생성을 조절하는지를 확인하기 위하여 COX-2 단백질에 대한 면역화학분석을 수행하였다. PGE2의 함량은 Prostaglandin E2 Parameter Assay Kit (R&D Systems, Minneapolis, MN, USA)를 이용하여 제조사의 방법에 따라 competitive ELISA법으로 측정하였고, PGE2의 표준검량곡선에 내삽하여 PGE2 함량을 계산하였다.
7. 전세포 추출액의 제조 및 면역화학 분석
처치된 세포를 Xpert protease inhibitor cocktail, 1 mM sodium fluoride, 1 mM β-glycerophosphate, 1 mM sodium orthervanadate, 2.5 mM sodium pyrophosphate가 포함된 radioimmunoprecipitation buffer를 첨가하여 ice 하에서 1시간 반응시킨 후, 15,000 × g에서 10분간 원심분리하여 회수한 상층액을 전세포 추출액으로 사용하였다. 추출액 내의 총단백질 함량은 bicinchoninic acid assay (Thermo, Rockford, IL, USA)를 이용하여 측정하였고, 동량의 단백질을 sodium dodecyl sulfate-polyacrylamide gel electrophoresis system을 이용하여 전기영동한 후, nitrocellulose membrane (GE Healthcare Life Sciences, Buckinghamshire, UK)에 전이하였다. 5% skim milk로 blocking한 후 membrane은 anti-COX-2 antibody (Cayman Chemical, Ann Arbor, MI, USA)와 4℃에서 12시간 이상 반응시키고, horseradish peroxidase-conjuaged secondary antibody와 반응시켜 enhanced chemiluminescence detection kit를 이용하여 X-ray film에 감광하였다. β-acitn에 대한 면역화학분석을 통해 동량의 단백질 loading에 대하여 확인하였고, image J를 이용하여 desitometic analysis를 수행하였다.
8. 통계분석
모든 데이터는 최소 3회 이상 독립적으로 수행한 데이터의 mean ± SD로 표현하였으며, 모든 데이터가 정규분포를 따를 경우, 각 그룹간 평균은 ANOVA에 의해 비교하였으며, 등분산 가정이 성립할 때에는 Tukey’s HSD, 등분산 가정이 성립하지 않을 때에는 Dunnett’s T3법을 사후검정법으로 이용하여 각 그룹 간 평균 차이의 유의성을 평가하였다. 정규분포를 따르지 않는 경우, Kruskal-Wallis test과 Mann-Whitney U test에 의해 각 그룹 간 평균 차이의 유의성을 평가하였다.
결 과
1. MEMix의 라디칼 소거능
MEMix의 in vitro 항산화능은 DPPH를 이용한 자유라디칼 소거능으로 측정하였다. 0.1-1 mg/mL MEMix에 의한 라디칼 소거능은 통계적으로 유의하였고, 농도의존적으로 증가하였다. 0.03, 0.1, 0.3, 1 mg/mL MEMix에 의한 라디칼 소거능은 각각 -0.20 ± 11.75, 26.72 ± 4.61, 64.18 ± 2.54, 64.75 ± 6.43%였고, 30 μM trolox에 의한 라디칼 소거능은 61.71 ± 4.04%였다. 0.3, 1 mg/mL MEMix의 라디칼 소거능은 30 μM trolox에 의한 라디칼 소거능과 유사하였다(Fig. 1).
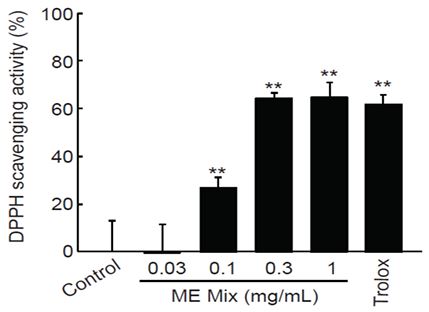
DPPH scavenging activity of MEMix. MEMix increased radical scavenging activity in a concentration dependent manner. Statistical significant of differences were observed in 0.1-1 mg/mL of MEMix. In addition, radical scavenging activities by 0.3 and 1 mg/mL of MEMix were comparable to those by 30 μM of trolox. Values are expressed mean ± SD of four separate experiments (Significant as compared with control by Tukey’s HSD test, **p<0.01). MEMix = Moringa Folium and Eucommiae Cortex 2:1 (g/g) mixed formula.
2. MEMix의 세포생존율에 미치는 영향
0.03-1 mg/mL의 MEMix 처치시 HaCaT 세포생존율은 대조세포와 비교하여 통계적으로 유의하게 감소하였고, 농도의존성은 관찰되지 않았다. 0.01, 0.03, 0.1, 0.3, 1 mg/mL의 MEMix 처치시 세포생존율은 각각 대조세포의 96.41 ± 4.39, 80.85 ± 6.68, 77.65 ± 2.60, 76.43 ± 1.91, 77.31 ± 3.84%였다 (Fig. 2, left). MEMix 처치시 피부 유래 섬유아세포의 생존율에는 유의한 영향이 나타나지 않았다. 0.01, 0.03, 0.1, 0.3, 1 mg/mL의 MEMix 처치시 세포생존율은 각각 대조세포의 96.55 ± 7.86, 92.50 ± 6.91, 92.83 ± 6.00, 98.25 ± 6.04, 109.03 ± 4.33%였다(Fig. 2, right).
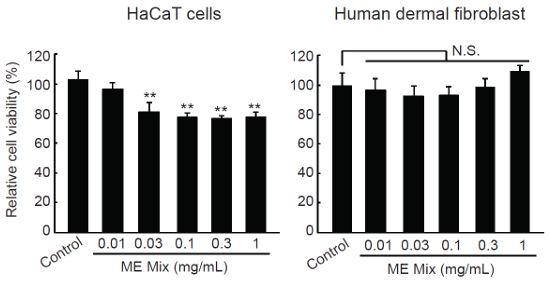
Effect of MEMix on viability of human skin derived cells. After HaCaT and human dermal fibroblast cells were treated with 0.01-1 mg/mL of MEMix for 24 h, effects of MEMix on cell viabilities were investigated by MTT assay. MEMix tended to decrease silightly, but significantly, the viabilities of HaCaT cells, while concentration-dependent gradual reduction of cell viability could not be observed. However, treatment with 0.01-1 mg/mL of MEMix did not change the cell viability of human dermal fibroblast cells. Values are expressed mean ± SD of at least five separate experiments (Significant as compared with control by Tukey’s HSD test, **p<0.01). N.S. = not significant; MEMix = Moringa Folium and Eucommiae Cortex 2:1 (g/g) mixed formula.
3. MEMix의 Raw 264.7 세포의 NO 생성 및 세포생존율에 미치는 영향
18시간 LPS를 처치한 경우는 대조세포와 비교하여 통계적으로 유의하게 NO 생성이 13.87 ± 1.89배 증가되었고, 30 μM의 LQ를 전처치한 경우는 대조세포와 비교하여 LPS에 의한 NO 생성이 4.09 ± 1.15배로 감소되었다. MEMix를 전처치한 경우 농도의존적으로 통계적으로 유의하게 LPS에 의한 NO 생성이 억제되었다. 0.1, 0.3, 1 mg/mL의 MEMix 전처치에 의한 NO 생성은 대조세포와 비교하여 각각 11.47 ± 1.99, 8.44 ± 2.08, 7.86 ± 2.04배로 나타났다 (Fig. 3, left). 18시간의 LPS 처치는 Raw 264.7 세포의 생존율을 49.81 ± 4.92%로 통계적으로 유의하게 억제하였고, MEMix를 전처치한 경우에는 0.3 mg/mL 농도만 제외하고 LPS에 의해 감소된 세포 생존율에 통계적으로 유의한 영향은 나타나지 않았다. 30 μM의 LQ 전처치 또한 LPS에 의하여 감소한 Raw 264.7 세포의 생존율에 영향을 주지 못하였다. 0.1, 0.3, 1 mg/mL의 MEMix 전처치에 의한 세포생존율은 대조세포와 비교하여 각각 56.68 ± 6.74, 61.78 ± 8.57, 56.73 ± 7.32%였다(Fig. 3, right).
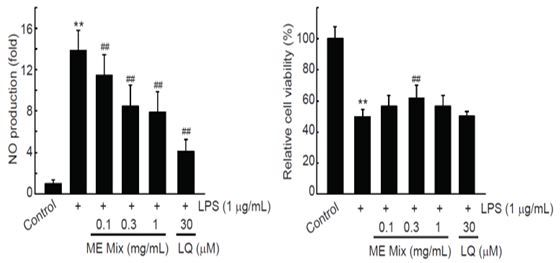
Effects of MEMix on NO Productions and cell viabilities in Raw 264.7 Cells. Raw264.7 cells were pretreated with 0.1-1 mg/mL of MEMix for 1 h, subsequently exposed to 1 μg/mL of LPS for 18 h, and then determined the NO production in culture medium by adding a Griess reagent. Exposure of LPS for 18 h significantly increased NO production, and LQ (30 μM) significantly decreased NO production by LPS. Pretreatment with MEMix gradually decreased NO production in a concentration-dependent manner. Statistical significances of differences were observed in 0.1-1 mg/mL of MEMix pretreated cells. In addition, LPS treatment for 18 h in Raw 264.7 cells significantly decreased the cell viability. Pretreatment of MEMix did not change LPS-mediated reduction of cell viability, except that 0.3 mg/mL of MEMix pretreatment slightly, but significantly, increased the cell viability by LPS. Values are expressed mean ± SD of at least four separate experiments. Experimental data for NO production and cell viatility were analyzed by Mann-Whitney U test and Tukey’s HSD test, respectively (Significant as compared with control, **p<0.01; significant as compared with LPS alone treated cells, ##p<0.01). LQ = liquiritigenin; MEMix = Moringa Folium and Eucommiae Cortex 2:1 (g/g) mixed formula.
4. MEMix의 Raw 264.7 세포의 LPS 유도 전염증성 싸이토카인 생성에 미치는 영향
18시간의 LPS 처치는 대조세포와 비교하여 전염증성 싸이토카인의 생성을 통계적으로 유의하게 증가시켰으며, MEMix의 전처치는 통계적으로 유의하게 전염증성 싸이토카인의 생성을 억제하였다. 특히, 1 mg/mL MEMix 전처치는 30 μM의 LQ 전처치에 의한 전염증성 싸이토카인 생성억제와 비슷한 수준을 나타났다(Fig. 4). LPS 단독, LPS와 MEMix를 0.1 mg/mL, 0.3 mg/mL, 1 mg/mL의 농도로 처치한 경우 TNF-α 생성은 대조세포와 비교하여 각각 26.08 ± 1.18, 20.53 ± 2.17, 17.58 ± 1.22, 11.20 ± 2.01 배로 나타났고, IL-1β 생성은 대조세포와 비교하여 각각 8.10 ± 0.86, 4.82 ± 0.51, 2.16 ± 0.13, 2.53 ± 0.24 배로 나타났으며, IL-6 생성은 대조세포와 비교하여 각각 57.98 ± 2.63, 46.53 ± 1.77, 31.77 ± 1.18, 28.90 ± 1.47배로 나타났다.
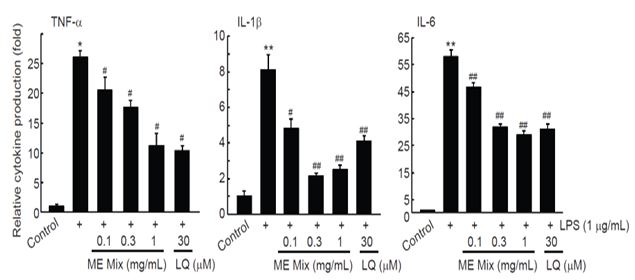
Effect of MEMix on productions of pro-inflammatory cytokines in Raw 264.7 Cells. Raw 264.7 cells were pretreated with 0.1-1 mg/mL of MEMix for 1 h, subsequently exposed to 1 μg/mL of LPS for 18 h, and then determined the cytokine productions in culture medium by enzyme linked immunosorbent assay. When comparing to the control, treatment with LPS significantly increased production of TNF-α, IL-1β, and IL-6. Pretreatment of MEMix significantly inhibited LPS-inducible TNF-α, IL-1β, and IL-6 productions in a concentration dependent manner. Especially, reductions of cytokine production by 1 mg/mL of MEMix were comparable to those by 30 μM of LQ. Values are expressed mean ± SD of four separate experiments. Experimental data for TNF-α, IL-1β, and IL-6 were analyzed by Mann-Whitney U, Dunnett T3, and Dunnett T3 test, respectively (Significant as compared with control, **p<0.01, *p<0.05; Significant as compared with LPS treated cells, ##p<0.01, #p<0.05). LQ = liquiritigenin; MEMix = Moringa Folium and Eucommiae Cortex 2:1 (g/g) mixed formula.
5. MEMix의 Raw 264.7 세포의 LPS에 의해 유도된 PGE2 생성 및 COX-2 발현에 미치는 영향
Raw 264.7 세포에서 LPS는 대조세포와 비교하여 PGE2 생성을 43.66 ± 0.67 배 통계적으로 유의하게 증가시켰고, MEMix 전처치는 농도의존적으로 PGE2의 생성을 억제하였다. 0.3와 1 mg/mL MEMix 전처치는 PGE2의 생성을 LPS 단독 처치군과 비교하여 통계적으로 유의하게 억제하였다. 1 mg/mL MEMix 전처치에 의한 PGE2 생성 억제는 30 μM LQ 전처치에 의한 PGE2 생성 억제와 비슷한 수준이었다(Fig. 5, left). LPS 단독, LPS와 MEMix를 0.1 mg/mL, 0.3 mg/mL, 1 mg/mL의 농도로 처치한 경우 PGE2 생성은 대조세포와 비교하여 각각 43.66 ± 0.67, 39.84 ± 1.18, 34.88 ± 0.74, 4.39 ± 3.95 배였다.
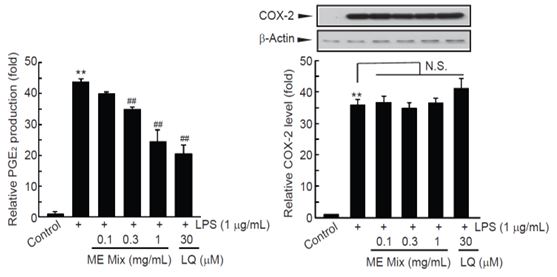
Effects of MEMix on PGE2 Production and COX-2 Expression in Raw 264.7 Cells. Treatment with LPS significantly increased PGE2 productions. However, pretreatment with MEMix significantly decreased PGE2 productions in a concentration dependent manner. Especially, pretreatment with 0.3 and 1 mg/mL of MEMix showed statistically significant reduction of PGE2 productions, and the reduction of PGE2 productions by 1 mg/mL of MEMix was comparable to those by 30 μM of LQ. Unlike PGE2 production, MEMix did not change the expression levels of COX-2 by LPS. Values are expressed mean ± SD of at least three separate experiments. Experimental data for PGE2 production, and COX-2 expression were analyzed by Tukey’s HSD, and Mann-Whitney U test, respectively (Significant as compared with control, **p<0.01; Significant as compared with LPS treated cells, ##p<0.01). N.S. = not significant; LQ = liquiritigenin; MEMix = Moringa Folium and Eucommiae Cortex 2:1 (g/g) mixed formula.
MEMix는 LPS에 의한 COX-2 증가를 억제하지 못하였다. LPS 단독, LPS와 MEMix를 0.1 mg/mL, 0.3 mg/mL, 1 mg/mL의 농도로 처치한 경우 COX-2 발현은 대조세포와 비교하여 각각 35.84 ± 1.90, 36.58 ± 2.06, 34.76 ± 1.94, 및 36.53 ± 1.44 배였다(Fig. 5, right).
고 찰
본 연구에서는 기존 동물연구24)에서 치주질환 치료 및 예방물질로서의 가능성이 나타난 MEMix의 항산화 및 항염 효능을 in vitro에서 평가하였다.
항염 효능과 관련하여 MEMix는 LPS로 유도된 NO 생성을 농도의존적으로 억제하였는데(Fig. 3, left), NO 생성 억제는 세포 독성에서 기인한 것은 아니었고(Fig. 3, right), MEMix는 LPS로 유도된 전염증성 싸이토카인의 생성도 농도의존적으로 억제하였다(Fig. 4). LPS는 그람 음성균의 세포벽에 존재하는 내독소로서 toll-like receptor 4와 결합하여 대식세포를 포함한 내재면역에 관련된 세포의 전염증 반응을 활성화시킨다27). NO는 nitric oxide synthase (NOS)에 의해 L-arginine으로부터 합성되며 iNOS가 염증반응에서의 NO 생성에 관여하는데28,29) 생리적 농도 범위의 NO 생성은 대식작용에 의해 흡수된 병원체를 공격하여 제거하는데 관여하지만, 과도하고 지속적인 NO의 생성은 생성세포로부터 주변 조직으로 유리되어 주변세포를 파괴한다. TNF-α, IL-1β, IL-6는 내재 면역 세포에 의해 분비되어 다양한 면역/염증반응을 활성화시킬 수 있는 대표적인 전염증성 싸이토카인이다. IL-1β는 자연살해세포 및 B/T 림프구를 활성화시키고 시상하부에 작용하여 염증과정에서의 열을 발생시킨다. IL-6는 간에서 급성기 단백의 발현을 증가시키며 림프구의 활성화를 통한 항체 형성을 증가시킨다30,31). TNF-α는 자가면역질환의 발생과 염증반응의 초기에 다른 전염증성 싸이토카인의 발현을 증가시키는 핵심 인자로 보고되었다30,32). 따라서 MEMix는 NO 생성을 억제하여 염증 주변 세포의 파괴를 막고, 전염증성 싸이토카인의 생성을 억제하여 면역, 염증반응의 활성화를 억제하는 것으로 생각된다.
다만 MEMix는 LPS에 의해 증가한 PGE2의 생성은 농도의존적으로 억제하였으나(Fig. 5, left), COX-2의 발현은 억제하지 못하였다(Fig. 5, right). Prostanoid는 NO 및 전염증성 싸이토카인과 더불어 염증과정에 관여하는 핵심 인자 중 하나이며, 세포 내에서 prostanoid의 생합성은 cyclooxygenase의 활성 및 발현량에 의해 결정된다. 아라키돈산으로부터 prostaglandin 생성과정의 핵심효소는 COX이며, COX-2는 대식세포를 포함한 염증세포에서 PGE2 생성에 관여한다33,34). 따라서 MEMix는 COX-2의 발현 조절이 아닌 효소 활성 제어를 통하여 PGE2 생성을 억제하였을 것으로 추정되나 이에 대해서는 후속 연구를 통한 확인이 필요하다.
치주염은 부분적인 치조골 소실이 나타나며 동반되는 염증이 강력한 병인으로 알려져 있다6). 치조골의 소실과정에서의 재흡수는 분화된 파골세포에 의한 것으로 알려져 있으며35,36), 염증은 RANK-RANKL, vitamin D2, prostaglandin, IL-1, IL-6, TNF-α 신호회로의 활성화를 통하여 파골세포의 분화를 촉진한다37-39). 치주염 조직에 증가하는 파골세포에 대해서는 치주 조직내 존재하는 대식세포가 파골세포로 분화 가능한 기원세포로써 인식되고 있다40). 치주질환 유도 모델을 대상으로 한 이전 연구24)에서 치주골 내 파골세포의 수가 대조군은 정상군에 비해 715.63% 증가하였으나 MEMix 투여군에서는 대조군에 비해서 63% 감소되는 결과가 나타났고 대조군에서는 치주골량이 유의하게 감소되었는데, MEMix 투여군에서는 치주골량이 유의하게 증가되었다. 이를 MEMix의 in vitro 항염 효능과 종합하여 볼 때 MEMix는 NO 생성 억제, 전염증성 싸이토카인 생성의 억제, PGE2 생성 억제의 측면에서 염증을 조절하여 치주조직에서 대식세포가 파골세포로 분화되는 것을 억제한 결과 치주질환 유도 모델에서 파골세포의 감소 및 치주골량의 증가24)가 나타난 것으로 생각된다. 따라서 MEMix는 염증반응에 의한 조직 파괴를 감소시키고 치주조직을 유지, 재생 가능할 수 있다는 측면에서 임상에서 활용 가능한 효과적인 물질로 기대된다.
항산화 효능과 관련하여 MEMix는 DPPH에 의해 발생한 라디칼을 농도 의존적으로 소거하였고, 1 mg/mL MEMix 의 라디칼 소거능은 30 μM Trolox의 효과와 유사하였다(Fig. 1). Trolox는 높은 항산화능이 잘 알려진 비타민 E의 수용성 유사체로서26) 이와 유사한 효과를 나타낸 MEMix도 산화적 스트레스로부터 세포 및 조직을 보호하고 염증반응을 억제하는 것으로 생각된다.
추가적으로 MEMix의 in vitro 세포 독성을 HaCaT 및 피부 섬유아세포에서 평가한 결과 MEMix는 1 mg/mL의 농도까지 피부 섬유아세포의 생존율에 영향을 미치지 않았다. 흥미롭게도, MEMix는 처치 농도에 관계없이 HaCaT 세포 생존율은 약 80% 내외로 감소시켰는데 HaCaT 세포는 정상세포인 피부 섬유아세포와 달리 암화된 keratinocyte이므로 MEMix 내 특정 성분이 미약하나마 암화된 세포의 생존율에 영향을 준 것으로 판단된다. 따라서, MEMix는 in vitro에서 비교적 고농도에 해당되는 1 mg/mL까지 정상세포에 대한 세포독성이 관찰되지 않았으나 다른 암세포 등을 대상으로 하는 세포 독성에 대한 추가적인 연구가 필요할 것으로 생각된다.
결 론
MEMix를 치주질환의 치료 및 예방에 이용 가능한 기능성 물질로 발굴하기 위해 in vitro 에서의 항산화 및 항염 효능을 평가한 결과, MEMix는 농도의존적으로 항산화능을 증가시켰고 1 mg/mL의 농도까지 피부 유래 섬유아세포에 대한 세포독성은 관찰되지 않았다. 또한 MEMix는 COX-2 발현 증가에 있어 통계적으로 유의한 작용은 나타내지 않았으나 농도의존적으로 NO, TNF-α, IL-1β, IL-6, PGE2의 생성을 억제하여 항염 효능을 나타내었다. 따라서, MEMix는 후속 연구를 통하여 효과적인 치은염 및 치조골 소실 개선제로서의 개발 가능성이 높을 것으로 기대된다.
References
-
Habashy RR, Abdel-Naim AB, Khalifa AE, Al-Azizi MM. Anti-inflammatory effects of jojoba liquid wax in experimental models. Pharmacol Res 2005;51(2):95-105.
[https://doi.org/10.1016/j.phrs.2004.04.011]

-
Williams RC. Periodontal disease. N Engl J Med 1990;322(6):373-82.
[https://doi.org/10.1056/NEJM199002083220606]

- Williams RC, Paquette DW. Understanding the pathogenesis of periodontitis: a century of discovery. J Int Acad Periodontol 2000;2(3):59-63.
-
Sallay K, Sanavi F, Ring I, Pham P, Behling UH, Nowotny A. Alveolar bone destruction in the immunosuppressed rat. J Periodontal Res 1982;17(3):263-74.
[https://doi.org/10.1111/j.1600-0765.1982.tb01153.x]

-
Samejima Y, Ebisu S, Okada H. Effect of infection with Eikenella corrodens on the progression of ligature-induced periodontitis in rats. J Periodontal Res 1990;25(5):308-15.
[https://doi.org/10.1111/j.1600-0765.1990.tb00920.x]

-
Botelho MA, Rao VS, Carvalho CB, Bezerra-Filho JG, Fonseca SG, Vale ML, Montenegro D, Cunha F, Ribeiro RA, Brito, GA. Lippia sidoides and Myracrodruon urundeuva gel prevents alveolar bone resorption in experimental periodontitis in rats. J Ethnopharmacol 2007;113(3):471-8.
[https://doi.org/10.1016/j.jep.2007.07.010]

-
Reddy MS, Geurs NC, Gunsolley JC. Periodontal host modulation with antiproteinase, anti-inflammatory, and bone-sparing agents: a systematic review. Ann Periodontol 2003;8(1):12-37.
[https://doi.org/10.1902/annals.2003.8.1.12]

-
Bhatavadekar NB, Williams RC. New directions in host modulation for the management of periodontal disease. J Clin Periodontol 2009;36(2):124-6.
[https://doi.org/10.1111/j.1600-051X.2008.01354.x]

- Kim S. The current state and effect of the drugs for the treatment of periodontal disease in market. Chonnam National University 2016.
- Min DJ, Yi SW, Lee SH, Kim SS, Kim CH, Lee JH, Bae JH, Kim HK. The Anti-inflammatory Effect of Green Tea Extract Against Prevotella intermedia. J Soc Cosmet Scientists Korea. 2011;37(1):67-73.
- Lee DJ, Han IM, Kim WJ, Cho IS. Anti-microbial, Anti-inflammatory and Anti-oxidative Effects of Herbal Medicine Extracts as Anti-gingivitis Ingredients. J Dent Hyg Sci 2010;10(1):25-9.
- Park YH. Ameliorating Effects of Curcumin on the Ligation-induced Experimental Periodontitis and Alveolar Bone Loss in Rats. Kyungpook National University 2019.
- Park, J.H. Anti-Periodontitis Effects of Magnolia obovata Thunberg. Cortex with Zea Mays L. Extract on the Ligature-Induced Periodontitis Rat, Kyung Hee University 2016.
-
Cheenpracha S, Park EJ, Yoshida WY, Barit C, Wall M, Pezzuto JM, Chang LC. Potential anti-inflammatory phenolic glycosides from the medicinal plant Moringa oleifera fruits. Bioorg Med Chem 2010;18(17):6598-602.
[https://doi.org/10.1016/j.bmc.2010.03.057]

- Kim DS. Phytochemical analysis, antioxidant and antiobesity effects of Moringa oleifera leaves extracts. Chosun University 2019.
-
Choi YJ, Jung, KI. Anti-Diabetic, Alcohol-Metabolizing, and Hepatoprotective Activities of Moringa (Moringa oleifera Lam.) Leaf Extracts. J Korean Soc Food Sci Nutr. 2016;45(6):819-27.
[https://doi.org/10.3746/jkfn.2016.45.6.819]

-
Ghasi S, Nwobodo E, Ofili JO. Hypocholesterolemic effects of crude extract of leaf of Moringa oleifera Lam in high-fat diet fed wistar rats. J Ethnopharmacol 2000;69(1):21-5.
[https://doi.org/10.1016/S0378-8741(99)00106-3]

-
Okuda T, Baes AU, Nishijima, W, Okada M. Coagulation mechanism of salt solution-extracted active component in Moringa oleifera seeds. Water Res 2001;35(3):830-4.
[https://doi.org/10.1016/S0043-1354(00)00296-7]

- Zheng, J, Yan, Q, Zhang, K, Zheng, Y, Zhao, S. Protective effects of different extracts of Eucommia ulmoides Oliv. against thioacetamide-induced hepatotoxicity in mice. Indian J Exp Biol 2012;50(12):875-82.
-
Hsieh CL, Yen GC. Antioxidant actions of Du-zhong(Eucommia ulmoides OLIV.) toward oxidative damage in biomolecules. Life Sci 2000;66(15):1387-400.
[https://doi.org/10.1016/S0024-3205(00)00450-1]

-
Kim BH, Park KS, Chang Il-Moo. Elucidation of anti-inflammatory potencies of Eucommia ulmoides bark and Plantago asiatica seeds. J Med Food. 2009;12(4):764-9.
[https://doi.org/10.1089/jmf.2008.1239]

-
Kwon SH, Lee HK, Kim JA, Hong SI, Kim SY, Jo TH, Park YI, Lee CK, Kim YB, Lee SY, Jang CG. Neuroprotective effects of Eucommia ulmoides Oliv. bark on amyloid beta(25-35)-induced learning and memory impairments in mice. Neurosci Lett 2011;487(1):123-7.
[https://doi.org/10.1016/j.neulet.2010.10.042]

-
Lin J, Fan YJ, Mehl C, Zhu JJ, Chen H, Jin LY, Xu JH, Wang HM. Eucommia ulmoides Oliv. antagonizes H2O2-induced rat osteoblastic MC3T3-E1 apoptosis by inhibiting expressions of caspases 3, 6, 7, and 9. J Zhejiang Univ Sci B 2011;12(1):47-54.
[https://doi.org/10.1631/jzus.B1000057]

-
HLSCIENCE Co., LTD. Method for improving periodontitis and alveolar bone loss of complex extracts of Moringa leaf and Eucommia Bark by anti-bacterial, antioxidant, anti-inflammatory, antioxidant effects and inhibition of alveolar bone loss. 10-2380781-0000 (2022-03-25).
[https://doi.org/10.8080/1020170037935]

-
Kim DO, Chun OK, Kim YJ, Moon HY, Lee CY. Quantification of polyphenolics and their antioxidant capacity in fresh plums. J Agric Food Chem 2003;51(22):6509-15.
[https://doi.org/10.1021/jf0343074]

-
Luis Anel-López, Manuel Alvarez-Rodríguez, Olga García-Álvarez, Mercedes Alvarez, Alejandro Maroto-Morales, Luis Anel, Paulino de Paz, J Julián Garde, Felipe Martínez-Pastor. Reduced glutathione and Trolox (vitamin E) as extender supplements in cryopreservation of red deer epididymal spermatozoa. Anim Reprod Sci 2012;135(1-4):37-46.
[https://doi.org/10.1016/j.anireprosci.2012.09.001]

-
Barton GM, Medzhitov R. Toll-like receptor signaling pathways. Science 2003;300(5625):1524-5.
[https://doi.org/10.1126/science.1085536]

-
Aktan F. iNOS-mediated nitric oxide production and its regulation. Life Sci 2004;75(6):639-53.
[https://doi.org/10.1016/j.lfs.2003.10.042]

- Guzik TJ, Korbut R, Adamek-Guzik T. Nitric oxide and superoxide in inflammation and immune regulation. J Physiol Pharmacol 2003;54(4):469-87.
-
Delgado AV, McManus AT, Chambers JP. Production of tumor necrosis factor-alpha, interleukin 1-beta, interleukin 2, and interleukin 6 by rat leukocyte subpopulations after exposure to substance P. Neuropeptides 2003;37(6):355-61.
[https://doi.org/10.1016/j.npep.2003.09.005]

-
Yoshimura A. Signal transduction of inflammatory cytokines and tumor development. Cancer Sci 2006;97(6):439-47.
[https://doi.org/10.1111/j.1349-7006.2006.00197.x]

-
Beutler B, Cerami A. The biology of cachectin/TNF-α primary mediator of the host response. Annu Rev Immunol 1989;7:625-55.
[https://doi.org/10.1146/annurev.iy.07.040189.003205]

-
Botting RM. Cyclooxygenase: Past, present and future. A tribute to John R. Vane (1927-2004). J Therm Biol 2006;31(1-2):208-19.
[https://doi.org/10.1016/j.jtherbio.2005.11.008]

-
Blobaum A.L., Marnett, L.J. Structural and functional basis of cyclooxygenase inhibition. J Med Chem 2007;50(7):1425-41.
[https://doi.org/10.1021/jm0613166]

-
Takayanagi H. Inflammatory bone destruction and osteoimmunology. J Periodontal Res 2005;40(4):287-93.
[https://doi.org/10.1111/j.1600-0765.2005.00814.x]

-
Takahashi S, Fukuda M, Mitani A, Fujimura T, Iwamura Y, Sato S, Kubo T, Sugita Y, Maeda H, Shinomura T, Noguchi, T. Follicular dendritic cell-secreted protein is decreased in experimental periodontitis concurrently with the increase of interleukin-17 expression and the Rankl/Opg mRNA ratio. J Periodontal Res 2014;49(3):390-7.
[https://doi.org/10.1111/jre.12118]

-
Tyagi AM, Srivastava K, Mansoori MN, Trivedi R, Chattopadhyay N, Singh D. Estrogen deficiency induces the differentiation of IL-17 secreting Th17 cells: a new candidate in the pathogenesis of osteoporosis. PLoS ONE 2012;7(9):e44552.
[https://doi.org/10.1371/journal.pone.0044552]

-
Boyce BF, Xing L. Functions of RANKL/RANK/OPG in bone modeling and remodeling. Arch Biochem Biophys 2008;473(2):139-46.
[https://doi.org/10.1016/j.abb.2008.03.018]

-
Kearns AE, Khosla S, Kostenuik PJ. Receptor activator of nuclear factor kappaB ligand and osteoprotegerin regulation of bone remodeling in health and disease. Endocr Rev 2008;29(2):155-92.
[https://doi.org/10.1210/er.2007-0014]

-
Asagiri M, Takayanagi H. The molecular understanding of osteoclast differentiation. Bone 2007;40(2):251-64.
[https://doi.org/10.1016/j.bone.2006.09.023]
