
SU어혈약침의 복귀돌연변이시험을 이용한 유전독성평가
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
SU-Eohyeol pharmacopuncture(SUEP) was developed by adding Cervi Pantotrichum Cornu to Jungsongouhyul pharmacopuncture. This genotoxicity evaluation was performed to evaluate the mutagenic potential of the test substance SUEP agent using histidine, which requires strains of Salmonella typhimurium (TA98, TA100, TA1535, TA1537), and tryptophan, which requires Escherichia coli (WP2uvrA) strain in the presence and absence of metabolic activation. According to the results of the dose range finding study conducted prior to the main study, the dose levels of the test substance in the main study were determined as 100, 50, 25, 12.5, 6.25%, and positive and negative controls were established. As a result of the main study, the mean number of revertant colonies compared to negative controls was less than 2-fold at all dose levels of SUEP in all strains with and without metabolic activation. In the positive control group, the mean number of revertant colonies for each strain was markedly increased by more than two times compared to the negative control group. Based on the result of this study, the test substance, SUEP did not show any indication of mutagenic potential under the conditions of this study.
Keywords:
Safety, Reversion mutation test, Genotoxicity, Jungsongouhyul pharmacopuncture, Cervi Pantotrichum Cornu, SU Eohyeol서 론
2020년 한방의료이용실태조사1)에서 한방의료 이용 경험률이 69.0%였고, 치료 방법 중 약침 이용 경험은 23.7%였다. 또한 한방의료 분야에서 우선 개선해야 할 사항으로 ‘보험급여적용확대’(33.4%)다음으로 ‘한약재의 안전성 확보’(22.3%)인 것으로 나타났다. 원외탕전실이란 한방 의료기관 외부에 별도로 설치되어 계약을 맺은 한의사의 처방에 따라 탕제, 산제, 환제, 고제, 캡슐제, 정제 등의 다양한 제형의 한약 및 약침액을 전문적으로 조제하는 시설이다. 한약 역시 환자에게 투여되는 의약품이기 때문에, 의약품에 준하는 관리가 필요하다. 안전성 및 신뢰성 확보의 방법 중 하나로, 보건복지부는 2018년 9월부터 원외탕전실 인증제를 도입하여 원료 입고부터 보관, 조제, 포장, 배송까지 전반적 조제과정을 평가하여 안전관리체계를 검증한다. 원외탕전실 인증제는 다양한 한약제형을 총칭하는 ‘일반한약’ 조제와 ‘약침’ 조제로 구분하여 적용되며, 일반한약 인증의 경우 중금속, 잔류농약 등 안전성 검사를 마친 규격품 한약재 사용 등 81개 정규항목에 의해 평가되며, 약침 인증의 경우 청정구역 설정 및 환경관리, 멸균 처리공정, 무균시험 등 165개 정규항목에 의해 평가된다2-5). 비록 보건복지부 인증 약침 원외탕전실에서 조제된 약침이 재료 및 제조과정이 안전하게 관리되었다고 판단될 수 있더라도, 조제된 약침의 유효성 및 안전성 관련 검증은 별도로 이루어져야 한다.
약침은 한약재들을 추출한 약침액을 경혈 및 양성반응점에 시술하는 일종의 신침요법이며, 현재 한의 임상에서 면역약침(경락약침, 경락장약침), 팔강약침, 동물성 약침 등 다양한 약침 종류들이 사용되고 있다6,7). 약침 사용 초기 약침액들 뿐 아니라 기존 약침액들이 수정 및 보완되거나 새로운 약침제제들이 개발되고 있으며, 그 유효성과 안전성 관련 다양한 연구결과들이 보고되고 있다.
최근 개발된 SU어혈약침은 한의 임상에서 봉독과 함께 가장 많이 사용되는 약침 중의 하나인 중성어혈약침8)에 자음윤조(滋陰潤燥), 강근건골(强筋健骨), 보허(補虛)하는 효능을 가진 녹용을 고농축으로 추출하여 혼합한 약침액이다. 팔강약침에 속하는 중성어혈약침은 청열량혈(淸熱凉血), 활혈거어(活血祛瘀)하는 약으로 구성되어 기체혈어(氣滯血瘀)로 인한 제반통증, 어혈저체(瘀血阻滯)로 기혈순행이 불량하여 발생한 마비질환 등에 주로 사용되고 있고9), 실험연구를 통해 좌골신경 손상 후 진통 및 신경재생 효과10), 골절 초기 골절유합 효과11), 외상성 뇌손상에 대한 신경보호 효과12), 등이 보고되었고, 임상연구를 통해 요통13), 경항통14), 견비통15), 요골신경마비16), 안면신경마비17) 등에 대한 치료효과 보고들이 있었다18).
면역약침이론에서 녹용은 골(骨), 호르몬 등의 개념으로 보고 뼈 쪽 문제, 폐경기 및 성장 등 호르몬 부족 문제, 퇴행성 질환 등에 사용하면 좋다고 하였다6). 녹용약침의 경우 기존의 많은 실험연구에서 관절염에 대한 항염증 효과가 보고된 바 있고 근골격계 질환에 대해 임상 치료효능이 다수 보고되었다19-21). SU어혈약침은 이러한 녹용약침의 효능을 기존 중성어혈약침에 고농축으로 혼합하여 기제(氣劑) 형태로 개발하여, 중성약침의 효능에 아시혈 및 치료혈에 진액을 보충하는 효력을 높이고 허증 환자에 대한 치료효과를 높여 급성 손상 뿐 아니라 만성 통증 및 관절 질환 등에 넓게 사용될 수 있도록 하고자 하였다.
이미 기존 실험 및 임상 연구들을 통해 유효성과 안전성이 확인되어 있는 중성어혈약침과 녹용약침을 기반으로 하고 있지만, 중성어혈약침과 기존 녹용약침을 혼합한 임상연구가 1편22) 보고되어 있고, 고농축 녹용 추출액 관련 연구가 거의 없으며, 중성어혈약침 관련 독성연구 결과보고는 없었다. 이에 SU어혈약침 안전성 근거 확보를 위하여, 경제협력개발기구(Organisation for Economic Cooperation and Development, 이하 OECD) 유전독성시험 가이드라인에서 제시하고 있는 유전독성검사 중 박테리아를 이용한 복귀돌연변이시험을 실시하여 그 결과를 보고하는 바이다.
재료 및 방법
1. 시험물질 조제
㈜자연담은 (양주시, 경기도, 한국)에서 구입된 9가지 한약재로 만들어진 SU어혈약침액은 녹용 (50 ㎎/㎖), 치자 (75 ㎎/㎖), 유향(30 ㎎/㎖), 몰약(30 ㎎/㎖), 현호색 (30 ㎎/㎖), 도인 (22.5 ㎎/㎖), 단삼 (22.5 ㎎/㎖), 작약 (22.5 ㎎/㎖), 소목 (22.5 ㎎/㎖)으로 구성되어 있다. KGMP 시설을 갖춘 보건복지부 인증 약침 원외탕전원 중 한 곳인 남상천한의원 원외탕전실 (용인, 한국)에서 아래의 조제 방법을 통해 바이알 형태로 제공받아 4.2~5.4℃에서 보관하였다.
SU어혈약침액 조제에 있어서 녹용과 나머지 한약재에 대해 두 가지 다른 추출 방법이 사용되었으며, 녹용 추출은 러시아산 분골을 추말 후 증류추출기에 주사용수로 순환추출하고 회수된 추출물에 주정을 넣고 교반 후 종이여과하고 감압농축기를 이용해서 주정 제거 후 분획분자량 10,000 달톤으로 한외여과한다. 다른 한약재들은 증류추출기에 주사용수를 넣고 순환 후 증류액을 회수한다. 녹용 농축액과 다른 한약재들 증류액을 혼합하여 0.9% NaCl을 넣고 교반하여 녹인 후 pH 7.4로 적정하고, 최종 0.45 – 0.2 ㎛ filter로 여과하여 용기에 담아 밀봉한다. 부형제는 생리식염주사액에 용해되었기 때문에 생리식염주사액을 부형제로 선택하였다. 시험물질의 조제는 시험물질 처리일에 실시하였다. 최고용량은 시험물질 그대로를 사용하였고, 이하 용량에 대해서는 부형제로 규정 용량이 되도록 단계희석하여 사용시 조제하였다.
음성대조물질로는 본 시험의 부형제인 생리식염수주사제(Lot No./Batch No. 21039, 21081, JW Pharmaceutical Co., Ltd., Korea)를 사용하였다.
양성대조물질의 경우, Sodium azide (SA, Lot No./Batch No. STBJ9888), 2-Nitrofluorene (2-NF, Lot No./Batch No. STBF2425V), 2-Aminoanthracene (2-AA, Lot No./Batch No. STBJ3963), 9-Aminoacridine (9-AA, Lot No./Batch No. BCCB4167), 4-Nitroquinoline N-oxide (4-NQO, Lot No./Batch No. WXBC9940V)를 Sigma-Aldrich, Co., (USA)로부터 구입하여 사용하였다. 부형제의 경우, SA 조제에는 주사용수(Lot No./Batch No. 20019, JW Pharmaceutical Co., Ltd., Korea)를, 2-NF, 2-AA, 9-AA, 4-NQO 조제에는 Dimethyl sulfoxide (Lot No./Batch No. K51637131, Merck, Germany)를 사용하였으며, 부형제를 넣고 조제된 양성대조물질은 소분하여 동결 보관된 것을 처리일에 해동하여 사용하였다. 각 균주에 대한 양성대조물질의 종류는, 대사활성화 비존재하에서 Salmonella typhimurium TA98에 대해서는 2-NF, TA100와 TA1535에 대해서는 SA, TA1537에 대해서는 9-AA, WP2uvrA에 대해서는 4-NQO를 사용하였고, 대사활성화 존재하에서는 5종류 균주 모두 2-AA를 사용하였다.
2. 시험 균주 및 배지
Nutrient broth 배지는 Nutrient broth (BD, USA)를 칭량 후, 소량 초순수 첨가하고, 교반하여 용해시켰으며, 0.8%의 최종농도가 되도록 초순수로 조제 후, 고압증기멸균처리를 시행했다. 최소 glucose 한천평판배지 조제는 Bacto agar 15 g, VB salts 10배 농축액 100 mL, 20% glucose 100 mL, 초순수 800 mL 등 총 액량 1L로 조성되었다. Top agar의 경우, 염화나트륨 및 bacto agar (BD, USA)를 칭량한 후, 초순수를 넣어 각각 0.5 및 0.6%가 되도록 조제하고 고압증기 멸균 시행 후, 살모넬라균주용 top agar는 0.5 mM L-Histidine/D-Biotin (Sigma-Aldrich, Co, USA)을, 대장균용 top agar는 0.5 mM L-Tryptophan (Sigma-Aldrich, Co, USA)을 10:1 비율로 혼합하여 준비했다.
Oriental Yeast Co., Ltd, (Japan)의 S9 (Lot No.: 21080605)과 Cofactor A (Lot No.: A21080305)를 –80~-60℃에 보관했다. S9는 수컷 Sprague-Dawley rat [Crl:CD(SD)]에 Phenobarbital (PB) 및 5,6-benzoflavone (BF) 유도물질을 복강내 투여 후 간장에서 제조되었다. S9 mix는 총 액량 1 mL 기준, S9 0.1 mL, Cofactor C의 경우, MgCl2 0.02 mL (8 μmol), KCl 0.02 mL (33 μmol), Glucose-6-phosphate 0.005 mL (5 μmol), NADPH 0.04 mL (4 μmol), NADH 0.04 mL (4 μmol), Sodium phosphate buffer 0.5mL (pH7.4, 100 μmol), 정제수 0.275 mL로 조성되었다. S9 mix는 사용시 필요한 양만큼 조제하였고, 동결 보관된 S9과 Cofactor A를 해동 후 1:9 비율로 혼합하여 준비했다.
본 실험에서는 Molecular Toxicology, Inc. (MOLTOXTM, Inc., USA.)에서 제조된 Salmonella enterica serovar Typhimurium (Salmonella typhimurium, 이하 S. typhimurium) 균주인 TA98, S. typhimurium TA100, S. typhimurium TA1535, S. typhimurium TA1537, Escherichia coli (이하 E.coli) 균주인 WP2uvrA를 사용하였다. 이 균주들은 가이드라인에서 추천하는 균주로, 변이원성물질에 대한 높은 감수성을 가지며, 가장 일반적으로 변이원성시험에 사용되고 있다. 균주 특성을 확인한 후, 동결 보관된 각 균주를 실온 해동 및 nutrient broth 배지 접종 후에 진탕배양 (37℃, 130 rpm)하였다. 전배양 종료 후, UV/VIS spectrophotometer (V-550, Jasco, Japan)로 각 균주의 흡광도를 측정파장 660 nm로 측정하여 균수가 1×109 cells/mL 이상임을 확인 후에 시험에서 사용하였다.
3. 시험 방법
본시험의 용량을 설정하기 위하여 용량설정시험을 먼저 실시했고, 최고용량은 SU어혈약침액 원액 (100%)을 처리하는 것으로 하여, 이하 용량에 대해 공비 2를 적용하여, 50, 25, 12.5, 6.25 및 3.13% 등의 6단계 용량 SU어혈약침액군을 설정했으며, 음성 및 양성대조군을 설정하했다. 본시험과 동일한 방법과 조건을 사용하여 각 용량당 2개의 플레이트를 사용하여 용량설절시험을 시행하였다.
본시험은 프리인큐베이션법으로 실시하였으며, 대사활성화 비존재하(-S9mix) 및 존재하(+S9mix)의 2가지 계열로 수행되었다. 본시험은 각 용량에 대해 3개의 플레이트를 사용해서 두 번 실시하였다. 대사활성화 비존재하(-S9mix)의 경우, 100 µL의 모든 용량 SU어혈약침액, 음성 및 양성대조물질을 각각의 튜브에 넣고, 500 µL 0.1 mol/L 인산완충액 (pH 7.4)과 100 µL 각 균주현탁액 100 µL을 넣은 후, 진탕배양 (37℃, 90 rpm, 20min)하였다. 이후, S. typhimurium 균주 TA98, TA100, TA1535, TA1537에 살모넬라용 top agar를, E.coli 균주 WP2uvrA에 대장균용 top agar를 각각 2 mL씩 넣고 vortexing하고, 최소 glucose 한천평판 배지에 중층하여 실온에서 굳혔다. 대사활성화 존재하(+S9mix)에서는 0.1 mol/L 인산완충액 (pH 7.4) 대신 500 µL의 S9 mix 를 넣었으며, 그 외 처리는 동일 하게 이루어졌다. 잡균에 의한 오염 여부는 500 µL의 0.1 mol/L 인산완충액 (pH 7.4)과 500 µL의 S9 mix를 각 튜브에 넣고, 그 외의 처리는 동일하게 실시 후, 미생물 오염에 의한 콜로니 형성 유무로 확인하였다. 배양법 및 배양시간은, Top agar 경화 후 플레이트를 뒤집어 37℃ 배양기 (DK-LI020-P, Daiki scientific Co., LTD., Korea)에서 48시간 배양하였다.
시험물질인 SU어혈약침액 처리 시 및 복귀변이콜로니수 계측 시에 시험물질인 SU어혈약침액의 침전을 육안으로 관찰하고 기록하였다. 복귀변이콜로니수의 계측의 경우, 배양 종료 후, 복귀변이콜로니의 수는 자동콜로니 계측기 (ProtoCOL3, SYNBIOSIS, UK)를 사용하여 자동계측하거나 육안계수를 실시하였다. 자동계측이 정확하지 않다고 판단되는 경우, 육안계수를 실시하였다. 또한 생육저해 유무 확인을 위해, 복귀변이콜로니수 계측 시, 실체현미경 (45배 배율, SZ61, Olympus, Japan)을 이용하여 background lawn의 형성 유무를 확인하였고, 생육저해의 판정기준은 음성대조군에 비해 복귀변이콜로니수가 현저히 감소하거나, background lawn이 엷어지거나 없어지거나 해서 현저하게 감소하는 것으로 했다.
시험의 성립조건은 첫째, 유전자돌연변이 유발성 결과에서 재현성이 확보된 경우, 둘째, 생육저해가 확인되지 않은 용량이 4단계 이상 확보된 경우, 셋째, 음성 및 양성대조군의 평균 복귀변이콜로니수가 과거 대조군 데이터의 범위 내에 있거나 또는 양성대조군의 복귀변이콜로니수가 음성대조군보다 2배 이상 많을 것, 넷째, 오염이 없을 것 등의 모든 조건을 만족하는 경우로 설정하였다.
결과 판정에 있어서, 1개 이상의 균주에서 음성대조군에 비하여 복귀변이콜로니의 수가 2배 이상 증가하고, 증가에 따른 용량의존성이 존재하거나, 결과에 재현성이 있는 경우 양성으로 판정하였고 확인시험은 실시하지 않았으며 상기 조건 이외는 음성으로 판정하였다.
복귀변이콜로니수의 측정값은 실측치를 표기하고, 평균치 및 표준편차를 구하며 통계학적 방법은 사용하지 않았다.
결 과
1. 용량설정시험 (Fig. 1, Table 1, 2)
본 시험의 최고용량 설정을 위해 실시한 용량설정시험 결과, 모든 용량의 시험물질 SU어혈약침액에 의한 생육저해 및 침전은 대사활성화 존재하 및 비존재하의 5가지 균주에서 관찰되지 않았다.
이에, SU어혈약침액 100%(305 ㎎/㎖)를 본시험의 최고용량으로 하고, 공비 2를 적용하여 50, 25, 12.5, 6.25%의 이하용량의 5단계 시험물질군을 설정했으며, 음성 및 양성대조군을 설정했다.
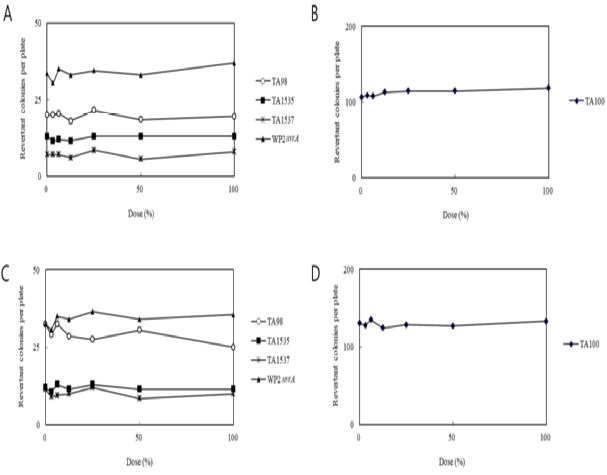
Dose-response Curve in the Absence and Presence of Metabolic Activation in a Dose Range Finding Study. Dose-response curves in the absence of metabolic activation (TA98, TA1535, TA1537 and WP2uvrA) (A) and TA100 (B), and in the presence of metabolic activation (TA98, TA1535, TA1537 and WP2uvrA) (C) and TA100 (D) in a Dose Range Finding Study.

The Number of Revertant Colonies per Plate in the Absence of Metabolic Activation (Dose Range Finding Study)
2. 본 시험 (복귀변이콜로니수의 계측 결과) (Fig. 2)(Table 3, 4)
시험물질 SU어혈약침액군에서는 대사활성화 유무에 관계없이 S. typhimurium TA98, TA100, TA1535, TA1537 및 WP2uvrA의 각 균주의 모든 용량에서 복귀변이콜로니수는 음성대조군의 2배를 초과하지 않았다. 각 균주에 대한 양성대조군의 복귀변이콜로니수는 음성대조군에 비해 2배 이상 확실한 증가를 보였다. 모든 용량의 SU어혈약침액에 의한 생육저해 및 침전은 대사활성화 비존재하(-S9mix) 및 존재하(+S9mix)의 S. typhimurium TA98, TA100, TA1535, TA1537 및 WP2uvrA 등의 5가지 균주에서 관찰되지 않았다.
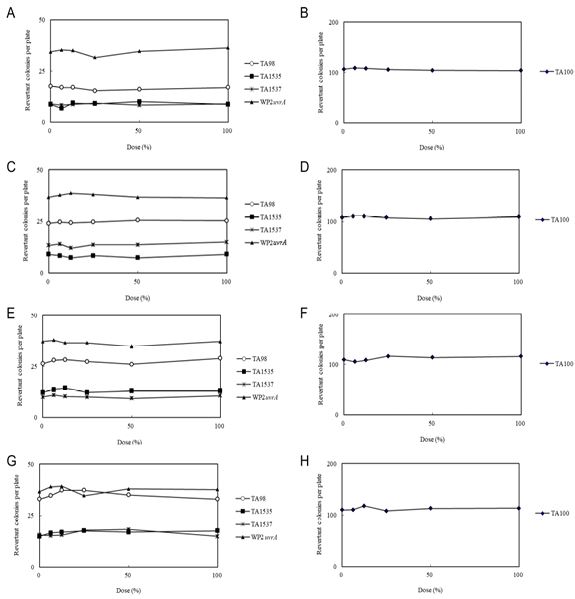
Dose-response Curve in the Absence and Presence of Metabolic Activation in the Main Study. In the 1st main study, dose-response curves in the absence of metabolic activation (TA98, TA1535, TA1537 and WP2uvrA) (A) and TA100 (B), and in the presence of metabolic activation (TA98, TA1535, TA1537 and WP2uvrA) (C) and TA100 (D). In the 2nd main study, dose-response curves in the absence of metabolic activation (TA98, TA1535, TA1537 and WP2uvrA) (E) and TA100 (F), and in the presence of metabolic activation (TA98, TA1535, TA1537 and WP2uvrA) (G) and TA100 (H).

The Number of Revertant Colonies per Plate in the Absence of Metabolic Activation (1st and 2nd Main Studies)
고 찰
의약품등의 품목허가를 신청할 때, 일반적으로는 모든 유전독성시험자료들을 제출해야 한다. 한약(생약)제제_비임상시험_가이드라인에서 한약(생약)제제 품목허가 시 비임상시험 자료의 제출범위는 다른 의약품과 마찬가지로 의약품의 특성, 적응증, 투여경로, 대상 환자군의 특성을 고려하여 시험의 종류와 범위를 결정한다23). 한약(생약)제제의 경우. 각 시험의 필요성, 시험방법, 결과평가에 있어서 오랜 전통적 사용 기반의 인체 안전성 관련 정보와 풍부한 문헌 자료에 의한 안정성 근거 부분이 고려되고 있다. 하지만, 약침의 경우는 경구용이나 외용과 달리 대부분 전통적 사용경험이 고려될 만한 근거가 부족하다고 여기는 새로운 투여경로의 의약품에 속하기 때문에, 한약(생약) 주사제로 개발되는 경우 신약과 동일한 수준의 비임상시험 자료가 요구된다23). 한의학 관련 문헌적 근거와 한의사들의 임상적 경험을 토대로 여러 약침들이 개발되고 있는데, 유효성 뿐 아니라 안전성 검증을 위해서 임상 연구 결과와 함께 유전독성시험을 통한 독성 결과가 필요할 것이다.
유전독성시험은 의약품 개발 초기 단계에서 물질을 스크리닝하고 발암성을 예측하기 위한 시험으로 널리 이용되는 시험으로, 시험물질이 유전자 또는 염색체에 미치는 손상 작용을 평가하고 잠재적 발암성 또는 돌연변이 유발물질을 검출할 수 있다. 의약품 등의 유전독성시험은 의약품규제조화위원회(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceutical for Human Use, 이하 ICH) 및 OECD의 가이드라인에 따라 수행되고 있다. 기존 유전독성시험의 문제점 대두 및 최신 과학기술 발달에 따라, ICH와 OECD에서는 최근 유전독성시험 가이드라인을 제·개정하고 있다. OECD에서는 최근 사용빈도가 낮은 6가지 시험법 가이드라인을 폐지하고, 기존 가이드라인에 결과판정 기준, historical data 관리, 시험기관의 숙련도 등의 내용을 포함하여 개정하였다. 또한 in vitro 시험에서의 최고농도 설정 기준 등을 변경하고, 새로운 시험법에 대한 신규 가이드라인을 제정하였다24). 본 연구에서 사용한 박테리아를 이용한 복귀돌연변이시험의 경우 1997년 이후 OECD에서 개정된 사항이 없었고, in vitro mouse lymphoma assay, in vitro chromosome aberration assay 또는 in vivo micronucleus assay 등의 다른 battery test 시험법들보다 높은 특이도를 가진 시험으로 음성물질을 정확하게 음성으로 구분할 수 있으며, 다른 시험들에 비해 간단하고 빠르게 수행할 수 있고, 지금까지 누적된 시험결과가 가장 많이 축적되어 돌연변이원성 시험 중 가장 적절한 시험법이라고 할 수 있다25). 또한 복귀돌연변이 시험으로 박테리아를 사용하는 방법은 동물을 사용하지 않아 동물 윤리 및 동물 보호 정책이 중요해지는 최근 추세에 적합하다.
본 연구에 사용한 균주 중 S. typhimurium 4종은 Histidine 요구성 균주이며, E. coli WP2 uvrA 균주는 Tryptophan 요구성 균주이다. 가이드라인에서 S. typhimurium과 E. coli로 최소 5균주 이상을 사용하도록 제안하며, 외인성 물질 및 그 대사산물의 유전독성을 모두 평가할 수 있도록 대사활성계인 설치류 간의 S9을 사용하도록 규정한다25). 따라서 우리는 새로 개발된 SU어혈약침액에 대해서 유전자돌연변이 유발성을 히스티딘 요구성인 살모넬라균 (TA98, TA100, TA1535 및 TA1537 균주)과 트립토판 요구성인 대장균 (WP2uvrA 균주)을 이용하여 대사활성화 비존재하(-S9mix) 및 대사활성화 존재하(+S9mix)의 경우에 대하여 각각 검토하여 유전독성을 측정하였다.
본 시험 전에 실시한 용량설정시험 결과에 따라, 본 시험에서 최고용량을 시험물질 그대로인 100% SU어혈약침액으로 하여, 이하 공비 2로 50.0, 25.0, 12.5, 6.255% 등의 5단계 용량의 SU어혈약침액 처리군을 설정하였으며, 생리식염주사액을 음성대조물질로 사용하였다. 양성대조군은 일반적으로 사용되는 SA, 2-NF, 2-AA, 9-AA, 4-NQO를 사용하였다32).
본시험에서 대사활성화 비존재하(-S9mix)와 대사활성화 존재하(+S9mix)에서 복귀변이콜로니수를 계측한 결과, S. typhimurium TA98, TA100, TA1535, TA1537 및 E. coli WP2uvrA 등의 5가지 균주에 대한 양성대조군의 복귀변이콜로니수는 음성대조군과 비교하여 2배 이상 확실하게 증가하는 것을 관찰할 수 있었다. 반면, 모든 농도별 SU어혈약침액 처리군에서 복귀변이콜로니수가 대사활성화 유무에 관계없이 5가지 균주에서 음성대조군의 2배를 초과하지 않는 것으로 관찰되었고, 대사활성화 비존재하 및 존재하 각 균주에서 모든 용량의 SU어혈약침액에 의한 생육저해 및 침전은 나타나지 않았다.
본 SU어혈약침액 복귀돌연변이시험에서, 시험의 성립조건을 모두 만족하였고, 하나 이상의 균주에서 음성대조군에 비해 복귀변이콜로니의 수가 2배 이상 증가하고, 증가에 따른 용량의존성이 존재하거나, 결과에 재현성이 있을 경우를 제외하고 음성으로 판정된다는 결과판정 기준에 따라, 본 독성시험 결과는 음성으로 판정된다.
이러한 결과로부터, 살모넬라균 (TA98, TA100, TA1535 및 TA1537 균주)과 트립토판 요구성인 대장균 (WP2uvrA 균주) 등의 박테리아를 이용한 복귀돌연변이 시험에서 SU어혈약침액의 유전자돌연변이 유발성은 음성으로 판단되었다. 의약품 허가나 임상시험 등을 위한 한약(생약)제제의 경우 포괄적 유전독성 결과를 포함한 비임상시험 결과가 필요하므로, 향후 SU어혈약침액에 대한 다양한 독성시험평가를 비롯한 안전성 검증이 되어야 할 것이다. 또한 임상에서의 SU어혈약침 치료의 유효성 및 안전성 검증을 위한 과학적 근거들도 만들어져야 할 것이다.
결 론
본 SU어혈약침액 복귀돌연변이시험 결과, SU어혈약침액의 유전자돌연변이 유발성은 음성으로 판단되었다. 향후 SU어혈약침액에 대한 다양한 독성시험평가를 비롯한 안전성 검증이 필요할 것이다.
References
- National Institute for Korean Medicine Development (NIKOM). 2020 Korean medicine use status survey. 2021.
-
Sung SH, Shin BC, Park MJ, Kim KH, Kim JW, Ryu JY, Park JK. Current status of management on pharmacopuncture in Korea through introduction of an accreditation system. Journal of Pharmacopuncture. 2019;22(2):75.
[https://doi.org/10.3831/KPI.2019.22.009]

- Korea Ministry of Health and Welfare. Guideline on Installation and Utilization of External Herbal Dispensaries of Traditional Korean Medicine Clinics and Share-use of Herbal Dispensaries. From. http://www.mohw.go.kr/react/jb/sjb0406vw.jsp?PAR_MENU_ID=03&MENU_ID=030406&CONT_SEQ=342727&page=1 (retrieved on 21 Nov 2018) [Ref list]
- Korea Ministry of Health and Welfare. Introduction of external herbal dispensaries of traditional Korean medicine clinics. From. http://www.mohw.go.kr/react/al/sal0301vw.jsp?PAR_MENU_ID=04&MENU_ID=0403&page=1&CONT_SEQ=344877&SEARCHKEY=TITLE&SEARCHVALUE=%ED%95%9C%EC%95%BD (retrieved on 21 Nov 2018) [Ref list]
- A Study on the Management and Dispensing Standards of Herbal Medicine in Herbal Dispensaries
- Jung C, Jung JH, Lee MS. A clinical study of immune pharmacopuncturology. Yeongi: Kyungrak Medical Publishing Co.; 2011.
- Korean Acupuncture and Moxibustion Society. Acupuncture medicine. Seoul: Hanmi Medical Publishing Co.; 2020. p. 204-28
-
Park JE, Kim KH, Kang S, Lee EK, Kim J, Jang B et al. Usage status and satisfaction with pharmacopuncture in Korea: A survey among Korean medicine doctors. Eur J Integr Med 2019;27:121-30.
[https://doi.org/10.1016/j.eujim.2019.03.001]

-
Choi EH, Chun HS, Ryu HS, Lee JH, Yang DS, Hong S. Case Report of Radial Nerve Palsy Patients Treated with Additional Jungsongouhyul Parmacopuncture. The Journal of Pharmacopuncture. 2011;14(4):63-9.
[https://doi.org/10.3831/KPI.2011.14.4.063]

- Jung MJ, Lee JH, Yeom SR, Lee SK, Song YS, Kim KB, Kwon YD. Effects of Ohyaksungisan and Jungsongouhyul Pharmacopuncture on Pain Reduction and Nerve Regeneration After Crush Injury in Rat Sciatic Nerve. The Journal of Korean Medicine Rehabilitation. 2009;19(2):51-72.
- Ahn HL, Shin MS, Kim SJ, Choi JB. Effects of Neutral Eohyeol(Yuxue) Herbal Acupuncture and Dangkisoosan(Dangguixu-san) on Fracture Healing in the Early Stage in Rats. The Journal of Korean Medicine Rehabilitation. 2007;17(1):1-16.
- Jong IM, Choi JB. Neuroprotective Effects of Neutral Pharmacopuncture for Blood Stasis and Tangguisusangami-tang(Dangguixusanjiawei-tang) in the Experimental Traumatic Brain Injury Rats. The Journal of Korean Medicine Rehabilitation. 2010;20(1):13-26.
- Lee SH, Kang MW, Lee H, Lee SY. Effectiveness of Bee-venom Acupuncture and Ouhyul Herbal Acupuncture in Herniation of Nucleus Pulposus-comparison with Acupuncture Therapy Only. The Journal of Korean Acupuncture&Moxibustion Society. 2007;24(5):197-205.
- Yoon IJ. Effect of Jungsongouhyul Herbal Acupuncture Therapy for Neck Pain Patients. Daejeon University Korean Medicine Research Institution. 2007;16(2):1-5.
-
Ji MJ, Lim SC, Kim JS, Lee HJ, Lee YK. The Comparative Study on Effect of Jungsongouhyul Pharmacopuncture and Electroacupuncture in Patients with Acute Traumatic Shoulder Pain. The Journal of korean Acupuncture&Moxibustion Society. 2014;31(4):205-11.
[https://doi.org/10.13045/acupunct.2014067]

- Lee JE, Lee JM, Oh MS. A Case Study of Radial Nerve Injury Associated with Humerus Shaft Fracture. Daejeon University Korean Medicine Research Institution. 2014;23(1):157-66.
-
Jang YJ, Yang TJ, Shin JC, Kim HH, Kim TG, Jeong MY, Kim JH. Clinical Case Study of Facial Nerve Paralysis with Sensorineural Hearing Loss and Tinnitus Caused by Traumatic Temporal Bone Fracture. The Journal of Korean Acupuncture & Moxibustion Society. 2016;33(1):95-101.
[https://doi.org/10.13045/acupunct.2016009]

-
Yoon JW, Kim SJ. A review of clinical study on Jungsongouhyul pharmacopuncture treatment published in Korea. Journal of Korean Medicine Rehabilitation. 2017;27(4):75-84.
[https://doi.org/10.18325/jkmr.2017.27.4.75]

-
Lee DJ, Hwangbo M, Kwon K, Seo HS. Review of cervi cornu parvum pharmacopuncture in Korean medicine. Journal of Pharmacopuncture. 2013;16(2):7.
[https://doi.org/10.3831/KPI.2013.16.008]

- Bensky D, Gamble A. Chinese herbal medicine: materia medica. Revised ed. Seattle: Eastland Press; 1992. p. 32-44.
-
Wu F, Li H, Jin L, Li X, Ma Y, You J, et al. Deer antler base as a traditional Chinese medicine: A review of its traditional uses, chemistry and pharmacology. J Ethnopharmacol. 2013;145(2):403-15.
[https://doi.org/10.1016/j.jep.2012.12.008]

- Ryu HS, Kim SP, Chun HS, Ryu MS, Shin JC, Wei TS. The Comparative Study of Effects between Acupuncture Treatment and Cotreatment with Mixed Pharmacopuncture of Jungsongouhyul and Cervi Pantotrichum Cornu on Low Back Pain Patients. Journal of Acupuncture Research. 2011;28(6):149-57.
- Ministry of Food and Drug Safety (MFDS). Guidelines for Clinical Trial of Herbal Medicines (Crud drug) -General Considerations- (Complainant's Guide). 2020.
- Kim JH, Ahn IY, Noh JY, Park SE, Yi JS, Koh KY, Son SJ, Lee JK. Recent trend of international guidelines for genotoxicity testing. The Korean Society of Food, Drug and Cosmetic Regulatory Sciences. 2016;11(2):201-9.
- National Institute of Food and Drug Safety Evaluation (NIFDS). Explanatory note on toxicity test standards for pharmaceuticals, etc. 2012.