사삼생맥산 추출물이 Balb/c mice의 면역활성에 미치는 효과
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
The purpose of this study was to investigate the immune activation effect of Sasamsaengmaek-san (SSSMS) consisted of a mixture of Adenophora triphylla var. japonica, Liriope platyphylla, Panax ginseng C. A. Meyer and Schisandra chinensis. in Balb/c mice. Measuring alanine aminotransferase (ALT) and aspartic acid transaminase (AST) levels in Balb/c mice was performed to analyze the cytotoxicity. Cytokines (IFN-γ, IL-2, IL-12) which regulate the immune activation in Balb/c mice were measured by enzyme-linked immunosorbent assay (ELISA). Activated T lymphocytes in peripheral blood mononuclear cell (PBMC), spleen, lymph nodes were analyzed by flow cytometry using percentages. All tests were compared with red ginseng 100 μg/mL (RG 100), which is the most used for immune activity. As a result, cytokine activity was significantly increased at SSSMS 300 group. Activated T lymphocytes in PBMC, spleen, lymph nodes were significantly increased at SSSMS 300 group. These results suggest that there is a possibility of SSSMS activating an immune system by activating the cytokines, and it is confirmed that SSSMS also effective for generation and differentiation of T, B lymphocytes which activate the immune response.
Keywords:
Immune activity, Cytokine, T lymphocyte, Sasamsaengmaek-san, Red ginseng서 론
면역계는 개체가 생존하는 동안 지속적으로 보유되고 있으면서 생체 내, 외부로부터 출현하는 각종 병원체 등의 이물질의 공격으로부터 개체를 효과적으로 방어하는 생체방어체계이다1). 면역반응에 관여하는 생체기관으로는 혈액, 임파선, 비장, 흉선 등이 있고, 면역세포에 관여하는 세포로는 사이토카인, T 세포, B 세포, 대식세포 및 NK세포 등이 있다2).
사이토카인은 면역세포로부터 분비되는 단백질 면역조절제로서 신호전달 과정에서 특정 수용체와 결합하여 면역반응에 관여한다. 사이토카인의 종류는 세포의 증식, 분화, 사멸 등에 다양한 역할의 사이토카인이 존재하며, 특히 면역과 염증에 가장 많이 관여하여 면역활성에 있어 임상적으로 중요한 지표이다3).
면역반응에 관여하는 세포 중 림프구인 T 세포, B 세포는 면역반응을 담당하는 주된 세포이며1),세포막에 존재하는 단백질의 종류에 따라 활성화 될 때 다양한 표현형으로 나타나고 또한 면역의 활성도를 알아보는 실험에서 주로 사용된다4).
최근 인간의 수명이 증가하면서 저하된 면역력을 회복시킬 수 있는 약재에 대한 관심이 증가하고 있다. 특히 천연약재에서 분리된 물질에 의한 면역조절 관련 연구는 항염작용 및 면역활성에 대한 주요 관심 대상이다5).
면역기능은 한의학적 관점에서 볼 때 ‘정기(精氣)’에 비유할 수 있는데, 정기는 인체의 생리활동이 정상적으로 유지되도록 하고, 내외의 병인으로부터 인체를 방어하여 질병으로부터 회복시키는 작용을 뜻하여 면역학적 관점과 많은 유사성을 가지고 있다. 면역기능의 증진은 보익의 개념에서 접근하고 있다6).
보익약 중 보음약인 사삼은 약리작용으로 강심작용, 거담작용, 항균작용, 면역체계에 대한 작용, 항염작용 등이 있고7), 면역활성에 대한 연구가 활발히 이루어지고 있다6-8,10).
보익약 중 보기약인 인삼, 보음약인 맥문동, 오미자로 구성된 생맥산은 한의학적으로 정기가 저하될 때 청열(淸熱), 보기(補氣), 생진(生津) 작용을 한다고 알려져 있으며11), 전신의 생리기능을 촉진하여 심장기능 회복 및 면역증강의 효과가 있다12).
생맥산의 개별 약재 효능으로 지금까지 알려진 것은 인삼의 경우 중추신경계에 대한 작용, 면역기능 조절작용, 항산화 작용 등13-15)이 보고되고 있으며 맥문동의 효능으로는 항균, 면역체계에 대한 작용, 항염작용 등8,16)이 있고, 오미자는 항산화작용, 면역력 증강, 항균효과 등의 연구가 수행되었다17,18).
이 연구에서 대조군으로 사용된 홍삼추출물은 면역활성에 효과적임이 여러 실험을 통해 증명되었다3,26,29). 홍삼과 생맥산에 관련된 연구로는 생맥산의 구성성분 중 하나인 인샘 대신 홍삼으로 배합한 생맥산이 일반 생맥산보다 항산화 효능이 더 높다는 연구가 있다34).
본 연구에서는 면역 활성화에 효과가 있다고 알려진 사삼과 항산화, 면역기능 조절 등의 효과가 있는 인삼, 맥문동, 오미자의 복합물이자 생리활성 촉진으로 면역작용에 영향을 미치는 생맥산의 혼합물인 사삼생맥산 추출물이 면역활성에 있어 시너지효과를 보일 것으로 기대되어 시행하는 실험으로 면역활성에 효과적임이 여러 실험을 통해 증명된 홍삼추출물3,26,29)을 대조군으로 설정하여, balb/c 마우스를 대상으로 비장에서 활성 T 림프구 분석, T 세포 활성물질인 IFN-γ, IL-2, IL-12의 변화 등을 관찰하여 유의한 결과를 얻었기에 보고하는 바이다.
연구대상 및 방법
1. 재료
본 실험에서 사용한 사삼, 맥문동, 인삼, 오미자는 옴니허브 (대구, Korea)에서 구입한 것을 정선하여 실험에 사용하였다. 본 실험에 사용된 약재 구성과 분량은 다음과 같다 (Table 1).
본 약재들을 한일분쇄기 (FM-700SS, 한국)로 분쇄하여 환류추출기 (heating Mantle, MS-DM609/20L)에 넣고 100℃ 에서 증류수를 1ℓ 가하여 120분 추출하였다. 그 후 감압증류기 (N-1200A, EYELA. CO. LTD, Japan)를 이용하여 추출액을 농축하고, 동결건조기 (PF-10/ALPHA 1-2LD, Germany)를 사용하여 건조된 열수 추출물을 얻어 –80℃에서 냉동 보관하여 실험에 사용하였다.
옴니허브 (대구, Korea)에서 구입한 인삼을 정선하여 실험에 사용하였다. 이 인삼을 40℃에서 24시간 건조한 후 95℃로 예열된 증숙기에서 3시간 동안 증숙하고 내부온도가 60℃인 건조기에서 1차 증숙 후 36시간, 2차 증숙 후 14시간, 3차부터 9차 증숙 후 12시간 동안 건조하여 홍삼을 제조하였다. 이렇게 얻은 홍삼 100g에 증류수 1ℓ를 가하여 열탕 추출기에서 3시간 동안 추출하여 얻은 액을 흡입 여과하여 감압 증류장치로 농축, 이를 다시 동결 건조기를 사용하여 완전 건조한 홍삼농축액 추출물(Red ginseng, RG)을 –84℃에서 냉동 보관하면서 실험 시마다 희석하여 사용하였다.
실험동물은 FOLAS INTERNATIONAL (서울, Korea)에서 8주령의 Balb/c 마우스 (male)를 분양받아 고형사료와 물을 자유롭게 공급하여 2주간 실험 동물실에 적응시킨 후 사용하였다. 실험 동물실 온도는 22±2℃로 유지하였고 명암주기 (Light/Dark)는 12시간 단위로 조절하였다.
실험은 총 4군으로 나누었으며 8주령의 Balb/c 생쥐 (male)를 아무 처치를 하지 않은 무처치 대조군 (Ctrl), 홍삼 추추물 100mg/kg을 투여한 대조군 (RG 100), 사삼생맥산 추출물 150mg/kg, 300mg/kg을 투여한 실험군 (SSSMS 150, SSSMS 300)으로 나누었으며 14일간 (2주간) 매일 경구 투여하였다.
본 실험에 사용된 시약은 Enzyme-linked immuno-sorbent assay (ELISA) kit (Chondrex, USA), heparin, antibody avidin-HRP-conjugated, formaldehyde, trypsin-0.2% EDTA, chloroform, RPMI-1640 배양액, trichloroacetic acid, isopropanol, Dulbecco's phosphate buffered saline (D-PBS) 등은 Sigma-Aldrich(St. Louis, MO, USA)사의 제품을 사용하였고, anti-CD4-FITC (fluorescein isothiocyanate), anti-CD8-FITC, anti-CD25-PE, anti-CD49d-PE, anti-B220-PE 등은 PharMingen (San Diego, CA, USA)사의 제품을, IFN-γ, IL-2 ELISA kit는 from Biosourse (Camarillo, CA, USA)사의 제품을, IL-12 ELISA kit는 R&D system(Minneapolis, MN, USA)사의 제품을 사용하였으며 기타 일반 시약은 특급 시약을 사용하였다.
본 연구에 사용된 기기는 탕추출기 (DWT-1800T, 대웅, Seoul, Korea), 감압 증류장치 (rotary vaccum evaporator, BUCHI B-480, Flawil, Switzerland), 동결 건조기 (freeze dryer, EYELA FDU-540, Tokyo, Japan), ELISA reader는 Molecular devices(CA, USA)사 제품을, 유세포 분석기는 BD biosciece (Becton, USA)사, 자동 ELISA 세척기는 Bio-Tek(CA, USA)사 제품 등을 사용하였다.
2. 방법
12시간 절식 후 ether로 마취시킨 다음 심장에서 12㎖ 이상의 혈액을 취하여 5㎖를 15㎖ conical tube에 넣어 6,500 rpm에 15분간 원심 분리시켜 혈청을 분리하였다. 분리한 혈청은 생화학기기를 이용하여 alanine aminotransferase (ALT)와 aspartic acid transaminase (AST)를 측정해 세포독성 실험을 하였다.
비장을 적출하여 100mesh로 비장세포를 분리하여 ACK 용액으로 RBC를 제거하고 anti-CD3 mAb를 바른 well에 5×105세포씩 5% FBS-DMEM 배양액에서 48시간 동안 배양하였다. 그 후 원심분리기 2,000 rpm에서 3 분간 원심분리한 후 200㎕의 배양상층액을 얻었다. IL-12는 anti-mouse IL-12 capture 단클론 항체fh 48시간동안 자극하여 배양상층액을 얻었다. 각 well에 배양상층액 50㎕를 분주하고 2 시간 동안 25℃ 실온에서 방치한 후 2회 washing 완충용액으로 세척, antibody biotin-IL conjugated를 넣고 2시간 방치한 후, 다시 2 회 세척 후, antibody Avidin-HRP conjugated 100㎕를 처리하고 1 시간 실온에서 방치한 후 다시 세척하여 TMB 기질을 100㎕씩 분주하고 암소에서 30 분간 방치한 후 100㎕의 stop 용액을 처리하여 배양상층액내의 IFN-γ, IL-2, IL-12의 수준 측정을 enzyme-linked immuno-sorbent assay로 ELISA leader 450㎚에서 흡광도를 측정하였다.
PBMC (Peripheral blood mononuclear cell)는 heparin을 처리한 3 ㎖ 주사기로 심장천좌법으로 채혈하였다. 미리 준비한 10 ㎖의 ACK용액 (8.3 g NH4Cl, 1g KHCO3, in 1ℓ of demineralized water + 0.1 mM EDTA)에 혼합하여 실온에서 5 분 동안 처리하여 적혈구를 제거하였다. 비장 및 림프절은 적출하여 100mesh로 비장세포를 분리하여 D-PBS로 5 분간 원심분리 (1,700 rpm)후 cell strainer (FALCON)에 통과시켜 세포 이외의 분해되지 않은 조직이나 불순물을 제거하였다.
분리된 PBMC와 비장세포, 림프절 세포를 2 회 1%의 FBS가 함유된 PBS (FACS buffer)로 세척한 후 각각의 시험 관에 PBMC, 비장세포, 림프절 세포를5×105세포로 조정하여 4℃에서 면역 형광염색을 실시하였다. 각각에 FITC-anti-CD4, FITC-anti-CD8, PE-anti-CD25, FITC-anti-CD69, 후 flow cytometry의 Cell Quest 프로그램을 이용하여 백분율 (%)로 분석해 경향성을 파악하였다.
자료분석을 위해 Statistical Package for Social Sciences version 23.0 for Windows (SPSS, Chicago, Illinois, United States)를 사용하여 정규성 검정 후 one-way analysis of variance(ANOVA, 일원배치분산분석)를 실시하였다. 정규성이 없는 실험군의 경우 비모수법인 Kruskal-Wallis test을 사용하였으며 p-value<0.05 일 때 유의성이 있는 것으로 판정하였다.
결 과
1. 혈청 내 AST, ALT 생성량에 미치는 영향
홍삼 및 사삼생맥산 추출물의 경구 투여 후, 혈청을 분리하여 ALT와 AST를 측정, 분석한 결과, Ctrl군의 ALT는 27±4 U/L, RG 100군은 23±2 U/L, SSSMS 150군은 3±5 U/L, SSSMS 300군은 26±3 U/L로 측정되었으며 Ctrl군과의 유의성 있는 차이는 없었다.
Ctrl군의 AST 수치는 62.17±9.95 U/L, RG 100군의 수치는 84.50±18.75 U/L, SSSMS 150군은 81.17±18.81 U/L, SSSMS 300군의 수치는 87.83±23.88 U/L로 측정되었으며 Ctrl군 과의 유의성 있는 차이는 없었다(Fig. 1).
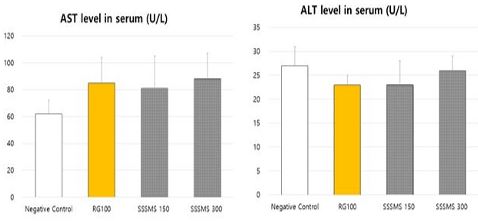
Effects of extracts of Sasamsaengmaek-san on Asparate aminotransferase (AST), Alanine aminotransferase (ALT) levels in mice. Mice were treated with Red Ginseng components (RG 100) once a day and extract of Sasamsaengmaek-san for 2 weeks. Negative control : Not treated Balb/c mouse group. RG100 : Balb/c mouse group treated with RG 100 mg/kg once a day for 2 weeks. SSSMS 150 : Balb/c mouse group treated with SSSMS 150 mg/kg once a day for 2 weeks. SSSMS 300 : Balb/c mouse group treated with SSSMS 300 mg/kg once a day for 2 weeks. The results are expressed the mean ± S.E.M. (N=6). Comparisons between control and test groups were analyzed using ANOVA.
2. Cytokine 발현량 분석
비장세포 배양액 내 사이토카인 발현량 실험 결과, Ctrl군의 경우 1874.12±887.98 pg/mL, RG 100군은 13208.70±3755.95 pg/mL, SSSMS 150군은 11561.12±2228.27 pg/mL, SSSMS 300군은 16821.55±3948.72 pg/mL로 측정되었다. RG 100, SSSMS 300군은 **p<0.05로 모두 유의미하게 증가하였다.
RG 100군과 SSSMS 투여군들 사이에선 유의한 차이는 없었다(Fig. 2).
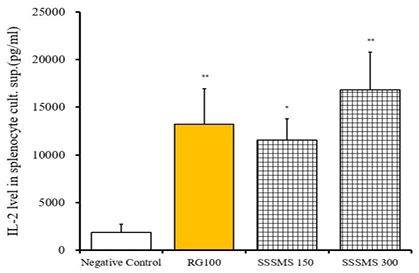
Effects of extracts of Sasamsaengmaek-san on IL-2 cytokine expressions in mouse splenocyte culture. After mice were treated with Red Ginseng components (RG 100) once a day and extract of Sasamsaengmaek-san for 2 weeks, blood was collected and serum was obtained by 20.000 rpm centrifugation. IL-2 cytokine gene expressions were analyzed by enzyme-linked immuno-sorbent assay. The results are expressed the mean ± S.E.M. (N=12). Comparisons between control and test groups were analyzed using ANOVA. **p < 0.05 vs normal by Tukey HSD.
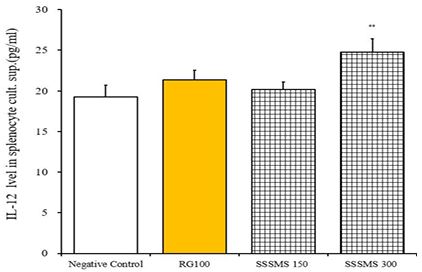
IL-12 발현량 실험 결과 Ctrl군은 19.28±1.45 pg/mL, RG 100군은 21.37±1.17 pg/mL, SSSMS 150군은 20.20±0.91 pg/mL, SSSMS 300군은 24.78±1.60 pg/mL로 측정되었으며 SSSMS 300에서 유의성 있게 증가하였다. (**p<0.05)
RG 100군과 SSSMS 150, 300군들 사이에선 유의성 있는 차이는 없었다(Fig. 3).
IFN-γ 발현량 실험 결과 Ctrl군은 75.75±36.30 pg/mL, RG100군은 6084.00±5671.75 pg/mL로 유의성 있게 증가하였다. (***p<0.001)
SSSMS 150군은 1097.26±956.86 pg/mL로 측정되었고 SSSMS 300군은 5915.05±3916.51 pg/mL로 측정되었으며 SSSMS 300군에서 유의성 있게 증가되었다. (***p<0.001)
RG100군과 SSSMS300군과의 차이는 유의성이 없었다(Fig. 4).
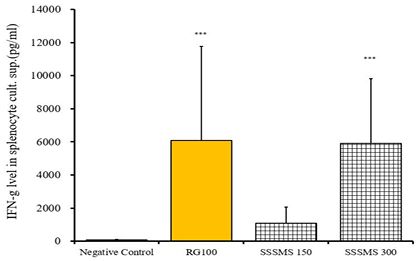
Effects of extracts of Sasamsaengmaek-san on IFN-γ Cytokine Expressions in mouse spleen. Comparisons between control and test groups were analyzed using Kruskal Wallis test, post hoc test was performed by Mann-Whitney U test. Bonferroni adjustment was made with statistical significance defined at P less than 0.008. ***p < 0.001 vs normal by Mann-Whitney U test.
3. 형광 유세포 분석
(1) CD4+ T 세포와 CD8+ T
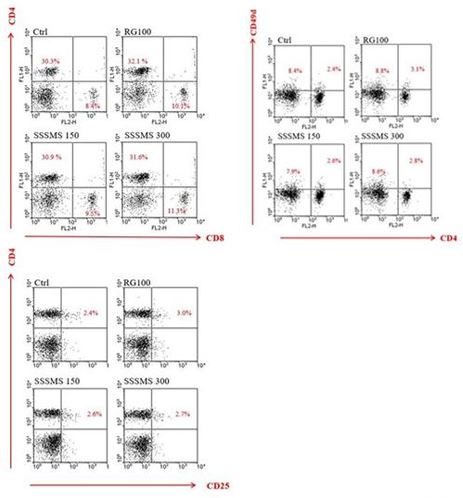
분리된 말초혈액 내 면역세포를 형광유세포 분석한 결과, CD4+ T 세포 비율이 Ctrl군의 경우 30.3%가 나타났으며, RG100군은 CD4+ T 세포 비율은 32.1%로 증가된 경향을 보였다.
SSSMS 150군의 CD4+ T 세포 비율은 30.9%로 Ctrl군에 비해 증가되었고 RG 100군 보다는 약간 낮은 비율을 나타내었다.
SSSMS 300군의 CD4+ T 세포 비율은 31.6%로 Ctrl군에 비해 증가되었고, RG 100군보다는 약간 낮은 비율을 나타내었다.
CD8+ T 세포 비율은 Ctrl군의 경우 8.4%가 나타났으며, RG 100군의 CD8+ T 세포 비율은 10.1%로 증가된 경향을 보였다.
SSSMS 150군의 CD8+ T 세포 비율은 9.5%로, Ctrl군에 비해 유의하게 증가됨을 확인할 수 있었고, RG 100군보다는 약간 낮은 비율을 나타내었다.
SSSMS 300군의 CD8+ T 세포 비율은 11.3%로, Ctrl군과 RG 100군보다 현저하게 증가된 비율로 나타났다.
(2) CD4+CD49d+ T 세포
말초혈액 내 CD4+CD49d+ T 세포를 분석한 결과, Ctrl군의 경우 2.4%가 나타났으며, RG 100군의 3.1%로 현저하게 증가된 경향을 보였다.
SSSMS 150군의 세포 비율은 2.6%로 Ctrl군에 비해 0.2% 증가된 비율을 나타내었고, SSSMS 300군의 비율은 2.8%로 Ctrl군에 비해 증가되었으나, RG 100군의 비율보다는 약간 낮은 비율로 나타났다.
(3) CD4+CD25+ T 세포
말초혈액 내 CD4+CD25+ T 세포를 분석한 결과, Ctrl군의 경우 2.4%의 비율로 나타났으며, RG 100군의 세포 비율은 3.0%로, 0.6% 증가된 경향을 보였다.
SSSMS 150군의 CD4+CD25+ T 세포 비율은 2.6%로, Ctrl군에 비해 0.2% 증가된 비율을 나타내었고, SSSMS 300군의 세포 비율은 2.7%로 Ctrl군에 비해 증가되었으나, RG 100군의 비율보다는 0.3% 낮은 비율로 나타났다(Fig. 5).
(1) CD4+ T 세포/CD8+ T 세포
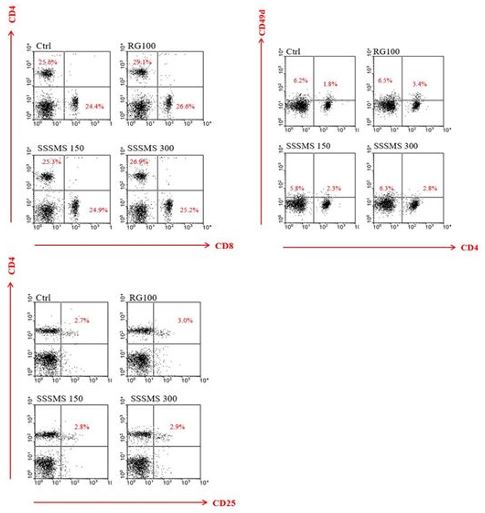
분리된 비장 내 면역세포를 형광유세포 분석한 결과, CD4+ T 세포 비율이 Ctrl군의 경우 25.6%가 나타났으며, RG 100군의 세포 비율은 29.1%로 나타나 3.5% 증가된 경향을 보였다.
SSSMS 150군의 세포 비율은 25.3%로, Ctrl군에 비해 0.3% 약간 감소됨을 확인할 수 있었고, SSSMS 300군의 비율은 26.9%로 Ctrl군 보다 증가된 비율을 나타내었다 .
CD8+ T 세포 비율은 Ctrl군의 경우 24.4%, RG 100군의 비율은 26.6%로 약간 증가되었다.
SSSMS 150군의 비율은 24.9%로, Ctrl군에 비해 0.5% 증가됨을 확인할 수 있었고, SSSMS 300군의 비율은 25.2%로, Ctrl군의 비율보다 0.8% 증가된 비율을 나타내었다.
(2) CD4+CD49d+ T 세포
비장 내 CD4+CD49d+ T 세포를 분석한 결과, Ctrl군의 경우 1.8%가 나타났으며, RG 100군의 비율은 3.4%로 현저하게 증가된 경향을 보였다.
SSSMS 150군의 세포 비율은 2.3%로, Ctrl군보다 현저하게 비율이 증가되었고, RG 100군보다는 0.6% 낮은 수준으로 나타났다.
SSSMS 300군의 세포 비율은 2.8%로 Ctrl군과 SSSMS 150군에 비해 증가되었으나, RG 100군보다는 낮은 비율로 나타났다.
(3) CD4+CD25+ T 세포
비장 내 CD4+CD25+ T 세포를 분석한 결과, Ctrl군의 경우 2.7%의 비율로 나타났으며, RG 100군의 비율은 3.0%로 약간 증가된 경향을 보였다.
SSSMS 150군의 비율은 2.8%로, Ctrl군보다는 0.1% 증가되었고, RG 100군에 비해선 약간 낮은 수준으로 비율이 나타났다.
SSSMS 300군의 세포 비율은 2.9%로 Ctrl군과 SSSMS 150군에 비해서는 높은 비율을 나타내었으나, RG 100군에 비해서는 낮은 수치를 나타냈다(Fig. 6).
(1) CD4+ T 세포/CD8+ T 세포
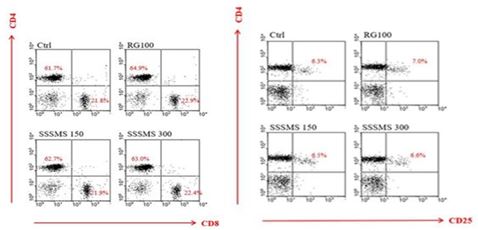
분리된 Draining lymph nodes (DLN) 내 면역세포를 형광유세포 분석한 결과, CD4+ T 세포 비율이 Ctrl군의 경우 61.7%가 나타났으며, RG 100군의 CD4+ T 세포 비율은 약 64.9%로 증가된 경향을 보였다.
SSSMS 150군의 세포 비율은 62.7%로 나타나, Ctrl군에 비해 1% 증가됨을 확인할 수 있었으나, RG 100군에 비해서는 2.2% 낮은 수치를 나타내었다.
SSSMS 300군의 세포 비율은 63.0%로, Ctrl군, SSSMS 150군 보다는 증가된 비율을 나타내었으나, RG 100군 보다는 1.9% 낮은 것으로 나타났다.
CD8+ T 세포 비율이 Ctrl군의 경우 21.8%, RG 100군의 비율은 22.9%로 Ctrl군에 비해 1.1% 증가된 비율로 나타났다.
SSSMS 150군의 비율은 21.9%로, Ctrl군과 거의 비율적으로 차이가 없었고, RG 100군에 비해 1.0% 비율이 약간 낮음을 확인할 수 있었다.
SSSMS 300군의 세포 비율은 22.4%로 Ctrl군과 SSSMS 150군보다는 증가된 비율로 나타났으나, RG 100군의 비율보다는 0.5% 낮게 나타났다.
(2) CD4+CD25+ T 세포
DLN 내 CD4+CD25+ T 세포를 분석한 결과, Ctrl군의 경우 6.3%의 비율로 나타났으며, RG 100군의 비율은 7.0%로 약간 증가된 경향을 보였다.
SSSMS 150군의 비율은 6.5%로, Ctrl군의 비율보다 0.2% 높은 수준으로 나타났으나, RG 100군의 비율보다는 0.5% 낮은 비율 수준으로 나타났다.
SSSMS 300군의 비율은 6.6%로 Ctrl군의 비율보다는 0.3% 증가된 수준으로 나타났고, RG 100군의 비율보다는 0.4% 낮은 수준으로 나타났으며, SSSMS 150군의 비율과는 거의 차이를 나타내지 않았다(Fig. 7).
고 찰
면역계란 원래 생체 내에 갖추어져 있는 것이며 면역기능을 활성화함으로써 각종질병을 예방하는 기능을 가지고 있다6). 그 중 적응면역반응은 특정 항원에 대하여 특정 림프구가 먼저 작용한 후, 그 이후엔 첫 번째 면역반응을 기억하여 다음에 동일 항원이 들어오면 반응한다. 적응 면역반응은 T 림프구가 관여하는 세포 매개성 면역반응과 B 림프구가 관여하는 체액성 면역반응으로 구분된다. 체액성 면역반응은 항원 자극과 T 림프구의 도움을 받아 B 림프구가 항체를 생성하여 혈액과 림프로 분비하여 이루어지며, 세포매개성 면역반응은 T 림프구가 항체를 생성, 분비하지 않고 세포 가까이 접촉하여 직접 제거하는 반응이다. 면역반응에 관여하는 생체기관으로는 혈액, 임파선, 비장, 흉선 등이 있고, 면역세포에 관여하는 세포로는 T 세포, B 세포, NK세포 및 대식세포 등이 있다1,2).
면역기관 중 2차 림프기관인 비장은 항원에 대한 주된 보호 면역 반응을 담당하는 장기로 혈액으로부터 항원을 수집하고 T 및 B 세포의 성숙과 항원으로부터의 자극 후 이들의 분열 및 분화가 이루어지는 주요 림프기관이다1,2,19). 림프절은 전신에 분포하고 있으며 면역작용을 담당하는 림프구를 생성한다. 1차 림프기관인 흉선은 림프에서 생성된 T림프구가 성숙하고 증식되는 곳이며 정상림프구를 선별하여 분비한다20).
사이토카인이란 세포, 주로 백혈구에서 분비되는 단백활성 물질을 뜻하며 대식세포와 협력하여 면역을 담당한다21). 항원제시를 받은 helper T cell이 대식세포를 활성화하고 killer T cell을 활성화할 때 사이토카인이 방출되며 자연 및 특이면역을 활성화 시키는 단계에서 생산되어 염증반응을 자극하거나 저해하는 선천면역의 조절 매개자 역할을 한다. 또한 특정항원을 인식하여 분비되거나 염증 반응을 강하게 하거나 특수화 하는데 관여하는 특이면역의 매개 조절자의 기능 등 면역반응 및 염증반응에서 다양한 역할을 하는 것으로 알려져 있다1,2,22).
본 연구에서 면역기능 조절을 알아보기 위해 측정한 IL-2는 항원인식으로 Th1 세포에 의해 생성되며 초기 염증반응에서 세포 간 신호전달을 수행함으로써 면역반응에 중요한 역할을 담당한다22). 또한 항원 특이세포를 증식시키고 T림프구, B 림프구 및 NK cell의 증식과 분화를 촉진시켜 면역반응의 강도를 결정하는데 주요 인자로 알려져 있다24). INF-γ는 TH1세포에서 생산되는 세포분열촉진물질로 T cell에 의해 유발되는 면역반응, T세포의 작용 조절과 자연면역세포 (NK세포)의 기능 항진을 유도하여 식균작용을 상승시킨다. 이 외에도 바이러스로부터의 세포보호, 조직배양에서나 골수에서의 세포분열 억제, 또 특수 암세포의 분열 억제 등 많은 기능이 알려져 있다23). IL-12는 대식세포에서 생산되며 INF-γ의 발현을 돕고 Th1(helper T cell)의 분화를 야기하며 자연살해세포 및 CD8+ T 세포의 세포독성 활성을 증가시킨다고 알려져 있다26).
면역증진기능은 다른 어떤 기능분야 보다도 영양상태에 영향을 많이 받는다26). 한의학에서는 이러한 면역반응을 정기를 회복시킴으로써 신체 내 면역력을 조절하고 신체 방어 기전을 활성화 시킨다고 보고 있으며27), 생체 방어기능이 관계된 면역학적 관점과 유사성을 가지고 있다고 보고 있다6).
한의학에서 정기를 회복시키는 보익약 중 보음약인 사삼은 초롱꽃과에 속한 다년생 초본인 잔대 Adenophora triphylla var. japonica Hara 및 동속근연식물의 뿌리이다7). 사삼의 면역조절 작용은 세포성 면역과 비특이성 면역을 높이고, 체액성 면역을 억제하며, 림프구의 전환률을 제고한다는 보고가 있다29). 사삼의 면역작용에 대한 연구로는 보음약의 면역활성에 대한 비교 연구8), 류마티즘 관절염에 관한 사삼의 면역활성 연구9), 사삼의 면역활성조절에 대한 실험적 연구10) 등이 있다.
생맥산의 재료 중 하나인 인삼은 특히 인체의 면역기능에 유효하게 작용하는데, 저하된 면역기능을 항진시켜서 각 기관의 평형을 유지함으로써 생체의 건강을 지키는 효과가 확인되고 있으며14), 주로 대사활성 등의 관점에서 연구가 수행되어 지고 있다7,26).
맥문동은 항염작용, IgM 항체 생산 억제 등 면역과 관련된 효능이 보고된 바 있고16), 오미자는 혈당강화, 면역조절, 항암 등의 생리적 활성을 나타낸 연구17,18)가 있다.
이렇게 생맥산 단일 약재에 대한 연구는 활발히 이루어지고 있는 편이나 생맥산 복합물이 면역활성에 미치는 효과에 대한 연구는 별로 없으며, 특히 비장, 림프, 흉선에서의 활성도를 살펴보는 연구는 부족하기에 사삼과 생맥산의 합방인 사삼생맥산 추출물이 면역활성에 미치는 영향을 실험적으로 분석하고자 Balb/c 마우스에게 사삼생맥산 추출물을 투여하여 면역활성 효과를 보고자 하였고, 대조군으로 면역활성에 효과적이라는 연구3,29)가 많은 홍삼 추출물을 기준하여 효능을 비교하였다.
먼저 생체 내 간독성 여부를 알아보기 위해 혈청 내 ALT, AST 검사를 시행하였으며 검사 결과 RG 100군과 SSSMS군에 대한 간독성은 없었다(Fig. 1).
사삼생맥산의 배양 비장세포에서 T세포 활성물질인 IFN-γ, IL-2, IL-12의 발현량을 통한 항염증 효능을 분석하기 위해 SSSMS 150, 300군과 RG 100군을 ctrl군과 비교, 분석하였다. SSSMS 150군, SSSMS 300군 및 RG 100군에서 IL-2의 발현량이 유의한 수준으로 증가하였고(Fig. 2), RG 100군과 SSSMS 150, 300군 간의 유의한 차이는 없었다. IL-12의 경우 Ctrl군에 비해 SSSMS 300군에서 유의한 증가를 보였다(Fig. 3). IFN-γ는 Ctrl군에 비해 RG 100군과 SSSMS 300군에서 유의한 증가를 보였다(Fig. 4).
면역반응에 관여하는 세포 중 림프구인 T 세포, B 세포는 면역반응을 담당하는 주된 세포이며, 림프구 상태에서 흉선, 비장, 림프절 등에 들어가 분화, 성숙하여 림프구 클론 집단을 형성하고 방출된다1,2). 골수에서 만들어진 림프구의 전구세포인 흉선세포가 흉선 내에서 성숙과정을 거쳐 T 림프구로 발달하며 T림프구는 세포막에 존재하는 단백질의 종류에 따라 CD4+로 표현되는 보조 T 세포(helper T cell)과 CD8+로 표현되는 세포독성 T 세포(killer T cell)로 나뉘고, T 림프구가 아닌 대부분의 림프구는 B 림프구가 된다22,24). PBMC는 말초혈액 단핵세포로 핵을 가진 혈액세포를 말하며 75%는 T cell, 나머지 25%는 B cell, NK cell로 이루어져 있어 면역활성 정도를 알아보는 실험에서 주로 사용된다30).
PBMC, 비장 및 림프절 에서의 CD4+ T 세포와 CD8+ T 세포는 SSSMS 투여군 및 RG 100군에서 모두 증가되었다(Fig. 5-7). 이는 면역을 활성화하는 T cell이 말초혈액 및 비장, 림프절에서 그 비율이 증가함을 의미하며 사삼맥문동 추출물이 T cell 의 생성 및 분화에 영향을 줄 수 있음을 시사한다. 또한 홍삼 추출물 역시 T cell의 활성화로 인한 말초혈액, 비장 및 림프절에서의 비율 증가로 T cell의 생성과 활성에 영향을 준다는 것으로 시사한다.
활성화된 T 세포를 의미하는 CD4+CD25+ T 세포는 조절(억제) T림프구로도 볼 수 있는데 여러 자가면역과 감염질환의 병인에 관여하여 이식거부를 억제하고자 할 때도 중요한 역할을 한다. 또한 IL-10과 TGF-β를 생성하여 염증질환을 유발하고 관절을 파괴하는 사이토카인을 생성하는 활성화 Th1 세포를 효과적으로 억제시키고, 골수에서 적혈구세포 성숙과정을 조절하는 기능도 한다고 알려져 있다4). PBMC, 비장 및 림프구에서 CD4+CD25+ T 세포의 비율은 모두 증가한 것으로 보아(Fig. 5-7) 사삼맥문동 추출물이 CD4+CD25+ T 세포 활성화를 통해 염증반응의 균형을 유지하도록 하며, 면역활성을 효과적으로 조절하는 가능성이 있음을 시사한다31). 하지만 CD4+CD25+ T 세포의 증가가 조절 T 림프구의 무조건적인 증가를 의미하지는 않는데 이는 regulatory T 세포가 되기 위한 CD62L, CD152, Foxp3 같은 유전자의 증가가 있었는지를 관찰해야 하기 때문에 사삼맥문동 추출물이 조절 T 세포를 증가시켜 염증반응을 조절하여 면역활성을 증진시킨다고 한다면 추가적인 연구가 필요할 것으로 보인다.
CD49는 activated B와 T cell, 대식세포, NK cell에 분포하고, 세포 접착 및 세포 표면 매개 신호 전달에 관여한다. 특히 관절염과 같은 염증질환에서 주로 나타나는 면역세포로서 Th1/Th2 균형의 변화에 큰 역할을 한다는 보고가 있다9,32). SSSMS 투여군은 PBMC 및 비장에서 CD4+CD49+ T세포 비율을 증가시켰다(Fig. 5, 6).
이상의 결과로 볼 때 SSSMS 300군은 Ctrl군에 비해 IL-2, IL-12, IFN-γ의 수가 유의하게 증가하였고 RG 100군도 Ctrl군에 비해 IL-2, IFN-γ에서 유의한 증가가 있었으며, RG 100군과 SSSMS 300군 사이는 유의한 차이가 없었다. 활성 T 림프구 분석의 경우 비장 내 CD4+ T 세포의 비율에서 SSSMS 150군 에서만 Ctrl군에 비해 약간 감소함을 보였으며, 나머지 활성 T 림프구의 경우 RG 100군 및 SSSMS 투여군에서 Ctrl군에 비해 모두 증가하는 경향을 보였다. 또한 면역기능 활성화와 관련된 RG 100군과 비교했을 때에도 사이토카인 발현량 및 활성 T 림프구 발현에서 유의한 차이를 보이지 않아 사삼생맥산 추출물이 면역기능을 증진시킬 수 있는 가능성이 있는 것으로 사료된다. SSSMS 300군에서 IL-2, IL-12의 분비능은 SSSMS 150군에 비해 더 증가하여(Fig. 2, 3) 높은 농도군에서 면역활성에 더욱 효과적일 수 있음을 알 수 있었다.
본 연구는 사삼생맥산 추출물이 면역기능 활성화의 가능성이 있음을 확인하였다는데에 의의가 있다. 향후 사삼생맥산 추출물의 효능 메커니즘을 규명하기 위해 지속적인 연구가 필요하며 8주령 보다 더 노화된 마우스에서의 실험이나, 병태모델에서의 면역 활성에 미치는 영향에 대한 임상적인 연구 및 실험이 추가적으로 필요할 것으로 사료된다.
결 론
사삼생맥산 추출물(SSSMS)이 Balb/c 마우스의 면역활성에 미치는 영향을 알아보고자 총 사이토카인 발현량, 활성화 T 세포의 비율을 측정 및 분석하여 다음과 같은 결론을 얻었다.
혈청 내 AST, ALT 검사를 분석한 결과, SSSMS 150mg/kg, 300mg/kg 용량에서 간독성은 없었다.
혈청 내 사이토카인의 발현량을 분석한 결과 SSSMS 300군에서 IL-2, IL-12, IFN-γ의 생성이 유의하게 증가하였다.
PBMC 내 활성 T 림프구 비율의 겅향성을 분석한 결과, Ctrl군에 비해 SSSMS 150, 300 투여군에서 CD4+ T, CD8+ T, CD4+CD49d+ T, CD4+CD25+ T 세포수는 모두 증가하는 경향을 보였다.
비장 내 활성 T 림프구 비율의 겅향성을 분석한 결과, Ctrl군에 비해 SSSMS 150, 300 투여군에서 CD8+ T, CD4+CD49d+ T, CD4+CD25+ T 세포수는 증가하였으나, SSSMS 150 투여군에서는 CD4+ T 세포수는 감소하는 경향을 보였다.
림프절 내 활성 T 림프구 비율의 겅향성을 분석한 결과, Ctrl군에 비해 SSSMS 150, 300 투여군에서 CD4+ T, CD8+ T, CD4+CD25+ T 세포수는 모두 증가하는 경향을 보였다.
References
- Seoul National university college of medicine. Immunology. Seoul: Seoul National university textbook compilation committee; 2000.
- Pyo SN, Son EH. Introduction to immunology. Seoul:Shinilbooks; 2021.
-
Son EH, Yoon JW, Park DW, Namkoong S, Han HS, Kang SC. Immunomodulating Effects of Red Ginseng on the Regulation of Cytokine Release in vivo. Korean journal of plant resources. 2012;25(5):578-85.
[https://doi.org/10.7732/kjpr.2012.25.5.578]

- Choi DY, Lee JD, Back YH, Lee SS, Yoo MC, Han CS, et al. Recent trends of Immunologic studies of Herbal medicine on Rheumatoid arthritis. J. of Kor. Acupucture & Moxibation Soc.. 2004;21(4):177-96.
-
Kayser O, Masihi KN and Kiderlen AF. 2003. Natural products and synthetic compounds as immunomodulators. Expert. Rev. Anti-Infect. Ther. 1:319-35.
[https://doi.org/10.1586/14787210.1.2.319]

- Sang Woo Shin, Young Sun Lee, Jong Hyun Park, Taeg Kyu Kwon, Seong Il Suh, Young Kyu Kwon. Comparison of Immunomodualtory Effects of Water-extracted Ginseng Radix, Pilose Asia-bell, Astragali Radix, Astractylodes Rhizoma alba and Dioscoreae Rhizoma. Journal of Physiology & Pathology in Korean Medicine. 2004;18(4):1140-6.
- National College of Korean Medicine collaborative textbook compilation Committee. Herbology. 2nd ed. Seoul: Younglimsa; 2011.
- Park SD, Lee GH, LEE YS, Kwon YK, Park JH, Choi SM, et al. Comparison of Immunomodualtory Effects of Water-extracted Adenophorae Radix, Liriopis Tuber, Dendrobii Herba, Polygonati Odorati Rhizoma and Polygonati Rhizoma. Korean J. Oriental Physiology & Pathology. 2007;21(2):414-4.
- Kim CG. Effect of Adenophorae Radix on collagen-induced arthritis mice model. Dajeon University. PhD degree thesis. 2007.
- Shin DH, Seo YB. The Experimental Studies on the Immunomodulational Effects of Adenophorae Radix. Kor. J. Herbology. 2000;15(1):31-43.
- Yoon YG. Dong-eui Herbal formula and explanation. Seoul: Eui Seong Dang; 2004.
- Hur NY, Baek EK. Development of Traditional Drinks using Sangmaksan. The Kor. J. of Culinary Research. 2005;11(3):166-78.
-
Benishin CG, Lee R, Wang LC, Liu HJ. Effects of ginsenoside on central cholinergic metabolism. Pharmacology. 1991;42:223-9.
[https://doi.org/10.1159/000138801]

-
Nam KY. Clinical Applications and Efficacy of Korean Ginseng. J. Ginseng Res. 2002;26(3):111-31.
[https://doi.org/10.5142/JGR.2002.26.3.111]

- Kim KH, Lee IR, Jung IS, Chung HY, Yun YS. The pattern of cytokine mRNA expression induced by polysaccharide from Panax ginseng. J. Ginseng Res. 1997;21(2):78-84.
- Mita A, Shida R, Kasai N, et al. Enhancement and suppression in production of IgM-antibody in mice treated with purified saponins. Biomedicine. 1979;31:223-7.
- Sung KC. A Study on the Pharmaceutical & Chemical Characteristics and Analysis of Natural Bokbunja Extract. J. of Korean Oil Chemists’ Soc.. 2011;28(3):290-8.
- Park JH, Kim JH, Kim DH, Mun HC, Lee HJ, Seo Sm, et al. Comparison of Immuno-stimulatory Activities by Purification Process of Schizandra chinensis Baillon Fruits. Kor. J. of Medicinal Crop Science. 2004;12(2):141-8.
-
Seo YS, Shin KS. Immune System-Stimulating Activities of Mucilage Polysaccharides Isolated from Opuntia humifus. J Korean Soc Food Sci Nutr. 2012;41(1):95-102.
[https://doi.org/10.3746/jkfn.2012.41.1.095]

-
Kuka M and Iannacone M. The role of lymph node sinus macrophages in host defense. Ann N Y Acad Sci. 2014;131(9):38-46.
[https://doi.org/10.1111/nyas.12387]

- National College of Korean Medicine Department of Pathology. Korean medicine Pathology. Seoul: Il-joong publishing; 2002.
- Kim YS, Lee JD, Kimg CH, Choi DY, Park DS, Nam SS, et al. The Effect of Kongjindan Aqua-acupuncture on the CD4+ T cell count at al. in rats were administered with MTX. J. of Kor. Acupucture & Moxibation Soc.. 1999;16:179-202.
- Ryu HS. Effects of Water Extract Acorn on Mouse Immune Cell Activation Ex Vivo. The Korean Journal of Food And Nutrition. 2010;23(2):135-40.
- Abbas, Lichtman, Cellular and Molecular Immunology. Seoul: Panmuneducation; 2004.
-
Trinchieri G. Interleukin-12 and the regulation of innate resistance and adaptive immunity. Nat. Rew. Immunol. 2003;3(2):133-79.
[https://doi.org/10.1038/nri1001]

- Kwak YS, Park JD, Yang JW. Present and Its Prospect of REd Ginseng Efficacy Research. Food industry and Nutrition. 2003;8(2):30-7.
- Lee WB, Jung HS, Kwon J, Oh CH, Lee WG. Immunoregulatory Action of Cornus officinalis Sieb.et Zucc. Korean J. Oriental Physiology & Pathology. 2002;16(2):267-71.
- Roh SS, Ku SK, Seo YB. Effect of Mori Ramulus on Collagen-induced Arthritis Rat – Expression o fImmunocells in Draining Lymph Node. Korean J. Oriental Physiology & Pathology. 2009;23(5):1106-15.
- Choi MS, Kim YH, Jang CC. Effect of red ginseng extracts on the immune response in mouse. J. Basic and Kife Res. Sci. 2002:2(2);47-58.
- Springhouse Corporation. Pathophysiology. Seou: Koonja publishing; 2004.
- Kim IG, Park HJ, Kim KJ, Kim SH, Kim MJ, Lee JA, et al. Mixture Bombyx mori L. and Liriopis seu Ophiopogonis Tuber effects on T cells in Thymus, Lymph Nodes. Kor. J. Herbol. 2018;33(5):47-52.
-
Nicola Gagliani, Chiara F Magnani, Samuel Huber, Monica E Gianolini, Mauro Pala, Paula Licona-Limon, Binggege Guo, De'Broski R Herbert, Alessandro Bulfone, Filippo Trentini, Clelia Di Serio, Rosa Bacchetta, Marco Andreani, Leonie Brockmann, Silvia Gregori, Richard A Flavell, Maria-Grazia Roncarolo Coexpression of CD49b and LAG-3 identifies human and mouse T regulatory type 1 cells. Nature Medicine. 2013;19(6):739-46.
[https://doi.org/10.1038/nm.3179]

- Kim TH, Lim YI, Hong KE, Yim YK, Lee H, LEe BR. Influence on the Anti-cancer and Immune response improvement of Herbal-acupuncture with Sinomenii acuti Lignum infusion solution into Joksamni(ST36). J. of Kor. Acupucture & Moxibation Soc.. 2018;33(5):47-52.
- Yang HJ, Ryu GH. Combined Effect of Fermentation and Extrusion Process on Antioxidant Properties of Sangmaksan. Korean J. Food SCI. Technol. 2009;41(5):566-81.