
산화적 스트레스에 대한 천마 추출물의 신경세포 보호 및 항산화 효과
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
We recently reported that Gastrodia elata extracts (GEE) had an effects to protect against lipopolysaccharide-induced cognitive impairment in vivo model. In this study, we investigated the neuroprotective effects and the mechanism of action of GEE in hydrogen peroxide (H2O2)-induced cell death of SH-SY5Y human neuroblastoma cell. The SH-SY5Y cells were divided into five groups, including control(non-treated group), 100 μM H2O2, 100, 200, 500 ㎍/㎖ GEE+ 100 μM H2O2 groups. Pre- and co-treatment with GEE prevented cell death induced by 100 μM H2O2 for 24 h in SH-SY5Y cells. Our findings also showed that anti-oxidants enzymes (Cu/Zn superoxide dismutase, Mn superoxide dismutase, catalase) were up-regulated by 100 μM H2O2. But GEE suppressed H2O2-induced anti-oxidants enzymes decrease in a dose-dependent manner. Treatment with GEE also inhibited phosphorylation of eukaryotic initiation factor-2α (eIF-2α) and p38 by H2O2. Taken together, the neuroprotective effects of GEE in terms of recovery of antioxidant enzymes expression, down-regulation of eIF-2α and p38 phosphorylation, and inhibition of cell death are associated with reduced oxidative stress in SH-SY5Y cells.
Keywords:
Gastrodia elata, Neuroprotective effects, Anti-oxidants enzymes, Hydrogen peroxide, SH-SY5Y cell서 론
인구 고령화는 치매, 파킨슨병(Parkinson`s disease) 등과 같은 노인의 퇴행성 뇌병변(neurodegenerative disease)을 증가시키는 것으로 보고되고 있다1). 퇴행성 뇌병변을 일으키는 주요 원인 중 하나는 활성산소종(reactive oxygen species, ROS)에 의한 신경세포 독성을 야기하는 것으로 알려져 있다2,3). 활성산소종은 superoxide radical (O2-), hydrogen peroxide (H2O2), hydroxyl radical (OH-) 등이 있으며, 나이가 듦에 따라 활성산소종은 과다 생성되고 축적되어 산화적 스트레스를 일으키고, 이는 신경세포에 독성을 일으켜 퇴행성 뇌병변을 유발한다4). 이러한 활성산소를 제거하여 활성산소종에 의한 세포 독성을 방어하기 위한 항산화 시스템이 존재한다. 이러한 기능을 하 항산화 효소로 Cu/Zn superoxide dismutase (SOD1), Mn superoxide dismutase (SOD2), catalase (CAT), glutathione peroxidase (GPx) 등이 알려져 있다5). 최근 한약재를 이용하여 산화적 스트레스에 의한 신경세포 보호 효과 및 기전에 대한 연구가 보고되고 있다6-8). 이러한 연구는 부작용과 독성이 적으면서 활성산소종에 의한 신경세포 독성을 보호하는 효과가 있는 한약재를 선별함으로서 산화적 스트레스에 의한 퇴행성 뇌병변을 예방하거나 치료할 수 있는 건강기능식품 혹은 천연물 신약 개발을 위한 단초를 제공하는데 의의가 있는 것으로 사료된다.
천마(Gastrodia elata BL.)는 난초과(Orchidaceae) 에 속한 다년생 기생초본의 근경을 건조한 것으로9), 실험적으로 신경세포 손상에 대한 in vitro10) 및 in vivo11) 방어 효과, 임상적으로 기억력 향상에 대한 효과12-14) 등이 있는 것으로 보고되었다. 최근 우리는 lipopolysaccharide (LPS)에 의해 유도된 인지기능 손상모델에 대한 천마 추출물의 방어 효과 및 그 기전 연구를 수행하여 유의한 결과를 얻어 보고 하였다15).
In vivo 환경에서 천마 추출물의 뇌 손상 보호 효과를 나타낸 연구 결과15)를 토대로 in vitro 조건에서 신경세포를 대상으로 활성산소종에 의한 산화적 스트레스에 의한 독성 보호 효과 및 그 기전을 연구하고, 항산화 효소 발현 및 활성도 등을 조사하여 유의한 결과를 얻었기에 보고하는 바이다.
재료 및 방법
1. 천마 추출물 제조
본 연구에 사용된 (건)천마(Gastrodia elata)는 무주농협(무주군, 전북)에서 구입하여 아래와 같이 추출하였다. 천마 100 g에 15배수의 물을 투입한 후 90°C에서 6시간 전탕하여 추출물을 얻어 여과하고, 다시 1차 잔여물에 15배수의 물을 넣어 90°C에서 6시간 전탕하여 2차 추출물을 얻어 여과한 후, 1, 2차 추출물을 혼합, 농축, 살균, 분무건조를 하여 30.2 g의 추출물을 획득한 후 실험에 사용하였다.
2. 시약 및 재료
Minimum essential medium α (MEM-α), Antibiotic-Antimycotic (10,000 units/㎖ penicillin, 10,000 ㎍/㎖ streptomycin, 25 ㎍/㎖ amphotericin B), Fetal bovine serum (FBS), phosphate buffered saline (PBS), Trypsin/EDTA solution (0.025% trypsin, 0.01% EDTA)은 Gibco (CA, USA)에서 구입하였고, Hydrogen peroxide는 TCI (Tokyo, Japan)에서 구입하였다. EZ-cytox, EZ-SOD assay kit는 Dogenbio (Seoul, Korea)에서 구입하였다. RIPA buffer와 BCA Protein Assay kit는 Thermo Fisher Scientific (CA, USA)에서 구입하였고, Phosphatase Inhibitor Cocktail, Protease inhibitor Cocktail, ECL kit는 Millipore (Darmstadt, Germany)에서 구입하였다. p38 MAPK Antibody, Phospho-p38 MAPK (Thr180/Tyr182) Antibody, Phospho-eIF2α Antibody는 Cell Signaling Technology (MA, USA)에서 구입하였고, Anti-Superoxide Dismutase 1 Antibody, Anti-SOD2/MnSOD Antibody, Goat Anti-Mouse IgG H&L (HRP), Goat Anti-Rabbit IgG H&L (HRP)는 Abcam(Cambridge, UK)에서 구입하였고, β-Actin Antibody는 Santa Cruz Technology (CA, USA)로부터 구입하였다. skim milk는 BD Difco (NJ, USA)에서 구입하였고, PVDF blotting membrane은 GE Healthcare Life Sciences (Buckinghamshire, UK)에서 구입하였다. TRIzol™ Reagent는 Invitrogen (CA, USA)에서 구입하였고, Prime Script TM reagent kit (perfect realtime)는 Takara (Tokyo, Japan)에서 구입하였고, Power SYBR Green PCR Master Mix는 Applied Biosystems (CA, USA)로부터 구입하였다. 그 외 Bovine serum albumin (BSA), Isopropanol, Methanol 등 다른 시약들은 Sigma-Aldrich (MO, USA)에서 구입하였다.
3. 세포 배양
본 실험에 사용한 인간 신경모세포종인 SH-SY5Y 세포주는 한국세포주은행(Seoul, Korea)으로부터 분양받아 사용하였다. 10% FBS, 2mM L-glutamine, 100 units/㎖ penicillin, 100 ㎍/㎖ streptomycin, 250 ng/㎖ amphotericin B가 포함된 MEM-α 배지로 배양하였고, PBS, Trypsin/EDTA solution을 사용하여 계대 배양하였다.
4. 세포 독성 시험
Water soluble tetrazolium salt (WST) assay 시약인 EZ-cytox를 사용하여 세포 독성을 확인하였다. SH-SY5Y를 1.3×10⁵ cells/well의 농도로 96well plate에 분주하고 37℃, 5% CO₂ 조건에서 48시간 동안 배양한 후 100 ㎍/㎖, 200 ㎍/㎖, 500 ㎍/㎖ 농도의 천마 추출물을 단독으로 처리하거나 100 μM의 Hydrogen peroxide와 함께 처리하여 24시간 동안 배양하였다. 각 well에 10μl의 EZ-cytox 시약을 첨가하고 37℃, 5% CO₂ 조건에서 30분 동안 반응시킨 후 ELISA reader (Molecular Devices, California, USA)로 450 nm 파장에서 흡광도를 측정하였다.
5. SOD activity 시험
EZ-SOD assay kit를 사용하여 SOD activity를 확인하였다. 세포 내 단백질은 protease inhibitor, phosphatase inhibitor를 포함한 RIPA lysis buffer를 사용하여 분리하였다. BCA protein assay를 이용하여 분리한 단백질을 정량하고 단백질 양이 동일하도록 검체를 제작하였다. 검체나 ddH₂O에 WST working solution을 첨가하고 Enzyme working solution을 첨가하지 않거나 첨가한 후 37℃에서 20분간 반응시켰다. 이후 ELISA reader로 450 nm 파장에서 흡광도를 측정하여 세포 내 SOD 활성을 확인하였다.
6. Western blot analysis
세포 내 단백질은 protease inhibitor, phosphatase inhibitor를 포함한 RIPA lysis buffer를 사용하여 분리하였다. BCA protein assay를 이용하여 분리한 단백질을 정량하고 단백질 양이 동일하도록 검체를 제작하였다. 20 ㎍의 단백질을 sodium dodecyl sulfate-polyacrylamide (SDS-PAGE) gel에 분주하고 전기영동시켜 분리하였다. Gel 내부에 크기별로 분리된 단백질은 PVDF membrane에 이동시켰다. 각각의 membrane은 5%의 skim milk 또는 5%의 BSA를 사용하여 2시간 동안 블로킹하였고, 1차 항체는 1㎍/㎖를 1 : 2000으로 희석하여 4℃에서 밤새 반응시켰다. 2차 항체는 1 : 2000으로 희석하여 실온에서 1시간 동안 반응시키고 ECL kit와 image analyzer (EZ-Capture ST, Tokyo, Japan)를 사용하여 단백질 발현량을 확인하였다.
7. Total RNA 분리 및 Real time reverse transcription-polymerase chain reaction (RT-PCR)
세포 내 RNA는 TRIzol reagent (Invitrogen, CA, USA)를 이용하여 분리하였고, 분광광도계(IMPLEN GmbH, Munich, Germany)에서 흡광도를 측정하여 정량하였다. RNA로부터의 cDNA 합성은 1㎍ total RNA와 Prime Script reagent kit을 이용하여 진행하였다. real time RT-PCR은 cDNA, primer sequences (Table Ⅲ), Power SYBR Green PCR master Mix를 이용하여 수행하였다. 발현된 각각 유전자의 mRNA양은 Real-time PCR systems (Applied Biosystems, CA, USA)를 이용하여 GAPDH에 대한 상대적인 양으로 계산하였다.
8. 통계 처리
모든 실험 결과는 평균 ± 표준편차로 표기하였다. 각 군 간의 통계적 유의성 검정에 따른 통계분석은 ANOVA (One-way analysis of variance test) Ducan 사후 검정 비교를 실시하여 p<0.05일 때 유의한 것으로 판정하였다(SPSS v12., SPSS Inc, IL, USA).
결 과
1. 과산화수소 세포 독성에 대한 천마 추출물의 방어 효과
실험에 사용할 천마 추출물의 농도를 확정하기 위하여 100, 200, 500 ㎍/㎖ 천마 추출물을 SH-SY5Y 신경세포에 48시간 동안 처리한 후 세포 독성을 조사한 결과 처리한 모든 농도에서 세포 독성은 발견되지 않았다(Fig. 1A).
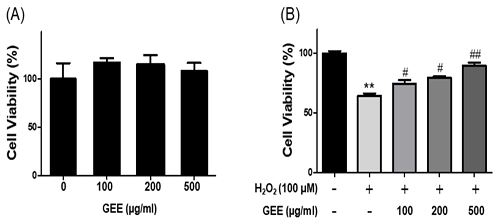
Cytotoxicity test of Gastrodia elata extracts (GEE) in SH-SY5Y cells. (A) Cells were treated with various concentrations of GEE for 24 h. (B) Cells were pretreated with various concentrations of GEE for 24 h, and then exposed to hydrogen peroxide (H2O2) and/or GEE for 24 h. The data are expressed as mean±SD in triplicate. **p<0.01 vs. non-treated group; #p<0.05, ##p<0.01 vs. H2O2 treated group.
과산화수소에 의한 신경세포 독성에 대한 방어 효과를 조사하기 위하여 과산화수소를 시간 동안 처리하기 하루 전에 100, 200, 500 ㎍/㎖ 천마 추출물을 처리한 후 24시간 후에 세포 독성을 조사하였다. 그 결과 100 µM 과산화수소를 처리한 군의 세포 생존율은 64.4 ± 3.2%로 대조군에 비해 유의하게 감소(p<0.01)하였다. 그러나 100, 200, 500 ㎍/㎖ 천마 추출물을 처리한 군의 세포 생존율은 각각 74.2 ± 5.5%, 79.4 ± 2.5%, 89.6 ± 4.1%로 과산화수소 단독 처리군과 비교하여 유의하게 증가하였다(Fig. 1B).
2. SOD 발현 및 활성도에 대한 천마 추출물의 효과
활성산소종을 제거하는 효소로 알려진 superoxide dismutase (SOD)에 대한 천마 추출물의 효과를 조사하기 위하여, 과산화수소를 24시간 동안 처리하기 하루 전에 100, 200, 500 ㎍/㎖ 천마 추출물을 처리한 후 24시간 후에 SOD mRNA, 단백질, 활성도를 조사하였다.
산화적 스트레스 유발인자인 과산화수소 처리군의 SOD1, SOD2 mRNA 발현 정도는 각각 0.57 ± 0.05, 0.53 ± 0.08 배(fold)로 대조군에 비해 유의하게 감소하였으나 천마 추출물을 처리한 군에서는 처리한 농도에 의존적으로 유의하게 증가하였다(Fig. 2A).
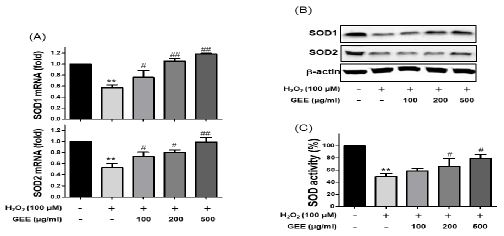
Effects of Gastrodia elata extracts (GEE) on SOD1 and SOD2 mRNA, protein expressions and SOD activity in SH-SY5Y cells. Cells were pretreated with various concentrations of GEE for 24 h, and then exposed to hydrogen peroxide(H2O2) and/or GEE for 24 h. (A) SOD1 and SOD2 mRNA expressions, (B) SOD1 and SOD2 protein expression, (C) SOD activity were analyzed as described in materials and methods. The data are expressed as mean±SD in triplicate. **p<0.01 vs. non-treated group; #p<0.05, ##p<0.01 vs. H2O2 treated group.
또한 100, 200, 500 ㎍/㎖ 천마 추출물을 처리한 군의 SOD1, SOD2 단백질 발현 정도는 mRNA 결과와 유사하게 과산화수소를 처리한 군에 비해 증가하였다(Fig. 2B).
마지막으로 같은 조건에서 SOD 활성도(activity)에 대한 천마 추출물의 효과를 조사하였다. 그 결과 과산화수소를 단독 처리하나 군의 SOD 활성도는 49.00 ± 5.4%로 대조군(100%)에 비해 유의하게(p<0.01) 감소하였으나 천마 추출물을 처리한 군의 SOD 활성도는 처리한 농도에 비례하여 증가하였다. 특히 200, 500 ㎍/㎖ 천마 추출물을 처리한 군의 SOD 활성도는 65.93±12.94, 79.03±6.07%로 과산화수소 단독 처리군과 비교하여 유의하게 증가하였다(Fig. 2C).
3. Catalase 발현에 대한 천마 추출물의 효과
활성산소종을 제거하는 효소로 알려진 catalase에 대한 천마 추출물의 효과를 조사하기 위하여, 과산화수소를 24시간 동안 처리하기 하루 전에 100, 200, 500 ㎍/㎖ 천마 추출물을 처리한 후 24시간 후에 catalase 단백질 발현량을 조사하였다.
산화적 스트레스 유발인자인 과산화수소 처리군의 catalase 단백질 발현 정도는 대조군에 비해 감소하였으나, 100, 200, 500 ㎍/㎖ 천마 추출물을 처리한 군의 catalase 단백질 발현 정도는 과산화수소를 처리한 군에 비해 증가하였다(Fig. 3).
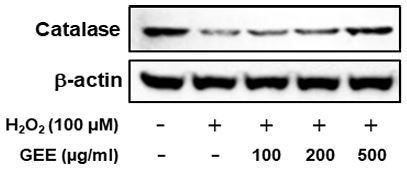
Effects of Gastrodia elata extracts (GEE) on catalase protein expression in SH-SY5Y cells. Cells were pretreated with various concentrations of GEE for 24 h, and then exposed to hydrogen peroxide(H2O2) and/or GEE for 24 h. Catalase protein expressions were analyzed by western blots as described in materials and methods.
4. Eukaryotic translation initiation factor 2α (eIF-2α)와 p38 단백질 발현에 대한 천마 추출물의 효과
소포체 스트레스로 인한 염증 관련 유전자인 eIF-2α의 인산된 단백질과 mitogen activated protein kinase (MAPK) 신호 전달 경로로 인한 염증 관련 유전자인 p38의 인산화된 단백질 발현에 대한 천마 추출물의 효과를 조사하기 위하여, 과산화수소를 12시간 동안 처리하기 전에 100, 200, 500 ㎍/㎖ 천마 추출물을 24시간 동안 전처리한 후 단백질 발현량을 조사하였다.
과산화수소 처리군의 인산화된 p-eIF2α 단백질 발현 정도는 대조군에 비해 증가하였으나, 100, 200, 500 ㎍/㎖ 천마 추출물을 처리한 군의 p-eIF2α 단백질 발현 정도는 과산화수소를 처리한 군에 비해 감소하였다(Fig. 4A).
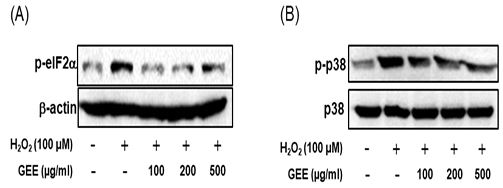
Effects of Gastrodia elata extracts (GEE) on phosphorylated eIF2α and p38 protein expression in SH-SY5Y cells. Cells were pretreated with various concentrations of GEE for 24 h, and then exposed to hydrogen peroxide(H2O2) and/or GEE for 12 h. phosphorylated eIF2α and p38 protein expressions were analyzed by western blots as described in materials and methods.
과산화수소 처리군의 인산화된 p-p38 단백질 발현 정도는 대조군에 비해 증가하였으나, 100, 200, 500 ㎍/㎖ 천마 추출물을 처리한 군의 p-p38 단백질 발현 정도는 과산화수소를 처리한 군에 비해 감소하였다(Fig. 4B).
고 찰
최근 권 등은 천마 추출물이 lipopolysaccharide (LPS)에 의해 유도된 인지기능 손상모델에서 방어 효과가 있음을 보고하였다15). 위 논문15)에서 100, 200, 500mg/kg 천마 추출물을 투여한 쥐는 LPS에 의한 뇌 손상에 대해 방어 효과를 나타냈으며 그 기전에 대뇌 피질의 mitogen-activated protein kinase (MAPK) 발현 억제가 포함되어 있음을 밝혔으며, 이러한 결과는 천마 추출물이 인지기능 손상을 예방하거나 치료할 수 있는 제제 개발의 후보물질이 될 수 있음을 시사한다.
인지기능의 손상은 활성산소에 의한 신경세포의 고사(apoptosis)가 주된 원인으로 알려져 있다. Fig. 1B에서 보여주듯이 산화적 스트레스를 유발하는 과산화수소(hydrogen peroxide, H2O2)를 SH-SY5Y 신경세포에 처리했을 때 세포 생존율이 유의하게 감소하였다. 그러나 천마 추출물을 전처리한 군에서는 과산화수소에 의한 세포 생존율의 감소를 유의하게 억제하였다(Fig. 1B). 이러한 결과는 정 등10)과 윤 등11)이 보고한 결과와 더불어 천마 추출물이 스트레스에 의한 신경세포 생존율의 감소를 방어함을 시사한다.
산화적 스트레스를 유발하는 활성산소(Reactive oxygen species, ROS)는 정상적으로 혹은 비정상적으로 산소를 이용한 대사 과정에서 발생한다. 이러한 ROS는 항산화 기전 즉 vitamin C, 항산화 효소 등에 의해 제거된다. Fig. 2에서 항산화 효소 중 하나인 superoxide dismutase(SOD)에 대한 천마 추출물의 효과를 조사하였다. 최근 보고에 의하면 알츠하이머 질환 혹은 파킨슨 질환에서 세포핵과 세포질에 존재하는 SOD1 (Cu/Zn-SOD)와 미토콘드리아에 존재하는 SOD2가 현저하게 감소된다고 보고되었다16). Fig. 2에서 보여주듯이 산화적 스트레스를 유발하는 과산화수소가 처리된 신경세포는 SOD1과 SOD2의 mRNA (Fig. 2A), 단백질(Fig. 2B), 활성도(activity)가 대조군과 비교하여 유의하게 감소하였다. 그러나 천마 추출물을 전처리한 후 과산화수소와 같이 처리한 군에서 과산화수소에 의한 SOD1과 SOD2의 mRNA, 단백질, 활성도의 감소를 유의하게 억제하였다. 이러한 결과는 Fig 1의 결과에서 과산화수소에 의한 신경세포 독성을 유의하게 방어한 천마 추출물의 효과 기전에 항산화 효소 중 하나인 SOD의 발현 및 활성도 증가가 관여함을 시사한다.
SOD와 더불어 산화적 스트레스로부터 신경세포 손상을 방어하는 효소가 catalase로 알려져 있다17). 활성산소종인 superoxide radical(O2-)는 SOD에 의해 과산화수소로 변환시키는데 관여하며, 이 변환된 과산화수소는 catalase에 제거된다17). Fig. 3에서 천마 추출물을 처리한 군은 과산화수소에 의한 catalase 단백질 발현의 감소를 유의하게 억제하였다. 이러한 결과는 Fig. 2에서 보여준 SOD에 천마 추출물의 효과와 더불어 과산화수소에 의해 유발되는 신경세포 독성에 대한 방어 효과 기전에 항산화 효소 중 하나인 catalase의 발현 증가가 관여함을 나타낸다.
최근 산화적 스트레스에 의한 신경세포 독성을 유발하는데 소포체 스트레스(endoplasmic reticulum stress, ER stress)가 관여한다고 보고되고 있다18,19). 소포체 스트레스에 관여하는 단백질 중의 하나가 protein kinase R-like endoplasmic reticulum kinase (PERK)이다20). 소포체 스트레스에 의한 PERK의 활성화는 변역(translation) 개시단계에서 진핵생물 개시인자인 eukaryotic initiation factor-2 (eIF-2)의 인산화를 유도하여 세포 독성을 유도한다20). Fig. 4A에서 천마 추출물을 처리한 군에서 인산화된 eIF-2α (p-eIF-2α)의 발현을 과산화수소를 처리한 군과 비교하여 유의하게 억제되었다. 이러한 결과는 과산화수소는 PERK 활성화에 의한 eIF-2α의 인산화를 유도하여 신경세포 독성을 유발하였으나 천마 추출물이 이 기전을 억제함으로써 과산화수소에 의한 세포 독성을 방어함을 시사한다.
산화적 스트레스에 의해 활성화되어 신경세포 독성을 유발하는 기전 중 하나가 mitogen activated protein kinase(MAPK)이다. 정 등21)과 Pan 등22)의 보고에 의한 신경세포에 과산화수소를 처리하면 MAPK를 구성하는 단백질 중 JNK와 p38의 인산화(phosphorylation)를 통한 활성화가 유발되어 독성을 유발하였다. 본 연구에서 SH-SY5Y 신경세포에 과산화수소를 처리한 군에서 p38의 인산화를 유도하였으나 천마 추출물을 처리한 군에서는 과산화수소에 의한 p38의 인산화를 농도 의존적으로 억제하였다(Fig. 4B). 그러나 천마 추출물이 다른 MAPK pathway 구성 요소인 ERK와 JNK의 인산화 억제 효과는 나타나지 않았다(data not shown). 이는 천마 추출물의 산화적 스트레스에 의한 신경세포 독성 방어 효과 기전에 MAPK pathway 중 p38의 활성화 억제가 관여함을 나타낸다.
종합해보면, 천마 추출물은 산화적 스트레스에 의한 신경세포 독성을 억제하며, 그 기전에 항산화 효소 발현 증가, 소포체 스트레스에 의한 번역 억제 방지, MAPK 활성화 억제가 관여함을 시사한다.
결 론
본 연구는 천마 추출물의 과산화수소에 의한 신경세포 독성 방어 효과 및 기전을 연구하여 아래와 같은 결론을 얻었다.
천마 추출물은 과산화수소에 의한 신경세포 생존율의 감소를 유의하게 억제하였다.
천마 추출물은 과산화수소에 의한 항산화 효소 발현의 감소를 유의하게 억제하였다.
천마 추출물은 과산화수소에 의한 신경세포 독성 방어 기전에 eIF-2α와 p38의 인산화 억제가 관여하였다.
이상의 결과는 천마 추출물의 산화적 스트레스에 의한 신경세포 독성을 억제하였으며 향후 퇴행성 뇌병변에 대한 예방제 혹은 치료제 개발의 후보물질이 될 수 있음을 시사한다.
Acknowledgments
본 연구는 2022년도 원광대학교 교비 지원에 의해 수행됨.
References
- Kim HB. Current Status and Implications of disease studies related to aging. Seoul: Korea Institute of Science & Technology Evaluation and Planning; 2012.
-
Budzynska B, Boguszewska-Czubara A, Kruk-Slomka M, Skalicka-Wozniak K, Michalak A, Musik I, Biala G. Effects of imperatorin on scopolamine-induced cognitive impairment and oxidative stress in mice. Psychopharmacology. 2015;232(5):931-42.
[https://doi.org/10.1007/s00213-014-3728-6]

-
Murakami S, Miyazaki I, Sogawa N, Miyoshi K, Asanuma M. Neuroprotective effects of metallothionein against rotenone-induced myenteric neurodegeneration in parkinsonian mice. Neurotox Res. 2014; 26(3):285-98.
[https://doi.org/10.1007/s12640-014-9480-1]

-
Stadtman ER, Berlett BS. Reactive oxygen-mediated protein oxidation in aging and disease. Chem Res Toxicol. 1997;10(5):485-94.
[https://doi.org/10.1021/tx960133r]

- Kim SH, Choi HJ, Oh HT, Chung MJ, Cui CB, Ham SS. Cytoprotective effect by antioxidant activity of codonopsis lanceolata and platycodon grandiflorum ethyl acetate fraction in human HepG2 cells. Korean J Food Sci Technol. 2008;40(6):696-701.
-
You SH, Jang M, Kim GH. Antioxidant Activity and Neuroprotective Effect of Root Bark of Morus alba L. Extract against Hydrogen Peroxide-Induced Cytotoxicity in PC12 Cells. Korean J Food Sci. 2018;47(5):519-27.
[https://doi.org/10.3746/jjkfn.2018.47.5.519]

-
Kim KB, Lee S, Heo JH, Kim JH. Neuroprotective effects of Momordica charantia extract against hydrogen peroxide-induced cytotoxicity in human neuroblastoma SK-N-MC cells. J Nutr Health. 2017;50(5):415-25.
[https://doi.org/10.4163/jnh.2017.50.5.415]

- Lee SI, Choi CH, Kim JS, Lim SS, Jung HW. Activities and Neuroprotective Effects of Hot Water Extracts from Torreyae Semen. Korean J Herbology. 2017;32(6):41-8.
-
Taguchi H, Yosioka I, Yamasaki K, Kim I. Studies on the constituents of Gastrodia elata BLUME. Chem Pharm Bull. 1981;29:55-62.
[https://doi.org/10.1248/cpb.29.55]

- Jung YS, Kang JH, Prak SH, Kwon YM, Kim GW, Ko BS. Protective Effect of Gastrodia Elata on Neuronal Cell Damage in Alzheimer’s Disease. J Orient Neuropsychiatry. 2010;21(2):125-40.
- Youn YS, Lee JS. Effect of Gastrodiae Rhizoma on Apoptosis in Cerebral Infarction Induced by Middle Cerebral Artery Occlusion in Rats. J Korean Med Rehabil. 2009;19(3):1-13.
-
Kim WC, Jeong JK, Kim JS, Kim KO. The Verify of Memory Improvement by Gastrodia Elata Blume. J Orient Neuropsychiatry. 2013:24(1):27-44.
[https://doi.org/10.7231/jon.2013.24.1.027]

-
Kim HN, Kim JE, Jeong JK, Kim JS, Kim KO. The Verify of Memory Improvement by Gastrodia Elata Blume Depends on the Amount. J Orient Neuropsychiatry. 2014;25(3):243-52.
[https://doi.org/10.7231/jon.2014.25.3.243]

- Alzheimer’s Association. 2012 Alzheimer’s disease facts and figures. Alzheimer’s & Dementia. 2012;8(2):131-68.
- Kwon KB, Kim HR, Kim YS, Park EH, Kang HW, Ryu DG. Protective Effect of Gatrodiae Rhizoma Extracts on the LPS-Induced Cognitive Impairment Model. J of Orient Neuropsychiatry. 2022;33(3):277-85.
-
Anantharaman M, Tangpong J, Keller JN, Murphy MP, Markesbery WR, Kiningham KK, St Clair EK. Beta-amyloid mediated nitration of manganese superoxide dismutase: implication for oxidative stress in a APPNLH/NLH X PS-1P264L/P264L double knock-in mouse model of Alzheimer's disease. Am J Pathol. 2006;168:1608-718.
[https://doi.org/10.2353/ajpath.2006.051223]

-
An H, Ling C, Xu M, Hu M, Wang H, Liu J, Song G, Liu J. Oxidative damage induced by nano-titanium dioxide in rats and mice: A systematic review and meta-analysis. Biol Trace Elem Res. 2020;194(1):184-202.
[https://doi.org/10.1007/s12011-019-01761-z]

-
Kim SH, Kon HJ, Koh HS, Song SH, Kwon K, Kon OY, Choi SW. Endoplasmic Reticulum Stress Response and Apoptosis via the CoCl2-Induced Hypoxia in Neuronal Cells. J Life Sci. 2010;20(12):1820-28.
[https://doi.org/10.5352/JLS.2010.20.12.1820]

-
Henshall DC. Apoptosis signalling pathways in seizure-induced neuronal death and epilepsy. Biochem Soc Trans. 2007;(35):421-3.
[https://doi.org/10.1042/BST0350421]

-
Liu Z, Lv Y, Zhao N, Guan G, Wang J. Protein kinase R-like ER kinase and its role in endoplasmic reticulum stress-decided cell fate. Cell Death Dis. 2015;(6):e1822.
[https://doi.org/10.1038/cddis.2015.183]

-
Chung MJ, Lee S, Park YI, Lee J, Kwon KH. Neuroprotective effects of phytosterols and flavonoids from Cirsium setidens and Aster scaber in human brain neuroblastoma SK-N-SH cells. Life Sci. 2016;148:173-82.
[https://doi.org/10.1016/j.lfs.2016.02.035]

-
Pan J, Chang Q, Wang X, Son Y, Zhang Z, Chen G, Luo J, Bi Y, Chen F, Shi X. Reactive oxygen species-activated Akt/ASK1/p38 signaling pathway in nickel compound-induced apoptosis in BEAS 2B cells. Chem Res Toxicol. 2010;23(3):568-77.
[https://doi.org/10.1021/tx9003193]

