
Streptozotocin 유도 당뇨병 생쥐 모델에서 지각 추출물의 항당뇨 효과
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
The aim of this study is to evaluate the antidiabetic effect of the water extract of Aurantii fructus immaturus (WAF), in diabetic models using enzyme, cells and mice, and to suggest a putative mechanism explaining its antidiabetic effect. In an enzyme model using the enzyme α-glucosidase, WAF had no significant effect on α-glucosidase, as compared with acarbose, an antidiabetic drug. Nonetheless, WAF was capable of reducing the blood glucose levels during oral sucrose tolerance test and oral glucose tolerance test, implying that there would be other antidiabetic pathways in no relation to inhibition of α-glucosidase. In cell models using RIN-m5f β-cells and L6 myotubes, WAF, at its non-cytotoxic doses, augmented the secretion of insulin in RIN-m5f β-cells stimulated with 5 mM glucose. In addition, it enhanced the cellular uptake of glucose in L6 myotubes stimulated with deprivation of glucose for 12 h. Therefore, it is most likely that WAF may exert its antidiabetic effects, at least in part, by enhancing insulin secretion and glucose uptake. Meanwhile, in diabetic mice induced with peritoneal injection of streptozotocin (STZ), WAF significantly improved fast blood glucose levels, glycosylated hemoglobin levels, body weight loose, blood pressure, and diabetic adverse effects on functions of the kidney and the liver. Taken together, the water extract of Aurantii fructus immaturus may ameliorate diabetes in mice injected with STZ, at least in part, by enhancing insulin secretion and glucose uptake.
Keywords:
Aurantii fructus immaturus, Diabetic complications, Diabetes mellitus, Antidiabetic effect, Insulin, Glycosylated hemoglobin서 론
당뇨병(diabetes mellitus)은 인슐린 분비 장애(insulin secretion disorder) 또는 인슐린 저항성(insulin resistance) 등에 의해서 혈당(blood glucose)이 오랫동안 높게 나타나는 고혈당증(hyperglycemia)을 말한다.1) 이러한 당뇨병은 발병 원인에 따라서 제1형 당뇨병과 제2형 당뇨병으로 구분할 수 있으며, 제1형 당뇨병은 심각한 인슐린 분비 장애가 주요 발병 원인이고, 제2형 당뇨병은 인슐린 저항성이 주요 발병 원인이다.2) 인슐린 분비 장애는 인슐린을 분비하는 β-세포(β-cell)가 어떤 원인에 의해 감소하거나 β-세포의 인슐린 분비가 감소하여 체내 인슐린이 절대적으로 부족한 상태를 말하며, 인슐린 저항성은 인슐린 수용체를 가진 세포가 인슐린에 대해 반응하지 않거나 반응 정도가 낮은 상태를 말한다.3) 인슐린 분비 장애에 의해 나타나는 제1형 당뇨병은 주로 소아에서 발병되는 특징이 있는 반면, 인슐린 저항성에 의해 나타나는 제2형 당뇨병은 주로 성인에서 발병되는 특징이 있다.4) 제1형 당뇨병에서는 인슐린을 체내로 공급하는 것이 유일한 치료법이고, 제2형 당뇨병에서는 탄수화물 섭취를 제한하여 포도당의 체내 흡수를 조절하거나, 적절한 운동을 통해 체내 포도당 소비를 증가시키거나, 적절한 약물을 사용하여 포도당의 흡수와 소비를 조절하는 다양한 치료법이 있을 수 있다.5,6) 제2형 당뇨병 치료에 자주 사용되는 약물에는 탄수화물의 소화를 방해하여 포도당 체내 흡수를 억제하는 acarbose 계열의 약물이 있고, β-세포에 작용하여 인슐린 분비를 증가시키는 glimepiride 계열의 약물, 세포의 포도당 흡수를 증가시켜 혈당을 감소시키는 metformin 계열의 약물 등이 있다.7-9) 그러나 이러한 약물들을 장기간 사용할 경우, 저혈당, 유산혈증, 간 기능 장애, 신장 기능 장애 등과 같은 여러 가지 부작용이 발생할 수 있다.9) 따라서 부작용이 적고 장기간 사용할 수 있는 새로운 제2형 당뇨병 치료제의 개발이 필요하다. 최근, 부작용이 비교적 적고 항당뇨 효과가 검증된 천연물을 이용하여 새로운 당뇨병 치료제를 개발하려는 다양한 연구가 활발히 진행되고 있다.10)
한의학에서 당뇨병을 消渴의 범주로 보고, 병증은 “消穀善飢, 渴而多飮” 등으로 보고, 병인은 “肝火熾盛, 腎水不足, 脾胃積熱, 心火偏盛, 飮食失節, 心志失常” 등으로 보고, 변증에 따라 “淸熱, 生津, 止渴, 滋陰” 등의 治法이 활용된다.11-14)
枳殼(Aurantii Fructus)은 芸香科(Rutaceae)에 속하는 탱자나무(Citrus aurantium L.)의 성숙한 과실을 건조한 것으로, 특이한 향이 있고 맛은 달고 약간 시다.15) 이 약재는 破氣, 消積, 行痰 등의 효능이 있어, 嘔逆, 嘔吐, 食積, 子宮脫垂, 脫肛, 下痢後重, 脇脹, 胸膈痰滯, 胸痺, 噫氣 등의 병증 치료에 활용되었다.15) 枳殼은 다량의 hesperidin을 유효성분으로써 함유하고, 소량의 flavonoid, terpenoid 등을 함유하고 있다.16) Hesperidin은 인슐린 저항성 개선, 탄수화물 소화 효소의 활성 조절, β-세포의 인슐린 분비 기능 개선과 같은 항당뇨(antidiabetic) 효과를 나타내는 천연물 소재로 알려져 있다.17-20) 한 등은 국내에서 시판되는 57종의 枳殼 건조물 중량(g) 중의 hesperidin의 함량(mg)을 백분율(%) 값으로 조사하여, 枳殼에는 hesperidin이 평균 2.13 ± 1.16% (n=57) 함유되어있다고 보고하였다.16) 이런 점을 고려하여, 박 등은 당뇨병 흰쥐에서 桑葉과 枳殼 혼합물의 항당뇨 효능을 조사하여 枳殼의 항당뇨 효과를 보였다.21) 그러나 이들의 연구는 枳殼의 가능한 항당뇨 효과를 기술했으나 항당뇨 기전을 명확하게 제시하지 못했다.
본 연구는 효소, 세포 및 실험동물 수준에서 枳殼 수용성 추출물(Water extract of Aurantii Fructus; WAF)의 항당뇨 효능을 평가하여 枳殼의 항당뇨 기전을 제시하고자 하였으며, 이에 유의한 연구결과를 얻었기에 이를 보고하는 바이다.
재료 및 방법
1. 재료 및 시약
본 실험에 사용된 건조 枳殼은 옴니허브(Korea)에서 구입하였고, 표본시료(JP-2019-09-03-1)는 원광대학교 대사성질환연구소에 보관하였다. streptozotocin(STZ), glucose, α-glucosidase, trypsin-EDTA, tetrazolium bromide salt (MTT), RPMI 1640, phosphate-buffered saline (PBS), dimethylsulfoxide (DMSO), Dulbecco's modification Eagle medium (DMEM), penicillin, streptomycin, acarbose, metformin, nicotinamide, 인슐린은 Sigma-Aldrich 사(USA)에서 구입하였고, horse serum과 fetal bovine serum(FBS)은 Hyclone 사(USA)에서 구입하였다. 2-(N-[7-nitrobenz-2-oxa-1,3-diazol-4-yl]amino)-2-deoxyglucose (2-NBDG)는 Invitrogen 사(USA)에서 구입하였다. 기타 시약은 분석등급으로 Sigma-Aldrich 사 및 Merck 사(Germany)에서 구입하여 사용하였다.
2. 실험방법
본 실험에 사용된 枳殼는 분쇄하여 분말로 만든 다음 분말(50 g) 부피의 10배에 해당하는 증류수를 첨가하여, 100℃(± 3℃)에서 2시간 동안 환류 냉각 추출하였다. 추출액은 정성필터(Advantech, Japan)로 흡입 여과한 다음 감압농축기(rotary evaporator, Eyela, Japan)를 사용하여 농축하였다. 농축액은 초저온 동결건조기(ultra-low temperature freezer, NuAire, USA)를 사용하여 건조하여 건조물(열수 추출물) 5.69 g (11.38%)을 수득하였다. 추출물은 냉동(-70℃) 보관하고 실험목적에 적합한 농도로 희석하여 사용하였다.
탄수화물을 분해하여 포도당을 생성하는 α-glucosidase 효소와 p-nitrophenyl-α-D-glucopyranoside (pNPG) 효소기질을 이용하여 시료의 활성 억제효율을 측정하여 항당뇨 효능을 평가하였다.22) 효소기질인 pNPG (2.5 mM)와 α-glucosidase (0.2 unit/mL)가 혼합된 인산염 완충용액(0.1 M, pH 6.8) 100 μL에 여러 농도의 시료(50 μL)를 첨가하여 반응용액을 만들었다. 이 반응용액을 37℃에서 20분간 방치하여 효소반응을 유도하였다. 이어서 1 mM 농도의 NaOH 용액 100 μL을 첨가하여 생성물의 발색반응을 유도하고, 405 nm 파장에서 시료가 첨가된 반응용액의 광학밀도(ODS), 기질과 효소를 첨가하지 않은 반응용액의 광학밀도(ODB) 및 시료를 첨가하지 않은 반응용액의 광학밀도(ODC)를 각각 측정하였다. 효소 억제효율은 다음 식으로 계산하였다.
RIN-m5f β-세포와 L6 근세포는 ATCC 사(USA)와 한국세포주은행(Korea)에서 각각 분양받아 실험목적에 부합하도록 배양하여 실험에 사용하였다. RIN-m5f β-세포와 L6 근세포는 열처리에 의해 비활성화된 10% FBS와 1% 항생제혼합액(streptomycin과 penicillin을 같은 양의 비율로 혼합)을 첨가한 DMEM 배지와 RPMI 1640 배지에서 각각 배양하였다. 모든 세포는 5% CO2/95% 공기, 37℃, 일정한 습도가 유지된 세포전용 배양기에서 배양하였다.
MTT 측정법을 이용하여 세포생존율을 측정한 다음 세포생존율 대비 세포독성을 평가하였다. 48-well plate(Corning, USA)에 RIN-m5f 세포 또는 분화된 L6 세포를 5 × 105 cells/well 수로 각 well에 분주하고 6시간 배양하여 세포를 안정화시킨 다음 배양배지를 새로운 배양배지로 교환하였다. 이어서 여러 농도의 시료를 각 well에 처리한 다음 24시간 배양하였다. 배양이 끝난 각 well에 5 mg/mL MTT 시약 20 μL을 첨가하고 1시간 동안 배양하여, 살아있는 세포에서 MTT 환원에 의한 formazan 생성을 유도하였다. 각 well에 생성된 formazan은 DMSO를 첨가하여 용해시킴으로써 자색의 변화를 유도하였다. 용해액을 96-well plate(Corning, USA)에 일정량으로 분주하고, microplate reader를 사용하여 540 nm 파장에서 흡광도 값을 측정하여 formazan의 농도를 결정하였다.
인슐린에 대해 선택적으로 결합하는 1차 항체와 인슐린에 결합하고 특정 기질을 관측 가능한 생성물로 전환하는 효소가 부착된 2차 항체를 이용하여 세포배양 배지 및 혈액 내의 인슐린양을 측정하였다. 실험방법을 간단히 기술하면, RIN-m5F 베타-세포를 5.0 × 105 cells/well 농도로 6-well plate에 분주한 다음 여러 농도의 시료를 각각의 well에 처리하여 12시간 배양하였다. 이어서, 베타-세포의 인슐린 분비를 유도하기 위해 15 mM 포도당을 3시간 동안 자극하였다. 자극이 끝난 다음 각각의 well에서 배양액을 회수하여 –20℃의 저온 냉동고에 보관하였다. 냉동 보관된 배양액과 혈청에서 인슐린은 해동 과정을 수행한 다음 인슐린 enzyme-linked immunosorbent assay (ELISA) kit (R&D System, USA)을 사용하여 측정하였다. 인슐린 측정 실험은 ELISA kit 공급자가 제공하는 실험 protocol을 참조하여 실험을 수행하였다. 측정 실험이 끝난 ELISA plate는 microplate reader (Molecular Devices)를 이용하여 450 ㎚ 파장에서 각 well의 흡광도를 측정하였다. 최종적으로, ELISA kit 공급자가 제공한 표준용액의 흡광도과 비교하여 배양액 또는 혈청의 인슐린 농도를 결정하였다.
이 실험에서는 먼저 미분화된 L6 myoblast 세포를 혈청결핍(serum starvation) 방법으로 L6 myotube 세포로 분화시킨 다음 이렇게 분화된 세포에서 포도당 흡수력(glucose uptake) 실험을 수행하였다. 세포분화는 먼저 6-well plate에 미분화 L6 myoblast 세포를 2 × 105 cells/well 농도로 분주하고 10% FBS 혈청이 포함된 배지에서 3일간 배양하였다. 이어서 2% horse serum이 포함된 배지로 교환하여 세포분화를 유도하였다. 2일간 배양 후에 다시 2% horse serum을 포함한 새로운 배지로 교환하고 광학 현미경을 사용하여 세포분화 과정을 매일 관찰하였다. 분화된 세포는 둥근 형태의 미분화 세포와 다르게 튜브 형태를 나타내기 때문에 현미경에서 구별할 수 있었다. 본 실험에서는 혈청고갈 7-8일 후에 80-90% 이상의 세포가 myotube 세포로 분화된 것을 확인할 수 있었다. 이렇게 분화된 세포를 실험목적에 맞게 사용하였다.
2-NBDG는 포도당에 형광표지가 결합된 물질로 포도당을 세포내부로 흡수하는 통로(transporter)를 통과할 수 있다. 세포내부로 흡수된 2-NBDG는 인산화 효소에 의해 2-NBDG-6-phosphate로 전환된다. 2-NBDG-6-phosphate는 세포외부로 빠져나갈 수 없고 쉽게 분해되지 않는다. 따라서 세포내부에 흡수된 2-NBDG-6-phosphate 농도를 형광분광기로 측정할 수 있다. 실험방법을 간단히 기술하면, 분화된 세포를 1 × 106 cells/well 농도로 96-blackwell plate에 분주하여 12시간 동안 배양하였다. 이어서 포도당이 첨가되지 않은 새로운 배지로 교환한 다음 12시간 포도당 결핍을 유도하였다. 인슐린 또는 여러 농도의 시료를 처리한 다음 100 μg/mL 농도의 2-NBDG을 처리하여 12시간 포도당 흡수를 유도하였다. 각 well을 PBS로 2회 세척하여 흡수되지 않은 2-NBDG를 제거한 다음 형광 microplate reader를 사용하여 각 well의 형광세기를 측정하였다. 이때 형광 microplate reader의 여기(excitation) 파장은 480 nm로 그리고 발광(emission) 파장은 535 nm로 조정하였다.
본 연구에 사용된 실험동물은 C57BL/6 계열의 4주령 수컷 마우스로 평균무게가 20.30 ± 1.05 g이며 샘타코(Korea)에서 구입하였다. 모든 실험동물은 1주일간의 안정화 과정을 거친 후에 당뇨병 실험에 사용하였다. 실험동물 사육실의 실내온도 및 실내습도는 23 ± 2℃ 및 50∼60%로 유지하였고, 사육실의 명암은 12시간 간격으로 조절하였다. 실험을 진행하기 전에 원광대학교 동물실험윤리위원회의 승인을 받아, 모든 동물실험을 수행하였다(승인번호: WKU20-96).
WAF의 항당뇨 효과를 당뇨병 실험동물에서 조사하기 위해 실험동물을 다음과 같이 4개의 군으로 구분하였다. 당뇨병을 유발하지 않은 정상군(normal), 당뇨병을 유발한 대조군(control), 당뇨병을 유발하고 WAF 200 mg/kg 또는 WAF 400 mg/kg를 투여한 두 실험군으로 구분하고, 각 군에 6마리 실험동물을 배정하였다.
2-Deoxy-D-glucose와 1-methyl-1-nitrosourea가 결합된 STZ는 포도당(D-glucose)과 유사한 분자구조를 가지고 있다. 이러한 분자구조의 유사성 때문에 STZ는 설치류 실험동물의 췌장(pancreas)에 존재하는 β-세포에 대해 선택적인 독성을 유발한다. 종합적으로 STZ는 β-세포의 인슐린 생성과 분비에 부정적인 영향을 미친다. 따라서 STZ는 노출량에 따라 실험동물에서 제1형 또는 제2형-유사(type II-like) 당뇨병을 유발한다.22) 본 연구에서는 낮은 농도의 STZ와 nicotinamide를 사용하여 실험동물에서 제2형-유사 당뇨병을 유발하였다. 포도당의 간섭을 피하기위해 실험동물을 16시간 절식시킨 다음 100 mg/kg nicotinamide를 0.9% NaCl 용액에 용해하여 복강에 1회 주사하고 15분 후에, 120 mg/kg STZ을 citrate 완충용액(100 mM, pH 4.5)에 용해하여 복강에 1회 주사하였다. 2주 후에 당뇨병 상태를 확인하기 위해 실험동물을 16시간 절식시킨 다음 실험동물의 꼬리 정맥에서 소량의 혈액을 채취하여 혈당 측정기(Roche 사, Germany)로 공복혈당을 측정하였다. 측정된 공복혈당이 200 mg/dL 이상인 경우, 당뇨병이 유발된 실험동물로 판정하고 선별하여 다음 실험에 사용하였다.
본 연구에서 경구 자당 내성 검사(oral sucrose tolerance test; OSTT)와 경구 포도당 내성 검사(oral glucose tolerance test; OGTT)는 당뇨병을 유발하지 않은 정상(normal) 실험동물에서 수행되었다. 실험동물의 군 분류는 다음과 같다. OSTT 실험에서는 자당을 투여한 대조군, 자당과 양성 대조약물을 투여한 양성 대조군, 자당과 WAF 100 mg/kg, WAF 200 mg/kg 또는 WAF 400 mg/kg를 투여한 3개 실험군으로 구분하고 각 군에 6마리 실험동물을 배정하였다. 한편, OGTT 실험에서는 포도당을 투여한 대조군(n=6), 포도당과 양성 대조약물을 투여한 양성 대조군(n=6), 포도당과 WAF 100 mg/kg, WAF 200 mg/kg 또는 WAF 400 mg/kg를 투여한 3개 실험군(n=6)로 구분하였다. 16시간 절식시킨 실험동물에 여러 농도의 시료 또는 양성대조 약물을 경구로 투여하고 1 g/kg 농도의 자당 용액(OSTT의 경우) 또는 포도당 용액(OGTT의 경우)을 경구로 투여하였다. 이어서, 30분 간격으로 실험동물의 꼬리에서 소량의 혈액을 채취하여 혈당 변화를 관찰하였다.
실험 마지막 날에 모든 실험동물을 diethyl ether를 사용하여 마취시켰다. 혈액 응고를 방지하는 EDTA가 코딩된 주사기와 혈액채취 용기를 사용하여 마취된 실험동물의 심장에서 혈액을 채취하였다. 채취한 혈액은 1시간 상온에서 안정화시키고, 20,000 rpm에서 20분간 원심분리하여 상층액 혈청을 얻었다. 모든 혈청은 혈청분석 실험에 사용할 때까지 –70℃ 초저온냉동고에 보관하였다.
실험에 참여한 모두 실험동물은 diethyl ether 마취상태에서 희생되었다. 희생된 모든 실험동물에서 신장과 간장을 세밀하게 적출하였다. 적출된 신장과 간장은 생리식염수로 1회 세척하고 여과지로 수분을 제거한 다음 디지털 저울을 사용하여 각 장기의 무게를 정밀하게 측정하였다. 또한, 디지털 사진기를 이용하여 장기의 외형을 일정한 높이에서 촬영하였다.
실험동물의 간 기능을 평가하기 위해, 분리된 혈청에서 간 기능 지표로 활용되는 glutamic pyruvic transaminase (GPT)와 glutamic oxaloacetic transaminase (GOT)의 활성을 측정하였다. GPT와 GOT 측정은 해당 ELISA kit (Asan Chemical, Korea)를 사용하였고 해당 kit 공급자가 제공한 측정 protocol에 따라 실험을 실시하였다.
실험 마지막 날에 모든 실험동물을 diethyl ether를 사용하여 마취시켰다. 혈액 응고를 방지하는 EDTA가 코딩된 주사기와 혈액채취 용기를 사용하여 마취된 실험동물의 심장에서 혈액을 채취하였다. 채취한 혈액에서 당화혈색소(hemoglobin A1c; HbA1c)를 측정하였다. 당화혈색소 측정은 HbA1c ELISA kit (MyBioSource, USA)를 사용하였고 해당 kit 공급자가 제공하는 측정 protocol에 따라 실험을 실시하였다.
실험동물의 신장 기능을 평가하기 위해, 분리된 혈청에서 신장 기능 지표로 활용되는 BUN과 creatinine을 측정하였다. BUN과 creatinine 측정은 해당 ELISA kit (Asan Chemical, Korea)를 사용하였고 해당 kit 공급자가 제공한 측정 protocol에 따라 실험을 실시하였다.
실험동물의 체중은 매주 일정 시간에 디지털 저울을 사용하여 정밀하게 측정하였다. 한편, 실험동물의 수축기 혈압과 이완기 혈압은 매주 일정 시간에 tail-cuff system (Kent Scientific, USA)을 사용하여 의식이 있는 상태에서 측정하였다.
모든 실험의 측정값은 평균 ± 표준편차(standard deviation; SD)로 표시하였다. 모든 통계처리는 Prism 소프트웨어(GraphPad Software, USA)를 사용하였다. 그룹 간의 차이는 Student’s t test를 실시하여 확인하였다. P 값이 0.05보다 작을 경우 통계적으로 유의한 것으로 판정하였다.
결 과
1. α-Glucosidase 효소활성 억제 효과
소장의 α-glucosidase 소화효소가 탄수화물을 포도당으로 최종 분해하고, 이어서 포도당이 체내로 흡수되어 혈당을 빠르게 상승시킨다.23) WAF가 α-glucosidase 효소활성을 억제할 수 있는지 조사하였다. 이 실험에서 당뇨병 치료에 이용되는 acarbose를 양성 대조군(positive control) 약물로 사용하였다. Acarbose는 α-glucosidase 효소활성을 농도 의존적으로 억제하였으며 높은 농도에서 90% 이상의 억제 비율을 관찰할 수 있었다. 반면, WAF는 α-glucosidase 억제 경향성을 보였으나, 높은 농도에서 20% 이하의 효소활성 억제 비율을 보였다(Fig. 1). WAF와 acarbose의 관찰 결과를 비교해보면, WAF의 α-glucosidase 효소활성 억제 효과는 크지 않은 것으로 판단된다.
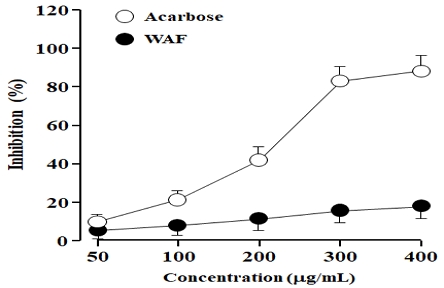
Effect of WAF on α-glucosidase activity. The antidiabetic drug acarbose was served as a positive control. Inhibitory activity of α-glucosidase was assayed by measuring the release of the product p-nitrophenol from the substrate p-nitrophenyl-α-D-glucopyranoside, as described in the section of Materials and Methods. Each point presents the mean ± SD of three independent experiments; ○ for acarbose and ● for WAF.
2. 정상 실험동물에서 OSTT 및 OGTT
자당(sucrose)은 포도당(glucose)과 과당(fructose)이 축합된 이당류(disaccharide)이며 소장의 α-glucosidase에 의해 체내 흡수가 가능한 포도당과 과당으로 분해됨으로써 혈당을 상승시킨다. 정상 실험동물에서 OSTT와 OGTT 실험을 수행하여, WAF가 α-glucosidase 효소활성 억제와 무관한 다른 경로를 통해 항당뇨 효과를 나타낼 수 있는지 조사하였다. 정상 실험동물에 WAF를 구강으로 투여한 다음 일정량의 자당 또는 포도당을 구강으로 투여하고 일정 시간의 간격으로 혈당의 변화를 측정하였다. 자당의 구강 투여에 대해 혈당의 변화를 측정하는 OSTT 실험에서, WAF (200 mg/kg, 400 mg/kg) 및 양성대조군 acarbose (300 mg/kg) 처리에 의해 혈당이 유의하게 감소하였다(Fig. 2). 그러나 100 mg/kg WAF 처리에서는 유의한 혈당 변화를 관찰할 수 없었다. 한편, 포도당의 구강 투여에 대해 혈당의 변화를 측정하는 OGTT 실험에서도, WAF 및 양성대조군 metformin 처리에 의해 혈당이 유의하게 감소하였다(Fig. 3).
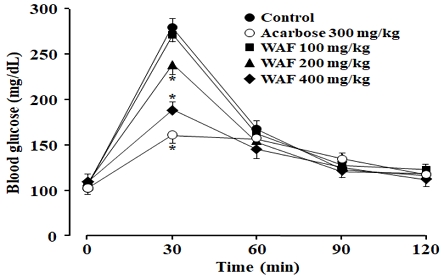
Effect of WAF on blood glucose levels in normal mice during OSTT. Acarbose was served as a positive control drug. Levels of blood glucose at indicated times were measured after oral treatment with WAF followed by oral treatment with sucrose (2 g/kg). OSTT was carried out as detailed in the section of Materials and Methods. Each value represents the mean ± SD (n = 6). *p < 0.05 compared with control group at the corresponding time; ● for control, ○ for 300 mg/kg acarbose, ■ for 100 mg/kg WAF, ▲ for 200 mg/kg WAF, ◆ for 400 mg/kg.
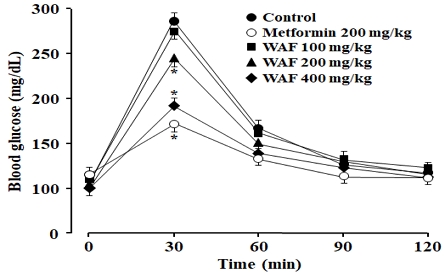
Effect of WAF on blood glucose levels in normal mice during OGTT. Metformin was served as a positive control drug. Levels of blood glucose at indicated times were measured after oral treatment with WAF followed by oral treatment with glucose (2 g/kg). OGTT was carried out as detailed in the section of Materials and Methods. Each value represents the mean ± SD (n = 6). *p < 0.05 compared with control group at the corresponding time; ● for control, ○ for 300 mg/kg acarbose, ■ for 100 mg/kg WAF, ▲ for 200 mg/kg WAF, ◆ for 400 mg/kg.
3. β-세포에서 인슐린 분비
높은 혈당에 반응하여 인슐린을 분비하는 β-세포에서 WAF의 세포독성을 조사하기 위해, RIN-m5F β-세포에 WAF를 100, 200, 400 μg/mL 농도로 24시간 처리한 다음 MTT 방법으로 세포생존율을 측정하여 세포독성을 간접적으로 산출하였다. WAF를 처리하지 않은 대조군과 WAF를 농도별로 처리한 실험군 사이의 세포생존율에는 유의적인 차이가 없었다(Fig. 4). 본 연구는 세포독성이 관찰되지 않는 WAF의 농도에서 WAF 처리가 β-세포의 인슐린 분비에 어떤 영향을 미치는지 조사하였다. RIN-m5F β-세포에 WAF를 100, 200, 400 μg/mL 농도로 12시간 동안 처리한 다음 고농도의 포도당(15 mM)으로 3시간 동안 자극하여 인슐린 분비를 유도하였다. 이와 같은 세포 수준의 실험에서 분비된 인슐린의 농도는 ELISA 측정 방법을 이용하여 결정하였다. 고농도 포도당 자극에 의한 다량의 인슐린 분비를 관찰할 수 있었다(Fig. 5). 100 μg/mL 농도의 WAF를 처리할 경우 인슐린 분비에 유의한 영향을 관찰할 수 없었으나, 200, 400 μg/mL 농도의 WAF를 처리할 경우 인슐린 분비가 유의하게 증가된 것을 관찰할 수 있었다(Fig. 5).
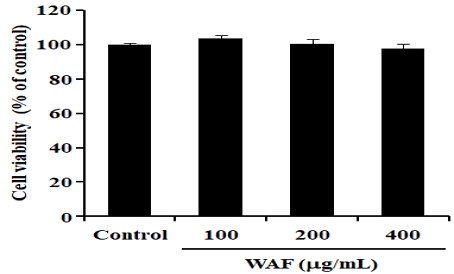
Effect of WAF on cell viability in RIN-m5F β-cells. Cells were exposed for 24 h to indicated concentrations of WAF. Cell viability was measured by MTT assay as detailed in the section of Materials and Methods. Each bar represents the mean ± SD (n = 6).
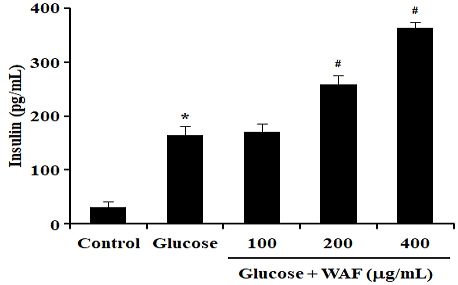
Effect of WAF on insulin secretion in RIN-m5F β-cells. Cells were exposed for 12 h with indicated doses of WAF, and then stimulated for 3 h with 15 mM glucose. Concentrations of insulin were determined by ELISA, as detailed in the section of Materials and Methods. Each bar represents the mean ± SD (n = 6). *p < 0.05 compared with the control, #p < 0.05 compared with the glucose alone.
4. 근세포에서 포도당 세포내 흡수
근세포에서 WAF의 세포독성을 조사하기 위하여, 분화된 L6 myotube에 WAF를 100, 200, 400 μg/mL 농도로 24시간 처리한 다음 MTT 방법으로 세포생존율을 측정하여 세포독성을 간접적으로 산출하였다. WAF를 처리하지 않은 대조군과 WAF를 농도별로 처리한 실험군 사이의 세포생존율에는 유의적인 차이가 없었다(Fig. 6). 본 연구는 세포독성이 관찰되지 않는 WAF의 농도에서 WAF 처리가 L6 myotube의 포도당 세포내 흡수에 어떤 영향을 미치는지 조사하였다. L6 myotube에 WAF를 100, 200, 400 μg/mL 농도로 처리하여 포도당 세포내 흡수를 유도하였다. 이와 같은 세포 수준의 실험에서 흡수된 포도당의 농도는 형광염료가 연결된 포도당 유도체인 2-NBDG의 형광 세기를 측정하여 결정하였다. 10 nM 농도의 인슐린 처리는 L6 myotube의 2-NBDG 세포내 흡수를 약 3.5배 증가시켰다(Fig. 7). 100 μg/mL 농도의 WAF를 처리할 경우 2-NBDG 세포내 흡수에 유의한 영향을 관찰할 수 없었으나, 200, 400 μg/mL 농도의 WAF를 처리할 경우 2-NBDG 세포내 흡수가 유의하게 증가된 것을 관찰할 수 있었다(Fig. 7).
Effect of WAF on cell viability in L6 myotubes. Cells were exposed for 24 h to indicated concentrations of WAF. Cell viability was measured by MTT assay as detailed in the section of Materials and Methods. Each bar represents the mean ± SD (n = 6).
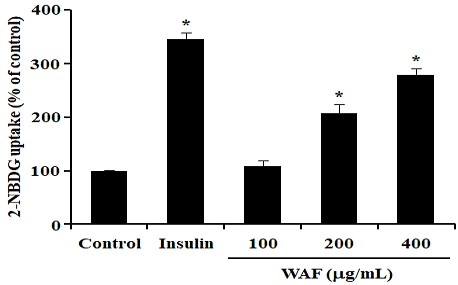
Effect of WAF on cellular uptake of glucose-like 2-NBDG in L6 myotubes. L6 myobalsts were differentiated by 2% horse serum into L6 myotubes. Differentiated L6 myotubes were stimulated for 1 h with the positive control insulin (10 nM) or indicated doses of WAF, and 2-NBDG, then, was added for 30 min. The cellular uptake of 2-NBDG was measured, as detailed in the section of Materials and Methods. Each bar represents the mean ± SD (n = 6). *p < 0.05 compared with the control.
5. 당뇨병 실험동물에서 공복혈당
당뇨병 실험동물에 4주간 1일 1회 WAF를 200, 400 mg/kg 농도로 경구 투여하고, 1주 간격으로 공복혈당과 체중을 측정하였다. 4주째에 공복혈당, 체중 및 혈압을 측정하고 실험동물을 마취시켜 심장에서 혈액을 채취한 다음 신장과 간을 적출하였다. 채취한 혈액에서 당화혈색소, 인슐린, 신장손상의 지표인 크레아틴 및 간 손상 지표인 GOT와 GPT를 각각 측정하고 적출된 신장과 간의 무게를 측정하여 WAF의 항당뇨 효과와 당뇨합병증 개선 효과를 조사하였다.
당뇨병 실험동물에서 공복혈당을 1주 간격으로 4주간 측정한 결과, 초기 공복혈당은 WAF를 투여하지 않은 대조군과 WAF을 투여한 실험군 사이에 큰 차이가 없었다(Fig. 8). 그러나 시간의 경과에 따라 대조군의 공복혈당이 점차적으로 증가하는 반면, 200 mg/kg WAF를 투여한 실험군에서는 대조군에 비해 공복혈당이 유의하게 감소하였다. 특히, 400 mg/kg WAF를 투여한 실험군에서는 공복혈당이 초기보다 4주째에 다소 감소한 것을 관찰할 수 있었다.
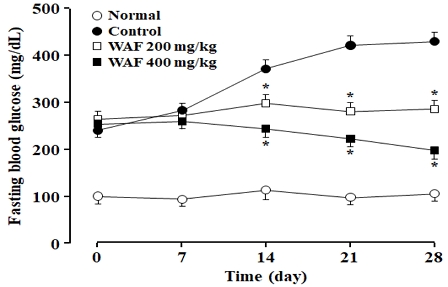
Effect of WAF on fasting blood glucose levels in diabetic mice. Diabetic mice were orally treated once a day with indicated doses of WAF for 4 weeks. Fasting blood glucose levels were measured weekly as detailed in the section of Materials and Methods. Each value represents the mean ± SD of 6 mice; ○ for normal mice, ● for diabetic mice, □ for diabetic mice treated with 200 mg/kg WAF, ■ for diabetic mice treated with 400 mg/kg. *p < 0.05 compared with the control group.
6. 당뇨병 실험동물에서 당화혈색소
당뇨병 실험동물에 4주간 1일 1회 WAF를 200 mg/kg 또는 400 mg/kg 농도로 경구 투여하고, 4주째에 당뇨병 실험동물에서 혈액을 채취하여 당뇨병 상태를 보여주는 당화혈색소(HbA1c)를 조사하였다. 당화혈색소의 변화양상은 4주째 공복혈당의 변화양상과 같은 경향성을 보였다(Fig. 9). 즉, WAF를 투여하지 않은 대조군에서는 정상군에 비해 당화혈색소 수치가 높게 관찰되었고, WAF를 투여한 실험군에서는 당화혈색소 수치가 대조군에 비해 유의하게 감소하였다.
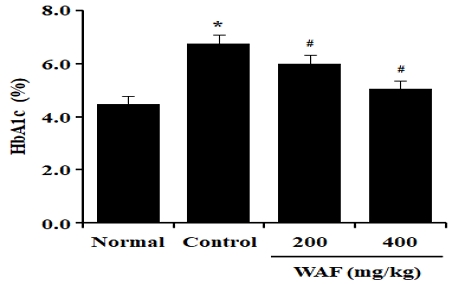
Effect of WAF on serum levels of glycosylated hemoglobin (HbA1c) in diabetic mice. Diabetic mice were orally treated once a day with indicated doses of WAF for 4 weeks. On day 28, serum HbA1c levels were measured as detailed in the section of Materials and Methods. Each bar represents the mean ± SD of 6 mice; ‘Normal’ for non-diabetic normal mice, ‘Control’ for diabetic mice treated with vehicle alone. *p < 0.05 compared with normal group, #p < 0.05 compared with control group.
7. 당뇨병 실험동물에서 혈청 인슐린
STZ 약물을 이용하여 β-세포의 인슐린 분비를 감소시킴으로써 당뇨병을 유발한 실험동물에 1일 1회 4주간 WAF(200 mg/kg 또는 400 mg/kg)를 경구로 투여하고, 4주째에 당뇨병 실험동물에서 혈액을 채취하여 혈청 인슐린 변화를 조사하였다. 당뇨병을 유발하지 않은 정상 실험동물에서 높은 농도의 혈청 인슐린이 관찰되었다(Fig. 10). 그러나 당뇨병을 유발한 실험동물에서는 낮은 농도의 혈청 인슐린이 관찰되었다. WAF를 투여한 실험군에서는 혈청 인슐린이 대조군에 비해 유의하게 증가하였다.
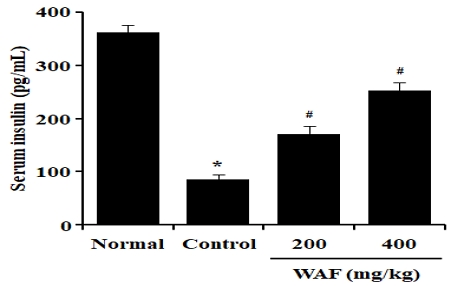
Effect of WAF on serum levels of insulin in diabetic mice. Diabetic mice were orally treated once a day with indicated doses of WAF for 4 weeks. On day 28, serum insulin levels were measured as detailed in the section of Materials and Methods. Each bar represents the mean ± SD of 6 mice; ‘Normal’ for non-diabetic normal mice, ‘Control’ for diabetic mice treated with vehicle alone. *p < 0.05 compared with normal group, #p < 0.05 compared with control group.
8. 당뇨병 실험동물에서 체중 및 혈압
정상 실험동물의 체중은 4주 동안 꾸준히 증가하였으나, 당뇨병 실험동물의 체중은 2주째부터 감소하였다(Fig. 11). 당뇨병 실험동물에서 관찰된 체중 감소는 WAF(200 mg/kg 또는 400 mg/kg) 처리에 의해 유의하게 증가하였다.
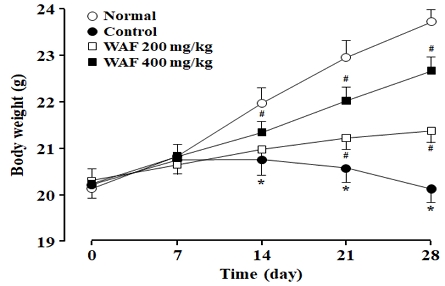
Effect of WAF on body weight in diabetic mice. Diabetic mice were orally treated once a day with indicated doses of WAF for 4 weeks. Body weight was measured weekly as detailed in the section of Materials and Methods. Each value represents the mean ± SD of 6 mice; ○ for normal mice, ● for diabetic mice, □ for diabetic mice treated with 200 mg/kg WAF, ■ for diabetic mice treated with 400 mg/kg. *p < 0.05 compared with normal group, #p < 0.05 compared with control group.
정상 실험동물과 당뇨병 실험동물의 수축기 혈압을 비교해 보면, 당뇨병 실험동물의 수축기 혈압이 상대적으로 높게 관찰되었다(Fig. 12). 당뇨병 실험동물에서 관찰된 수축기 혈압 증가는 WAF(200 mg/kg 또는 400 mg/kg) 처리에 의해 유의하게 감소하였다.
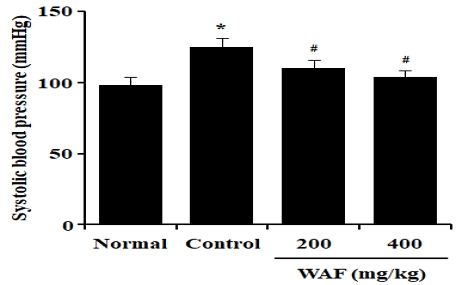
Effect of WAF on systolic blood pressure in diabetic mice. Diabetic mice were orally treated once a day with indicated doses of WAF for 4 weeks. On day 28, systolic blood pressure was measured as detailed in the section of Materials and Methods. Each bar represents the mean ± SD of 6 mice; ‘Normal’ for non-diabetic normal mice, ‘Control’ for diabetic mice treated with vehicle alone. *p < 0.05 compared with normal group, #p < 0.05 compared with control group.
9. 당뇨병 실험동물에서 당뇨합병증
당뇨병 실험동물에 4주간 1일 1회 WAF를 200 mg/kg 또는 400 mg/kg 농도로 경구 투여하고, 4주째에 당뇨병 실험동물의 신장과 간을 적출하여 육안으로 조사하고 이들 장기의 무게를 측정함으로써 당뇨합병증 여부를 조사하였다. 정상군 실험동물과 대조군 당뇨병 실험동물의 신장과 간의 크기와 색을 비교할 경우, 당뇨병 실험동물의 것이 정상 실험동물보다 상대적으로 크게 관찰되었으며 색 또한 상대적으로 연하게 관찰되었다(Fig. 13). 보다 정확하게 비교하기 위해, 이들 장기의 무게를 측정한 다음 평균값을 취하여 Table 1에 나타내었다. 정상군보다 대조군에서 상대적으로 큰 평균값이 관찰되었다. 대조군과 실험군을 비교할 경우, WAF를 투여한 당뇨병 실험동물에서 장기의 크기와 무게가 유의하게 감소하였다(Fig. 13 & Table 1).
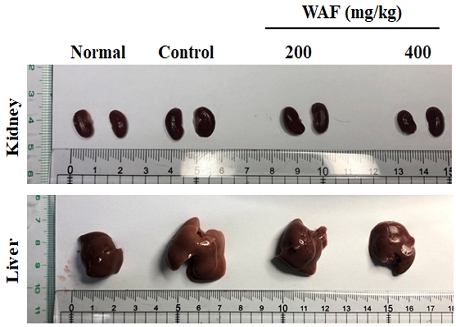
Representative photographs of kidney and liver obtained from normal and diabetic mice. Diabetic mice were orally treated once a day with indicated doses of WAF for 4 weeks. One of 6 photographs is representatively illustrated.
10. 당뇨병 실험동물에서 혈청 BUN 및 creatinine
혈청 요소질소(BUN)와 creatinine는 신장 기능을 평가하는 지표로 활용된다. Table 2는 실험 4주째에 정상 실험동물과 당뇨병 실험동물에서 채취한 혈액에서 BUN 농도와 creatinine 농도를 표시한 것이다. 정상군과 대조군의 BUN 측정값을 비교할 경우, 대조군에서 상대적으로 큰 측정값이 관찰되었다. WAF를 투여하지 않은 대조군과 WAF를 투여한 실험군의 BUN 측정값을 비교할 경우, 실험군에서 측정값이 유의하게 감소하였다. 한편, creatinine 측정값의 변화도 BUN 측정값의 변화와 유사한 경향성을 보였다.
11. 당뇨병 실험동물에서 GOT 및 GPT
혈청 GOT와 GPT는 간 기능을 평가하는 지표로 활용된다. Table 3은 실험 4주째에 정상 실험동물과 당뇨병 실험동물에서 채취한 혈액에서 GOT와 GPT 수치를 표시한 것이다. 정상군과 대조군의 GOT 측정값을 비교할 경우, 대조군에서 상대적으로 큰 측정값이 관찰되었다. WAF를 투여하지 않은 대조군과 WAF를 투여한 실험군의 GOT 측정값을 비교할 경우, 실험군에서 측정값이 유의하게 감소하였다. 한편, GPT 측정값의 변화도 GOT 측정값의 변화와 유사한 경향성을 보였다.
고 찰
한의학에서 당뇨병을 消渴의 범주로 보고 있다. 消渴은 “多飮, 多食, 多尿”가 특징인 병증으로 “情志失常, 勞逸失度”로 인한 臟腑燥熱로 陰虛火旺하게되어 발병한다.11-13) 주로 “滋陰, 潤燥, 降火”로써 치료하며, 病機, 症狀, 病勢의 차이에 따라 上消, 中消, 下消의 3가지로 구분한다.14) 上消는 心 때문이며, 多飮少食하며 大便은 평소와 다름없으나, 小便은 양이 많으면서 자주 마렵다. 中消는 脾 때문이며, 善渴善飢하며 잘 먹는데도 몸이 마르고 小便은 붉은색이고 大便은 막힌다. 下消는 腎 때문이며, 精枯髓竭되니 물을 마시는 즉시 小便으로 나오고, 小便이 기름처럼 뿌옇다. 이러한 증상은 현대의 당뇨병과 상당히 일치한다.
당뇨병 환자의 95% 이상을 차지하는 제2형 당뇨병은 심하지 않은 인슐린 분비 장애와 인슐린 저항성이 단독 또는 복합적으로 영향을 주어 혈당이 오랜 시간동안 높게 나타나는 대사성 질환이며, 이 질환이 지속될 경우 고혈당에 의해 신장 및 간 기능의 장애, 고혈압, 심혈관계 질환, 백내장 등과 같은 당뇨합병증이 나타날 수 있다.24,25) 따라서 당뇨병 및 당뇨합병증을 예방하거나 치료하기 위해서는 지속적인 혈당 관리를 통해 정상 혈당을 유지하는 것이 필요하다. 당뇨병에서 고혈당은 과량의 포도당 체내 흡수, 포도당 이용 저하, 인슐린 분비 감소와 같은 복합적인 원인에 의해서 나타난다.3) 따라서 정상적인 혈당을 유지하기 위해서는 포도당 체내 흡수를 억제하는 방법, 특정 세포의 포도당 이용을 증가시키는 방법, β-세포의 인슐린 분비를 증가시키는 방법 등이 당뇨병 예방과 치료에 도움이 될 수 있다.9) 당뇨병 환자에서 혈당은 주로 항당뇨 약물에 의해 관리되며, 식이요법과 운동요법이 보조적으로 혈당 관리에 사용될 수 있다.24,25) 그러나 혈당 관리를 위해 현재 사용되고 있는 항당뇨 약물에서 다양한 부작용이 발견되었다. 이러한 이유로 보다 부작용이 적은 천연물 소재를 이용하여 혈당을 관리하려는 다양한 연구가 활발히 진행되고 있다. Dhanya와 Jayamurthy26)는 근육세포에서 항당뇨 천연물 소재로 알려진 hesperidin이 인슐린 신호를 활성화시킴으로써 항당뇨 효과를 나타낼 수 있음을 보였고, Hanchang 등19)은 당뇨병 실험동물에서 hesperidin 투여가 공복혈당을 감소시키고 인슐린 생성을 증가시킴으로써 항당뇨 활성을 나타낸다고 하였다. Rehman 등27)은 비만 실험동물에서 hesperidin 섭취가 인슐린 저항성을 개선시킬 수 있다고 하였다. 한편, Chen 등28)은 당뇨병 실험동물에서 hesperidin 섭취는 당뇨병에 의해 유발되는 신장의 기능 손상에 대해 개선 효과가 있다고 하였고, Dokumacioglu 등29)도 hesperidin이 당뇨합병증으로 나타나는 간과 신장의 기능 손상에 대해 개선 효과가 있다고 하였다.
枳殼에는 항당뇨 효과가 있는 hesperidin이 다량으로 함유되어 있기 때문에, 枳殼의 항당뇨 효과를 과학적으로 조사해볼 필요성이 있다. 이런 점을 고려해서, 박 등21)은 당뇨병 흰쥐에서 桑葉과 枳殼 혼합물의 항당뇨 효능을 조사하여 枳殼의 항당뇨 효과를 보였다. 그러나 이들의 연구는 枳殼의 가능한 항당뇨 효과를 기술했으나 항당뇨 기전을 명확하게 제시하지 못했다. 본 연구는 枳殼의 가능한 항당뇨 기전을 조사하고 항당뇨 효능을 평가하기 위해, 효소, 세포 및 실험동물 수준에서 枳殼의 항당뇨 효과를 조사하였다.
본 연구는 枳殼의 항당뇨 약리 기전을 조사하기 위해, 일차적으로 효소 수준에서 枳殼 수용성 추출물(WAF)이 탄수화물로부터 포도당을 생성하는 α-glucosidase 효소의 활성에 어떤 영향을 주는지 조사하였다. WAF는 α-glucosidase 활성에는 큰 효과가 없었다. 그러나 정상 실험동물을 이용하는 OSTT 및 OGTT 검사에서 WAF는 실험동물의 혈당을 유의하게 감소시켰다. 이러한 실험결과로부터, WAF는 α-glucosidase 활성 억제와 관련이 없는 다른 항당뇨 기전을 통해 혈당을 조절하는 것으로 판단하였다.
본 연구는 枳殼의 다른 항당뇨 기전을 조사하기 위해, 근육세포와 β-세포를 이용하여 포도당 세포내 흡수와 인슐린 분비 활성을 각각의 세포에서 조사하였다. WAF는 근육세포에서 인슐린에 반응하여 포도당 세포내 흡수를 촉진하였고, β-세포에서는 고농도의 포도당에 반응하여 인슐린 분비를 증가시켰다. 이러한 실험결과로부터, WAF는 근육세포의 포도당 세포내 흡수를 촉진시키고 β-세포의 인슐린 분비를 증가시키는 약리 기전을 통해 항당뇨 효과를 나타내는 것으로 판단하였다.
효소 수준과 세포 수준에서 관찰된 실험결과를 종합적으로 고찰해보면, 枳殼은 α-glucosidase의 효소활성 억제와 무관하게 포도당 세포내 흡수를 촉진시키고 인슐린 분비를 증가시키는 약리 기전을 통해 항당뇨 효과를 나타내는 것으로 판단된다. 이러한 약리 기전으로 항당뇨 효과를 나타내는 것으로 판단되는 枳殼의 항당뇨 효과를 실험동물 수준에서 평가하기 위해, 본 연구는 당뇨병을 유발시키는 STZ 약물을 사용하여 당뇨병 실험동물을 제작하였다. 제작된 당뇨병 실험동물에 WAF를 4주간 경구로 투여한 다음 일정한 시간에 공복혈당(fasting blood glucose)을 측정하여 WAF의 항당뇨 효과를 조사하였다. 실험결과를 분석해보면, WAF를 처리하지 않은 대조군과 WAF를 처리한 실험군에서 당뇨병의 지표로 활용되는 공복혈당이 대조군에 비해 실험군에서 낮게 관찰되었다. 이러한 관찰결과와 일치하게, 혈당 관리의 지표로 활용되는 당화혈색소가 대조군보다 실험군에서 낮게 관찰되었다. 당뇨병 실험동물의 혈청 인슐린 함량을 비교해보며, 대조군보다 WAF를 투여한 실험군에서 혈청 인슐린 함량이 높게 관찰되었다. 이러한 실험결과는 세포 수준에서 관찰된 枳殼의 인슐린 분비 증가 효과와 잘 일치한다.
장기간 관리되지 않은 고혈당은 체중 감소, 혈압 상승, 신장 기능 및 간 기능 저하 등과 같은 당뇨합병증을 유발한다.3,6,30) 본 연구에서는 WAF의 항당뇨 효과가 당뇨합병증에 대해 개선 효과를 나타낼 수 있는지 조사하였다. WAF를 투여하지 않은 대조군과 WAF를 투여한 실험군에서 체중과 혈압을 조사한 결과, 실험군에서 체중 감소와 혈압 상승에 대해 개선 효과가 있었다. 한편, 신장의 부종과 신장 기능의 지표로 활용되는 BUN과 creatine 수치가 대조군에 비해 실험군에서 감소하였다. 이러한 실험결과로부터, 枳殼에는 항당뇨 효과가 있으며, 당뇨병에 의해 저하된 신장기능이 WAF 투여로 그 기능이 현저히 개선됨을 의미한다. 또한, 당뇨병 실험동물에서 간 손상 지표로 활용되는 GOT 및 GPT 수치가 정상 실험동물보다 높게 관찰되었으며, 이러한 관측결과는 당뇨병을 유발시키기 위해 사용된 STZ 약물의 독성과 고혈당이 복합적으로 작용하여 간 손상을 초래했기 때문에 나타난 간독성으로 판단된다. 당뇨병 실험동물에서 GOT 및 GPT 수치를 비교해보면, 대조군보다 WAF를 투여한 실험군에서 GOT 및 GPT 수치가 낮게 관찰되었다. 또한, 적출된 간을 육안으로 관찰한 결과, 간의 크기가 대조군에 비해 실험군에서 감소된 것을 확인할 수 있었다. 이러한 관찰결과는 枳殼의 항당뇨 효과에 의해 나타난 간 기능 개선 효과로 판단된다. 또한, 본 실험에서 4주 동안 투여한 枳殼에 의해 유발될 수 있는 간독성이 본 연구에서는 나타나지 않는 것으로 보이며, 枳殼의 일정 기간 섭취는 관측할 수 있는 간독성을 유발하지 않는 것으로 판단된다.
선행연구26-30)에서 밝혀진 hesperidin의 항당뇨 효과와 본 연구에서 관찰된 枳殼의 항당뇨 효과를 비교해보면, 枳殼의 항당뇨 효과의 일부는 枳殼에 함유된 hesperidin의 항당뇨 효과와 관련이 있어 보인다. 枳殼에는 hesperidin이 함유되어 있고, 枳殼에서 발견되는 항당뇨 기전이 hesperidin에서 발견된 항당뇨 기전과 일부 유사하기 때문이다. 특히, 순수물질인 hesperidin에서 관찰되는 당뇨합병증에 대한 개선 효과가 枳殼에서도 관찰되기 때문에, 枳殼에 함유된 hesperidin의 항당뇨 효과를 무시할 수 없다.
결 론
枳殼의 가능한 항당뇨 약리 기전을 제시하고 당뇨합병증에 개선 효과가 있는지 조사하기 위해, 枳殼 수용성 추출물(WAF)의 항당뇨 효과를 효소, 세포 및 실험동물 수준에서 조사하고, 당뇨병 실험동물에서 枳殼의 항당뇨 효능과 당뇨합병증 개선 효과를 확인하여, 다음과 같은 결론을 얻었다.
α-Glucosidase 활성 억제 효과를 조사하는 효소 수준의 실험에서, WAF는 α-glucosidase 활성 조절에 큰 영향을 주지 못하였으며, 정상 실험동물에서 OSTT와 OGTT를 수행하여 이를 검증하였다.
β-세포에서 인슐린 분비 활성과 근세포에서 포도당 세포내 흡수 활성을 조사하는 세포 수준의 실험에서, WAF 처리는 인슐린 분비와 포도당 세포내 흡수를 증가시켰다.
당뇨병 실험동물에서 WAF의 항당뇨 효능을 평가한 결과, WAF 경구 투여는 공복혈당을 감소시켰고, 혈청 인슐린을 증가시켰으며, 당화혈색소 수치를 감소시켰다.
당뇨병 실험동물에서 WAF의 당뇨합병증 개선 효과를 조사한 결과, WAF는 체중 감소, 혈압 상승, 신장 기능 저하 및 간 기능 저하에 대해 개선 효과가 있었다.
이상의 결과로부터 枳殼 수용성 추출물은 β-세포의 인슐린 분비를 증가와 근세포의 포도당 세포내 흡수를 증가시킴으로써 혈당을 강하시키는 항당뇨 효과를 나타냄으로써 당뇨합병증에 대해 개선 효과를 나타내는 것으로 판단된다.
Acknowledgments
본 연구는 2021년도 원광대학교 교비 지원에 의하여 연구되었음.
References
-
Guthrie RA, Guthrie DW. Pathophysiology of diabetes mellitus. Crit Care Nurs Q. 2004;27(2):113-25.
[https://doi.org/10.1097/00002727-200404000-00003]

-
Arneth B, Arneth R, Shams M. Metabolomics of Type 1 and Type 2 Diabetes. Int J Mol Sci. 2019;20(10):2467.
[https://doi.org/10.3390/ijms20102467]

-
Zaccardi F, Webb DR, Yates T, Davies MJ. Pathophysiology of type 1 and type 2 diabetes mellitus: a 90-year perspective. Postgrad Med J. 2016;92(1084):63-9.
[https://doi.org/10.1136/postgradmedj-2015-133281]

-
Henning RJ. Type-2 diabetes mellitus and cardiovascular disease. Future Cardiol. 2018;14(6):491-509.
[https://doi.org/10.2217/fca-2018-0045]

-
Balakumar P, Maung-U K, Jagadeesh G. Prevalence and prevention of cardiovascular disease and diabetes mellitus. Pharmacol Res. 2016;113(Pt A):600-9.
[https://doi.org/10.1016/j.phrs.2016.09.040]

-
Laakso M, Kuusisto J. Insulin resistance and hyperglycaemia in cardiovascular disease development. Nat Rev Endocrinol. 2014;10(5):293-302.
[https://doi.org/10.1038/nrendo.2014.29]

-
Xie F, Chan JC, Ma RC. Precision medicine in diabetes prevention, classification and management. J Diabetes Investig. 2018;9(5): 998-1015.
[https://doi.org/10.1111/jdi.12830]

-
Ibrahim M, Tuomilehto J, Aschner P, et al. Global status of diabetes prevention and prospects for action: A consensus statement. Diabetes Metab Res Rev. 2018;34(6):e3021.
[https://doi.org/10.1002/dmrr.3021]

- Davoren P. Glucose-lowering medicines for type 2 diabetes. Aust Fam Physician. 2015;44(5):176-9.
-
Kashyap H, Gupta S, Bist R. Impact of Active Antihyperglycemic Components as Herbal Therapy for Preventive Health Care Management of Diabetes. Curr Mol Med. 2019;19(1):12-9.
[https://doi.org/10.2174/1566524019666190219124301]

- Saimei Li, Peizheng Lin. Recent Status of "Dampness-heat-induced Resolution" in Diabetes Mellitus Traditional Chinese Medicine. Zhejiang Chinese Medicine Journal. 2006;4:242-5.
- Min Liu, Jing Li, Zhangzhi Zhu, Lianyi Dai. Analysis of syndrome of damp-heat syndrome of Diabetes Mellitus. The New Chinese Medicine Journal. 2005;37(9):3-5.
- Taikang Huang, Editor. Traditional Chinese Medicine Treatment for Endocrine Metabolism Disease. Beijing: China Medical Science Press; 2002, p. 459.
- Xinlan Ma. Analysis of Diabetes Mellitus Qi and blood. Liaoning Chinese Medicine Journal. 1997:4:167.
-
Korea Institute of Oreintal Medicine. Citrus aurantium A, Korean Intellectual Property Office, 2007
[https://doi.org/10.20929/KTKP.MED.0000080008.]

- Doo Ill Han, Bang Yeon Hwang, Suk Yeon Hwang, Jeong Hill PARK, Kun Ho Son, Seung Ho Lee, Seung Yeup Chang, Shin Jung Kang, Jai Seup Ro, Kyong Soon Lee. Isolation and Quantitative Analysis of Hesperidin from Aurantii Fructus. Korean Journal of Pharmacognosy. 2001;32(2):93-7.
-
Sundaram R, Nandhakumar E, Haseena Banu H. Hesperidin, a citrus flavonoid ameliorates hyperglycemia by regulating key enzymes of carbohydrate metabolism in streptozotocin-induced diabetic rats. Toxicol Mech Methods. 2019;29(9):644-53.
[https://doi.org/10.1080/15376516.2019.1646370]

-
Xuguang H, Aofei T, Tao L, Longyan Z, Weijian B, Jiao G. Hesperidin ameliorates insulin resistance by regulating the IRS1-GLUT2 pathway via TLR4 in HepG2 cells. Phytother Res. 2019;33(6):1697-1705.
[https://doi.org/10.1002/ptr.6358]

-
Hanchang W, Khamchan A, Wongmanee N, Seedadee C. Hesperidin ameliorates pancreatic β-cell dysfunction and apoptosis in streptozotocin-induced diabetic rat model. Life Sci. 2019;235:116858.
[https://doi.org/10.1016/j.lfs.2019.116858]

-
Bai L, Li X, He L, et al. Antidiabetic Potential of Flavonoids from Traditional Chinese Medicine: A Review. Am J Chin Med. 2019;47(5):933-57.
[https://doi.org/10.1142/S0192415X19500496]

- Park, Jung-Sup, Park, Chong-Hyeong, Jun, Chan-Yong, Choi, You-Kyung, Hwang, Gwi-Seo, Kim, Dong-Woo. The Anti-diabetes and Vasoelasticity Effects of Mori Folium and Aurantii Fructus in Streptozotocin Induced Type II Diabetes Mellitus Model. The journal of internal Korean medicine 007;28(3):544-59.
-
Furman BL. Streptozotocin-Induced Diabetic Models in Mice and Rats. Curr Protoc Pharmacol. 2015;70:5.47.1-5.47.20.
[https://doi.org/10.1002/0471141755.ph0547s70]

-
Aoki K, Sato H, Terauchi Y. Usefulness of antidiabetic alpha-glucosidase inhibitors: a review on the timing of administration and effects on gut hormones. Endocr J. 2019;66(5):395-401.
[https://doi.org/10.1507/endocrj.EJ19-0041]

-
Rios JL, Francini F, Schinella GR. Natural Products for the Treatment of Type 2 Diabetes Mellitus. Planta Med. 2015;81(12-13):975-94.
[https://doi.org/10.1055/s-0035-1546131]

-
Naveen J, Baskaran V. Antidiabetic plant-derived nutraceuticals: a critical review. Eur J Nutr. 2018;57(4):1275-99.
[https://doi.org/10.1007/s00394-017-1552-6]

-
Dhanya R, Jayamurthy P. In vitro evaluation of antidiabetic potential of hesperidin and its aglycone hesperetin under oxidative stress in skeletal muscle cell line. Cell Biochem Funct. 2020;10.1002/cbf.3478.
[https://doi.org/10.1002/cbf.3478]

-
Rehman K, Munawar SM, Akash MSH, et al. Hesperidin improves insulin resistance via down-regulation of inflammatory responses: Biochemical analysis and in silico validation. PLoS One. 2020;15(1):e0227637.
[https://doi.org/10.1371/journal.pone.0227637]

-
Chen YJ, Kong L, Tang ZZ, et al. Hesperetin ameliorates diabetic nephropathy in rats by activating Nrf2/ARE/glyoxalase 1 pathway. Biomed Pharmacother. 2019;111:1166-75.
[https://doi.org/10.1016/j.biopha.2019.01.030]

-
Dokumacioglu E, Iskender H, Musmul A. Effect of hesperidin treatment on α-Klotho/FGF-23 pathway in rats with experimentally-induced diabetes. Biomed Pharmacother. 2019;109:1206-10.
[https://doi.org/10.1016/j.biopha.2018.10.192]

-
Forbes JM, Cooper ME. Mechanisms of diabetic complications. Physiol Rev. 2013;93(1):137-88.
[https://doi.org/10.1152/physrev.00045.2011]

