
꾸지뽕나무 잎과 우슬 복합물이 MIA로 골관절염이 유도된 Rat에 미치는 영향
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
This study was to investigate the effects of cudrania tricuspidata leaf and achyranthes japonica nakai complex (CAC) treatment on monosodium iodoacetate (MIA)-induced osteoarthritis rats. Osteoarthritis was induced by injection of MIA (3 mg) into right knee joints of rats. The rats were divided into 5 groups; Non-induced normal rat (Con, n=10), MIA-induced osteoarthritis rat (MIA, n=10), osteoarthritis rat treated with indomethacin 2 mg/kg (Indo, n=10), osteoarthritis rat treated with CAC 200 mg/kg (Low, n=10) or 400 mg/kg (High, n=10). The rats were treated orally for 14 days. On the last day of oral administration, the hind paw weight bearing of the experimental animals was measured using an incapacitance test meter. The interleukin-1β (IL-1β), interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α), prostaglandin E2 (PGE2), cartilage oligomeric matrix protein (COMP) and, C-telopeptides of type II collagen (CTX-II) levels in serum were measured by ELISA. And Then, that gene expression (IL-1β, IL-6, TNF-α, COX-2) levels in cartilage were measured by qRT-PCR. Also, cartilage volume was measured by micro CT arthrography. Administration of CAC reduced the inflammatory cytokine (IL-1β, IL-6, TNF-α, PGE2) levels in serum and gene expression levels in cartilage, and the COMP and CTX-II level in serum, which is an indicator of cartilage degradation. In addition, the hind paw weight bearing and cartilage volume, which were decreased due to osteoarthritis, were significantly increased. In the future, if the results of clinical studies including studies on safety are supplemented, it is considered that it can be used as an oriental medicine treatment to improve or treat symptoms of osteoarthritis.
Keywords:
Cudrania tricuspidata Leaf, Achyranthes japonica Nakai, Osteoarthritis, Monosodium iodoacetate, Herbal medicine서 론
골관절염(osteoarthritis; OA)은 퇴행성 관절염이라고 불리며, 관절통과 관절 연골의 점진적인 손실 및 연골 퇴행을 특징으로 하는 질환으로 초고령화 사회에서 이는 공중 보건 문제로 인식되고 있다1,2). 이러한 골관절염의 병리학적 핵심 과정은 염증성 사이토카인과 다양한 매개 물질들로 인해 MMP(matrix metalloproteases)와 같은 조직 단백질 분해효소의 발현이 상향 조절되고 관절 내 연골의 세포 외 기질이 분해되는 과정이다3). 골관절염을 치료하기 위한 관절 치환술은 치료 효율이 높지만, 수술 비용이 높고 치환된 관절의 교체 및 풀림 등으로 인한 재수술 비용에 대한 부담감이 크다4). 이로 인해 비스테로이드성 소염제(nonsteroidal anti-inflammatory drug; NSAID) 치료 비중이 외과적 수술 치료에 비해 높게 나타나고 있다5,6).
염증성 매개물질들 중 하나인 프로스타글란딘 E2(prostaglandin E2; PGE2)는 MMP의 발현을 상향 조절하는 주요 인자로서 사이클로옥시게나제(cyclooxygenase; COX)의 대사를 통해 합성된다7). 이러한 사이클로옥시게나제는 위 점막을 보호하는 COX-1과 프로스타글란딘 E2를 합성하는 COX-2로 나뉘며, 아스피린 및 이부프로펜 등 대부분의 비스테로이드성 소염제는 사이클로옥시게나제를 억제하여 프로스타글란딘 합성을 저해함으로서, 소염, 해열 및 진통작용을 나타내고 위장 장애와 같은 부작용을 야기한다5,6). 따라서 비스테로이드성 소염제의 단점을 해결하기 위해 부작용이 적은 천연물을 사용한 항염증 소재 개발 연구는 현재도 다양하게 진행중이다.
꾸지뽕나무(Cudrania tricuspidata)는 뽕나무과에 속하는 낙엽교목으로 한국, 일본, 중국 등 동아시아에 주로 자생하며, 열매, 잎, 뿌리, 줄기 등은 염증성 질환에 사용되어 왔다8,9). 이에 대한 연구로는 꾸지뽕나무 열매에서 유래된 플라보노이드의 산화질소 억제 효과10) 및 아토피피부염 개선11)에 대한 연구가 있으며, 뿌리 및 껍질은 항산화 효과12)와 염증 개선13)에 대한 연구가 진행되었다. 본 연구에서 사용한 시료와 같은 잎은 HPLC 분석을 통해 항산화 물질에 대한 연구14)가 진행되었으며, 골관절염 실험모델에서의 관절염 개선 효과15)가 확인된 바가 있다.
우슬(Achyranthes japonica Nakai)은 비름과에 속하는 다년생 초본식물인 쇠무릎의 뿌리부분으로 동아시아에 주로 자생하며, 골 관절염 및 통증 개선에 사용되어왔다16,17). saponin, triterpenoids, phytoecdysteroid, inokosterone 등의 성분이 이미 골 질환에 효과적인 성분으로 알려져 있으며16), 실험적 연구를 통해 항염증18), 항산화19), 항류마티스 관절염20) 효능이 보고되었다. 특히 본 연구와 관련된 조골세포 및 파골세포의 증식과 ALP 및 TRAP 활성21)과 골관절염에 대한 유의적인 결과도 보고되었다22,23).
이에 저자는 꾸지뽕나무 잎과 우슬 복합물(cudrania tricuspidata leaf and achyranthes japonica nakai complex 이하, CAC)이 MIA (monosodium iodoacetate)로 골관절염이 유도된 동물모델에 미치는 영향을 살펴보고자, 골관절염이 유도된 rat의 혈액 내 염증성 바이오마커들의 생성량 및 실험동물의 뒷다리 체중 부하력을 측정하였으며, 연골량(cartilage volume)과 조직병리학적 변화를 관찰한 결과, 유의적인 연구결과를 얻었기에 이를 보고하는 바이다.
재료 및 방법
1. 시료 제작
꾸지뽕나무 잎과 우슬 복합물을 제작하기 위해 충남 금산의 홍익약초 영농법인에서 꾸지뽕나무 잎을 공급받았고 국내에서 재배된 우슬을 옴니허브에서 구입하여 사용하였다. 먼저 꾸지뽕나무 잎과 우슬을 각각 25 g씩 넣고 500 mL의 증류수를 추가하여 100℃에서 3시간동안 추출하였고 정성여과지를 사용하여 추출물을 여과하였다. 여과한 추출물은 rotary vacuum evaporator (EYELA, Japan)를 사용하여 감압농축하고 freeze dryer (ilShinbiobase, Korea)를 사용하여 동결건조를 진행하였다. 동결건조 완료 후, 14.8 g(수득률 : 29.6%)의 분말을 획득하였고 –20℃에 보관하면서 실험 당일 소분하고 증류수에 용해시켜 사용하였다.
2. 실험 동물
SD-Rat(4주령, 수컷, 170∼200g)은 라온바이오(Korea)에서 공급받았고 실험 동물은 1주간의 안정기를 가지면서 순화를 시켰으며, 안정기 및 실험기간에 모든 실험군에는 일반 사료와 물을 충분히 공급하였다. 1주간의 안정기 이후 5주령부터 동물 실험을 진행하였으며, 동물 사육실은 22±2℃의 온도로 유지하였고 12시간은 200-300 Lux로 조명, 12시간은 빛을 차단하는 상태로 설정하였다. 본 연구는 대전대학교 동물실험윤리위원회의 승인(승인번호 DJUARB2020-024)을 받아 동물윤리준칙에 의거하여 실험을 진행하였다.
3. 골관절염 유도 및 시료 투여
실험 그룹은 골관절염 유발을 진행하지 않고 증류수를 경구투여하는 Con군, 골관절염 유발 후 증류수를 경구 투여하는 MIA군과 2 mg/kg 농도의 indomethacin (Sigma-Aldrich, USA)을 경구투여하는 Indo군, CAC를 200, 400 mg/kg의 농도로 경구 투여하는 Low 및 High군 등 총 5개의 그룹으로 분류하였다. 5주령이 된 SD-Rat을 마취하고 우측 무릎 부분을 제모하였으며, 제모 후 무릎 관절낭에 0.9 % saline에 용해시킨 60 mg/mL 농도의 monosodium iodoacetate (MIA; Sigma-Aldrich, USA)를 50 μL씩 주입함으로써 골관절염을 유발하였다. 골관절염 유발 후, 모든 실험동물은 매일 1회 2 mL씩 2주간 경구투여하였다.
4. 뒷발 체중부하 측정
투여 마지막 날에 incapacitance test meter (IITC Life Science, USA)를 이용하여 실험동물의 뒷발 체중부하를 측정하였으며, 플라스틱 방에 비스듬히 세운 후 양쪽 뒷발에 가해지는 세기를 10초에 걸쳐 측정하였다. 골관절염이 유도된 우측 하지에 분포된 체중 부하는 아래 수식에 대입하여 계산하였다.
5. 혈액 및 조직 분리
모든 투여가 종료된 후, 실험동물을 마취하고 심장천자법으로 채혈을 진행하였으며, 혈액을 30분간 상온에서 굳히고 3,000 rpm에서 15분간 원심분리하여 혈청을 분리하였다. 분리한 혈청은 200 μL씩 소분하여 –80℃에 보관하였으며, 바이오마커 생성량 측정 시, 해동하여 분석에 사용하였다. 대퇴골 경부와 발목 관절을 절단하여 피부 및 근육을 제거한 후, 10% neutral buffered formalin (Sigma-Aldrich, USA)에 고정시켰으며, 이후 Micro-CT 분석과 유전자 발현량 측정에 사용하였다.
6. 바이오마커 생성량 측정
분석용 kit에 동봉된 96 well plate에 분리한 혈청을 100 μL씩 넣고 37℃에서 90분간 반응시켰다. 반응 후 washing buffer를 이용하여 3회 세척 작업을 진행한 후 100 μL의 detection antibody를 넣어 다시 37℃에서 60분간 반응시키고 세척하였다. 세척 후 HRP conjugate를 100 μL씩 넣어 37℃에서 30분간 반응시키고 세척한 뒤 substrate reagent를 90 μL씩 넣어 37℃에서 15분간 반응시키고 50 μL의 stop solution을 추가하여 micro plate reader (Molecular Devices, USA)를 통해 450 nm 파장에서 흡광도를 측정하였으며, standard curve를 기준으로 생성량을 분석하였다.
7. 유전자 발현량 측정
분리한 무릎 연골 조직에서 accuPrep® universal RNA extraction kit (Bioneer, Korea)를 사용하여 RNA를 추출하였으며, 추출한 RNA는 accupower® cyclescript RT premix (Bioneer, Korea)와 혼합하고 PCR cycler (alpha cycler 1; PCRmax, U.K.)를 사용하여 45℃에서 60분, 95℃에서 5분간 반응을 통해 cDNA를 합성하였다. 합성된 cDNA로부터 특정 유전자를 증폭시켜 확인하기 위해 real-time PCR을 진행하였으며, cDNA와 특정 유전자에 맞는 primer, SYBR green premix (PCR Biosystems, USA)를 혼합하고 real-time PCR cycler (Exicycler™ 96; Bioneer, Korea)를 사용하여 95℃에서 2분 동안 반응시키고 95℃에서 5초, 62.5℃에서 30초를 40회 반복하여 특정 유전자를 증폭시켰다. 유전자 발현량은 대조군의 유전자 발현량을 기준으로 상대정량 하였으며, 사용된 primer들의 정보는 Table 1과 같다.
8. Micro-CT 및 조직학적 검사
10% neutral buffered formalin에 고정시켰던 무릎 조직을 시험검사 기관인 KPNT (Korea)에 Micro-CT 분석을 의뢰하였으며, Micro-CT 분석 결과를 3D로 변환하여 연골 부위를 판독하고 연골량을 측정하였다.
9. 통계처리
연구 결과는 mean±standard error of mean으로 나타내었으며, 연구 결과의 통계 분석은 SPSS Statistics Version 21.0 (IBM, USA)을 이용하였다. 먼저 두 그룹 간의 통계적 비교는 independent sample t-test를 사용하여 수행하였고 Tukey’s HSD test를 통해 유의수준 0.05로 설정하여 유의성을 검정하였으며, p<0.05, p<0.01 및 p<0.001의 3가지 유의수준으로 나누어 표기하였다.
결 과
1. 뒷발 체중부하 측정
실험동물의 뒷발 체중부하를 측정한 결과, 골관절염이 유도되지 않은 Con군에 비해 골관절염이 유도된 MIA군에서 뒷발 체중부하가 유의적으로 감소하였으며, 관절염 치료제인 indomethacin을 경구투여한 Indo군과 CAC를 200 및 400 mg/kg 농도로 투여한 Low 및 High군에서는 뒷발 체중부하가 MIA군에 비해 유의적으로 증가하였다(Fig. 1).
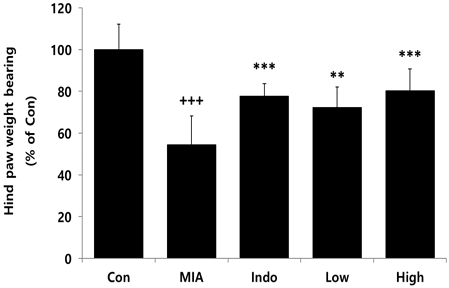
Effects of CAC on hind paw weight bearing of MIA-induced osteoarthritis rat. The result were presented by the mean±standard error of mean (N=10). Significance of results, +++ : p<0.001 compared to Con, ** ; p<0.01, *** ; p<0.001 compared to MIA. Con; MIA-untreated group, MIA; MIA-induced osteoarthritis rat, Indo; MIA-induced osteoarthritis rat treated with indomethacin (2 mg/kg), Low or High; MIA-induced osteoarthritis rat treated with CAC (200 or 400 mg/kg).
2. 혈청 내 사이토카인 생성량
실험동물의 혈청 내 사이토카인의 생성량을 측정한 결과, 골관절염이 유도되지 않은 Con군에 비해 골관절염이 유도된 MIA군에서 염증성 사이토카인(IL-1β, IL-6, TNF-α, PGE2)들이 유의적으로 증가하였으며, 관절염 치료제인 indomethacin을 경구투여한 Indo군과 CAC를 200 및 400 mg/kg 농도로 투여한 Low 및 High군에서는 혈청 내 IL-1β, IL-6, TNF-α, PGE2 생성량이 MIA군에 비해 유의적으로 감소하였다(Fig. 2).
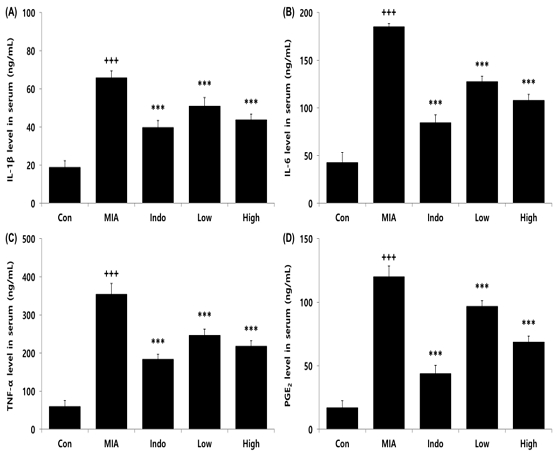
Effects of CAC on cytokine level in serum of MIA-induced osteoarthritis rat. The result were presented by the mean±standard error of mean (N=10). (A) IL-1β, (B) IL-6, (C) TNF-α, (D) PGE2 level in serum. Significance of results, +++ : p<0.001 compared to Con, *** ; p<0.001 compared to MIA. Groups are the same as in Fig. 1.
3. 연골 내 유전자 발현량
실험동물의 연골 내 유전자 발현량을 측정한 결과, 골관절염이 유도되지 않은 Con군에 비해 골관절염이 유도된 MIA군에서 염증성 사이토카인 유전자(IL-1β, IL-6, TNF-α, COX-2)들이 유의적으로 증가하였으며, 관절염 치료제인 indomethacin을 경구투여한 Indo군과 CAC를 200 및 400 mg/kg 농도로 투여한 Low 및 High군에서는 IL-1β와 TNF-α 유전자 발현량이 MIA군에 비해 유의적으로 감소하였고 IL-6와 COX-2 유전자 발현량은 Indo군과 High군에서만 유의적인 감소가 나타났다(Fig. 3).
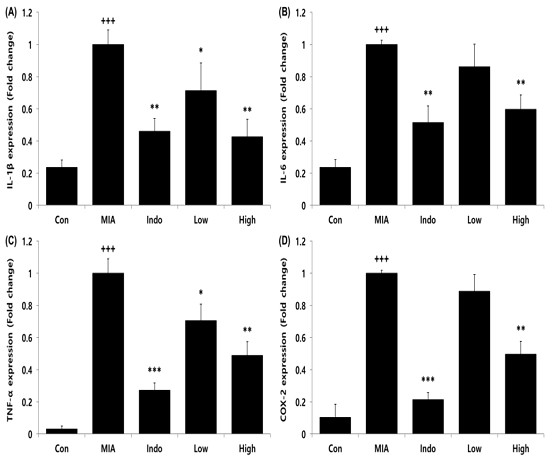
Effects of CAC on gene expression level in cartilage of MIA-induced osteoarthritis rat. The result were presented by the mean±standard error of mean (N=10). (A) IL-1β, (B) IL-6, (C) TNF-α, (D) COX-2 expression level in cartilage. Significance of results, +++ : p<0.001 compared to Con, * ; p<0.05, ** ; p<0.01, *** ; p<0.001 compared to MIA. Groups are the same as in Fig. 1.
4. 혈청 내 바이오마커 생성량
실험동물의 혈청 내 바이오마커의 생성량을 측정한 결과, 골관절염이 유도되지 않은 Con군에 비해 골관절염이 유도된 MIA군에서 골관절염 관련 바이오마커인 COMP(cartilage oligomeric matrix protein)와 CTX-2(C-terminal cross-linked telopeptides of type II collagen) 생성량이 유의적으로 증가하였으며, 관절염 치료제인 indomethacin을 경구투여한 Indo군과 CAC를 200 및 400 mg/kg 농도로 투여한 Low 및 High군에서는 COMP 생성량이 MIA군에 비해 유의적으로 감소하였고 CTX-2 생성량은 Indo군과 High군에서만 유의적인 감소가 나타났다(Fig. 4).
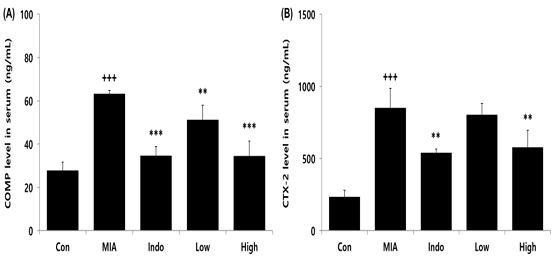
Effects of CAC on COMP and CTX-2 level in serum of MIA-induced osteoarthritis rat. The result were presented by the mean±standard error of mean(N=10). (A) COMP, (B) CTX-2 level in serum. Significance of results, +++ : p<0.001 compared to Con, ** ; p<0.01, *** ; p<0.001 compared to MIA. Groups are the same as in Fig. 1.
5. Micro-CT 분석
실험동물의 무릎 관절을 micro-CT 분석을 진행한 결과, 골관절염이 유도되지 않은 Con군에 비해 골관절염이 유도된 MIA군에서 파란색 부분으로 표시된 연골량(cartilage volume)이 유의적으로 감소하였으며, 관절염 치료제인 indomethacin을 경구투여한 Indo군과 CAC를 400 mg/kg 농도로 투여한 High군에서는 연골량이 MIA군에 비해 유의적으로 증가하였다(Fig. 5).
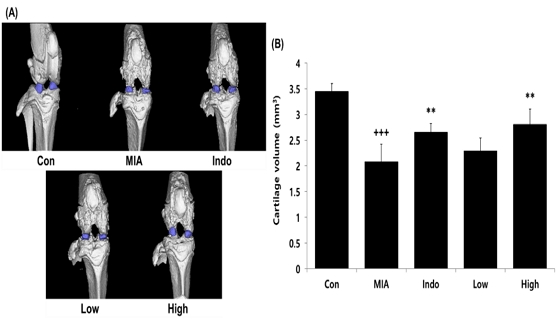
Effects of CAC on cartilage volume in MIA-induced osteoarthritis rat. The result were presented by the mean±standard error of mean(N=10). (A) Micro-CT results, (B) Cartilage volume. Significance of results, +++ : p<0.001 compared to Con, ** ; p<0.01 compared to MIA. Groups are the same as in Fig. 1.
고 찰
골관절염 병태를 유도하는 MIA(monosodium iodoacetate)는 글리세르알데히드-3-인산탈수소효소(glyceraldehyde 3-phosphate dehydrogenase, GAPDH)의 활성을 억제하며, 이는 연골세포의 사멸 및 연골조직의 괴사와 붕괴를 유도하고 관절부위에서의 염증 반응을 촉진한다24). 이러한 MIA를 동물 모델의 무릎 관절낭에 주입하면 사람의 골관절염과 유사한 병태가 빠르게 나타난다24).
본 연구에서는 꾸지뽕나무 잎과 우슬 복합물이 골관절염에 대해 미치는 영향을 알아보기 위해 MIA로 유도된 골관절염 동물모델에 복합물을 경구투여하고 뒷다리 체중부하를 측정하였으며, 실험동물의 혈청 내 염증 및 골관절염 관련 인자의 생성량과 무릎 관절부위의 micro-CT 분석을 진행하였다. 가장 먼저 실험동물의 뒷다리 체중부하를 측정한 결과, MIA로 골관절염이 유도된 실험군은 뒷발 체중부하가 골관절염을 유도하지 않은 정상군에 비해 유의적으로 감소하였으며, 꾸지뽕나무 잎과 우슬 복합물을 투여한 실험군은 뒷다리 체중부하를 골관절염이 유도된 실험군에 비해 유의적으로 증가시켰다. 이는 꾸지뽕나무 잎과 우슬 복합물을 투여를 통해 골관절염으로 유도되는 통증을 억제할 수 있음이 확인되었다.
그 다음 혈청에 존재하는 염증성 사이토카인 생성량을 분석하였으며, 수많은 연구들을 통해 사이토카인 및 케모카인 등 염증성 인자들이 골관절염의 발병과 관련되어 있음이 확인되었다25). IL-1β와 TNF-α는 NF-κB(nuclear factor kappa-light-chain-enhancer of activated B cells) 및 MAPK(mitogen-activated protein kinase) 등의 다양한 신호전달과정을 통해 활성화되고 생성량이 증가하며, MMPs(matrix metalloproteinases)등 체내 기질 단백질들을 분해하는 인자들의 발현을 유도하여 연골을 구성하는 세포외기질(ECM; extracellular matrix)을 분해한다25). 또한 IL-1β는 콜라겐과 어그레칸(aggrecan)의 생성을 억제한다고 알려져 있으며, IL-6는 B 세포와 T 세포를 활성화하고 염증 부위로의 염증 세포들의 이동을 매개한다26). 또한 PGE2는 체내에서 염증, 혈압, 뼈의 항상성 등 다양한 기능을 조절하는 인자로써, 주로 COX-2 (cyclooxygenase-2)에 의해 생성되고 골관절염 환자의 연골 조직에서 조골세포에 의해 과도하게 분비되어 골관절염을 악화시키기 때문에 골관절염의 치료를 위한 중요한 조절 인자로 알려져 있다27,28). 혈청 내 IL-1β, IL-6, TNF-α, PGE2 생성량을 확인한 결과, 꾸지뽕나무 잎과 우슬 복합물을 투여한 그룹은 골관절염을 유도한 MIA군에 비해 유의적인 감소가 나타났으며, 이는 꾸지뽕나무 잎과 우슬 복합물이 골관절염으로 인한 염증 반응을 개선시켰음을 확인하였다.
또한 COMP(cartilage oligomeric matrix protein)는 콜라겐 섬유와 기질의 상호작용을 통해 연골 내 세포외기질의 합성과 구조화를 담당하며, 콜라겐과 섬유소의 결합을 촉진하고 조직의 섬유화를 가속화한다29). 이러한 COMP는 주로 연골에서 발견되고 최근 연구들에 기능이 입증되어 연골 손상과 골관절염의 진단에 사용되는 특이적 바이오마커로 활용되고 있다29,30). 여러 연구를 통해 골관절염 환자의 혈청 내 COMP 수치가 건강한 대조군에 비해 상당히 높게 나타났음이 확인되었으며, 혈청 내 COMP 수치가 높은 환자는 낮은 환자에 비해 무릎, 골반 및 손 관절의 손상이 더 빠르게 나타난다고 보고하였다31-33). 또한 CTX-II(C-telopeptides of type II collagen)는 연골에 존재하는 세포외기질의 분해 산물로 알려져 있기 때문에 COMP와 더불어 연골 및 뼈의 손상 및 분해에 대한 평가 바이오마커로 사용되고 있다34). 본 연구에서 연골의 손상 및 파괴가 발생하면 증가하는 COMP 및 CTX-II 생성량을 분석한 결과, 꾸지뽕나무 잎과 우슬 복합물을 투여한 실험군은 골관절염을 유도한 MIA군에 비해 혈액 내 COMP 및 CTX-II 생성량을 유의적으로 감소시켰으며, 이는 꾸지뽕나무 잎과 우슬 복합물이 연골 손상을 방어하였음을 시사한다.
마지막으로 무릎 관절부위의 micro-CT 분석을 진행한 결과, MIA로 골관절염이 유도된 실험군은 무릎 관절부위의 연골 볼륨이 골관절염을 유도하지 않은 정상군에 비해 유의적으로 감소하였으며, 이는 MIA로 인해 무릎 관절의 연골이 손상 및 분해되어 나타난 결과이며, 이는 이전의 연구들35-37)과 동일한 결과로 확인되었다. 꾸지뽕나무 잎과 우슬 복합물을 투여한 그룹에서는 골관절염을 유도한 MIA군에 비해 연골 볼륨을 유의적으로 증가하였으며, 이러한 결과는 꾸지뽕나무 잎과 우슬 복합물이 골관절염으로 인한 관절 연골이 손상 및 분해되는 것을 보호할 수 있음이 확인되었다.
결과적으로 본 연구를 통해서 꾸지뽕나무 잎과 우슬 복합물은 염증성 사이토카인을 억제하고 골관절염 지표인자를 감소시켰고 골관절염으로 인한 관절 연골이 손상 및 분해되는 것을 보호하고 관절 부위의 통증을 감소시킴으로써 골관절염을 개선시키거나 예방할 수 있음을 객관적으로 증명하였다. 하지만 기존의 개별 천연물 또는 유사 혼합물과의 효능 비교 결과와 안전성에 대한 연구를 비롯한 임상연구 결과를 보완한다면 골관절염 치료에 대한 한의학적 처방으로 사용 가능할 것이라 사료된다.
결 론
본 연구는 꾸지뽕나무 잎과 우슬 복합물이 골관절염에 미치는 영향을 확인하기 위해 MIA로 골관절염이 유도된 동물모델에 꾸지뽕나무 잎과 우슬 복합물을 투여하고 혈액 및 조직학적 변화를 확인하였다. 먼저 골관절염으로 인한 무릎 통증을 확인할 수 있는 실험동물의 뒷다리 체중부하를 꾸지뽕나무 잎과 우슬 복합물은 개선시켰으며, 혈청 내 염증성 사이토카인(IL-1β, IL-6, TNF-α, PGE2)과 COMP 및 CTX-II 생성량을 유의적으로 감소시켰다. 또한 micro-CT 분석을 통해 골관절염으로 인한 관절 연골이 손상 및 분해가 억제되는 것이 객관적으로 규명되었다. 향후, 안전성에 대한 연구를 비롯한 임상연구 결과를 보완한다면 골관절염에 대한 증상을 개선하거나 치료하는 한의학적 치료제로써 사용 가능할 것이라 사료된다.
References
-
Kraus VB, Blanco FJ, Englund M, Karsdal MA, Lohmander LS. Call for standardized definitions of osteoarthritis and risk stratification for clinical trials and clinical use. Osteoarthritis and cartilage. 2015;23(8):1233-41.
[https://doi.org/10.1016/j.joca.2015.03.036]

-
Chow YY, Chin K-Y. The role of inflammation in the pathogenesis of osteoarthritis. Mediators of inflammation. 2020;2020.
[https://doi.org/10.1155/2020/8293921]

-
Yorifuji M, Sawaji Y, Endo K, Kosaka T, Yamamoto K. Limited efficacy of COX-2 inhibitors on nerve growth factor and metalloproteinases expressions in human synovial fibroblasts. Journal of Orthopaedic Science. 2016;21(3):381-8.
[https://doi.org/10.1016/j.jos.2016.01.004]

-
Castañeda S, Roman-Blas JA, Largo R, Herrero-Beaumont G. Subchondral bone as a key target for osteoarthritis treatment. Biochemical pharmacology. 2012;83(3):315-23.
[https://doi.org/10.1016/j.bcp.2011.09.018]

- Olszewska-Słonina DM, Matewski D, Drewa G, Woźniak A, Czajkowski R, Rajewski P, et al. Oxidative equilibrium in the prophylaxis of degenerative joint changes: an analysis of pre-and postoperative activity of antioxidant enzymes in patients with hip and knee osteoarthritis. Med Sci Monit. 2010;16(5):238-45.
-
Ou Y, Tan C, An H, Jiang D, Quan Z, Tang K, et al. Selective COX-2 inhibitor ameliorates osteoarthritis by repressing apoptosis of chondrocyte. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research. 2012;18(6):BR247.
[https://doi.org/10.12659/MSM.882901]

-
Pecchi E, Priam S, Mladenovic Z, Gosset M, Saurel A-S, Aguilar L, et al. A potential role of chondroitin sulfate on bone in osteoarthritis: inhibition of prostaglandin E2 and matrix metalloproteinases synthesis in interleukin-1β-stimulated osteoblasts. Osteoarthritis and cartilage. 2012;20(2):127-35.
[https://doi.org/10.1016/j.joca.2011.12.002]

-
Chang SH, Jung EJ, Lim DG, Oyungerel B, Lim KI, Her E, et al. Anti‐inflammatory action of Cudrania tricuspidata on spleen cell and T lymphocyte proliferation. Journal of Pharmacy and Pharmacology. 2008;60(9):1221-6.
[https://doi.org/10.1211/jpp.60.9.0015]

-
Kim D-W, Lee W-J, Asmelash Gebru Y, Choi H-S, Yeo S-H, Jeong Y-J, et al. Comparison of bioactive compounds and antioxidant activities of Maclura tricuspidata fruit extracts at different maturity stages. Molecules. 2019;24(3):567.
[https://doi.org/10.3390/molecules24030567]

-
Han XH, Hong SS, Jin Q, Li D, Kim H-K, Lee J, et al. Prenylated and benzylated flavonoids from the fruits of Cudrania tricuspidata. Journal of natural products. 2009;72(1):164-7.
[https://doi.org/10.1021/np800418j]

-
Lee H, Ha H, Lee JK, Seo Cs, Lee Nh, Jung DY, et al. The fruits of Cudrania tricuspidata suppress development of atopic dermatitis in NC/Nga mice. Phytotherapy Research. 2012;26(4):594-9.
[https://doi.org/10.1002/ptr.3577]

-
Lee YJ, Kim S, Lee SJ, Ham I, Whang WK. Antioxidant activities of new flavonoids from Cudrania tricuspidata root bark. Archives of pharmacal research. 2009;32:195-200.
[https://doi.org/10.1007/s12272-009-1135-z]

-
Jeong G-S, Lee D-S, Kim Y-C. Cudratricusxanthone A from Cudrania tricuspidata suppresses pro-inflammatory mediators through expression of anti-inflammatory heme oxygenase-1 in RAW264. 7 macrophages. International Immunopharmacology. 2009;9(2):241-6.
[https://doi.org/10.1016/j.intimp.2008.11.008]

-
Song S-H, Ki SH, Park D-H, Moon H-S, Lee C-D, Yoon I-S, et al. Quantitative analysis, extraction optimization, and biological evaluation of Cudrania tricuspidata leaf and fruit extracts. Molecules. 2017;22(9):1489.
[https://doi.org/10.3390/molecules22091489]

-
Kim OK, Lee J. Therapeutic effects of Curdrania tricuspidata leaf extract on osteoarthritis. Journal of the Korean Society of Food Science and Nutrition. 2013;42(5):697-704.
[https://doi.org/10.3746/jkfn.2013.42.5.697]

-
Al-Mijan M, Park H, Lee Y, Lim B. Evaluation of the antioxidant and anti-inflammatory potential of fermented Achyranthes japonica Nakai extract. Nat Prod Chem Res. 2018;6(5):337-43.
[https://doi.org/10.4172/2329-6836.1000337]

-
Park J, Kim I. Effects of dietary Achyranthes japonica extract supplementation on the growth performance, total tract digestibility, cecal microflora, excreta noxious gas emission, and meat quality of broiler chickens. Poultry science. 2020;99(1):463-70.
[https://doi.org/10.3382/ps/pez533]

- Iqbal Z, Shah Y, Ahmad L. Evaluation of anti-inflammatory activity of selected medicinal plants of Khyber Pakhtunkhwa, Pakistan. Pak J Pharm Sci. 2014;27(2):365-8.
-
Jang G-Y, Kim H-Y, Lee S-H, Kang Y-R, Hwang I-G, Woo K-S, et al. Effects of heat treatment and extraction method on antioxidant activity of several medicinal plants. Journal of the Korean society of food science and nutrition. 2012;41(7):914-20.
[https://doi.org/10.3746/jkfn.2012.41.7.914]

- Kim C-S, Park Y-K. The therapeutic effect of Achyranthis Radix on the collagen-induced arthritis in mice. The Korea Journal of Herbology. 2010;25(4):129-35.
- Kim K-Y, Kim S-W, Kim J-K, Ko S-Y. Effects of achyranthes radix extracts on osteoblasts and osteocalsts. International Journal of Oral Biology. 2005;30(2):39-45.
- Jang SH, Lee SH, Lee HS, Seo Y, Song H-J, Hwang HS, et al. The effects of fermented Achyranthes japonica Radix extract on osteoarthritis model in rats. Korean Association for Laboratory Animal Science Symposium. 2015:150.
- HUANG Y-f, XIE X-y, LIN Q, QIU Z-w, YE J-x, FU C-l. Efficacy of Achyranthis Bidentatae Radix Against Cartilage Degeneration in Osteoarthritis: An Exploration Based on Computer Simulation. Chinese Journal of Experimental Traditional Medical Formulae. 2021:148-55.
-
Pitcher T, Sousa-Valente J, Malcangio M. The monoiodoacetate model of osteoarthritis pain in the mouse. Journal of visualized experiments: JoVE. 2016(111).
[https://doi.org/10.3791/53746-v]

-
Sokolove J, Lepus CM. Role of inflammation in the pathogenesis of osteoarthritis: latest findings and interpretations. Therapeutic advances in musculoskeletal disease. 2013;5(2):77-94.
[https://doi.org/10.1177/1759720X12467868]

-
Gabay C. Interleukin-6 and chronic inflammation. Arthritis research & therapy. 2006;8(2):1-6.
[https://doi.org/10.1186/ar1917]

-
Jiang W, Jin Y, Zhang S, Ding Y, Huo K, Yang J, et al. PGE2 activates EP4 in subchondral bone osteoclasts to regulate osteoarthritis. Bone research. 2022;10(1):27.
[https://doi.org/10.1038/s41413-022-00201-4]

-
Zhu J, Zhen G, An S, Wang X, Wan M, Li Y, et al. Aberrant subchondral osteoblastic metabolism modifies NaV1. 8 for osteoarthritis. Elife. 2020;9:e57656.
[https://doi.org/10.7554/eLife.57656]

-
Bi X. Correlation of serum cartilage oligomeric matrix protein with knee osteoarthritis diagnosis: a meta-analysis. Journal of orthopaedic surgery and research. 2018;13(1):1-8.
[https://doi.org/10.1186/s13018-018-0959-y]

-
Verma P, Dalal K. Serum cartilage oligomeric matrix protein (COMP) in knee osteoarthritis: a novel diagnostic and prognostic biomarker. Journal of Orthopaedic Research. 2013;31(7):999-1006.
[https://doi.org/10.1002/jor.22324]

-
Fernandes F, Pucinelli MLC, Da Silva N, Feldman D. Serum cartilage oligomeric matrix protein (COMP) levels in knee osteoarthritis in a Brazilian population: clinical and radiological correlation. Scandinavian journal of rheumatology. 2007;36(3):211-5.
[https://doi.org/10.1080/03009740601154186]

-
Blumenfeld O, Williams F, Hart D, Spector T, Arden N, Livshits G. Association between cartilage and bone biomarkers and incidence of radiographic knee osteoarthritis (RKOA) in UK females: a prospective study. Osteoarthritis and Cartilage. 2013;21(7):923-9.
[https://doi.org/10.1016/j.joca.2013.04.009]

-
El-Arman MM, El-Fayoumi G, El-Shal E, El-Boghdady I, El-Ghaweet A. Aggrecan and cartilage oligomeric matrix protein in serum and synovial fluid of patients with knee osteoarthritis. HSS Journal®. 2010;6(2):171-6.
[https://doi.org/10.1007/s11420-010-9157-0]

-
Henrotin Y. Osteoarthritis in year 2021: biochemical markers. Osteoarthritis and cartilage. 2022;30(2):237-48.
[https://doi.org/10.1016/j.joca.2021.11.001]

-
Mohan G, Perilli E, Kuliwaba JS, Humphries JM, Parkinson IH, Fazzalari NL. Application of in vivo micro-computed tomography in the temporal characterisation of subchondral bone architecture in a rat model of low-dose monosodium iodoacetate-induced osteoarthritis. Arthritis research & therapy. 2011;13:1-14.
[https://doi.org/10.1186/ar3543]

-
Min G-Y, Park J-M, Joo I-H, Sim B-Y, Choi H-J, Kim H-Y, et al. Effects of Chondroitin on Blood Related Pathologic Factor and Weight Bearing in MIA Osteoarthritis Model. 2019.
[https://doi.org/10.3746/jkfn.2019.48.3.306]

- Joo I-H, Kim D-H. Effects of Yeonsan-Ogye Egg on MIA-induced Osteoarthritis Rat. The Korea Journal of Herbology. 2017;32(6):63-9.
