도파민 일주기 리듬 손상과 미병, 파킨슨병 전구기 증상의 연관성에 관한 고찰
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Awareness of Mibyeong, a key concept in preventive Korean medicine, leads to preventive health care by focusing on clinical symptoms and risk factors that appear before disease, as well as improving health by changing one's circadian rhythm and lifestyle. Parkinson's disease motor symptoms, such as bradykinesia, tremor, rigidity, and postural instability, appear after more than half of the dopaminergic neurons in the substantia nigra are lost. Non-motor symptoms such as hyposmia, sleep disturbance, depression, fatigue, and foveal visual impairment, on the other hand, appear from the prodromal stage of Parkinson's disease. Dopamine is secreted in different areas of the brain under circadian control and is known to interact closely with circadian clock genes. The loss of normal dopaminergic rhythm in the midbrain, striatum, retina, and olfactory bulbs has recently been linked to Parkinson's disease non-motor symptoms such as circadian disruption, REM sleep behavior disorder, foveal vision loss, and hyposmia. Furthermore, circadian disruption is linked to several pathological mechanisms of Parkinson's disease, hastening disease progression. There is a growing awareness that early diagnosis and preventive measures of Parkinson’s disease should be prioritized. Parkinson's disease must be prevented at the prodromal stage through increased awareness and active preventive treatment.
Keywords:
Parkinson’s disease, Prodromal phase, Mibyeong, Dopamine, Circadian rhythm서 론
파킨슨병은 알츠하이머병 다음으로 흔한 퇴행성 뇌 질환으로, 한국을 비롯하여 인구 고령화에 직면한 여러 나라에서 그 유병률이 증가하는 추세이다. 국내 국민건강보험공단 표본 코호트 자료를 기반으로 한 조사에서는 파킨슨병의 유병률이 10만 명당 2004년 41.4명에서 2013년 142.5명으로 증가한 것으로 나타났으며,1) 국내 레지스트리 데이터베이스를 기반으로 한 조사에서는 파킨슨병 성별 및 연령 표준화 유병률이 10만 명당 2010년 115.9명에서 2015년 139.8명으로 증가한 것으로 나타났다.2) 현재 파킨슨병의 진단은 서동, 진전, 경직, 자세 불안정 등 파킨슨병 특이적 운동증상의 존재 여부에 따라 이루어지며, 이러한 운동증상은 중뇌 흑질의 도파민 뉴런이 절반 이상 소실된 이후에 나타나는 것으로 알려져 있다. 한편, 후각저하, 렘수면행동장애를 포함한 수면장애, 우울증, 피로, 통증, 중심와 시각 저하, 변비 등의 비운동증상은 파킨슨병 전구기부터 서서히 나타나기 시작한다. 파킨슨병은 만성 진행성 신경퇴행성 질환으로, 신경세포가 비가역적으로 손상된 이후에는 치료가 어려워 질병을 조기에 발견하고 조절하는 것이 중요하다. 따라서 파킨슨병의 조기 진단, 효율적 관리, 그리고 환자 삶의 질 향상을 위해 비운동증상에 주목해야 한다는 인식이 생겨나고 있다.3,4)
한편, 최근 일주기 리듬 장애(circadian rhythm disruption)와 파킨슨병의 비운동증상과의 연관성에 주목하는 연구들 또한 증가하고 있다. 거의 모든 비운동증상과 관련이 있는 일주기 리듬 장애는 파킨슨병 운동증상이 드러나기 훨씬 오래전부터 나타나며, 파킨슨병의 발병 과정과도 직접적인 연관이 있는 것으로 밝혀지고 있다.5) 또한, 생체시계 유전자와 파킨슨병 병태생리 기전의 상호작용에 관한 연구들이 최근 활발하게 진행되고 있다.5) 파킨슨병의 핵심 병태생리와 연관되는 도파민의 경우 뇌의 다양한 영역에서 일주기 리듬의 조절을 받아 분비되며, 도파민 자체가 생체시계 유전자 발현을 조절하기도 하는 등 일주기 리듬과 긴밀한 상호작용을 하는 것으로 알려져 있다. 특히 뇌의 중뇌, 선조체, 망막, 그리고 후신경구에서의 정상적인 도파민 리듬의 손상과 파킨슨병 전구기 증상인 일주기 장애, 렘수면행동장애, 중심와 시각 저하, 후각저하 등의 관련 가능성을 시사하는 연구 결과들이 꾸준히 보고되고 있어5,6) 이에 본 논문에서는 일주기 리듬 손상과 한의학의 미병(未病) 개념의 관련성을 도파민 기능 저하와 파킨슨병 전구기 증상을 예로 들어 서술하고자 한다.
본 론
1. 연구방법
파킨슨병 전구기 증상, 도파민, 일주기 리듬, 미병의 연관성에 관한 고찰을 위해 PubMed (https://pubmed.ncbi.nlm.nih.gov/) 및 Google Scholar (https://scholar.google.com) 데이터베이스에서 "Parkinson", "circadian", "dopamine" 키워드를 조합하여 검색을 시행하였다. 검색 결과 중 전문(full-text)이 있는 문헌고찰, 종설, 임상연구, 실험연구를 선택하여 고찰을 수행하였다. PubMed에서 "Parkinson" and "circadian" and "dopamine" 키워드로 검색 시 1975년부터 2022년까지 전문이 존재하는 문헌은 총 139개였으며, 점진적으로 증가하는 추세를 확인할 수 있었다(Fig. 1). 그 중 사람을 대상으로 한 연구가 83건, 동물을 대상으로 한 연구가 62건이였으며, 체계적 문헌고찰 논문이 1건, 종설 논문이 41건, 무작위 대조군 임상시험 및 관찰 연구를 포함한 임상 연구가 7건, 증례 연구가 7건으로 (Table 1) 아직 체계적인 연구나 실질적으로 사람을 대상으로 한 연구는 적었다. 따라서 본 논문에서는 동물을 대상으로 한 연구와 사람을 대상으로 한 연구 결과를 종합하여 도파민 일주기 리듬 손상이 파킨슨병 전구기 증상으로 이어지는 기전과, 미병과의 연관성에 관하여 살펴보고자 하였다. 이때 미병에 관한 한의학 연구를 포함시키기 위하여 PubMed 및 Google Scholar에서 "미병"을 키워드로 추가 검색을 시행하였다.
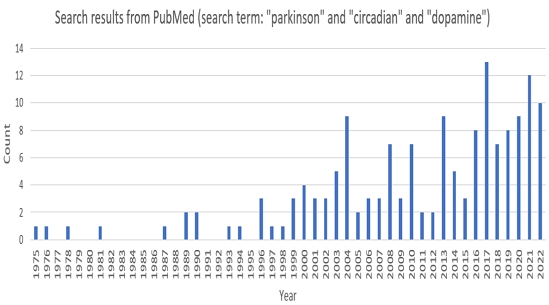
The number of articles published each year on idiopathic Parkinson's disease, dopamine, and circadian rhythm, based on a PubMed search.
2. 파킨슨병 전구기 증상과 미병
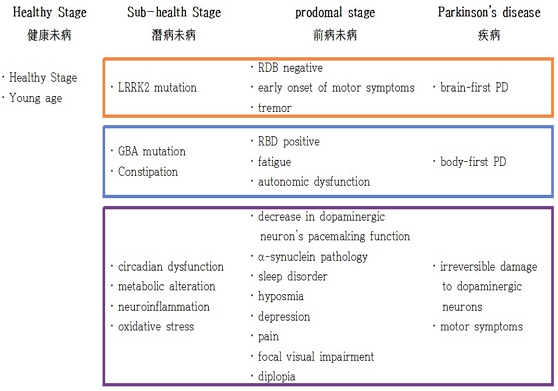
최근 연구에 따르면 파킨슨병 발병 10~20년 전부터 나타나는 전구기 증상은 환자의 병태생리와 임상 양상, 발병연령, 그리고 유전형에 따라 여러 종류의 아형으로 나뉜다. 2021년 Berg 등의 정리에 의하면 파킨슨병의 아형은 크게 (1) 비교적 젊은 나이에 운동증상이 나타나기 시작하여 발병하며 렘수면행동장애는 동반하지 않는 경우가 많으며 질병 진행이 상대적으로 완만한 유형과 (2) 비교적 늦은 나이에 발병하며 렘수면행동장애 및 여러 복합적인 증상들을 동반하는 경우가 많고 질병 진행이 상대적으로 빠른 유형, 그리고 이 두 유형 사이에 있는 (3) 중간 유형의 세 개의 군으로 나누어볼 수 있다. 또한, (1) leucine-rich repeat kinase 2 (LRRK2) 유전자 돌연변이를 가진 환자들은 주로 운동증상이 먼저 발병하는 전자의 유형을 따르는 경우가 많으며, (2) glucocerebrosidase (GBA) 유전자 돌연변이를 가진 환자들은 주로 렘수면행동장애를 동반하는 후자의 유형을 따르는 경우가 많은 것으로 알려져 있다.7)
LRRK2 유전자는 포유류의 신장, 폐, 면역세포, 뉴런 등에서 발현되는 유전자이며, Ras-of-Complex (Roc) GTPase 도메인과 tyrosine kinase-like kinase 도메인, 그리고 그 둘을 연결하는 C-terminal-of-Roc (COR) 도메인과 나머지 네 개의 도메인들로 구성된다. 가족성 파킨슨병과 관련되는 돌연변이는 Roc-COR tandem 또는 kinase 도메인에서 나타난다. 이러한 돌연변이의 결과로 kinase의 활성도가 증가하여 기질의 인산화가 증가하는 것으로 여겨진다. 이러한 결과가 어떻게 파킨슨병으로 이어지는지는 아직 잘 밝혀져 있지 않으나, 증가된 kinase 활성을 억제하는 것이 LRRK2 돌연변이에 의한 신경독성을 감소시키고, 그에 따른 파킨슨병증 또한 완화할 수 있을 것이라는 관점이 제기되고 있다.8)
한편, GBA 유전자는 스핑고지질(sphingolipid) 분해에 관여하는 리소좀 효소인 glucocerebrosidase(GCase)를 암호화하는 유전자다. GBA 유전자 변이는 리소좀 축적 질환 및 그에 따른 중추신경계 손상으로 나타나는 질환인 고셔병 (Gaucher's disease) 환자 집단에서 최초로 발견되었다. 고셔병 환자 집단에서 파킨슨병의 발생률이 높게 나타난다는 사실이 밝혀진 후 현재까지 GBA 유전자 변이는 특발성 파킨슨병 발병 관련 가장 큰 단일 위험 인자로 알려져 있다. 고셔병과 관련되는 GBA 유전자 변이를 가지고 있는 경우 GCase 효소의 활성이 감소되어 있는데, 이는 신경세포 내 잘못 접힌 알파-시누클레인(alpha-synuclein) 단백질의 축적으로 이어지며, 이는 다시 GCase를 감소시켜 악순환의 고리로 이어지게 된다. 또한, GBA 돌연변이는 리소좀(lysosome) 기능 저하 및 소포체 스트레스(endoplasmic reticulum stress, ER stress)와도 관련이 있다. GBA 변이 또한 어떻게 파킨슨병으로 이어지는지에 관해서는 아직 완전히 밝혀져 있지 않으나, 비정상적인 GCase를 정상화시키는 것이 GBA 돌연변이에 의한 파킨슨병증을 완화할 수 있을 것이라고 여겨진다.9-11)
위와 같은 2021년 Berg 등의 분류는 2020년 Horsager 등의 덴마크 연구진들이 파킨슨병으로 새로이 진단받은 37명의 환자를 대상으로 콜린성 부교감신경 분포를 확인하기 위한 11C-도네페질(donepezil) 양전자방출전산화단층촬영(positron emission tomography-computed tomography, PET/CT), 심장의 교감신경 분포를 확인하기 위한 123I-메타이오도벤질구아니딘(metaiodobenzylguanidine) (MIBG) 조영술, 청반(locus coeruleus)에 있는 색소신경세포(pigmented neuron)의 상태를 확인하기 위한 신경멜라닌(neuromelanin)-민감성 MRI, 그리고 피각(putamen)의 도파민 저장 능력을 확인하기 위한 18F-디하이드록시페닐알라닌(dihydroxyphenylalanine) (FDOPA) 양전자방출단층촬영(positron emission tomography, PET) 등 다양한 영상학적 검사를 시행하여 그 결과를 기반으로 제시한 “뇌에서 먼저 시작되는 유형(brain-first type)”과 “몸에서 먼저 시작되는 유형(body-first type)”과도 일맥상통하는 바가 있다. 뇌에서 먼저 시작되는 유형의 환자들은 발병 초기 진전 등의 운동증상이 더 우세하게 나타나며 FDOPA PET 검사상의 이상 소견이 비교적 초기부터 뚜렷하게 확인할 수 있으나, MIBG 조영술에서는 크게 이상이 나타나지 않으며 자율신경실조 및 렘수면행동장애 관련 증상들은 동반하지 않는 경우가 많다. 한편, 몸에서 먼저 시작되는 유형의 환자들은 발병 초기 변비 등을 포함한 비운동증상이 더 우세하게 나타나며 FDOPA PET 검사상의 이상 소견이 초기에는 비교적 심하지 않으나, MIBG 조영술에서 심장 교감신경 기능의 저하를 비교적 초기부터 뚜렷하게 확인할 수 있으며, 자율신경실조 및 렘수면행동장애를 동반하는 경우가 많다.12) 앞서 언급한 두 유전형 중에서 LRRK2 돌연변이를 가진 환자들의 경우 대다수가 뇌에서 먼저 시작되는 유형을 나타내며, GBA 돌연변이를 가진 환자들의 경우 대다수가 몸에서 먼저 시작되는 유형을 나타내는 경향이 있다. 하지만 공통적인 유전자 변이는 전체 파킨슨병 위험의 약 20% 정도만을 차지할 뿐이며, 간혹 이 두 분류에 명확하게 해당하지 않는 환자들도 존재하여, 향후 보다 정밀한 대규모 연구가 필요한 실정이다.7)
한편, 일주기 리듬(circadian rhythm)에 관여하는 ARNTL (Aryl hydrocarbon receptor nuclear translocator-like protein 1, BMAL1이라고도 알려짐), CLOCK (Clock Circadian Regulator), PER1 (Period Circadian Regulator 1), CRY1 (Cryptochrome Circadian Regulator 1) 등의 생체시계 유전자(clock gene)의 특정 변이 또한 파킨슨병과 관련이 있다는 보고가 되어 있다. 그 예로, 중국 한족을 대상으로 한 파킨슨병 환자-대조군 연구에서 ARNTL rs900147, 그리고 PER1 rs2253820 변이가 파킨슨병 위험과 연관이 있는 것으로 밝혀졌다. 좀 더 구체적으로는 rs900147의 경우 떨림 증상이 우세한 파킨슨병과 관련이 있었고, rs2253820의 경우 자세불안정 및 보행장애 증상이 두드러지는 파킨슨병과 관련이 있었다.13) 또한, CLOCK rs1801260(3111T/C)의 경우에도 중국 한족을 대상으로 한 연구에서 다른 위험인자들을 보정하더라도 파킨슨병 위험과 관련이 있는 것으로 확인되었다.14) 같은 연구진들은 rs1801260 변이가 파킨슨병 환자들의 운동동요(motor fluctuation)와 수면장애와 관련이 있음을 보고하였다.15) 이러한 사실들에 근거하여 파킨슨병의 복잡한 병태생리에 일주기 리듬 장애(circadian rhythm disruption)가 관여할 것이라는 가설을 세워볼 수 있다.
일주기 리듬 장애는 한의학의 미병 개념과도 관련지을 수 있다. 한의학의 미병 개념은 여러 고전 의서에 기록되어 있는 개념이다. 그 중 대표적인 『黃帝內經 素問 四氣調神大論』의 “이미 병든 것을 다스리지 않고 아직 병들지 않은 것을 다스린다(不治已病治未病)”는 구절, 그리고 『東醫寶鑑 雜病篇卷之二 風』의 “성인은 병이 들기 전에 병을 치료하고, 병이 오기 전에 알기 때문에 훌륭한 것이다. 중풍일 경우 반드시 전조 증상을 가지고 있다(聖人治未病之病, 知未來之疾, 此其良也. 其中風者, 必有先兆之證)”는 구절16) 등에 나타나는 미병 개념은 질병이 발생하기 이전의 아건강(亞健康) 상태로, 아직 큰 병으로 이어지지는 않았지만 그러할 가능성이 크며, 전조 증상이 나타나기 때문에 뛰어난 의사라면 이를 미리 알아차리고 예방을 위한 치료적 접근을 취할 수 있는 단계를 의미한다. 『黃帝內經 素問 四氣調神大論』에는 또한 “음양과 사계절의 변화를 등지고 거스르는 것은 몸 안에서 싸우고 대적하는 꼴이라고 할 수 있다(反順爲逆 是謂內格)”고 하여16) 아직 몸이 병들지 않았을 때 규칙적인 생활 습관을 통해 음양의 이치를 잘 따르고 어지러워진 생체 리듬을 조절함으로써 미병을 다스려야 한다고 하였다.17) 특히 고령화가 진행됨에 따라 만성 질환의 유병률이 점진적으로 증가하고 있는 현대 사회에서 미병을 관리하는 것은 신체 기능 저하의 위험성을 사전에 인식하고 기능 저하가 심각한 질환으로 이어지기 전에 대처하여 예방한다는 의의가 있다.18)
또한, 『黃帝素問 靈樞 營衛生會』에서는 젊은 사람과 달리 노인이 밤에 잠을 자지 못하는 이유를 “영기(營氣)와 위기(衛氣)의 운행이 일정하지 못하고(營衛之行 不失其常), 오장의 기운이 서로 싸워서 영기는 쇠약해지고 위기가 안을 침범하여 낮에는 정신이 맑지 않고 밤에는 잠을 자지 못한다(五藏之氣相搏 其營氣衰少 而衛氣內伐 故晝不精 夜不瞑)”고 하였다.16) 노인에서 신체 기능 저하는 광범위하게 나타나는데, 그중에서 가장 핵심적인 것은 일주기 리듬의 약화 및 손상이다. 포유동물에서 일주기 리듬은 Clock, Bmal1, Period, Cryptochrome 등을 포함하는 생체시계 유전자의 전사-번역 되먹임 회로(transcription-translation feedback loop)에 의해 분자적으로 조절된다. 인체에서의 일주기 리듬은 시교차상핵(suprachiasmatic nucleus, SCN)에 존재하는 중앙 시계(central clock)와 핵을 가지고 있는 모든 세포에 존재하는 말초 시계(peripheral clock)의 상호작용을 통해 분자적으로 조절되며 동기화되며, 이는 수면-각성 주기(sleep-wake cycle) 및 광범위한 대사 내분비 시스템의 일주기 조절에 영향을 미친다. 노화는 시교차상핵의 일주기 리듬 진폭(amplitude)의 저하 및 위상 어긋남(phase misalignment)을 초래하는데, 중앙 시계의 리듬이 약화되고 말초 시계들의 위상이 서로 어긋남에 따라 신체 대사 조절 기능이 점진적으로 손상되며 이는 다양한 대사질환, 심뇌혈관질환 및 퇴행성 뇌 질환 등으로 이어지게 된다. 그러므로 최근에는 생체 리듬 조절을 통해서 노인에서 특히 흔하게 나타나는 다양한 만성 퇴행성 질환을 치료하고 관리해야 한다는 인식 또한 커지고 있다.19,20)
알츠하이머병에 이어 두 번째로 흔한 퇴행성 뇌 질환인 파킨슨병의 경우 환자에게 파킨슨병 특이적인 운동증상이 나타나기 10~20년 전부터 후각저하, 수면장애, 우울증, 피로, 통증, 중심와 시각 저하, 변비 등의 다양한 비운동증상이 나타난다. 실제로 93명의 파킨슨병 환자를 대상으로 한 인터뷰 연구에서 98.8%의 환자들이 파킨슨병을 최초로 진단받기 이전에 평균 7.6개의 증상을 알아차렸으며, 파킨슨병으로 진단받기 평균적으로 10.2년 전부터 그중 한 개 이상의 증상을 가지고 있었다고 회상하였다.21) 운동증상은 중뇌 흑질 도파민 뉴런이 절반 이상 손상되었을 때 뚜렷하게 드러나지만, 그보다 비특이적이면서 다양한 스펙트럼으로 나타날 수 있는 비운동증상은 파킨슨병 전구기 때부터 나타나기 시작하기 때문에 최근 연구자들은 파킨슨병 아형에 따라 각각 다르게 발현되는 비운동증상을 연구함으로써 파킨슨병 각 아형의 병태생리를 정확하게 이해하고 조기에 치료하고자 하는 노력을 기울이고 있다.7)
최근 들어 파킨슨병의 거의 모든 비운동증상이 일주기 리듬 장애와 관련이 있다는 사실이 밝혀져 관련 연구들이 이루어지고 있다.5) 그중에서 특히 파킨슨병의 핵심 병리 기전과 연결되는 도파민의 경우 뇌에서 생체시계 유전자와 긴밀한 상호작용을 하며 일주기 리듬을 조절하는 것으로 밝혀지고 있다.6) 파킨슨병에서 중뇌의 도파민 뉴런은 잘못 접힌(misfolded) 알파-시누클레인이라는 단백질의 축적, 자가포식 시스템의 혼란, 미토콘드리아 기능 저하 및 산화스트레스 등에 의해 손상을 입어 사멸하게 되며,22) 이러한 기전들은 모두 일주기 리듬 장애와 관련이 있다.5) 따라서 도파민 뉴런이 사멸하기 전부터 이와 관련되는 전조 증상들이 일주기 리듬 장애와 맞물려 전구기 증상으로 드러날 것으로 사료된다. 이에 본 논문에서는 도파민 일주기 리듬 손상의 관점에서 파킨슨병의 비운동증상을 재조명해보고자 하였다.
3. 도파민의 생리학적 기능과 일주기 리듬
인체에서 도파민은 신경전달물질이자 호르몬으로 작용한다. 중추신경계에서 도파민의 작용은 운동(locomotion), 각성(wakefulness), 보상 추구 행동(reward-seeking behavior) 등과 관련이 있으며, 도파민은 출생 전 모체와 배아 사이의 시교차상핵 리듬을 동기화시키는 기능을 하는 것으로도 알려져 있다.23) 한편 말초에서도 도파민은 다양한 기능을 하는데, 대표적으로 심혈관계에 작용하면 혈압과 심장 활동을 증가시키며, 신장에 작용하면 혈관을 확장하여 신장 혈류량을 증가시키며, 췌장에서는 인슐린 분비를 조절하며, 눈에서는 모양체 혈류 조절 작용을 한다.24) 사람에서는 말초에 순환하는 도파민 대부분이 황산 도파민(dopamine sulfate)의 형태로 존재한다. 황산 도파민은 아릴설파타아제 A(arylsulfatase A, ARSA)에 의하여 생리 활성을 가지는 도파민으로 전환되는데 사람의 지방세포에서 도파민 수용체와 ARSA가 발현되는 것이 밝혀졌다. 도파민은 뇌하수체에 작용하여 프로락틴의 분비를 억제하는 기능을 하는데, 지방세포에서도 D2R 수용체를 통해 유사한 작용을 하여 지방세포에 의한 프로락틴 호르몬의 분비를 억제하며, 이를 통해 지방형성(adipogenesis)을 저해하고, 지방분해를 촉진시키는 것으로 여겨진다. 또한, 도파민은 지방세포에서 D1R-유사 수용체를 통해 아디포카인(adipokine) 분비를 조절하는 것으로 여겨진다. 도파민의 작용으로 렙틴(leptin)의 분비는 강하게 억제되며, 아디포넥틴(adiponectin)과 인터류킨-6(interleukin-6, IL-6) 분비는 다소 촉진되는 경향이 나타난다 (Table 2).25)
정상 생리학적 상태에서 도파민은 일주기 리듬에 따라 분비된다. 건강한 성인 남성을 대상으로 24시간 동안 앙와위 자세를 유지한 채 30분 간격으로 말초 혈액을 채혈하여 혈장 도파민, 노르에피네프린, 에피네프린 수준을 측정한 한 연구에서는 세 호르몬이 모두 일주기 패턴을 나타내는 것으로 밝혀졌으나 그 중 특히 도파민의 일주기 패턴이 가장 뚜렷한 것으로 드러났다. 연구자들은 이를 도파민이 다른 두 호르몬에 비하여 스트레스, 자세, 신체 활동, 식이 등 순간순간 작용하는 환경 요인의 즉각적인 영향을 적게 받기 때문으로 보았다. 대상자들이 생활하는 공간의 조명은 오후 21시 30분에 꺼지고 오전 6시 30분에 켜졌으며, 이때 혈장 도파민은 오전 3시경에 최저치를, 그리고 오전 8시경에 최고치를 나타내었다. 혈장 도파민 수준은 대상자들이 기상한 직후 가파르게 증가하여 최고점을 찍은 뒤 오후 9시경까지 서서히 감소하였으며, 대상자들이 잠이 든 이후 추가로 감소하는 패턴을 보였다. 노르에피네프린과 에피네프린 또한 비슷한 일주기 패턴을 나타내었으나 24시간 주기 동안 실제 시간과 선형 상관관계가 가장 크게 나타난 호르몬은 도파민이었다.26)
중추신경계에서도 도파민은 일주기 리듬에 따라 분비되고 작용하는 것으로 알려져 있다. 사람을 대상으로 한 연구에서는 뇌척수액(cerebrospinal fluid, CSF)을 통한 간접적인 방법으로 중추신경계의 도파민 일주기 리듬을 측정한 연구들이 보고되어 있다. 3명의 건강인 대상자, 3명의 하지불안증후군 환자, 그리고 3명의 약물치료를 시작하지 않은 초기 파킨슨병 환자를 대상으로 24시간 동안 요추 천자를 통해 뇌척수액 내의 도파민 일주기 리듬을 측정한 연구에서 건강인 대상자 집단의 경우 일주기에 따른 도파민 수치의 증가 또는 감소 경향이 뚜렷하게 나타나지는 않았으나 파킨슨병 환자군의 경우 기상 후 오전에 도파민 수치가 가장 높게 나타났으며, 그 후 점진적으로 감소하여 다음 날 오전 6시경 도파민 수치가 가장 낮게 측정되었다. 하지불안증후군 환자군의 경우 증상이 가장 심해지는 저녁 시간에 도파민 수치가 가장 낮게 측정되는 경향이 드러났다. 하지만 대상자의 수가 적었기 때문에 통계적으로 유의한 패턴은 나타나지 않았으며, 뇌 실질에서 분비되는 호르몬이 뇌척수액을 통해 요추 부위로 운반되기까지는 시간차가 존재하기 때문에 이 또한 결과 해석의 한계로 작용하였다.27)
한편, 설치류에서는 뇌 실질의 도파민 일주기 리듬을 보다 직접적인 방법으로 측정한 연구들이 보고되어 있다. 12시간 어둠, 12시간 빛 조건, 24시간 빛 조건, 그리고 24시간 어둠 조건 아래 미세투석법(microdialysis)을 사용하여 수컷 위스타 쥐(Wistar rat)의 선조체(striatum)와 측좌핵(nucleus accumbens)에서의 도파민 일주기 리듬을 측정한 연구에서는 야행성인 쥐의 활동을 유도하는 어둠 조건을 조성할 때 선조체와 측좌핵에서 세포 외(extracellular) 도파민이 증가해 최고치에 이르렀으며, 빛 조건에서는 세포 외 도파민이 감소해 최저치에 이르렀다. 도파민 대사 산물인 3,4-다이하이드록시페닐아세트산 (3,4-dihydroxyphenylacetic acid, DOPAC) 및 호모바닐산(homovanillic acid, HVA)은 사인파 형태의 일주기 리듬을 나타내었다. 24시간 빛 조건을 조성하였을 때는 쥐의 선조체 및 측좌핵의 도파민 일주기 패턴이 유지되었으며, 도파민 대사 산물의 일주기 패턴 또한 일정 부분 유지되었으나, 선조체에서의 일주기 패턴은 사인파 형태를 따르지는 않았다. 24시간 어둠 조건을 조성하였을 때는 쥐의 선조체 도파민 및 도파민 대사 산물의 일주기 패턴이 모두 소실되었다. 측좌핵에서는 평균적인 도파민 일주기 리듬은 소실된 듯 나타났으나 도파민 대사 산물의 일주기 패턴은 사인파 형태의 일주기 패턴을 보였다. 이러한 결과는 선조체 및 측좌핵 등 뇌 실질에서 도파민이 일주기 패턴에 따라 분비되고 대사되며, 특히 선조체에서는 빛 자극이 도파민 분비 및 대사에 영향을 미침을 시사한다.28)
4. 도파민 일주기 리듬 손상과 파킨슨병의 병태생리
파킨슨병의 대표적인 특징은 중뇌 흑질의 도파민 뉴런 손상이다. 본래 카테콜아민(catecholamine)은 대사 과정에서 세포독성 물질들이 생성되기 때문에 도파민 뉴런을 비롯한 카테콜아민 뉴런은 산화스트레스에 취약하여 중추신경계에서 희소하게 존재하는 것으로 여겨진다.29) 중추신경계에서 도파민 뉴런은 도파민의 지속적인 분비를 통하여 표적 영역의 기능이 잘 발현되도록 하기 위한 박동 조율(pacemaking) 기능을 가지며, 여기에는 L-타입 칼슘(Ca2+) 통로(L-type calcium channel)가 관여한다.30) 노화에 따라 L-타입 칼슘 통로의 전류(current)가 줄어들고 도파민 뉴런의 박동 조율의 정확도가 감소하는 것으로 나타나는데, 이러한 노화에 따른 도파민 뉴런의 생리적 기능 저하가 파킨슨병의 발병 원인 중 하나로 지목되고 있다.31) 또한, 알파-시누클레인 저중합체(oligomer)는 도파민 뉴런으로 칼슘 이온이 유입되도록 유도하여 도파민 뉴런의 칼슘 항상성을 저하시킬 수 있다.32) 도파민 뉴런 내부에 칼슘이 과잉 축적되거나, 지나치게 감소하는 경우 모두 도파민 뉴런의 칼슘 이온을 통한 자율적인 박동 조율 기능에 문제가 생기게 되며 이는 도파민 뉴런의 사멸로 이어질 수 있다.22)
Michel 등은 이와 더불어 도파민 세포의 사멸 기전을 크게 잘못 접힌 알파-시누클레인의 축적, 자가포식 시스템의 혼란, 미토콘드리아 기능 저하, 소포체 스트레스, 그리고 칼슘 항상성 저하 등으로 나누어 설명한다. 파킨슨병 환자에서 잘못 접힌 알파-시누클레인의 축적은 루이소체(Lewy body)와 함께 나타나는 경향이 있으며, 이러한 현상이 일어나는 대표적인 원인으로 리소좀의 자가포식 경로 손상이 주목받고 있다. SNCA 유전자를 2배 또는 3배로 가지고 있는 집단에서 알파 시누클레인의 발현량이 많으므로 파킨슨병의 위험이 더 커지는 것으로 알려져 있는데, 실제로 알파-시누클레인 단백질이 과발현(overexpression)될 경우 세포의 자가포식 기능을 억제하는 작용을 한다. 또한, LRRK2 유전자가 과발현되는 경우에도 잘못 접힌 알파-시누클레인 축적 및 리소좀 기능 저하가 나타나 파킨슨병 위험이 커지는 것으로 알려져 있다. 또한, 리소좀의 GBA 단백질 기능 저하가 잘못 접힌 알파-시누클레인의 축적을 야기하고, 병리적인 알파-시누클레인의 축적이 다시 GBA의 기능을 저해하여 파킨슨병 위험을 증가시킬 수 있다 (Table 3).22) 알파-시누클레인은 주변의 조건에 따라 다양한 형태의 구조를 취하는 것으로 알려져 있는데, 따라서 이 외에도 다양한 종류의 단백질 번역 후 변형(post-translational modification)이 알파-시누클레인의 응집과 독성화로 이어질 수 있다.32)
미토콘드리아 및 미토콘드리아 전자전달계의 복합체 I (complex I) 기능 저하의 경우 파킨슨병 환자 부검을 통해 확인된 바 있으며, 파킨슨병 동물 모델에서 활용하는 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) 또한 미토콘드리아 복합체 I을 저해하여 파킨슨병과 유사한 형태의 비가역적 파킨슨 증후군을 유발하는 것으로 잘 알려져 있다.33) 이러한 복합체 I의 기능 저하는 정상 노화에서도 나타나지만,32) 파킨슨병에서 그 정도가 더 심하게 나타나며, 환자의 중뇌 흑질뿐 아니라 대뇌피질, 골격근, 섬유모세포, 혈소판 등에서 광범위하게 나타나는 것으로 밝혀졌다. 미토콘드리아 기능에는 칼슘 이온(Ca2+) 및 소포체가 관여하므로 파킨슨병에서는 이들의 항상성 조절에 문제가 생기는 것이 미토콘드리아 기능 저하로 이어질 것으로 여겨지고 있다. 더불어 도파민 세포 내에 잘못 접힌 알파-시누클레인이 축적되면 소포체에서부터 미토콘드리아로 칼슘 이온의 전달이 증가하여 미토콘드리아의 팽창 및 기능 저하로 이어지는 현상이 보고되어 있다.33) 소포체는 또한 단백질 접힘(folding)에 관여하므로 소포체 스트레스가 잘못 접힌 알파-시누클레인 축적으로 이어질 것이라는 가설이 여러 실험 연구에서 검증되고 있다.22)
이러한 복합적인 문제들이 모두 일주기 기능 장애(circadian dysfunction)와 관련된다는 보고들이 근래에 증가하고 있다. 먼저, 유전자 이식을 통해 알파-시누클레인이 과발현되도록 변형된 생쥐는 정상 생쥐와 비교하였을 때 노화와 관련되는 운동 능력 상실이 조기에 나타났으며, 낮 동안 시교차상핵 뉴런의 활동 속도(firing rate)가 저하되는 것으로 보고되어 있다.34) 또한, 주변 환경의 신호에 따라 미토콘드리아 생합성(biogenesis)을 조절하는 핵심 인자인 peroxisome proliferator-activated receptor gamma coactivator 1-alpha (PGC-1α) 단백질은 파킨슨병에서 발현이 저해되는 것으로 나타나며, 이는 파킨슨병에서 나타나는 미토콘드리아 기능 저하와도 관련이 있다.32) 산화스트레스에 의해 세포 내의 알파-시누클레인 발현량이 증가하여 핵 내부에도 축적되면 PGC-1α를 암호화하는 유전자인 Ppargc1a의 프로모터에 결합하여 해당 유전자의 활성을 저해시키는데, 이는 정상 노인에게도 어느 정도 나타나는 것으로 보고되는 현상이지만 파킨슨 환자의 경우 그 정도가 훨씬 더 심하게 나타난다. 그로 인하여 파킨슨병에서는 PGC-1α 단백질의 발현이 감소하게 되며, 이는 미토콘드리아 형태 이상, 그리고 복합체 I 기능 저하 등으로 이어지게 된다.35) PGC-1α 단백질은 또한 AMP-activated protein kinase (AMPK), Sirtuin 1 (SIRT1) 등의 효소들과 상호작용하여 대사 조절 작용을 하는데, 이러한 효소들은 생체시계 유전자와 맞물려 작용하는 대사 센서(metabolic sensor)로, 일주기 리듬을 주변 환경에 맞추어 조절하는 기능을 한다. 따라서 일주기 기능 장애 및 그로 인한 대사 이상, 산화스트레스, 미토콘드리아 기능 저하, 알파-시누클레인의 비정상적 축적 등의 문제들이 서로 악순환의 고리를 형성하여 파킨슨병 병태생리를 촉진하는 것으로 보인다.32)
한편, MPTP를 이용한 파킨슨병 영장류 동물 모델에서 24시간 동안 빛 자극이 계속되는 환경이 주어지는 경우 중뇌의 도파민 뉴런의 손상이 확인된 동물들의 수면-활동 주기가 심각하게 손상되거나 완전히 사라지는 것이 관찰되었다. 이 동물들의 시교차상핵 기능에는 문제가 없었기 때문에 연구자들은 중뇌 흑질의 도파민 뉴런 손상 자체가 외부 환경으로부터의 신호가 주어지지 않는 조건에서 선조체의 생체시계 유전자 조절 실패로 이어지는 것으로 보았으며, 그 결과 도파민 뉴런이 손상된 영장류들이 일주기에 따른 운동 조절 능력을 잃어버린다는 결론을 내렸다.36) 유사한 다른 연구에서 수컷 위스타 쥐에게 독성 물질인 6 hydroxy-dopamine을 주입하여 도파민 뉴런 손상을 유발하였던 또 다른 연구에서는 배측(dorsal) 선조체의 생체시계 유전자 리듬의 손상이 확인되었는데 특히 생체시계 단백질인 Period2 (PER2)의 발현 조절에 문제가 생기는 것이 확인되었다. 또한, 저자들은 약물을 사용하여 도파민 수용체를 활성화함으로써 선조체 영역의 생체시계 유전자 리듬을 복원할 수 있음을 밝혔다.37) 이러한 결과들은 도파민 뉴런 자체가 표적 영역의 생체 리듬 조절에 관여하며, 도파민 뉴런의 리듬 조절 기능이 손상됨에 따라 일주기 리듬의 손상이 야기될 수 있음을 시사한다.
5. 도파민 리듬 손상과 파킨슨병 전구기 증상
최근 Korshunov 등의 보고에 의하면 도파민은 망막, 후신경구, 선조체, 복측 피개부 등에서 일주기 활성을 보이며 생체시계 유전자와 서로 영향을 주고받는다. 망막에서의 도파민 리듬은 멜라토닌 의존적으로 나타나며, 망막의 도파민 D1 수용체는 Per2 유전자에 영향을 미치고, 도파민 D2 수용체는 CLOCK:BMAL1 복합체를 통하여 Per1 유전자에 영향을 미친다. 또한, 도파민은 망막에서 멜라토닌의 활동과 생성을 억제하고 조절한다.6) 도파민이 망막에서 정상적으로 기능하지 못하는 경우 망막의 일주기 리듬이 소실되며, 더불어 원뿔 세포(cone cell)에 의한 고해상도(high-resolution)의 명순응 시각 (light-adapted vision), 대비 민감도(contrast sensitivity), 그리고 시력(visual acuity)이 저해되는 것이 생쥐 실험을 통해 확인되었다.38) 파킨슨병 환자 또한 망막에서 도파민 수준이 저하되어 있고, 도파민 세포가 존재하는 망막 층이 얇아져 있다는 것이 보고되어 있으며, 이러한 현상이 중심와 시각(foveal vision)과 대비 민감도 저하, 그리고 빛 적응 문제 등의 증상과 관련이 있을 것이라고 여겨진다.6) 더불어 색상 구별과 대조 식별이 어려워지고 시야가 흐려지는 증상 등은 모두 도파민 조절 문제와 관련되는 파킨슨병의 전구기에 나타날 수 있는 증상이다.39)
포유동물이 후각 정보를 받아들이고 처리하는 부위인 후신경구 또한 일정량의 도파민 뉴런을 포함하고 있다. 후신경구는 망막과 마찬가지로 독자적인 일주기 리듬을 나타내는데, 그 기전은 아직 명확하게 밝혀져 있지 않다. 다만, 쥐의 후신경구에서 도파민 일주기 리듬이 나타나는 것으로 보아 도파민이 후신경구 자체의 일주기 리듬에 영향을 미치는 것으로 여겨지고 있다. 후신경구에서는 도파민이 활성이 아닌 억제 기능을 가지며, 후각 신호를 여과하는 기능을 하는데, 설치류에서는 빛 자극이 있는 동안 후신경구의 도파민 수준이 증가하며 이는 동물이 수면 상태일 때 보다 중요한 후각 정보를 선택적으로 전달하기 위한 기능으로 보인다.6) 사람의 후신경구에서도 도파민은 유사한 기능을 하는데, 아이러니하게도 노인과 파킨슨병 환자에서는 후신경구의 도파민 활성이 증가되어 있는 경향이 나타난다. 후각 저하는 파킨슨병의 대표적인 전구기 증상의 하나인데, 이는 파킨슨병 환자의 후신경구에서 도파민이 과도하게 작용하고, 그 결과 도파민 수용체 중 D2R이 과도하게 활성화되어 후각 기능을 저해하는 결과로 나타나는 것으로 여겨진다.40)
한편, 중뇌에는 흑질과 복측 피개부(ventral tegmental area, VTA)에 도파민 뉴런이 존재한다. 흑질의 도파민 뉴런은 선조체로, 그리고 복측 피개부의 도파민 뉴런은 피질과 변연계로 도파민 신호를 전달한다. 선조체는 도파민 신호의 영향을 크게 받는 영역으로, 다양한 생체시계 유전자들이 선조체에서 도파민에 의해 조절되는 것이 확인된 바 있다. 따라서 중뇌의 도파민 뉴런 소실이 파킨슨병의 운동증상뿐 아니라 비운동증상에도 직접적인 영향을 미치는 것으로 여겨지며 실제로도 그러한 증거들이 증가하고 있다.6) 앞선 MPTP를 사용한 파킨슨 동물 모델에서 확인할 수 있듯이 흑질에서 선조체로의 도파민 신호 손상은 외부 빛 자극이 교란되는 상황에서 일주기에 따른 운동 조절 능력의 소실을 야기한다.36) 또한, 유전자 변형으로 인하여 파킨슨증이 유발되는 MitoPark 생쥐는 시간이 지남에 따라 도파민 뉴런에 퇴행성 변화가 나타나면서 동시에 일주기에 따른 운동 조절 능력이 교란되며, 어둠이 지속되는 환경에서는 아예 일주기성 활동 리듬이 소실되고, 그 이후 다시 빛 자극에 노출되더라도 일주기 리듬은 회복되지 않았다.41)
복측 피개부에서는 도파민 등 카테콜라민 생합성에 관여하는 효소인 tyrosine hydroxylase(TH)가 일주기 리듬에 따라 발현되며, 생체시계 유전자인 CLOCK 및 REV-ERBα에 의해서는 발현이 억제된다. Clock 또는 Rev-Erbα 유전자가 정상 기능을 하지 않는 쥐의 복측 피개부에서는 TH의 발현이 증가되어 있으며, 도파민 뉴런의 활동 속도(firing rate) 또한 증가되어 있고, 쥐가 탐닉 행동 또는 조증 유사 행동을 보이기도 한다.6) 2015년 Alberico 등이 파킨슨병 환자 대상 연구 결과를 종합한 결과를 보면 환자에서 복측 피개부 손상이 뚜렷하게 나타나는 것으로 보이지만, 중뇌 흑질의 손상 정도와 비교했을 때 그 정도가 심하지는 않은 것으로 나타났다. 복측 피개부의 도파민 뉴런은 실제로 흑질의 도파민 뉴런에 비하면 도파민을 적게 분비하며, 따라서 카테콜라민 대사로 인한 산화스트레스 또한 덜 심할 것으로 여겨진다. 한편, 환자에 따른 복측 피개부 손상 정도가 상이하게 나타났는데, 연구진은 이를 파킨슨병 환자의 임상 양상이 다양하게 나타나는 것과도 관련이 있을 것으로 보았다. 아직은 가설의 단계이나, 복측 피개부에서 전전두엽과 같은 대뇌피질로 이어지는 도파민 회로 손상 시 환자가 집행 및 인지 기능 저하에 취약해질 수 있으며, 변연계로 연결되는 도파민 회로 손상 시에는 환자가 불안, 우울 등과 같은 정서 문제에 취약해질 수 있을 것이다 (Table 4).42)
다른 한편으로는, 파킨슨병의 전구기부터 나타나는 일주기 기능 장애 그 자체 또한 수면장애, 그리고 비만, 인슐린 저항성과 같은 대사 장애를 동반하는 우울증이나 양극성 장애 등 정서 장애와 관련이 있다.43) 인슐린 저항성은 흔히 자율신경 불균형을 동반하며, 제2형 당뇨뿐 아니라 대사성 질환, 퇴행성 뇌 질환 등 다양한 질환의 위험 인자로 작용한다. 불규칙한 생활 습관, 생체시계 유전자 변이, 수면장애 등은 모두 일주기 기능 장애로 이어지며 여기에 인슐린 저항성이 동반되는 것으로 여겨진다.44) 뇌에서 인슐린은 알파-시누클레인 응집을 억제하고, 도파민 생성 및 미토콘드리아 생합성을 촉진시키고, 신경염증 및 산화스트레스를 억제하는 기능을 한다.45) 수면장애와 인슐린 저항성은 모두 파킨슨병의 위험 인자로 잘 알려져 있다.46,47) 인슐린 저항성의 경우 당뇨병을 동반하지 않는 파킨슨병 환자에게서도 빈번하게 나타나며 신경의 퇴행 과정 및 질병 진행을 가속할 수 있으므로 주의가 필요하다.47) 한편, 수면장애를 동반하는 파킨슨병 환자에서 피로 증상을 호소하는 경우가 많았으며, 특히 렘수면행동장애를 가지고 있는 환자의 경우 피로 증상이 더 심하게 나타나는 것으로 확인되어 수면장애와 피로 증상의 관련성을 시사하였다.48) 자기공명영상 연구를 통해 확인한 결과 렘수면 행동장애 양상을 나타내는 파킨슨병 환자 및 전구기 환자의 경우 글림프 시스템(glymphatic system) 기능이 저하되어 있는 것으로 나타나며, 이는 알파-시누클레인병증과 연관이 있어 수면장애가 파킨슨병으로 이어지는 악순환의 고리가 있음을 시사한다.49)
2011년 Morris 등에 의한 동물 연구에서 인슐린 저항성으로 인한 흑질 도파민 기능 손상이 확인된 바 있다. 고지방식이에 노출된 쥐들은 일반적인 식이에 노출된 쥐에 비해 산화스트레스, 내당능장애 및 인슐린 저항성이 높은 것으로 나타났으며, 반면 선조체에서 도파민 분비 및 청소는 감소하였다. 또한, 자기공명영상으로 확인 시 고지방식이에 노출된 쥐들의 중뇌 흑질에서는 철분 축적이 증가한 것이 확인되었다. 이는 고지방식이를 한 쥐의 중뇌 흑질에서 인슐린 신호 증가로 인하여 철분 수송 및 축적이 증가한 것으로 여겨지며, 미토콘드리아 내 철분의 비정상적인 축적은 미토콘드리아의 산화적 손상을 초래하기 때문에 이러한 결과는 파킨슨병 발병 과정과도 관련이 있을 것으로 저자들은 결론지었다.50)
2015년 Kleinridders 등은 뇌에서 인슐린 수용체(insulin receptor)를 녹아웃 시킨 NIRKO 생쥐에서 뇌의 미토콘드리아 기능 장애 및 활성산소가 증가하였으며, 선조체 및 측좌핵에서 지질 및 단백질 산화가 증가하였음을 관찰하였다. 또한, NIRKO 생쥐들의 해당 뇌 영역에서 모노아민 산화 효소(monoamine oxidase, MAO) A와 B의 수준이 증가하였으며, 이는 도파민의 회전율(turnover) 증가로 이어짐을 관찰하였다. 또한, 이 생쥐들은 노화와 관련되는 불안 및 우울증 유사 행동을 나타내게 되는데 이는 MAO 억제제 투여를 통해 회복시킬 수 있다. 결론적으로 뇌의 인슐린 저항성은 미토콘드리아와 도파민 기능 장애를 야기하며, 이는 불안 및 우울 관련 행동으로 이어진다.51) 인슐린은 도파민을 분해하는 MAO 조절을 통하여 도파민 반감기를 조절할 뿐 아니라, 도파민 재흡수 수송체 (dopamine reuptake transporter, DAT) 발현을 유도한다. 또한, 식이로 인하여 인슐린 저항성이 유발되었을 때 도파민의 생성에 관여하는 속도제한 효소인 티로신 수산화효소(tyrosine hydroxylase)가 감소하게 된다. 이렇듯 뇌에서 도파민 시스템은 인슐린에 의하여 조절되기 때문에 인슐린 저항성은 불안, 우울, 산화스트레스, 미토콘드리아 기능 장애 등 파킨슨병의 다양한 전구기 증상 및 병태생리와도 많은 관련이 있다.52)
6. 파킨슨병에서 미병 개념의 임상적 의의
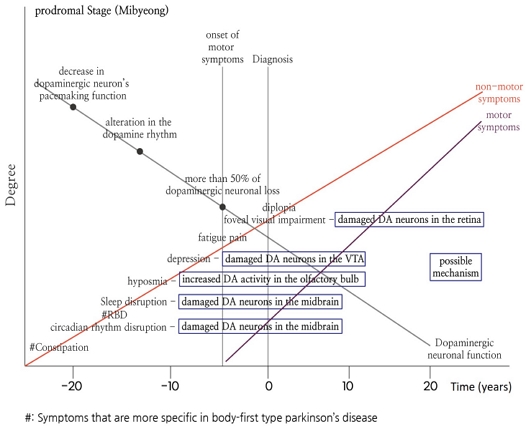
한의학에서 미병은 신체의 내부 및 외부와의 평형이 잘 보존되어 신체적, 정신적, 사회적으로 안녕한 상태인 건강 상태에서부터 비가역적으로 완전히 병든 상태에 이르기까지의 연속 선상에서 아직 만성 질환에 이르지 않은 과도기적 중간 상태를 지칭하는 용어다. 이 등은 미병 상태를 크게 병리 증상이 나타나지 않은 건강미병(健康未病)상태, 이미 병리적인 증상이 인체 내에 잠재되어 있으나 아직 임상적인 표현으로는 나타나지 않은 잠병미병(潛病未病)상태, 그리고 특정 질환에 관한 임상 양상이 아직 명확하게 두드러지지는 않으나 정상인에 비하면 활동 효율이 떨어지며, 발병에 가까워지면 전조 증상이 드러나는 전병미병(前病未病)의 세 가지 단계로 분류하였다.53) 파킨슨병과 같은 퇴행성 뇌 질환의 경우 발병 과정이 아주 긴 편이며, LRRK2, GBA 등 파킨슨병과 관련이 있는 돌연변이를 지닌 환자도 발병 전에는 외부 임상 표현으로는 나타나지 않는 잠병미병의 단계를 거친다. 또한, 변비와 같은 임상 증상은 파킨슨병의 비운동증상 중 하나이며 대규모 역학 조사 결과 파킨슨병으로 진단되기 십여 년 전부터 나타날 수 있음이 밝혀졌으나,54) 변비 증상 그 자체만으로는 질환으로 간주하기 어려우며, 노인을 포함한 일반 인구에서 비특이적으로 흔하게 나타날 수 있어 이 또한 잠병미병의 단계로 볼 수 있을 것이다.55) 보다 일반적으로 파킨슨병의 잠병미병 단계에서는 일주기 장애 및 이에 동반하는 인슐린 저항성과 같은 대사 변화, 신경염증, 산화스트레스가 나타난다(Fig. 2). 인슐린 저항성은 또한 파킨슨병 전구기 증상에 해당하는 우울, 불안과 같은 정서 장애뿐 아니라 동물 연구에 의하면 뇌의 도파민 시스템 조절 장애 및 중뇌 흑질 철분 축적 증가 등으로 이어지므로 이러한 대사 문제가 만성화되지 않도록 초기에 관리하는 것이 매우 중요하다.50-52)
이어서 파킨슨병 전구기에 해당하는 전병미병 단계를 살펴보면, 뇌에서 먼저 발병하는 유형의 경우 전구기에 렘수면행동장애를 동반하지 않는 경우가 많으며, 전조 증상으로 진전과 같은 운동증상이 나타날 수 있다. 한편, 몸에서 먼저 발병하는 유형의 경우 전구기에 렘수면행동장애, 자율신경실조증 및 이에 따른 피로 증상이 더 흔하게 나타난다. 알파-시누클레인 병태생리는 뇌에서 먼저 발병하는 유형의 경우 중뇌를 포함한 뇌에서 먼저 시작되는 반면, 몸에서 먼저 발병하는 유형의 경우 변비가 나타나며 장신경총에서부터 알파-시누클레인 병태생리가 먼저 시작되면서 미주신경을 통해 심장 자율신경을 침범하여 자율신경실조증을 유발하고, 이어서 뇌간을 타고 중뇌를 침범하는 과정을 거치는 것으로 알려져 있다.7,12) 보다 일반적으로 파킨슨병의 전병미병 단계에서 잘못 접힌 알파-시누클레인이 신경세포 내부에 축적되며 도파민 뉴런의 박동 조율 기능이 점차 소실되고, 수면장애, 후각저하, 우울증, 통증, 중심와 시각 저하 등의 전구기 증상들이 나타나게 된다(Fig. 2).
파킨슨병 특이적인 운동증상이 나타나며 환자가 임상적으로 진단을 받게 되는 시점에서 환자의 도파민 뉴런 기능은 이미 절반 이상 소실된 상태이다. 이는 질환이 이미 비가역적으로 진행된 상황으로(Fig. 2), 도파민성 약물을 통한 대증 요법을 통해 환자의 운동 기능 및 삶의 질을 개선하는 방법 외에 현재 뚜렷한 치료 방법이 제시되어 있지 않다.4) 유 등은 미병을 아건강과 같은 개념으로 보고, 이를 인체의 병변이 아직 기질적인 단계에는 이르지 않은, 기능적인 단계에서의 문제로 파악하였다.56) 장 등이 개발한 미병 설문지의 경우, 피로, 통증, 불면증, 소화불량, 우울증, 분노, 불안 등 7개 증상의 불편 정도, 지속 기간, 그리고 회복력을 통해 미병 점수를 계산한다.57) 미병 설문지에서 수집하는 이러한 증상들은 파킨슨병의 전구기 증상들과도 대부분 일치한다. 파킨슨병의 경우, 질환의 전구기 때부터 나타나는 일주기 장애 및 그로 인한 대사 이상, 신경염증, 산화스트레스가 질환의 위험 인자 및 악화 요인으로 작용한다. 또한, 일주기 교란으로 인해 도파민 뉴런이 손상되고, 도파민 뉴런의 기능이 점차 감소함에 따라 수면장애, 후각저하, 피로, 우울감, 중심와 시각 저하 등의 비운동증상, 그리고 더 나아가 운동증상으로 이어지게 된다(Fig. 3).4) 파킨슨병과 같은 만성 퇴행성 질환의 경우, 비가역적이며, 기질적인 손상이 나타나기 이전 단계인 비교적 가역적이며, 기능적인 손상만이 존재하는 미병 단계에 교란된 일주기 리듬과 대사 이상을 회복시키고, 신경염증 및 산화스트레스가 만성화되지 않도록 관리하는 것이 매우 중요할 것이다.
7. 파킨슨병 전구기 증상 관리를 위한 한의학적 양생법
인슐린 저항성에 의하여 도파민 시스템이 교란되고, 도파민 뉴런 기능이 소실되는 파킨슨병 전구기에는 수면장애, 변비, 피로, 불안, 우울 등의 비운동증상이 먼저 드러나며, 이후 도파민 뉴런의 기능이 절반 이상 소실되었을 때 운동증상이 나타나기 시작한다. 파킨슨병 특이적 운동증상이 나타나며 환자가 임상적으로 진단을 받게 되는 시점에는 이미 중뇌 흑질 손상이 비가역적으로 진행된 상태이다. 따라서 파킨슨병의 조기 진단 및 효율적 관리를 위하여 전구기부터 드러나기 시작하는 비운동증상에 주목할 필요가 있다.3,4) 이러한 비운동증상은 일주기 리듬 장애 및 인슐린 저항성과 깊은 관련이 있다. 가장 오래된 한의학 고전 중 하나인 『黃帝內經』에서는 지구 환경의 낮과 밤을 상징하는 음양(陰陽)과 사계절(四時)의 리듬에 따른 운동 및 섭생 조절 방법인 양생을 강조한다.17) 불규칙한 생활로 인한 일주기 리듬의 교란은 파킨슨병을 포함한 다양한 퇴행성 뇌 질환 및 정신질환, 만성 대사성 질환, 암, 심뇌혈관질환이 발생하는 원인으로 작용한다. 일주기 리듬은 또한 나이가 들수록 감퇴하기 때문에 운동과 섭생 조절을 통하여 노화에 따라 쉽게 교란되는 일주기 리듬을 지속해서 재동기화시킬 필요가 있다.19,20)
양생을 통한 건강 관리는 전구기 뿐 아니라 이미 파킨슨병이 진행된 환자에게도 필수적이다. 파킨슨병에 가장 효과적인 약물은 1960년대에 소개된 레보도파이지만, 도파민제는 복용 기간 및 용량이 증가함에 따라 약효가 나타나는 시간이 감소하며, 환자는 운동증상과 비운동증상 등이 나타나는 약효 소진(wearing-off) 현상을 경험하게 된다.58,59) 이러한 약효 소진 현상을 완화시키기 위해서는 약물 민감도 및 대사 조절과도 긴밀하게 상호작용을 하는 일주기 리듬 조절을 통해 체내 항상성 조절 기능을 회복시킬 필요가 있을 것으로 사료된다. 이렇듯 양생을 통한 미병 관리는 파킨슨병 환자에게 필수적이며, 또한 과거부터 한의학에서 중요하게 다루어지는 개념이기도 하였으나, 현대에 와서 구체적인 정의를 내리기가 모호하고 실제에 적용하기가 어려워 현재 미병 치료를 위한 중재 임상연구가 부족한 실정이다.60) 따라서 향후 파킨슨병과 같은 퇴행성 뇌 질환의 전구기 증상인 수면장애, 변비, 피로, 불안, 우울 등의 적극적인 관리를 목적으로 하는 한의 양생 프로그램 개발을 위한 연구가 활발하게 이루어져서 점차 진행되고 있는 인구 고령화에 적극적으로 대비하고 국민 건강을 도모할 필요가 있을 것이다.
결 론
종합하면, 일주기 장애, 수면장애, 렘수면행동장애, 피로, 후각저하, 중심와 시각 저하 등은 도파민 뉴런의 기능 저하로 인해 파킨슨병의 전구기 단계에서 나타날 수 있다. 또한, 인슐린 저항성과 같은 대사 문제는 파킨슨병의 전구기 증상으로 여겨지지는 않으나 만성 대사성 질환, 심뇌혈관질환, 퇴행성 뇌 질환, 암 등 다양한 질환에 선행하여 나타나는 것으로 알려져 있으며, 도파민성 시스템에 문제를 일으킬 수 있어 파킨슨병의 위험 인자 및 악화 요인으로도 작용한다. 파킨슨병 전구기에 나타나는 비운동증상은 다른 여러 질환에도 선행하거나 동반될 수 있는 증상들이 대부분이기 때문에 전구기 증상을 바탕으로 파킨슨병을 조기에 진단하기 위해서는 향후 파킨슨병의 아형에 따라 전구기 때부터 나타날 수 있는 비운동증상의 패턴에 관한 깊이 있는 연구가 필요할 것으로 사료된다. 이러한 비운동증상은 일주기 장애와 깊은 관련이 있으며, 일주기 조절의 문제가 파킨슨병의 여러 병리 기전들과 서로 맞물려 질병 진행이 가속화된다는 사실이 최근 들어 학계에서 주목받고 있다. 따라서 인구 고령화로 각종 만성 질환이 증가하고 있는 현대 사회에서 파킨슨병과 같은 퇴행성 뇌 질환의 조기 예방 및 치료를 위해 일주기에 따른 생활 습관 교정 및 식이 조절 등을 통한 양생(養生)의 역할이 점차 중요해질 것으로 보인다.5,7,32)
Acknowledgments
본 연구는 보건복지부의 재원으로 한국보건산업진흥원의 보건의료기술연구개발사업 지원에 의하여 이루어진 것임 (과제고유번호: HF20C0174).
References
-
Lee JE, Choi JK, Lim HS et al. The prevalence and incidence of Parkinson’s disease in South Korea: a 10-year nationwide population–based study. J Korean Neurol Assoc. 2017;35(4):191-8.
[https://doi.org/10.17340/jkna.2017.4.1]

-
Park JH, Kim DH, Kwon DY et al. Trends in the incidence and prevalence of Parkinson’s disease in Korea: a nationwide, population-based study. BMC Geriatr. 2019;19(1):1-0.
[https://doi.org/10.1186/s12877-019-1332-7]

-
Olanow CW, Obeso JA. The significance of defining preclinical or prodromal Parkinson's disease. Mov Disord. 2012;27(5):666-9.
[https://doi.org/10.1002/mds.25019]

-
Schapira AH, Chaudhuri K, Jenner P. Non-motor features of Parkinson disease. Nat Rev Neurosci. 2017;18(7):435-50.
[https://doi.org/10.1038/nrn.2017.62]

-
Liu Y, Niu L, Liu X et al. Recent progress in non-motor features of parkinson’s disease with a focus on circadian rhythm dysregulation. Neurosci Bull. 2021;37(7):1010-24.
[https://doi.org/10.1007/s12264-021-00711-x]

-
Korshunov KS, Blakemore LJ, Trombley PQ. Dopamine: a modulator of circadian rhythms in the central nervous system. Front Cell Neurosci. 2017;11:91.
[https://doi.org/10.3389/fncel.2017.00091]

-
Berg D, Borghammer P, Fereshtehnejad SM et al. Prodromal Parkinson disease subtypes—key to understanding heterogeneity. Nat Rev Neurol. 2021;17(6):349-61.
[https://doi.org/10.1038/s41582-021-00486-9]

-
Nguyen AP, Tsika E, Kelly K et al. Dopaminergic neurodegeneration induced by Parkinson's disease-linked G2019S LRRK2 is dependent on kinase and GTPase activity. Proc Natl Acad Sci. 2020;117(29):17296-307.
[https://doi.org/10.1073/pnas.1922184117]

-
Sidransky E, Lopez G. The link between the GBA gene and parkinsonism. Lancet Neurol. 2012;11(11):986-98.
[https://doi.org/10.1016/S1474-4422(12)70190-4]

-
Migdalska‐Richards A, Schapira AH. The relationship between glucocerebrosidase mutations and Parkinson disease. J Neurochem. 2016;139:77-90.
[https://doi.org/10.1111/jnc.13385]

-
O’Regan G, deSouza RM, Balestrino R et al. Glucocerebrosidase mutations in Parkinson disease. J Parkinsons Dis. 2017;7(3):411-22.
[https://doi.org/10.3233/JPD-171092]

-
Horsager J, Andersen KB, Knudsen K et al. Brain-first versus body-first Parkinson’s disease: a multimodal imaging case-control study. Brain. 2020;143(10):3077-88.
[https://doi.org/10.1093/brain/awaa238]

-
Gu Z, Wang B, Zhang YB et al. Association of ARNTL and PER1 genes with Parkinson's disease: a case-control study of Han Chinese. Sci Rep. 2015;28;5(1):15891.
[https://doi.org/10.1038/srep15891]

-
Lou F, Li M, Ren Y et al. CLOCK rs1801260 polymorphism is associated with susceptibility to Parkinson’s disease in a Chinese population. Neurosci Bull. 2017;33:734-6.
[https://doi.org/10.1007/s12264-017-0167-5]

-
Lou F, Li M, Luo X et al. CLOCK 3111T/C variant correlates with motor fluctuation and sleep disorders in chinese patients with Parkinson’s Disease. Parkinsons Dis. 2018;2018:4670380.
[https://doi.org/10.1155/2018/4670380]

- MEDICLASSICS [internet]. Daejeon: Korea Institute of Oriental Medicine. [2015]-. [cited 2022 Aug 30]. Available from: https://www.mediclassics.kr/
-
Park M, Yoo H, Cho J et al. Lifestyles according to the seasons in the <Hwangjenaegyeong Somun Sagijosindaelon> re-examined from the perspective of modern researches on circadian clock. Korean J Subhealth Med. 2023;4(1):11-22.
[https://doi.org/10.37928/kjsm.2023.4.1.11]

- Bae S, Park M, Lee S et al. The Significance of Managing “Mibyeng” in Geriatric Health by Focusing on the Connection between Korean Medicine and Psychology: A Review. J Orient Neuropsychiatry. 2020;31(2):109-19.
-
Liu F, Chang HC. Physiological links of circadian clock and biological clock of aging. Protein & Cell. 2017;8(7):477-88.
[https://doi.org/10.1007/s13238-016-0366-2]

-
Chang HC, Guarente L. SIRT1 mediates central circadian control in the SCN by a mechanism that decays with aging. Cell. 2013;153(7):1448-60.
[https://doi.org/10.1016/j.cell.2013.05.027]

-
Gaenslen A, Swid I, Liepelt‐Scarfone I et al. The patients' perception of prodromal symptoms before the initial diagnosis of Parkinson's disease. Mov Disord. 2011;26(4):653-8.
[https://doi.org/10.1002/mds.23499]

-
Michel PP, Hirsch EC, Hunot S. Understanding dopaminergic cell death pathways in Parkinson disease. Neuron. 2016;90(4):675-91.
[https://doi.org/10.1016/j.neuron.2016.03.038]

-
Grippo RM, Purohit AM, Zhang Q et al. Direct midbrain dopamine input to the suprachiasmatic nucleus accelerates circadian entrainment. Curr Biol. 2017;27(16):2465-75.
[https://doi.org/10.1016/j.cub.2017.06.084]

-
Bucolo C, Leggio GM, Drago F et al. Dopamine outside the brain: The eye, cardiovascular system and endocrine pancreas. Pharmacol Ther. 2019;203:107392.
[https://doi.org/10.1016/j.pharmthera.2019.07.003]

-
Borcherding DC, Hugo ER, Idelman G et al. Dopamine receptors in human adipocytes: expression and functions. PloS One. 2011;6(9):e25537.
[https://doi.org/10.1371/journal.pone.0025537]

-
Sowers JR, Vlachakis N. Circadian variation in plasma dopamine levels in man. J Endocrinol Investig. 1984;7(4):341-5.
[https://doi.org/10.1007/BF03351014]

-
Poceta JS, Parsons L, Engelland S et al. Circadian rhythm of CSF monoamines and hypocretin-1 in restless legs syndrome and Parkinson’s disease. Sleep Med. 2009;10(1):129-33.
[https://doi.org/10.1016/j.sleep.2007.11.002]

-
Castaneda TR, de Prado BM, Prieto D et al. Circadian rhythms of dopamine, glutamate and GABA in the striatum and nucleus accumbens of the awake rat: modulation by light. J Pineal Res. 2004;36(3):177-85.
[https://doi.org/10.1046/j.1600-079X.2003.00114.x]

-
Goldstein DS, Kopin IJ, Sharabi Y. Catecholamine autotoxicity. Implications for pharmacology and therapeutics of Parkinson disease and related disorders. Pharmacol Ther. 2014;144(3):268-82.
[https://doi.org/10.1016/j.pharmthera.2014.06.006]

-
Guzman JN, Sánchez-Padilla J, Chan CS et al. Robust pacemaking in substantia nigra dopaminergic neurons. J Neurosci. 2009;29(35):11011-9.
[https://doi.org/10.1523/JNEUROSCI.2519-09.2009]

-
Branch SY, Sharma R, Beckstead MJ. Aging decreases L-type calcium channel currents and pacemaker firing fidelity in substantia nigra dopamine neurons. J Neurosci. 2014;34(28):9310-8.
[https://doi.org/10.1523/JNEUROSCI.4228-13.2014]

-
Phillipson OT. Alpha-synuclein, epigenetics, mitochondria, metabolism, calcium traffic, & circadian dysfunction in Parkinson’s disease. An integrated strategy for management. Ageing Res Rev. 2017;40:149-67.
[https://doi.org/10.1016/j.arr.2017.09.006]

-
Franco-Iborra S, Vila M, Perier C. The Parkinson disease mitochondrial hypothesis: where are we at?. Neuroscientist. 2016;22(3):266-77.
[https://doi.org/10.1177/1073858415574600]

-
Kudo T, Loh DH, Truong D et al. Circadian dysfunction in a mouse model of Parkinson's disease. Experimental neurology. 2011;232(1):66-75.
[https://doi.org/10.1016/j.expneurol.2011.08.003]

-
Siddiqui A, Chinta SJ, Mallajosyula JK et al. Selective binding of nuclear alpha-synuclein to the PGC1alpha promoter under conditions of oxidative stress may contribute to losses in mitochondrial function: implications for Parkinson’s disease. Free Radic Biol Med. 2012;53(4):993-1003.
[https://doi.org/10.1016/j.freeradbiomed.2012.05.024]

-
Fifel K, Vezoli J, Dzahini K et al. Alteration of daily and circadian rhythms following dopamine depletion in MPTP treated non-human primates. PloS One. 2014;9(1):e86240.
[https://doi.org/10.1371/journal.pone.0086240]

-
Hood S, Cassidy P, Cossette MP et al. Endogenous dopamine regulates the rhythm of expression of the clock protein PER2 in the rat dorsal striatum via daily activation of D2 dopamine receptors. Journal of neuroscience. 2010;30(42):14046-58.
[https://doi.org/10.1523/JNEUROSCI.2128-10.2010]

-
Jackson CR, Ruan GX, Aseem F et al. Retinal dopamine mediates multiple dimensions of light-adapted vision. J Neurosci. 2012;32(27):9359-68.
[https://doi.org/10.1523/JNEUROSCI.0711-12.2012]

-
Chaudhuri KR, Schapira AH. Non-motor symptoms of Parkinson's disease: dopaminergic pathophysiology and treatment. Lancet Neurol. 2009;8(5):464-74.
[https://doi.org/10.1016/S1474-4422(09)70068-7]

-
Mundinano IC, Caballero MC, Ordóñez C et al. Increased dopaminergic cells and protein aggregates in the olfactory bulb of patients with neurodegenerative disorders. Acta Neuropathol. 2011;122(1):61-74.
[https://doi.org/10.1007/s00401-011-0830-2]

-
Fifel K, Cooper HM. Loss of dopamine disrupts circadian rhythms in a mouse model of Parkinson's disease. Neurobiol Dis. 2014;71:359-69.
[https://doi.org/10.1016/j.nbd.2014.08.024]

-
Alberico SL, Cassell MD, Narayanan NS. The vulnerable ventral tegmental area in Parkinson’s disease. Basal Ganglia. 2015;5(2-3):51-5.
[https://doi.org/10.1016/j.baga.2015.06.001]

-
Barandas R, Landgraf D, McCarthy MJ et al. Circadian clocks as modulators of metabolic comorbidity in psychiatric disorders. Curr Psychiatry Rep. 2015;17(12):1-2.
[https://doi.org/10.1007/s11920-015-0637-2]

-
Stenvers DJ, Scheer FA, Schrauwen P et al. Circadian clocks and insulin resistance. Nat Rev Endocrinol. 2019;15(2):75-89.
[https://doi.org/10.1038/s41574-018-0122-1]

-
Fiory F, Perruolo G, Cimmino I et al. The relevance of insulin action in the dopaminergic system. Front Neurosci. 2019;13:868.
[https://doi.org/10.3389/fnins.2019.00868]

-
Lauretti E, Di Meco A, Merali S et al. Circadian rhythm dysfunction: a novel environmental risk factor for Parkinson’s disease. Mol Psychiatry. 2017;22(2):280-6.
[https://doi.org/10.1038/mp.2016.47]

-
Hogg E, Athreya K, Basile C, Tan EE, Kaminski J, Tagliati M. High prevalence of undiagnosed insulin resistance in non-diabetic subjects with Parkinson’s disease. J Parkinson's Dis. 2018;8(2):259-65.
[https://doi.org/10.3233/JPD-181305]

-
Cao XY, Zhang JR, Shen Y et al. Fatigue correlates with sleep disturbances in Parkinson disease. Chin Med J. 2021;134(06):668-74.
[https://doi.org/10.1097/CM9.0000000000001303]

-
Si X, Guo T, Wang Z, Fang Y et al. Neuroimaging evidence of glymphatic system dysfunction in possible REM sleep behavior disorder and Parkinson’s disease. NPJ Parkinsons Dis. 2022;8(1):54.
[https://doi.org/10.1038/s41531-022-00316-9]

-
Morris JK, Bomhoff GL, Gorres BK et al. Insulin resistance impairs nigrostriatal dopamine function. Exp Neurol. 2011;231(1):171-80.
[https://doi.org/10.1016/j.expneurol.2011.06.005]

-
Kleinridders A, Cai W, Cappellucci L et al. Insulin resistance in brain alters dopamine turnover and causes behavioral disorders. Proc Natl Acad Sci. 2015;112(11):3463-8.
[https://doi.org/10.1073/pnas.1500877112]

-
Kleinridders A, Pothos EN. Impact of brain insulin signaling on dopamine function, food intake, reward, and emotional behavior. Curr Nutr Rep. 2019;8:83-91.
[https://doi.org/10.1007/s13668-019-0276-z]

- Lee SD, Kim MD. Study on the Siginificance and Importance of Preclinic Phase Theory (= mibyung) in Oriental Medicine. J Soc Prev Kor Med. 1997;1(1):105-17.
-
Adams-Carr KL, Bestwick JP, Shribman S et al. Constipation preceding Parkinson's disease: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry. 2016;87(7):710-6.
[https://doi.org/10.1136/jnnp-2015-311680]

-
Gallegos-Orozco JF, Foxx-Orenstein AE, Sterler SM, Stoa JM. Chronic constipation in the elderly. Off J Am Coll Gastroenterol ACG. 2012;107(1):18-25.
[https://doi.org/10.1038/ajg.2011.349]

- Ryu JM, Park YB, Park YJ. A study on validity of the Korean version of the subhealth questionnaire. J Soc Kor Med Diagnostics. 2009;13(2):78-87.
- Jang E, Yoon JH, Lee Y. The evaluation of reliability and validity for Mibyeong questionnaire. J Soc Kor Med Diagnostics. 2017;21(1):13-25.
-
Marsden CD, Parkes JD. " On-off" effects in patients with Parkinson's disease on chronic levodopa therapy. Lancet. 1976;307(7954):292-6.
[https://doi.org/10.1016/S0140-6736(76)91416-1]

-
Chou KL, Stacy M, Simuni T et al. The spectrum of “off” in Parkinson's disease: what have we learned over 40 years?. Parkinsonism Relat Disord. 2018;51:9-16.
[https://doi.org/10.1016/j.parkreldis.2018.02.001]

- Kang S, Park S. Analysis of Studies on 'Mibyung'. J Soc Prev Korean Med. 2019;23(2):77-89.