
금은화(金銀花)물추출물이 마우스 대식세포의 사이토카인 생성에 미치는 영향
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Flos Lonicerae Japonicae (the flower buds of Lonicera japonica Thunberg) has been used as an antibacterial and antiviral drug in Korean Medicine. The aim of this study is to evaluate the effect of Flos Lonicerae Japonicae water extract (FL) on the production of cytokines in RAW 264.7 mouse macrophages stimulated by lipopolysaccharide (LPS). After 24 h treatment, the production of various cytokines from RAW 264.7 was measured with multiplex cytokine assay using Bio-Plex 200 suspension array system. FL at concentrations of 50, 100, and 200 μg/mL significantly inhibited productions of tumor necrosis factor-α, macrophage inflammatory protein (MIP)-1β, and MIP-2 in LPS-stimulated RAW 264.7 cells; FL at concentrations of 100 and 200 μg/mL significantly inhibited productions of leukemia inhibitory factor, LIX (CXCL5), and RANTES in LPS-stimulated RAW 264.7 cells; FL at concentrations of 200 μ g/mL significantly inhibited productions of granulocyte-macrophage colony-stimulating factor and macrophage colony-stimulating factor in LPS-stimulated RAW 264.7 cells; FL at concentrations of 50 and 100 μg/mL significantly increased productions of interleukin (IL)-10 in LPS-stimulated RAW 264.7 cells; FL at concentrations of 50, 100, and 200 μg/mL significantly increased productions of IL-6 and interferon gamma-induced protein-10 in LPS-stimulated RAW 264.7 cells; FL at concentrations of 100 and 200 μg/mL significantly increased productions of monocyte chemoattractant protein-1 in LPS-stimulated RAW 264.7 cells. Taken together, these data mean that FL might modulate productions of cytokines, chemokines, and growth factor in LPS-stimulated macrophages. Further study needs to verify the exact mechanism for modulatory activities of FL with macrophages.
Keywords:
Lonicerae japonicae flos, Lonicera japonica, Macrophage, Lipopolysaccharide, Cytokine, Chemokine, Growth factor서 론
금은화(金銀花)는 인동과(Caprifoliaceae) 인동속(genus lonicera)에 속하는 인동덩굴(Lonicera japonica Thunberg)의 화뢰(花蕾; 꽃봉오리) 또는 막 피기 시작한 꽃으로서 전통적으로 옹종정창(廱腫疔瘡), 후비(喉痺), 단독(丹毒), 열독혈리(熱毒血痢), 풍열감모(風熱感冒), 온병발열(溫病發熱) 등을 치료하는 것으로 알려져 있다1). 금은화에 대한 다양한 연구보고가 이루어져 왔는데, 최근에 Lin 등은 금은화 물추출물과 그 중요 함유성분이 luteolin이 바이러스(pseudorabies virus)에 감염된 RAW 264.7(마우스 대식세포) 내의 HO-1 발현과 STAT/NF-κB 경로 조절을 통하여 inducible nitric oxide synthase(iNOS), cyclooxygenase-2(COX-2), 염증성 사이토카인(inflammatory cytokines)들의 생성을 억제하는 항염효과를 나타낸다고 보고한 바 있다2). 2015년에 Li 등은 체계적 약리학(Systematic Pharmacology) 고찰을 통하여 금은화의 항균효과(Antibacterial Effects), 항바이러스효과(Antiviral Effects), 항염효과(Anti-Inflammatory Effects), 항산화효과(Antioxidative Effects), 해열효과(Antipyretic Effects), 간보호효과(Liver Protection), 면역조절효과(Immunoregulation), 항암효과(Antitumor Effects), 항알러지효과(Antiallergic Effects), 항죽상동맥경화효과(Antiatherosclerotic Effects), 항내독소효과(Antiendotoxin Effects), 항자외선효과(Antiultraviolet Radiation), 장내세균총 조절효과(Modulating Gut Microbiota), 임신억제효과(Antipregnancy Effects), 항혈소판효과(Antiplatelet Effect), 항경련효과(Spasmolytic Effects), 신경보호효과(Neuroprotective Effect) 등에 대하여 보고한 바 있다3).
인체가 겪게 되는 다양한 질환들은 외부로부터 침입하는 병원체에 대항하는 우리 몸의 면역체계가 약화되었을 때 발생하게 되는데, 우리 몸을 구성하는 세포 중 선천성면역을 담당하는 주요 세포가 바로 대식세포이다4). 대식세포는 감염체에 반응하여 싸이토카인(cytokine), 케모카인(chemokine), 성장인자(growth factor), 일산화질소(nitric oixde), 프로스타글란딘(prostaglandin) 등을 대량으로 생성, 분비함으로써 면역염증반응(immuno-inflammatory reaction)을 일으키고, 다른 면역세포들을 감염소, 즉 병소로 유인하여 감염체를 제거하거나 약화시키며, 손상된 조직을 회복시키는 작용을 한다5). 대식세포가 감염체에 대응하여 생성·방출하는 싸이토카인에는 인터루킨류(interleukins; ILs), 종양괴사인자류(tumor necrosis factors; TNFs) 등이 있으며, 그람음성균(gram-negative bacteria)의 세포벽구성물질 중 하나인 지질다당체로 자극된 경우에도 또한 대식세포는 이와 같은 다양한 종류의 싸이토카인을 방출한다6,7). 그러므로 지질다당체로 자극받은 대식세포를 대상으로 하여, 한약추출물의 대식세포의 싸이토카인생성에 미치는 효과에 대한 조사가 지속적으로 이루어져 오고 있다6,7). 위와 같이 금은화(金銀花)에 대한 많은 연구가 보고된 바 있으나, 아직까지 금은화(金銀花)열수추출물이 지질다당체로 자극된 대식세포의 싸이토카인 생성에 미치는 영향에 대한 보고는 이루지지 않고 있다. 본 연구에서는 금은화(金銀花)열수추출물이 대식세포의 싸이토카인 생성에 미치는 영향을 조사하고 유의한 결과를 얻었기에 이에 보고하는 바이다.
재료 및 방법
1. 재료
본 실험에 사용된 시약 중 세포배양을 위해서 Dulbecco's Modified Eagle's Medium(DMEM), heat-inactivated fetal bovine serum(FBS) 등이 써모피셔싸이언티픽사(Thermo Fisher Scientific, USA)로부터 구입하여 사용되었으며, indomethacin과 MTT[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide]시약은 시그마사(Sigma-Aldrich, USA)로부터, multiplex bead-based cytokine assay kit는 Millipore(Billerica, MA, USA)로부터 구입하여 사용하였다. 본 실험에 사용된 주요 기기는 CO2 incubator(NUAIRE, USA), clean bench(Jeiothec, Korea), freeze dryer(Eyela, Japan), Inverted Research Microscope(CK2, Olympus, Japan), centrifuge(Gyrozen, Korea), deep freezer(Gudero, IlshinLab, Korea), 형광분광기(TRIAD LT spectrofluorometer, Dynex, USA), Bio-Plex 200 suspension array system(Bio-Rad, Hercules, USA) 등이다.
본 실험에 사용된 약재 중 금은화(金銀花; no. 19-021) 옴니허브주식회사(대구, 한국)로부터 구입, 검정한 후 사용하였으며, 검정된 약재들은 가천대학교 한의과대학에 보관되었다.
2. 방법
시료의 제조는 선행연구6,7)의 방법에 따라 다음과 같이 시행하였다. 금은화(金銀花) 50 g을 전기약탕기에 1차 증류수 1,000 mL와 함께 넣은 뒤 150분 동안 가열, 추출하였다. 추출이 끝난 뒤 추출액을 filter paper(Advantec No.2, Japan)로 감압 여과한 뒤, 여과액을 회전증발농축기를 이용하여 농축하였다. 이 농축액을 동결건조기를 이용하여 건조하여 금은화(金銀花)물추출물(FL)을 얻었으며 수율은 45.17%였다. 이 동결건조물을 인산완충생리식염수(phosphate buffered saline; PBS)로 녹인 후 0.02 ㎛ syringe filter로 여과하여 실험에 사용하였다.
실험에 사용된 세포주는 마우스 대식세포(RAW 264.7)로서 한국세포주은행(KCLB, Korea)에서 구입 후 사용하였다.
세포의 배양은 선행연구6,7)의 방법에 따라 실시하였으며, 세포들은 37℃, 5% CO2조건에서 10% FBS, penicillin(100 U/mL), streptomycin(100 ug/mL)이 첨가된 DMEM 배지로 배양되었다.
금은화물추출물(FL)이 RAW 264.7 세포의 세포생존율에 미치는 영향을 알아보기 위하여 선행연구6,7)의 방법에 따라 MTT assay를 실시하였다.
선행연구6,7)의 방법에 따라 다중면역분석법(multiple cytokine assay)을 Multiplex bead-based cytokine assay kit(Millipore)를 이용하여 다음과 같이 실험하였다. 96 well plate에 1×104 cells/well의 농도로 분주되도록 1×105 cells/mL의 cell을 100 uL씩 넣고 37℃, 5% CO2 incubator에서 24시간동안 배양한 후, 배지를 버리고 배양세포 표면을 PBS 용액으로 씻어주었다. LPS(1 µg/mL) 단독 혹은 배지에 녹인 시료(50, 100, 200 µg/mL)와 함께 각 well에 처리하고 24시간 동안 배양하였다. 배양이 끝나면, kit에 포함되어 있는 멀티플렉스 어세이용 96plate의 각 well에 특정항체가 결합되어 있는 beads를 분주 후 세척액(wash buffer)으로 세척한다. 세척이 끝나면 세척액을 모두 제거한 후 준비된 세포배양상층액과 표준물질(standard antibody)을 각 well에 50 uL씩 분주한다. 분주가 끝나면 실온에서 30분간 500 rpm의 속도로 shaking한다. 30분간의 shaking incubation이 끝나면 세척액을 이용, 3회의 세척을 실시한다. 세척이 끝난 후 세척액을 제거하고, 미리 혼합된 Detection Antibody를 각 well에 25 uL씩 분주하고 실온에서 30분간 500 rpm의 속도로 shaking한다. 30분후 3회의 세척을 실시한다. 세척후 세척액을 모두 제거하고, Streptavidin-PE를 각 well에 50uL씩 분주하고 실온에서 30분간 500 rpm의 속도로 shaking한다. 30분후 3회의 세척을 실시하고, 각 well에 Reading buffer를 120uL씩 분주하고 실온에서 5분간 500 rpm의 속도로 shaking한 후 Bioplex-200을 이용, 종양괴사인자-알파 등 각 타겟(target) 물질들의 발현량을 측정, 비교한다. 제조사에서 제공한 각 타겟의 표준품으로 농도계산용 정량선을 작성하여 각 타겟의 발현량을 계산한다.
3. 통계처리
실험성적은 3회 이상 실시한 실험결과의 평균치 ± 표준편차(Mean ± SD)로 나타내었으며, 대조군과 각 실험군과의 평균 차이는 그라패드프리즘(GraphPad Software, USA)을 이용한 one-way analysis of variance test와 Tukey’s multiple comparison test를 실시하여 유의성을 판정하였다.
결 과
1. 금은화(金銀花)물추출물이 RAW 264.7의 세포생존율에 미치는 영향
금은화(金銀花)물추출물(25, 50, 100, 200 µg/mL)과 지질다당체(1 µg/mL)을 24시간 동안 함께 처리한 후 RAW 264.7 세포의 생존율을 조사한 결과, 25, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 98.84 ± 8%, 98.51 ± 4.71%, 98.89 ± 10.08%, 104.15 ± 5.89%로서 유의한 변화는 나타나지 않았다.
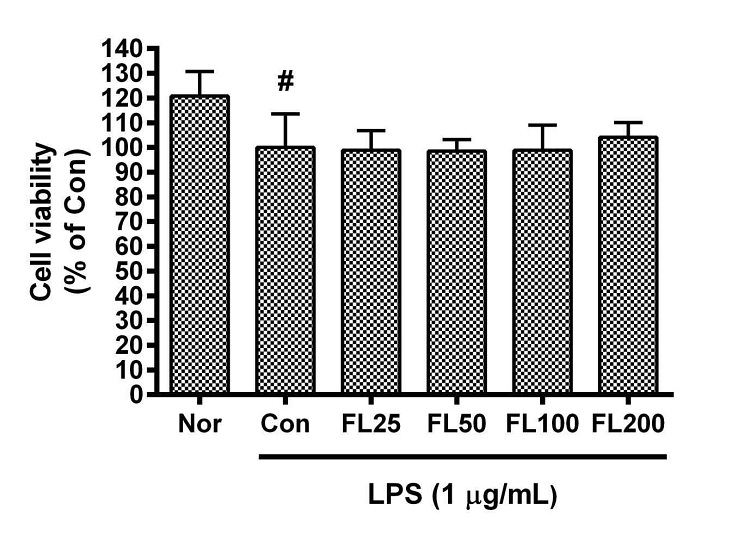
Effects of FL on cell viability of RAW 264.7 cells for 24 h incubation. Data represent Mean ± SD. FL, water extract of the dried flower buds of Lonicera japonica. Nor, the group incubated with media only. Con, the group treated with lipopolysaccharide (1 µg/mL) only. LPS indicates the group treated with 1 µg/mL of lipopolysaccharide. # p < 0.05 vs. Nor.
2. 금은화(金銀花)물추출물이 종양괴사인자-알파 생성에 미치는 영향
금은화(金銀花)물추출물과 지질다당체를 24시간 동안 처리한 후 RAW 264.7 세포의 종양괴사인자-알파(TNF-α) 생성을 측정한 결과, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 85.85 ± 9.78%, 84.57 ± 7.92%, 82.84 ± 7.94%로서 모든 농도에서 유의한 감소를 나타내었다(Fig. 2).
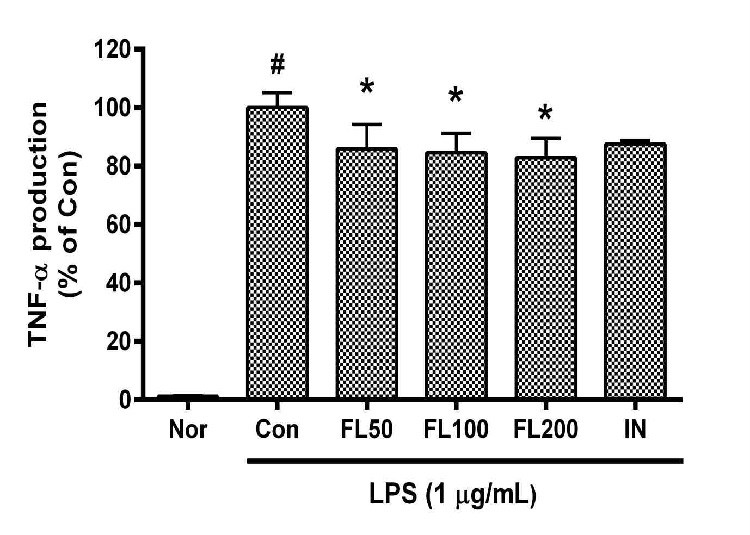
Effects of FL on TNF-α production in LPS-stimulated RAW 264.7 cells for 24 h treatment. Data represent Mean ± SD. FL, water extract of the dried flower buds of Lonicera japonica. Nor, the group incubated with media only. Con, the group treated with lipopolysaccharide (1 µg/mL) only. IN means indomethacin (0.5 μM). LPS indicates the group treated with 1 µg/mL of lipopolysaccharide. # p < 0.05 vs. Nor; * p < 0.05 vs. Con.
3. 금은화(金銀花)물추출물이 LIF 생성에 미치는 영향
금은화(金銀花)물추출물과 지질다당체를 24시간 동안 처리한 후 RAW 264.7 세포의 leukemia inhibitory factor(LIF) 생성을 측정한 결과, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 89.81 ± 13.81%, 85.62 ± 1.6%, 84.41 ± 1.09%였으며, 100, 200 µg/mL의 농도에서 유의한 감소가 나타났다(Fig. 3).
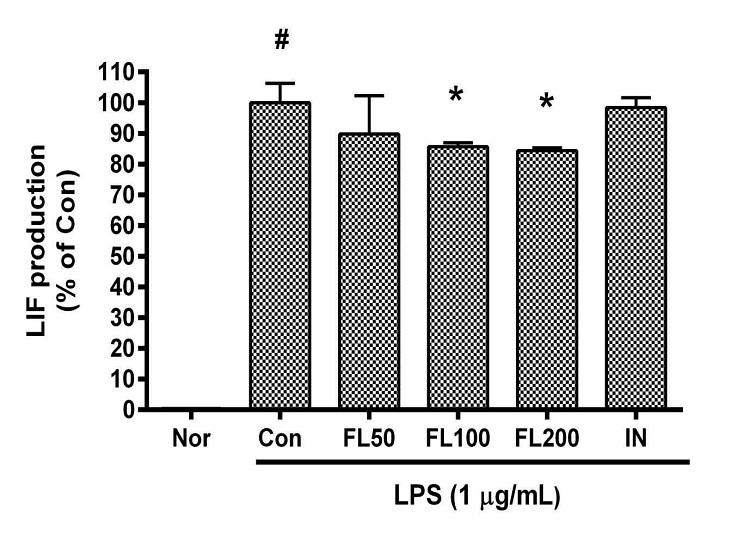
Effects of FL on LIF production in LPS-stimulated RAW 264.7 cells for 24 h treatment. Data represent Mean ± SD. FL, water extract of the dried flower buds of Lonicera japonica. Nor, the group incubated with media only. Con, the group treated with lipopolysaccharide (1 µg/mL) only. IN means indomethacin (0.5 μM). LPS indicates the group treated with 1 µg/mL of lipopolysaccharide. # p < 0.05 vs. Nor; * p < 0.05 vs. Con.
4. 금은화(金銀花)물추출물이 LIX 생성에 미치는 영향
금은화(金銀花)물추출물과 지질다당체를 24시간 동안 처리한 후 RAW 264.7 세포의 LIX(CXCL5) 생성을 측정한 결과, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 92.35 ± 9.62%, 88.04 ± 2.9%, 88.34 ± 3.13%였으며, 100, 200 µg/mL의 농도에서 유의한 감소가 나타났다(Fig. 4).
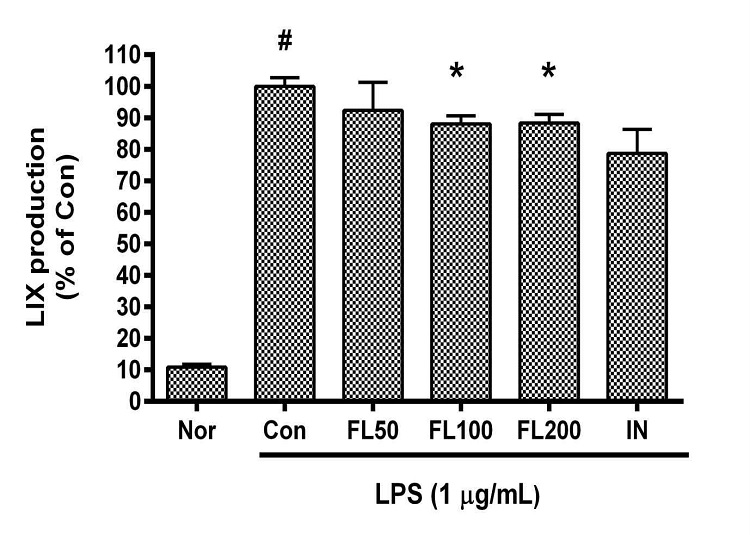
Effects of FL on LIX production in LPS-stimulated RAW 264.7 cells for 24 h treatment. Data represent Mean ± SD. FL, water extract of the dried flower buds of Lonicera japonica. Nor, the group incubated with media only. Con, the group treated with lipopolysaccharide (1 µg/mL) only. IN means indomethacin (0.5 μM). LPS indicates the group treated with 1 µg/mL of lipopolysaccharide. # p < 0.05 vs. Nor; * p < 0.05 vs. Con.
5. 금은화(金銀花)물추출물이 MIP-1β 생성에 미치는 영향
금은화(金銀花)물추출물과 지질다당체를 24시간 동안 처리한 후 RAW 264.7 세포의 Macrophage inflammatory protein(MIP)-1β 생성을 측정한 결과, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 92.22 ± 6.58%, 91.49 ± 4.04%, 91.34 ± 1.49%로 모든 농도에서 유의한 감소가 나타났다(Fig. 5).
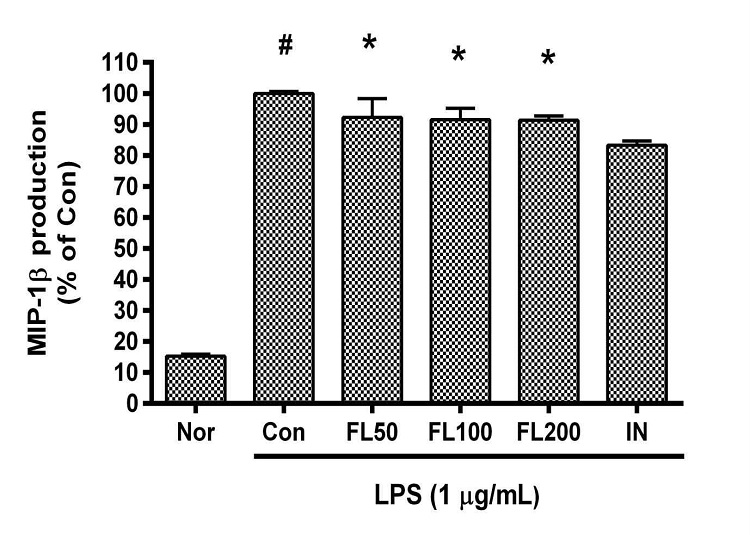
Effects of FL on MIP-1β production in LPS-stimulated RAW 264.7 cells for 24 h treatment. Data represent Mean ± SD. FL, water extract of the dried flower buds of Lonicera japonica. Nor, the group incubated with media only. Con, the group treated with lipopolysaccharide (1 µg/mL) only. IN means indomethacin (0.5 μM). LPS indicates the group treated with 1 µg/mL of lipopolysaccharide. # p < 0.05 vs. Nor; * p < 0.05 vs. Con.
6. 금은화(金銀花)물추출물이 MIP-2 생성에 미치는 영향
금은화(金銀花)물추출물과 지질다당체를 24시간 동안 처리한 후 RAW 264.7 세포의 MIP-2 생성을 측정한 결과, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 96.91 ± 2.35%, 93.57 ± 4.33%, 97.66 ± 1.74%로 모든 농도에서 유의한 감소가 나타났다(Fig. 6).
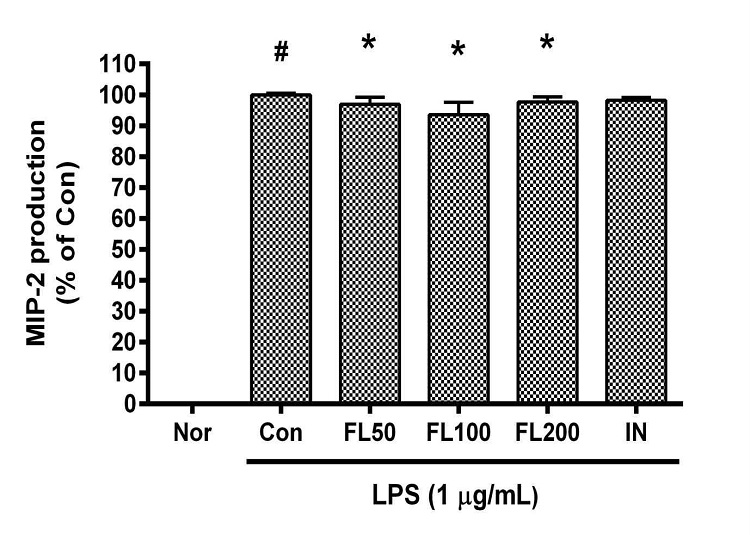
Effects of FL on MIP-2 production in LPS-stimulated RAW 264.7 cells for 24 h treatment. Data represent Mean ± SD. FL, water extract of the dried flower buds of Lonicera japonica. Nor, the group incubated with media only. Con, the group treated with lipopolysaccharide (1 µg/mL) only. IN means indomethacin (0.5 μM). LPS indicates the group treated with 1 µg/mL of lipopolysaccharide. # p < 0.05 vs. Nor; * p < 0.05 vs. Con.
7. 금은화(金銀花)물추출물이 RANTES 생성에 미치는 영향
금은화(金銀花)물추출물과 지질다당체를 24시간 동안 처리한 후 RAW 264.7 세포의 RANTES 생성을 측정한 결과, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 98.13 ± 22.79%, 87.41 ± 2.17%, 87.78 ± 5.2%였으며, 100, 200 µg/mL의 농도에서 유의한 감소가 나타났다(Fig. 7).
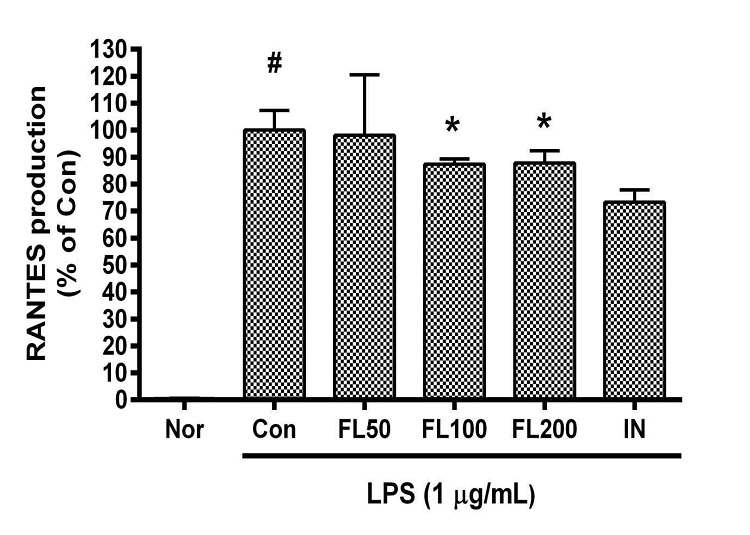
Effects of FL on RANTES production in LPS-stimulated RAW 264.7 cells for 24 h treatment. Data represent Mean ± SD. FL, water extract of the dried flower buds of Lonicera japonica. Nor, the group incubated with media only. Con, the group treated with lipopolysaccharide (1 µg/mL) only. IN means indomethacin (0.5 μM). LPS indicates the group treated with 1 µg/mL of lipopolysaccharide. # p < 0.05 vs. Nor; * p < 0.05 vs. Con.
8. 금은화(金銀花)물추출물이 IL-6 생성에 미치는 영향
금은화(金銀花)물추출물과 지질다당체를 24시간 동안 처리한 후 RAW 264.7 세포의IL-6 생성을 측정한 결과, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 144.1 ± 20.05%, 137.1 ± 12.03%, 117 ± 6.72%로 모든 농도에서 유의한 증가가 나타났다(Fig. 8).
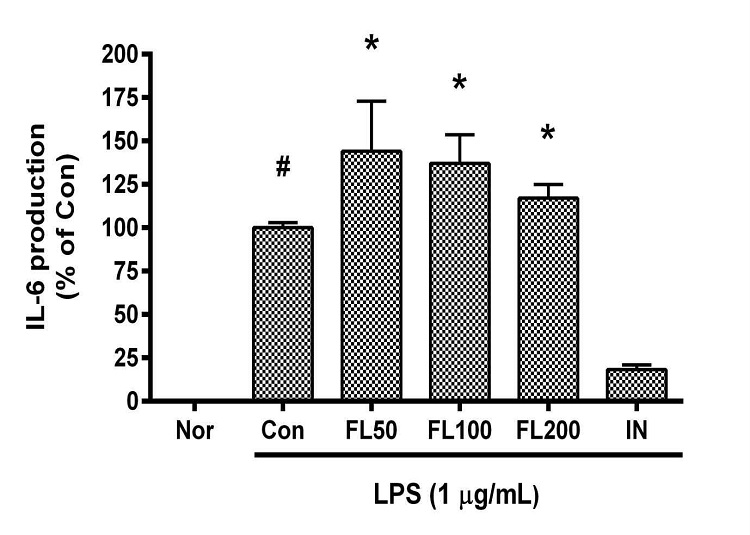
Effects of FL on IL-6 production in LPS-stimulated RAW 264.7 cells for 24 h treatment. Data represent Mean ± SD. FL, water extract of the dried flower buds of Lonicera japonica. Nor, the group incubated with media only. Con, the group treated with lipopolysaccharide (1 µg/mL) only. IN means indomethacin (0.5 μM). LPS indicates the group treated with 1 µg/mL of lipopolysaccharide. # p < 0.05 vs. Nor; * p < 0.05 vs. Con.
9. 금은화(金銀花)물추출물이 MCP-1 생성에 미치는 영향
금은화(金銀花)물추출물과 지질다당체를 24시간 동안 처리한 후 RAW 264.7 세포의 monocyte chemoattractant protein 1(MCP-1) 생성을 측정한 결과, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 200.8 ± 45.51%, 190.9 ± 27.22%, 145.52 ± 14.15%였으며, 100, 200 µg/mL의 농도에서 유의한 증가가 나타났다(Fig. 9).
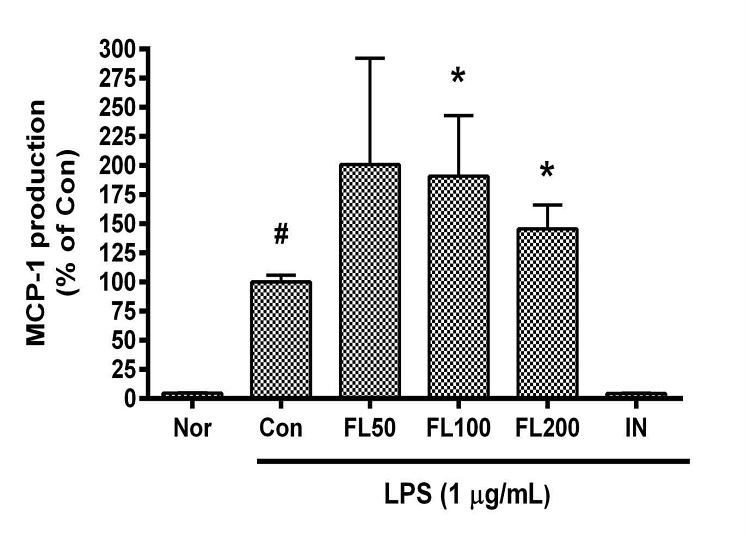
Effects of FL on MCP-1 production in LPS-stimulated RAW 264.7 cells for 24 h treatment. Data represent Mean ± SD. FL, water extract of the dried flower buds of Lonicera japonica. Nor, the group incubated with media only. Con, the group treated with lipopolysaccharide (1 µg/mL) only. IN means indomethacin (0.5 μM). LPS indicates the group treated with 1 µg/mL of lipopolysaccharide. # p < 0.05 vs. Nor; * p < 0.05 vs. Con.
10. 금은화(金銀花)물추출물이 IL-10 생성에 미치는 영향
금은화(金銀花)물추출물과 지질다당체를 24시간 동안 처리한 후 RAW 264.7 세포의 IL-10 생성을 측정한 결과, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 129.55 ± 7.67%, 132.16 ± 13.03%, 107.15 ± 6.99%였으며, 50, 100 µg/mL의 농도에서 유의한 증가가 나타났다(Fig. 10).
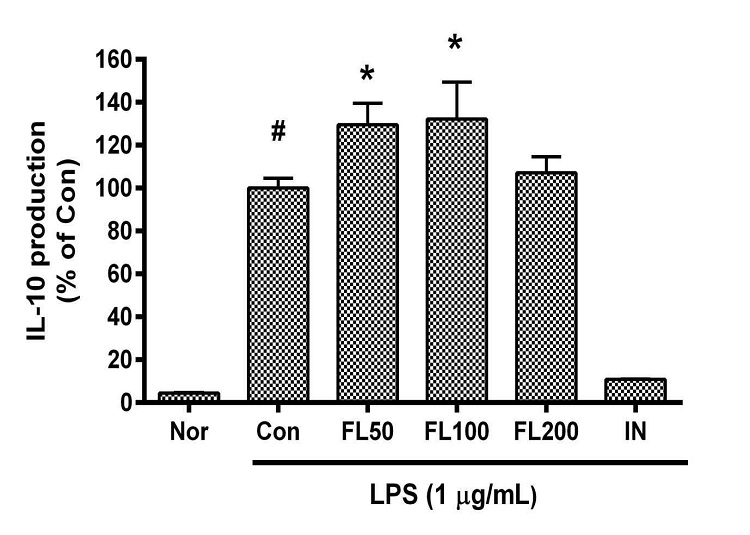
Effects of FL on IL-10 production in LPS-stimulated RAW 264.7 cells for 24 h treatment. Data represent Mean ± SD. FL, water extract of the dried flower buds of Lonicera japonica. Nor, the group incubated with media only. Con, the group treated with lipopolysaccharide (1 µg/mL) only. IN means indomethacin (0.5 μM). LPS indicates the group treated with 1 µg/mL of lipopolysaccharide. # p < 0.05 vs. Nor; * p < 0.05 vs. Con.
11. 금은화(金銀花)물추출물이 IP-10 생성에 미치는 영향
금은화(金銀花)물추출물과 지질다당체를 24시간 동안 처리한 후 RAW 264.7 세포의 interferon gamma-induced protein 10(IP-10) 생성을 측정한 결과, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 130.01 ± 20.59%, 117.07 ± 13.48%, 142.81 ± 15.93%로 모든 농도에서 유의한 증가가 나타났다(Fig. 11).
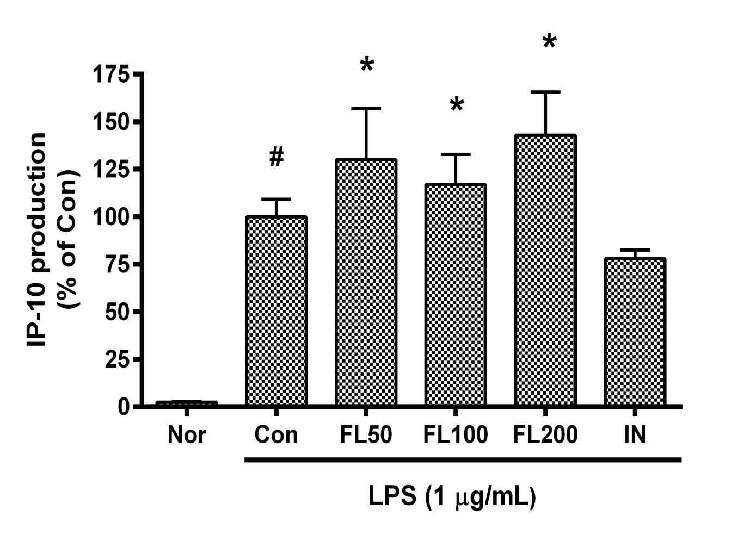
Effects of FL on IP-10 production in LPS-stimulated RAW 264.7 cells for 24 h treatment. Data represent Mean ± SD. FL, water extract of the dried flower buds of Lonicera japonica. Nor, the group incubated with media only. Con, the group treated with lipopolysaccharide (1 µg/mL) only. IN means indomethacin (0.5 μM). LPS indicates the group treated with 1 µg/mL of lipopolysaccharide. # p < 0.05 vs. Nor; * p < 0.05 vs. Con.
12. 금은화(金銀花)물추출물이 GM-CSF 생성에 미치는 영향
금은화(金銀花)물추출물과 지질다당체를 24시간 동안 처리한 후 RAW 264.7 세포의 granulocyte-macrophage colony-stimulating factor(GM-CSF) 생성을 측정한 결과, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 77.65 ± 15.16%, 74.42 ± 17.54%, 71.49 ± 5.72%였으며, 200 µg/mL의 농도에서 유의한 감소가 나타났다(Fig. 12).
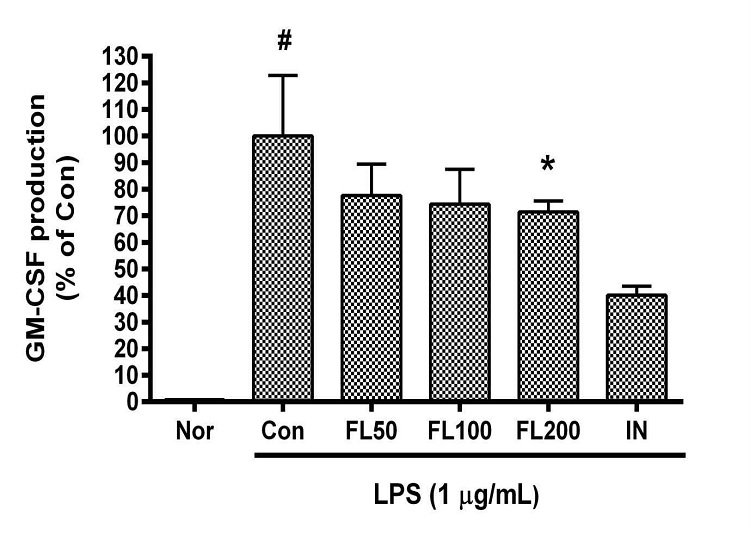
Effects of FL on GM-CSF production in LPS-stimulated RAW 264.7 cells for 24 h treatment. Data represent Mean ± SD. FL, water extract of the dried flower buds of Lonicera japonica. Nor, the group incubated with media only. Con, the group treated with lipopolysaccharide (1 µg/mL) only. IN means indomethacin (0.5 μM). LPS indicates the group treated with 1 µg/mL of lipopolysaccharide. # p < 0.05 vs. Nor; * p < 0.05 vs. Con.
13. 금은화(金銀花)물추출물이 G-CSF와 M-CSF 생성에 미치는 영향
금은화(金銀花)물추출물과 지질다당체를 24시간 동안 처리한 후 RAW 264.7 세포의 granulocyte colony-stimulating factor(G-CSF) 생성을 측정한 결과, 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 99.16 ± 2.62%, 100.01 ± 0.84%, 100.58 ± 1.48%였으며 유의성은 없었다. 또한 macrophage colony-stimulating factor(M-CSF) 생성을 측정한 결과에서는 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군) 대비 각각 98.64 ± 8.12%, 92.66 ± 8.64%, 88.59 ± 8.11%로 나타났으며 유의성은 없었다.
고 찰
금은화(金銀花)는 인동덩굴(Lonicera japonica)의 꽃봉오리 또는 막 피기 시작한 꽃으로서 한의학에서는 청열해독(淸熱解毒)·양산풍열(凉散風熱)하는 효능을 가지고 있어서, 옹종정창(廱腫疔瘡), 후비(喉痺), 단독(丹毒), 열독혈리(熱毒血痢), 풍열감모(風熱感冒), 온병발열(溫病發熱) 등을 치료하는 것으로 알려져 있으며, 배합례(配合例)를 살펴보면, 포공영(蒲公英)·야국화(野菊花)·자화지정(紫花地丁) 등을 배합하여 정창종독(疔瘡腫毒)을 치료하고, 당귀(當歸)·의이인(薏苡仁)·황금(黃芩) 등을 배합하여 장옹(腸癰)을 치료하며, 판남근(板藍根)·산두근(山豆根) 등을 배합하여 인후종통(咽喉腫痛)을 치료하고, 연교(連翹)·박하(薄荷)·형개(荊芥) 등을 배합하여 외감풍열(外感風熱)이나 온병초기(溫病初期)에 발열두통(發熱頭痛)과 구건인건(口乾咽乾)을 치료하며, 황금(黃芩)·백작약(白芍藥)·마치현(馬齒莧) 등을 배합하여 열독사리(熱毒瀉痢)를 치료하며, 금은화탄(金銀花炭)·선학초(仙鶴草)·백두옹(白頭翁) 등을 배합하여 열독결취(熱毒結聚)로 인한 혈리변혈(血痢便血)을 치료하며, 감국(甘菊)·자화지정(紫花地丁)·하고초(夏枯草)·백급(白芨)·백렴(白蘞)·패모(貝母)·연교(連翹)·서점(鼠粘) 등을 배합하여 일체종독(一切腫毒)을 치료하며, 지유(地楡)·작약(芍藥)·황연(黃連)·감초(甘草)·승마(升麻) 등을 배합하여 일체혈리(一切血痢)를 치료한다1).
위와 같은 한의학의 전통적인 이론에 의한 금은화의 효능분석 이외에도 현대적 실험연구 및 임상연구를 통한 금은화(金銀花)의 생리활성과 치료효능에 대한 많은 연구가 이루어져 오고 있다. 예를 들면, 2021년도 Lin 등의 보고2)에 의하면, 금은화 물추출물과 그 중요 함유성분인 luteolin이 pseudorabies virus에 감염된 RAW 264.7 내의 HO-1 발현을 억제하고 STAT/NF-κB 경로 조절을 통한 iNOS·COX-2·inflammatory cytokines의 생성을 억제하였다2). 2015년에 Li 등의 체계적 약리학적 고찰보고3)에 의하면, 금은화는 항균효과·항바이러스효과·항염효과·항산화효과·해열효과·간보호효과·면역조절효과·항암효과·항알러지효과·항죽상동맥경화효과·항내독소효과·항자외선효과·장내세균총 조절효과·임신억제효과·항혈소판효과·항경련효과·신경보호효과가 있다3). 2018년도에 Ge 등8)은 금은화꽃봉오리(L. japonica flower bud)의 구성 성분중 자바플라본(japoflavone A–D), 5-hydroxy-7,3׳,4׳-trimethoxyflavone, 트리신(tricin), 크리소에리올(chrysoeriol), 에리오딕툘(eriodictyol), 루테올린(luteolin), 캄페롤(kaempferol), 아피게닌(apigenin), 쿼서틴(quercetin), 아스트라갈린(astragalin), quercetin-3-O-β-d-6 (p-coumaroyl) glucopyranoside 등의 NMR spectrum을 제시한 바 있다. 2020년도에 발표된 Minami와 Makino의 보고9)에 의하면, 금은화(金銀花)추출물은 대장균의 생쥐모델인 Citrobacter rodentium을 처리한 생쥐의 생존율을 높혔으며, Citrobacter rodentium의 집락화(colonization)을 감소시켰고, Citrobacter rodentium에 대응하는 복강내 대식세포의 식작용(phagocytic activity)을 강화시키면서 대식세포로부터의 TNF-α와 인터루킨-1베타(IL-1β), 인터페론-감마(IFN-γ) 등의 농도를 증가시킴으로써 Citrobacter rodentium에 의해 유발되는 위장관감염증 치료에 유용할 수 있다. 2019년도 발표된 Miao 등의 보고10)에 의하면, 금은화물추출물은 Carbon Tetrachloride에 의해 촉발된 생쥐의 간섬유화(Liver Fibrosis)를 완화하였는데, 이러한 완화작용은 간성상세포(肝星狀細胞; hepatic stellate cell)의 흥분을 줄이면서 상피간엽이행(epithelial-mesenchymal transition)을 억제함과 함께 간의 산화스트레성 상처를 줄이고 nuclear factor erythroid 2-related factor 2(Nrf2)의 활성을 증강시키는 것과 병행되었으며, 특히 클로로제닉산(chlorogenic acid)이나 카페익산(caffeic acid) 등의 금은화의 중요 페놀산들은 실험관내 실험에서 간성상세포의 흥분을 감소시켰다. 2019년 Han 등에 의한 보고11)에 의하면, 금은화(金銀花)에탄올추출물이 실험관내 실험에서 multi-drug and toxin extrusion protein(MATE)1에 의해 매개되는 메트포르민(metformin) 흡수를 상당히 억제하였으며, rat을 이용한 실험에서 금은화(金銀花)에탄올추출물을 메트포르민과 28일간 함께 처리하면 메트포르민의 약리학적 표적 부위로 간에서 메트포르민 농도가 증가하였으며, 이는 간에서 MATE1 억제에 의해 간세포에서 담즙으로의 MATE1 매개성 메트포르민 유출이 감소되었기 때문일 수 있고, 포도당 관용 활성(glucose tolerance activity)도 메트포르민 단독처리와 비교했을 때 금은화(金銀花)에탄올추출물과 메트포르민의 28일 공동 처리의 경우에 더 많이 향상되었다. 2018년 발표된 Park 등의 보고에서는12) 금은화(金銀花)물추출물로부터 얻어진, Kaempferol 등을 함유하는 폴리페놀들(polyphenols)이 인간임파선암세포(U937)에 대하여 항암효과를 나타내었고, 이러한 효과는 TRAIL receptor(DR4)와 Fas receptor의 상향조절과 X-linked inhibitor of apoptosis protein의 억제, 그리고 부분적으로 PI3K/Akt 경로를 차단함으로써 이루어진다고 하였다. 2019년도에 발표된 Liu 등에 의한 보고13)에 의하면, 금은화(金銀花) 다당체(polysaccharide; 8.7% galacturonic acid, 8.2% rhamnose, 16.2% galactose, 19.5% arabinose, 26.9% glucose, 20.5% mannose)가 NLRP3 inflammasome을 억제함으로써 우울증모델 생쥐에 대하여 강력한 보호효과를 나타내었고, 이러한 효과는 우울증모델 생쥐 해마(hippocampus)에서의 NLRP3·인터루킨1-베타·caspase-1 발현증가를 감소시키는 것과 관련이 있다. 2020년도 발표된 Zhou 등의 보고14)에 의하면, 금은화(金銀花)다당체는 hydrogen peroxide로 손상받은 생쥐 심근세포(cardiomyocyte)의 생존율을 증가시켰고, 아울러 hydrogen peroxide로 손상받은 생쥐 심근세포내의 각종 효소(superoxide dismutase, catalase, glutathione peroxidase, Aspartate aminotransferase, creatine phosphokinase, lactic dehydrogenase 등)들의 활성을 증가시켰으며, 심근세포내의 caspase-3, caspase-8, caspase-9 활성을 억제하였다. 2019년도에 발표된 Fan 등의 보고15)에 의하면, 금은화(金銀花) 다당체는 1,1-diphenyl-2-picrylhydrazyl과 2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)에 대한 소거작용을 나타냈고, 티로시네이즈(tyrosinase) 억제효능을 나타냄으로써 항산화물질 및 티로시네이즈억제제로서의 가능성을 보여주었다. 2021년 Wang 등에 의한 보고16)에 의하면, 지질다당체로 자극된 생쥐의 기억 및 학습 변화는 금은화(金銀花) 다당체에 의하여 의미있게 조절되었는데, 이러한 효과는 ATG5, Beclin 1, Vps34, LC3 II 등의 발현과 관련된 것이다.
금은화(金銀花)의 이러한 다양한 치료효과는 대부분 면역염증반응(immuno-inflammatory reaction)과 연관되는 것이고, 면역염증반응(immuno-inflammatory reaction)은 대부분 싸이토카인(cytokine)의 작용에 의한 것이기 때문에 금은화(金銀花)의 싸이토카인생성에 대한 효과를 살펴보는 것은 금은화(金銀花) 치료효능의 보다 자세한 기전규명에 도움이 될 것이다. 또한 싸이토카인(cytokine)생성에 대한 연구는 주로 면역세포들을 이용하여 이루어지는 데, 특히 외부적 스트레스(stress)에 자극받을 때 다양하면서도 대량의 싸이토카인(cytokine)을 분비하는 대식세포(大食細胞, macrophage)를 이용한 연구가 많이 이루어져 왔다.
본 연구에서 금은화(金銀花)물추출물은 지질다당체로 자극받은 RAW 264.7의 TNF-α를 50, 100, 200 µg/mL의 농도에서 지질다당체만 처리한 대조군(100%)에 비해 각각 85.85%, 84.57%, 82.84%의 유의한 감소를 나타내었으며, GM-CSF의 생성에 대해서는 200 µg/mL의 농도에서 대조군에 비해 71.49%의 유의한 감소를 나타내었고, IL-1β의 생성에 대해서도 200 µg/mL의 농도에서 대조군에 비해 83.75%의 유의한 감소를 나타내었고, LIF의 생성에 대해서는 100, 200 µg/mL의 농도에서 대조군에 비해 각각 85.62%, 84.41%의 유의한 감소를 나타내었고, LIX의 생성에 대해서도 100, 200 µg/mL의 농도에서 대조군에 비해 각각 88.04%, 88.34%의 유의한 감소를 나타내었으며, MIP-1β의 생성에 대해서는 50, 100, 200 µg/mL의 농도에서 대조군에 비해 각각 92.22%, 91.49%, 91.34%의 유의한 감소를 나타내었고, MIP-2의 생성에 대해서도 50, 100, 200 µg/mL의 농도에서 대조군에 비해 각각 96.91%, 93.57%, 97.66%의 유의한 감소를 나타내었으며, RANTES의 생성에 대해서는 100, 200 µg/mL의 농도에서 대조군에 비해 각각 87.41%, 87.78%의 유의한 감소를 나타내었다. 이와는 반대로, IL-6의 생성에 대해서는 금은화(金銀花)물추출물이 50, 100, 200 µg/mL의 농도에서 대조군에 비해 각각 144.1%, 137.1%, 117%의 유의한 증가를 나타내었고, IP-10의 생성에 대해서는 50, 100, 200 µg/mL의 농도에서 대조군에 비해 각각 130.01%, 117.07%, 142.81%의 유의한 증가를 나타내었으며, MCP-1의 생성에 대해서는 100, 200 µg/mL의 농도에서 대조군에 비해 각각 190.9%, 145.52%의 유의한 증가를 나타내었고, IL-10의 생성에 대해서는 50, 100 µg/mL의 농도에서 대조군에 비해 각각 129.55%, 132.16%의 유의한 증가를 나타내었다.
내독소(LPS)에 의해 자극받은 대식세포는 다양한 싸이토카인을 대량으로 생성, 방출함으로 인해 급·만성염증질환을 악화시킬 수 있기 때문에, 본 연구에서 금은화(金銀花)물추출물이 TNF-α, GM-CSF, LIF, LIX, MIP-1β, MIP-2, RANTES의 생성을 유의하게 억제함은 감염성 과잉염증 현상을 완화함으로써 급·만성염증질환으로의 악화를 완화할 수 있을 것이다. 또한 IL-10은 염증억제의 역할이 알려져 있기 때문에17), 금은화(金銀花)물추출물이 IL-10의 생성을 증가시키는 것 또한 감염으로 인한 과잉염증을 완화할 수 있다는 것을 의미한다. 한편, IL-6에 관한 2010년도의 Brandt와 Pedersen의 흥미로운 보고18)에 의하면, IL-6가 일반적으로는 감염대응과정 중의 대식세포 신호경로를 통한 전염증 반응을 일으키지만, 근육에서는 myokine(근육에서 생성되는 싸이토카인)으로 작용하여 감염에 대응하는 NF-kB의 활성화와는 달리 독립적으로 항염증작용을 일으키며, 특히 근육운동 등 근육수축에 대응하는 과정에서 분비가 증가19)되는 것으로 알려져 있고, 이러한 증가는 IL-10과는 연계되지만, TNF-α와는 연계되지 않는다. IP-10은 단핵구와 T세포에 화학주성을 나타내고 T세포의 내피세포(endothelial cell)부착을 촉진하며, 항종양작용과 골수집락형성(bone marrow colony formation)을 억제하는데, 특히 염증이나 종양생성과정에서의 혈관신생(angiogenesis)을 억제하는 효과가 있는 것으로 알려져 있다20). MCP-1은 심혈관질환(cardiovascular disease)·다발성 경화증(multiple sclerosis)·류마티스성 관절염(rheumatoid arthritis) 등의 악화요인으로 알려져 있기는 하지만, 정상적인 면역감시작용과 면역조절작용, 바이러스제거활동에 있어서 중요한 역할을 하며 특히 뇌세포에 베타-아밀로이드(β-amyloid)가 침착되는 것을 억제함에 대해서도 알려진 바 있다21).
이러한 선행보고들을 참조할 때, 본 연구에서 나타난 지질다당체로 자극받은 대식세포에 대한 금은화(金銀花)물추출물의 IL-6·IP-10·MCP-1 생성증가 효과는 대식세포를 매개로 하여 일어나는 감염대항성 면역염증반응에 있어서 의미있는 조절효과가 나타내는 것으로 판단된다. 향후 그람음성균 감염증에 대한 금은화(金銀花)물추출물의 치료효과에 대한 보다 자세한 연구가 필요한 것으로 사료되는 바이다.
결 론
본 연구에서는 금은화(金銀花)물추출물(FL)을 다양한 농도(50, 100, 200 μg/mL)로 24시간동안 지질다당체와 함께 마우스대식세포 RAW 264.7에 처리한 후 각종의 싸이토카인 생성에 대하여 조사하여 다음과 같은 결과를 얻었다.
FL은 TNF-α의 생성을 50, 100, 200 µg/mL의 농도에서 대조군(지질다당체만 처리한 군)에 비해 각각 85.85%, 84.57%, 82.84%로 유의하게 감소시켰다.
FL은 GM-CSF의 생성을 200 µg/mL의 농도에서 대조군에 비해 71.49%로 유의하게 감소시켰다.
FL은 LIF의 생성을 100, 200 µg/mL의 농도에서 대조군에 비해 각각 85.62%, 84.41%로 유의하게 감소시켰다.
FL은 LIX의 생성을 100, 200 µg/mL의 농도에서 대조군에 비해 각각 88.04%, 88.34%로 유의하게 감소시켰다.
FL은 MIP-1β의 생성을 50, 100, 200 µg/mL의 농도에서 대조군에 비해 각각 92.22%, 91.49%, 91.34%로 유의하게 감소시켰다.
FL은 MIP-2의 생성을 50, 100, 200 µg/mL의 농도에서 대조군에 비해 각각 96.91%, 93.57%, 97.66%로 유의하게 감소시켰다.
FL은 RANTES의 생성을 100, 200 µg/mL의 농도에서 대조군에 비해 각각 87.41%, 87.78%로 유의하게 감소시켰다.
FL은 IL-10의 생성을 50, 100 µg/mL의 농도에서 대조군에 비해 각각 129.55%, 132.16%로 유의하게 증가시켰다.
FL은 IL-6의 생성을 50, 100, 200 µg/mL의 농도에서 대조군에 비해 각각 144.1%, 137.1%, 117%로 유의하게 증가시켰다.
FL은 IP-10의 생성을 50, 100, 200 µg/mL의 농도에서 대조군에 비해 각각 130.01%, 117.07%, 142.81%로 유의하게 증가시켰다.
FL은 MCP-1의 생성을 100, 200 µg/mL의 농도에서 대조군에 비해 각각 190.9%, 145.52%로 유의하게 증가시켰다.
이러한 결과는 금은화(金銀花)물추출물이 지질다당체로 자극받은 대식세포의 다양한 싸이토카인 생성을 조절함으로써 내독소로 인한 염증반응을 조절할 수 있음을 의미하는 것이다. 향후 그람음성균 감염증에 대한 금은화(金銀花)물추출물의 치료효과에 대한 보다 자세한 연구가 필요한 것으로 판단되는 바이다.
Acknowledgments
본 연구는 한국연구재단(No. 2017R1A2B4004933)의 지원에 의해 수행되었습니다.
References
- National College of Korean Medicine Collaborative Textbook Compilation Committee. Herbology. Seoul:Younglim Publishing Inc;1991. p. 198, 199.
-
Lin HW, Lee YJ, Yang DJ, Hsieh MC, Chen CC, Hsu WL, Chang YY, Liu CW. Anti-inflammatory effects of Flos Lonicerae Japonicae Water Extract are regulated by the STAT/NF-κB pathway and HO-1 expression in Virus-infected RAW264.7 cells. Int J Med Sci. 2021;18(11):2285-93.
[https://doi.org/10.7150/ijms.56198]

-
Li Y, Cai W, Weng X, Li Q, Wang Y, Chen Y, Zhang W, Yang Q, Guo Y, Zhu X, Wang H. Lonicerae Japonicae Flos and Lonicerae Flos: A Systematic Pharmacology Review. Evid Based Complement Alternat Med. 2015;2015:905063.
[https://doi.org/10.1155/2015/905063]

-
Davies LC, Taylor PR. Tissue-resident macrophages: then and now. Immunology. 2015;144(4):541-8.
[https://doi.org/10.1111/imm.12451]

-
Watanabe S, Alexander M, Misharin AV, Budinger GRS. The role of macrophages in the resolution of inflammation. J Clin Invest. 2019;129(7):2619-28.
[https://doi.org/10.1172/JCI124615]

-
Kim DH, Lee JY, Kim YJ, Kim HJ, Park W. Rubi Fructus Water Extract Alleviates LPS-Stimulated Macrophage Activation via an ER Stress-Induced Calcium/CHOP Signaling Pathway. Nutrients. 2020;12(11):3577.
[https://doi.org/10.3390/nu12113577]

-
Kim YJ, Lee JY, Kim HJ, Kim DH, Lee TH, Kang MS, Park W. Anti-Inflammatory Effects of Angelica sinensis (Oliv.) Diels Water Extract on RAW 264.7 Induced with Lipopolysaccharide. Nutrients. 2018;10(5):647.
[https://doi.org/10.3390/nu10050647]

-
Ge L, Li J, Wan H, Zhang K, Wu W, Zou X, Wu S, Zhou B, Tian J, Zeng X. NMR data for novel flavonoids from Lonicera japonica flower buds. Data Brief. 2018;21:2192-207.
[https://doi.org/10.1016/j.dib.2018.11.021]

-
Minami M, Makino T. Effects of Lonicera japonica Flower Bud Extract on Citrobacter rodentium-Induced Digestive Tract Infection. Medicines (Basel). 2020;7(9):52.
[https://doi.org/10.3390/medicines7090052]

-
Miao H, Zhang Y, Huang Z, Lu B, Ji L. Lonicera japonica Attenuates Carbon Tetrachloride-Induced Liver Fibrosis in Mice: Molecular Mechanisms of Action. Am J Chin Med. 2019;47(2):351-67.
[https://doi.org/10.1142/S0192415X19500174]

-
Han SY, Chae HS, You BH, Chin YW, Kim H, Choi HS, Choi YH. Lonicera japonica extract increases metformin distribution in the liver without change of systemic exposed metformin in rats. J Ethnopharmacol. 2019;238:111892.
[https://doi.org/10.1016/j.jep.2019.111892]

-
Park C, Lee WS, Han MH, Song KS, Hong SH, Nagappan A, Kim GY, Kim GS, Jung JM, Ryu CH, Shin SC, Hong SC, Choi YH. Lonicera japonica Thunb. Induces caspase-dependent apoptosis through death receptors and suppression of AKT in U937 human leukemic cells. Phytother Res. 2018;32(3):504-13.
[https://doi.org/10.1002/ptr.5996]

-
Liu P, Bai X, Zhang T, Zhou L, Li J, Zhang L. The protective effect of Lonicera japonica polysaccharide on mice with depression by inhibiting NLRP3 inflammasome. Ann Transl Med. 2019;7(24):811.
[https://doi.org/10.21037/atm.2019.12.64]

-
Zhou X, He G, Ma J, Tang M, Tian G, Gong X, Zhang H, Kui L. Protective Effect of a Novel Polysaccharide from Lonicera japonica on Cardiomyocytes of Mice Injured by Hydrogen Peroxide. Biomed Res Int. 2020;2020:5279193.
[https://doi.org/10.1155/2020/5279193]

-
Fan Z, Li L, Bai X, Zhang H, Liu Q, Zhang H, Fu Y, Moyo R. Extraction optimization, antioxidant activity, and tyrosinase inhibitory capacity of polyphenols from Lonicera japonica. Food Sci Nutr. 2019;7(5):1786-94.
[https://doi.org/10.1002/fsn3.1021]

-
Wang J, Liu P, Huang X, Wu X. Validation of the protective effects of Lonicera japonica polysaccharide on lipopolysaccharide-induced learning and memory impairments via regulation of autophagy based on network pharmacology. Ann Palliat Med. 2021;10(2):1089-100.
[https://doi.org/10.21037/apm-20-357]

-
Pfänder P, Eiers AK, Burret U, Vettorazzi S. Deletion of Cdk5 in Macrophages Ameliorates Anti-Inflammatory Response during Endotoxemia through Induction of C-Maf and Il-10. Int J Mol Sci. 2021;22(17):9648.
[https://doi.org/10.3390/ijms22179648]

-
Brandt C, Pedersen BK. The role of exercise-induced myokines in muscle homeostasis and the defense against chronic diseases. J Biomed Biotechnol. 2010;2010:520258.
[https://doi.org/10.1155/2010/520258]

-
Pedersen BK, Febbraio MA. Muscle as an endocrine organ: focus on muscle-derived interleukin-6. Physiol Rev. 2008;88(4):1379-406.
[https://doi.org/10.1152/physrev.90100.2007]

-
Angiolillo AL, Sgadari C, Taub DD, Liao F, Farber JM, Maheshwari S, Kleinman HK, Reaman GH, Tosato G. Human interferon-inducible protein 10 is a potent inhibitor of angiogenesis in vivo. J Exp Med. 1995;182(1):155-62.
[https://doi.org/10.1084/jem.182.1.155]

-
Deshmane SL, Kremlev S, Amini S, Sawaya BE. Monocyte chemoattractant protein-1 (MCP-1): an overview. J Interferon Cytokine Res. 2009;29(6):313-26.
[https://doi.org/10.1089/jir.2008.0027]
