Lactiplantibacillus plantarum으로 발효한 황련해독탕 가미방의 기능성 화장품 조성물로서의 생리활성 증대에 관한 연구
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Hwangryunhaedoktang is one of the prescriptions used in traditional medicine for skin diseases. In this study, Hwangryunhaedoktang-Gamibang (HG) was fermented with Lactiplantibacillus plantarum, a probiotic lactic acid bacterium, to evaluate its potential as a functional cosmetic composition. Strains with anti-inflammatory activity were selected by isolating lactic acid bacteria from kimchi, a traditional Korean fermented food. HG was inoculated with lactic acid bacteria and the viability was measured. The supernatant was obtained by centrifugation of fermented Hwangryunhaedoktang-Gamibang (HGF) and HG, and the filtered supernatant was freeze-dried and used in the experiment. By measuring DPPH and ABTS scavenging activity, it was confirmed that the antioxidant activity was increased. RAW264.7 cells were inoculated with HG and HGF to confirm anti-inflammatory activity through NO assay, and production levels of pro-inflammatory cytokines (IL-1β, IL-6, and TNF-α) were measured through ELISA assay. It was confirmed that HGF had a greater decrease in production than HG. Through lactobacilli fermentation, the beneficial probiotic properties and antioxidant and pro-inflammatory activities of lactic acid bacteria suggest potential clinical or technical applications.
Keywords:
Hwangryunhaedoktang, Lactiplantibacillus plantarum, Anti-inflammatory activity서 론
피부미용은 현대사회에서 남녀노소 불문하고 지속적으로 관심이 높아지고 있는 분야이다. 그러한 피부미용에서 여드름과 같은 염증성 피부질환은 큰 문제를 지닌 부분이다1). 여드름은 주로 얼굴, 목, 가슴 등 상체 전반에 발생하는 모낭피지선의 만성 염증성 질환으로, 주로 사춘기의 남녀에게 발생하던 과거와 달리 현대사회에서는 약물 오남용, 환경오염 등 외적요인으로 인하여 넓은 연령층에서 발생하고 있는 실정이다. 여드름의 생성원인은 피로, 스트레스 및 유전적인 원인 등 여러 요인들이 복합적으로 작용하는 것으로 알려져 있으며, 호르몬이나 다른 외부적인 요인으로 인해 피지가 모낭에 정체되어 모공이 막힌 경우, 세균증식에 의해 발생하는 것으로 알려져 있다2,3).
우리나라의 한의학 서적 동의보감(東醫寶鑑)에서 황련해독탕은 황련, 황금, 황백, 치자를 이용하는 처방으로 종독을 치료하며, 청열해독의 효능이 있어 열독을 치료하는데 사용하고, 항염증, 항알러지, 항균 효과 등이 알려져 있어, 주로 아토피성 피부염이나 지루성 피부염, 접촉성 피부염, 습진 등의 증상에 사용하는 것으로 알려져 있다4-6).
프로바이오틱스는 우리 몸에서 유익한 작용을 하는 균을 통칭하는 말로, 인간이나 동물의 장에 풍부하게 존재하며, 유제품 이나 발효식품에도 풍부하게 함유되어있는 균이다7,8). 이러한 프로바이오틱스 유산균은 이미 여러 방면으로 제품화가 진행되어 있으며9), 건강증진을 위해 섭취하거나. 질병의 예방목적으로도 사용되어지고, 무엇보다 유산 발효를 통한 2차대사산물의 효용성이 돋보여지며 이를 응용한 연구들이 전 세계적으로 이루어지고 있는 추세이다10-12).
따라서 이와 같이 항균, 항산화 및 항염증 활성 등 생리활성이 우수한 황련해독탕에 피부미용에 사용되어져 왔던 약재를 추가로 첨가한 가미방을 만들었고, 프로바이오틱스 균주를 이용하여 발효시켜 생리활성을 높여 기능성 화장품 조성물로 이용하기 위한 연구를 수행하였다.
재료 및 방법
1. 추출물 제조
본 실험에서 사용한 황련해독탕 가미방(HG) 구성인 황련, 황금, 황백, 치자, 금은화, 연교, 정향, 팔각회향은 명신당(광주)에서 구입하여 사용하였다. 물 1L에 황련, 황금, 황백, 치자 20g, 금은화, 연교, 정향, 팔각회향 5g씩 첨가 후 100℃에서 3시간 동안 전탕하여 식힌 뒤, 유산균 발효 후 원심분리(8000×g, 15분)하고 얻어진 상층액을 취하여 동결건조를 수행하였다. 황련해독탕 가미방(HG)은 27.6%의 수율을 보였고, 발효한 황련해독탕 가미방(HGF)은 25.7%의 수율을 보였다. 동결건조한 시료는 10, 50, 100, 200μg/ml 농도로 희석하여 실험에 사용하였다.
2. 유산균 배양 및 선발
본 실험실에서 보유한 Lactiplantibacillus plantarum 5균주(HUP1,2,3,4,5)를 MRS agar 고체배지에 100μl씩 도말하고 30℃ 배양기에서 혐기조건으로 48시간동안 배양 후, 콜로니 하나를 취해 MRS broth에 접종하여 30℃에서 48시간 배양한 뒤 원심분리(8000×g, 15분)를 하였고 배양 상등액을 membrane filter(0.45μm, Advantec Co., Japan)를 이용하여 제균하였다. 제균 상등액을 이용하여 NO assay를 수행하였고 항염증활성이 우수한 균주를 선발하였다. 선발되어진 균주는 HG에 접종하여 48시간 동안 30℃ 배양기에서 혐기조건으로 48시간동안 배양하였고, 0.85% 멸균 생리식염수로 십진 희석하여 MRS agar 고체배지에 100μl씩 도말하고 30℃ 배양기에서 혐기조건으로 48시간동안 배양 후 생육도를 측정하였다.
3. 항균활성 측정
Cutibacterium acnes(C.acnes) 배양은 cooked meet medium(Difco Lab., USA) 액체배지에 접종하여 30℃에서 48시간 혐기적으로 배양하였고, Staphylococcus aureus(S.aureus) 배양은 tryptic soy broth를 사용하였다. 배양상등액의 항균활성을 검증하기 위해 agar well diffusion method를 사용하였다. Tryptic soy agar(TSA, Difco, USA)에 피검균주를 접종한 중층배양 bioassay plate를 제조하였다. 선발균주의 배양액을 원심분리(8,000rpm, 10 min)하고, membrane filter(0.45μm, Advantec Co., Japan)를 이용하여 제균하였다. 피검균이 접종된 TSA 고체배지 상에 well을 만들고 200μL 배양상등액을 분주하여 30℃에서 배양한 후, 생육억제환 형성여부를 관찰하였다13).
4. 항산화 활성 측정
총 항산화 활성 측정은 ABTS and DPPH scavenging activity assay 방법으로 수행하였다. 70mM 2,2'-azino-bis (3-ethylbenzothiazoline-6-sulphonic acid) (ABTS) 과 24.5mM potassium persulfate을 12시간동안 암소 반응하여 ABTS 양이온을 형성시킨 후, 이 용액을 734nm에서 흡광도 값이 0.7∼0.8±0.02값이 나오도록 희석하였다. 희석된 ABTS용액 100μl에 시료를 50μl씩 농도별로 처리하여 30분 후 734nm에서 흡광도를 측정하였다. 양성대조군으로 L-ascorbic acid를 시료와 동일량 처리하였다14). 1,1-Diphenyl-2- picryhydrazyl(DPPH)용액 100μl에 시료 100μl를 잘 혼합하여 30분간 암소반응 시킨 후 microplate reader로 517nm에서 흡광도 값을 측정하여 농도에 따른 DPPH radical 소거능을 확인하였다. Blank는 시료의 희석용매를 사용하였고, control로는 시료 대신 시료의 희석 용매에 DPPH시약을 넣어 사용하였다. 양성대조군으로 L-ascorbic acid를 시료와 동일량 처리하였다15).
5. 세포생존률 및 NO 생성량 측정
RAW 264.7 cell은 96-well plate에 1×105 cell/well로 분주하고 4시간 후, media change를 하여 각 농도별로 시료를 처리하고 lipopolysaccharide(LPS)를 1μg/ml씩 처리한 군과 처리하지 않은 군으로 나누어 24시간동안 배양하였다. 배양 후 supernatant는 새로운 96-well plate에 옮겨 동일한 양의 Griess reagent를 첨가하여 15분 후에 흡광도(540nm)를 측정하였고 NO 농도는 sodium nitrate를 이용한 표준 곡선으로 계산하였다. RAW 264.7 cell 배양 96-well plate에 10% MTS solution이 함유된 DMEM medium을 well당 100μl씩 넣어주고 3시간동안 배양한 후, 흡광도(480nm)를 측정하여 cell viability 값을 계산하였다. 흡광도 측정은 ELISA microplate reader(Infinite 200pro, TECAN, Austria)을 사용하였다.
6. 염증성 cytokine 측정
염증성 cytokine 발현량을 측정하기 위하여 Quantikine® ELISA kit(R&D system, USA)를 이용하여 측정하였으며, 염증성 cytokine인 TNF-α, interleukin-1β(IL-1β), interleukin-6(IL-6)를 확인하였고 실험과정은 해당 protocol에 따라 수행하였으며 Stop solution 처리 후, 450nm에서 흡광도 값을 측정하여 발현량을 확인하였다.
7. 통계처리
본 실험에서 얻은 결과는 3회 반복 측정하여 평균 ± 표준편차 (mean ± S.D)로 나타내었으며, SPSS (Statistical Package for Social Science Inc., Chicago, IL, USA)를 이용하여 일원 변량분석(one way ANOVA)을 실시 한 후 Student’t t-test로 분석하여 유의성을 p<0.05 수준에서 검증하였다.
결 과
1. 유산균 선발 및 발효
본 실험에서 사용한 유산균은 전통 발효식품에서 분리한 Lactiplantibacillus plantarum 5균주를 사용하였고, 대조군으로 시료와 동량의 멸균증류수를 첨가하여 비교하였다. 멸균 증류수에 LPS를 처리한 군을 확인한 결과 NO의 생성이 정상적으로 일어난 것을 확인하였다. 5종 유산균 배양상등액의 LPS에 의한 NO 생성량을 측정한 결과 HUP3 균주가 가장 큰 폭으로 NO 생성량을 억제하는 것을 확인하여(Fig. 1), 해당균주로 황련해독탕 가미방(HG)의 발효를 진행하였다. 발효시킨 황련해독탕 가미방의 유산균 생육은 5.8×107CFU/ml으로 생육이 잘 이루어 지고 있는 것을 확인하였다(Fig. 2). 따라서 해당 균주로 발효한 황련해독탕 가미방(HGF)과 HG를 동결건조 후 멸균증류수에 희석하여 실험에 사용하였다.
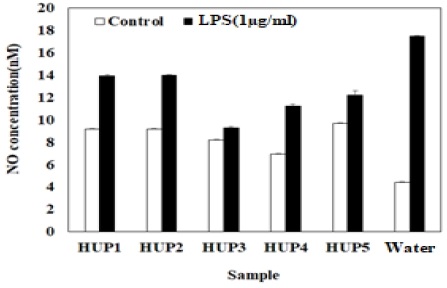
Effects of Lactobacillus culture supernatant on LPS-induced NO generation in RAW 264.7 macrophage cells. The cells were pre-treated with LPS(1μg/ml) for 24h and then treated with Lactobacillus culture supernatant for 24h. (n=3)
2. HG와 HGF의 항균 활성
HG와 HGF의 항균활성을 확인한 결과, HGF는 C.acnes와 S.aureus 두 피검균 모두에서 각각 19mm, 13mm의 생육 억제환을 확인하여 항균활성이 우수한 것으로 확인되었다. HG는 S.aureus 균주에서 11mm 생육 억제환이 확인되었고, C.acnes 균주에서는 생육 억제환의 직경이 7mm로 억제능이 미약한 것으로 나타났다. S.aureus의 경우에도 HGF에 비해 직경이 좁은 것으로 보아 유산균 발효를 통해 HG가 생물전환능에 의해 항균활성을 가진 물질이생성되어 나타난 결과로 사료되었다(Fig. 3).
3. HG와 HGF의 Free radical 소거에 미치는 영향
ABTS, DPPH Free radical 소거능을 확인하여 항산화 활성을 측정한 결과, HG와 HGF 모두 우수한 ABTS 소거능을 보여주었다. 100 및 200μg/ml 농도에서는 100%에 가깝게 소거되었고, 50μg/ml 농도에서 HGF는 95.2%로 HG의 90.5% 소거능 보다 항산화력이 증가하였으며, 10μg/ml 농도에서도 HGF 67.6%, HG 55.4%의 소거능으로 항산화력의 차이를 확이한였다. DPPH 소거능 또한 100 및 200μg/ml 농도에서는 100%에 가깝게 소거되었으며, 50μg/ml 농도에서 HGF는 89.6%로 HG의 82.5% 소거능 보다 항산화력이 증가 하였고, 10μg/ml 농도에서도 HGF 72.7%, HG 61.9%의 소거능을 확인하였다. 따라서 발효를 통해 항산화 활성이 증가하였다는 것을 확인 할 수 있었다.
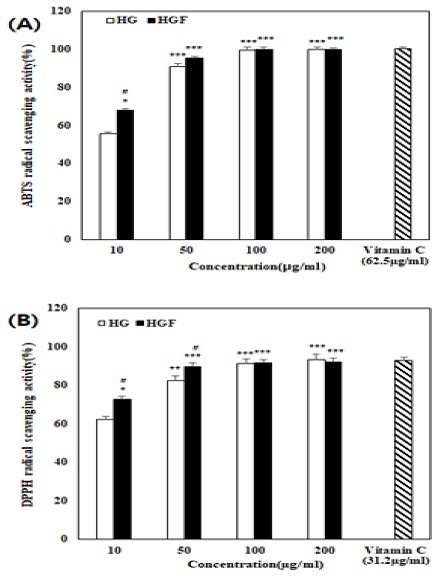
ABTS and DPPH radical scavenging activities of HGF and HG. An appropriate amount of ascorbic acid was used as a positive control. Each bar represents the mean ± S.D. from three independent experiments(*P<0.05, **P<0.01, ***P<0.5 compared with control and #P<0.05, ##P<0.01, ###P<0.05 compared with HGF and HG groups).
4. HG와 HGF를 처리한 RAW 264.7 Cell의 생존률 및 NO 발현량에 미치는 영향
MTS assay를 통해 RAW 264.7 cell의 생존율을 확인한 결과, HG와 HGF의 농도 10μg/ml에서 200μg/ml까지 96.5-102.8%의 세포 생존율을 보여 모두 RAW 264.7 cell에 대하여 유의적인 독성반응을 보이지 않는 것으로 확인하여 해당 농도로 NO assay를 실시하였다(Fig. 5).
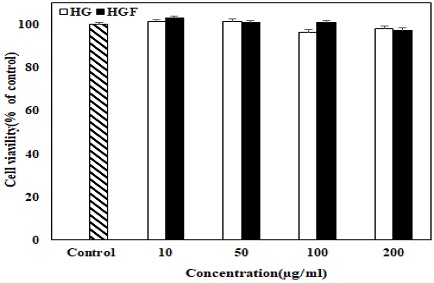
Cell viability was determined by MTS assay. Values are the means ± SD of three independent experiments (n=3).
농도별로 희석한 sodium nitrate 표준곡선으로 NO assay를 수행하였다. LPS로 자극한 RAW 264.7 cell에 HGF와 HG를 각각 처리한 후, nitric oxide 소거능을 확인한 결과, LPS(1㎍/ml) 처리시 NO 농도는 22.0μM 이었으나, HGF와 HG 처리군 모두 농도 비례적으로 점차 감소하는 것으로 확인하였다. HGF와 HG 모두 200㎍/ml 농도에서는 대조군과 거의 비슷한 농도를 보였다. 100㎍/ml 농도에서 HGF이 HG보다 1.4μM 함량이 더 감소된 차이를 나타내었다. 모든 농도 처리군에서도 Lactiplantibacillus plantarum 으로 발효시킬 경우 nitric oxide 생성 억제력이 더 증가된 것을 확인하였다(Fig. 6). 이를 통해 HGF와 HG의 우수한 항염증 활성을 확인하였으며, 이 결과에 근거하여 어떠한 기전으로 이러한 결과가 도출되었는지 알아보기 위해 염증성 cytokine 발현량을 측정하였다.
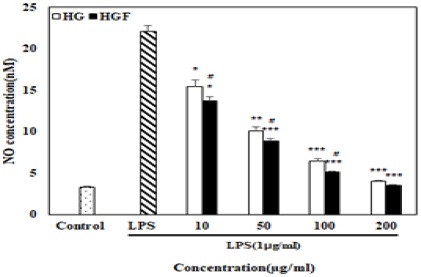
Effects of HGF and HG on LPS-induced NO generation in RAW 264.7 macrophage cells. The cells were pre-treated with LPS(1μg/mL) for 24h and then treated with various ratios of HGF and HG for 24h. Each bar represents the mean ± S.D. from three independent experiments(*P<0.05, **P<0.01, ***P<0.5 compared with control and #P<0.05, ##P<0.01, ###P<0.05 compared with HGF and HG groups).
5. 염증성 사이토카인 발현에 미치는 영향
Nitric oxide 생성 억제에 관여하는 요인을 확인하기 위해 염증성 cytokine인 IL-1β, IL-6 및 TNF-α의 발현량을 측정하였다. IL-1β의 경우 두 시료 모두 농도 의존적으로 발현량이 감소하는 것을 확인하였고, HGF가 HG에 비해 19.3 pg/ml을 더 감소시키는 것으로 확인하였다. IL-6의 경우이서도 농도 의존적으로 발현량이 감소하였으며, HGF가 HG에 비해 103.0pg/ml을 더 감소시켰다. 종양괴사인자인 TNF-α의 발현량을 측정하였을 때, 두 시료 모두 큰 폭으로 발현량을 감소시키지는 못하였지만, HG에 비해 HGF가 164.1 pg/ml이 감소한 것을 확인하였다(Fig. 7).
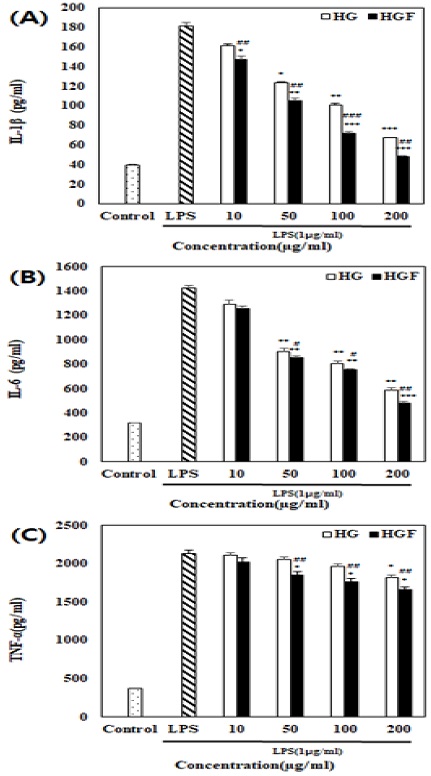
Effects of HGF and HG on IL-1β (A), IL-6 (B), and TNF-α (C) generation in LPS-induced in RAW 264.7 macrophage cells. The cells were pre-treated with LPS(1μg/mL) and then treated with various ratios of HGF and HG for 24h. Each bar represents the mean ± S.D. from three independent experiments(*P<0.05, **P<0.01, ***P<0.5 compared with control and #P<0.05, ##P<0.01, ###P<0.05 compared with HGF and HG groups).
고 찰
피부미용은 예로부터 여성들의 꾸미기 위한 목적으로 주로 행해져 왔으며, 관심도가 낮은 분야였다. 대부분의 사람들은 금전적, 시간적 여유가 많지 않아 피부미용에는 신경을 쓰지 못하는 현실이었으나 차츰 사람들의 삶의 질이 높아지며 피부 미용에 대한 관심도도 함께 높아지게 되었다. 피부에 염증성 질환을 일으키는 균으로는 황색포도상구균으로 불리는 S.aureus와 S.epidermidis, S.pyogens 등이 알려져 있으며, 여드름 유발 균으로는 C.acnes 가 알려져있다16). 절대혐기성 세균인 C.acnes는 모공이 막혔을 경우 모공 내에서 증식하며 lipase를 분비하여 피지의 주요 구성성분인 triglyceride를 free fatty acid로 분해하고, 이는 모낭 벽의 상피세포를 자극하여 미세 면포를 형성하며, 계속해서 각질과 피지가 분비됨으로서 모낭벽이 얇아지고 염증을 일으키게 된다. 여기서 염증반응이 계속 일어나게 되면 피지 및 노폐물이 모공 내벽을 찢고 피부 내부로 들어가 고름이 차있는 상태인 농포를 형성하여 염증을 악화시켜 더욱 심한 통증을 느끼게 된다17). 이러한 여드름의 약물 치료는 피지의 과잉 생산을 억제하거나 C.acnes균의 증식억제 또는 염증반응의 억제에 중점을 두고 개발되어지고 있으며, 현재는 여드름이 발생한 부위에 국소적으로 약을 도포하거나 내복약을 통한 치료약이 사용되어지고 있다. 그러나 이러한 약물치료는 인체에 무리를 주고 항생제 내성 등의 부작용이 있어 문제가 되고 있다18-19). 외과적으로 피부 박피술, 레이저 시술, 냉동치료 등의 물리적인 요법이 있지만 이는 흉터가 생기고 이를 교정하기 위해서는 비용이 많이 들어간다는 단점이 있다20). 이러한 단점을 보완하기 위해 부작용이 적고 안정성이 확보된 천연물을 이용한 치료방법이 연구되어지고 있으며21), 이러한 천연물을 발효를 통해 생리활성을 증가시키는 방법에 대한 다양한 연구가 이루어지고 있다22). 프로바이오틱스라 불리는 인체에 유익한 유산균은 대사산물을 생성하여 병원성 균주에 대해 항균 활성을 나타내기도 하며, 항산화 및 항염증 활성 등 인체에 유익한 대사산물을 생성하는 것으로 알려져 있다. 이러한 프로바이오틱스는 독성이 없고 비병원성 균주이고 우리나라의 전통식품인 김치나 된장 같은 발효식품에 풍부하게 함유되어있으며, 항생제 사용, 알콜의 과잉섭취, 스트레스, 질병, 독성물질 노출 등의 상황에 인체가 균형을 유지할 수 있도록 하는 역할을 한다. 항생제를 섭취하게 되면 유해균은 물론 유익균도 죽게 되는데 프로바이오틱스 균주를 이용하면 섭취 시에는 감소된 유익균을 증가시킬 수 있고, 프로바이오틱스 자체만으로도 유해균의 생육을 억제할 수 있다23,24). 앞서 말한 우리나라 전통식품에서 흔하게 발견되어지는 대표적인 프로바이오틱스 유산균인 L. plantarum는 발효식품 뿐만 아니라 각종 식물군, 심지어 인간의 타액에서도 발견되어진다. 또한 통성혐기성 균주이며 내산성, 내담즙성 및 내열성이 우수하여 생육 계수가 높고 항염증 및 항산화 활성에 관한 연구가 활발하게 이루어 지고 있는 균주이다33). 이러한 프로바이오틱스 유산균인 L. plantarum을 이용하여 발효한 황련해독탕 가미방은 성공적으로 피검균주에 대한 생육 억제능을 확인하였으며 이는 HGF의 우수한 항균활성을 통해 화장품 또는 피부질환 치료소재로서의 응용가능성이 매우 높음을 시사한다.
황련해독탕은 황련, 황금, 황백, 치자를 이용하는 처방으로 급성 염증, 폐렴, 고혈압 및 종독 증상에 쓰이며 아토피성 피부염, 습진 등 피부질환에 사용하는 것으로 알려져 있다. 황련, 황금, 황백은 phellodendrine과 berberine 성분과 같은 알칼로이드가 다량 함유되어 있어 항균작용이 뛰어나고, 치자 또한 피부미백 효과 및 항염증 효과가 있는 것으로 알려져 있다. 이러한 약재들의 복합 처방인 황련해독탕은 염증성 사이토카인인 IL-6의 발현량을 억제시키는 것으로 보고되었으며, S.aureus에 대한 생육 억제능 또한 널리 알려져 있다4-6). 금은화는 인동초 luteolin, saponin과 같은 유효물질을 가지고 있으며 항균, 항염증 효과를 가지고 있다25). 청나라의 연수방단(燕守方丹)에는 금은화는 피부를 촉촉하게 하고 젊어지게 한다고 적고 있으며, 현대사회에서도 피부 미백 등의 효능이 보고되어있다. 연교는 의성개나리의 열매로 해독작용 및 알레르기성 천식에 사용한다고 알려져 있으며, Olinic acid, forsytol 등의 유효물질을 함유하고 있다26). 정향은 정향나무의 꽃봉우리로 청열해독, 항균, 항바이러스, 소염작용에 사용하고, Decanoyl acetaldehyde, Methyl nonylketone, α-Pinene, Myrcene, Limonene 등의 유효물질이 풍부하게 함유되어 있는 것으로 알려져 있다27). 팔각회향은 팔각회향의 열매로 활혈, 청열, 해독, 항균, 항진균 활성이 알려져 있으며 Acetylshikonin 등의 물질을 함유하고 있으며 의약품에 자주 사용되어지는 약재중 하나이다28). 이러한 약제들의 복합처방인 HG는 그 자체만으로도 우수한 항산화 활성을 보여주었으며 발효 시 항산화능이 증가한 것으로 미루어 보아, 이와같은 항산화 활성 향상을 통해, 기능성 식품, 기능성 화장품, 의약품 개발에 사용할 수 있을 것으로 판단되었다.
Nitric oxide(NO)는 원래 염증성 기능과 항염증성 기능을 동시에 하는 것으로 알려져 있는데, NO의 생체 내 과다 생성은 오히려 세포독성을 가지게 되며, 세포를 파괴하고 shock를 일으키며, 염증반응을 촉진하여 조직의 손상을 유발하는 것으로 알려져 있다. Interleukin-1β(IL-1β)의 주요 기능은 TNF-α와 유사하나 감염이나 외부의 자극에 대한 숙주의 염증반응 매개자로 알려져 있다. IL-1β는 여러 가지 생성 유도물질의 자극을 통해 대식세포, NK cell, T-cell, B-cell 등 다양한 세포들로부터 생성되며, TNF-α와 동일하게 과다 발현시 류머티스성 질환이 발생하는 것으로 알려져 있다29). Interleukin-6(IL-6)는 선천면역과 적응면역 모두에서 기능을 나타내는 사이토카인이다. IL-6는 다기능성 사이토카인으로 대식세포, T-림프구와 B-림프구에서 주로 생성되며 대표적인 기능으로는 조혈세포 및 신경세포의 증식과 분화 및 면역반응 등에 관여하며, IL-6가 과다하게 분비될 경우 림프계 종양과 다양한 면역이상 증상이 발생하는 것으로 알려져 있다30). 종양괴사 인자(tumor necrosis factor, TNF-α)는 병원성 미생물에 의한 급성 염증반응의 매개자이며, 중증 감염 형태인 전신적인 합병증의 원인이 된다. TNF-α는 종양에 대하여 출혈성 괴사를 일으키는 혈청인자와 염증을 통한 생체방어 체계에 관여하는 사이토카인으로도 알려져 있다. TNF-α 기능으로는 항균활성, 항종양활성, 분화 증식 조절작용, 염증반응에 따른 면역작용 등이 보고되어 있으나, 과도한 분비시 류마티스성 질환의 원인이 되기도 한다31). MTS assay을 통해 황련해독탕의 안전성을 확인하였으며, NO의 발현량 감소로 보아 염증 반응을 조절할 수 있다는 결과를 도출하였다. NO 생성에 관여하는 요인인 염증성 사이토카인의 발현량 또한 유의적으로 감소된 것으로 보아 염증인자 조절에 관여한다는 결과를 얻었다. 사이토카인은 면역계와 염증에 있어서 세포사이의 신호전달을 담당하는 단백질로서 중요한 매개자 역할을 담당한다. IL-1β, IL-6, TNF-α 등 사이토카인 저해제를 투여하는 것은 면역 질환 및 염증 질환과 관련된 생물학적 반응을 변화시킬 잠재적인 접근 방법이 될 수 있다32). 이와 같은 결과로 미루어 볼 때, Lactiplantibacillus plantarum 발효를 통해 내재적 염증물질의 생산억제능이 증가함으로서 유산균이 항염증 활성에 증정적 영향을 주는 것으로 사료되었으며, 이를 통해 염증성 피부질환의 치료에도 응용이 가능할 것으로 판단되어지며, 향후 위의 실험결과를 참고하여 미백, 항아토피, 보습, 주름개선등의 추가 연구가 진행되어야 할 것으로 판단되었다.
결 론
본 연구에서는 프로바이오틱스 유산균인 Lactiplantibacillus plantarum으로 발효한 황련해독탕 가미방과 황련해독탕 가미방의 항균 및 항산화, 항염증 활성을 비교 측정하였다.
NO 생성 억제능이 우수한 Lactiplantibacillus plantarum 균주를 선발하여 황련해독탕 가미방을 발효하였으며, 5.8×107CFU/ml으로 높은 생육도 또한 확인 하였다. HGF 와 HG를 동결건조 하여 각각 27.6%, 25.7%의 수율로 시료를 얻어 10, 50, 100, 200μg/ml 농도로 희석하여 실험하였다.
항균 활성 측정결과, HG는 S.aureus 피검균만을 약간 억제시켰으나, HGF는 C.acnes와 S.aureus 피검균에서 모두 생육억제환을 형성하여 발효를 통해 항균력이 증가함을 확인하였다.
항산화 활성 측정에서 HG와 HGF 모두 우수한 항산화 활성을 확인하였으며, HGF가 HG에 비해 ABTS, DPPH 라디컬 소거능이 각각 4.7%, 12.2%의 소거능을 추가적으로 가지는 것을 확인하였다.
MTS assay를 통해 RAW 264.7 cell의 생존율을 확인한 결과, HG와 HGF의 농도 10μg/ml에서 200μg/ml까지 96.5-102.8%의 세포 생존율을 확인하여 안전성을 확보하였고, NO assay를 통해 NO 생성 억제를 확인하여 염증성 사이토카인 발현량 억제를 ELISA assay로 확인하였다. IL-1β, IL-6, TNF-α를 확인한 결과, 발효를 통해 각각 19.3, 103.0, 164.1pg/ml을 추가로 억제하는 것을 확인하여 기능성 화장품 조성물로서의 잠재력을 확인하였다.
Acknowledgments
본 연구는 2020년도 호남대학교 학술연구비 지원을 받아 수행되었다.
References
-
Chan IL, Cohen S, da Cunha MG, Maluf LC. Characteristics and management of Asian skin. Int J Dermatol. 2019;58(2):131-43.
[https://doi.org/10.1111/ijd.14153]

-
Kanwar IL, Haider T, Kumari A, Dubey S, Jain P, Soni V. Models for acne: A comprehensive study. Drug Discov Ther. 2018;12(6):329-40.
[https://doi.org/10.5582/ddt.2018.01079]

-
Fiedler F, Stangl GI, Fiedler E, Taube KM. Acne and Nutrition: A Systematic Review. Acta Derm Venereol. 2017;97(1):7-9.
[https://doi.org/10.2340/00015555-2450]

- Lee JH, Eum HA, Chung TH, Lee YH, Um YR, Yim NH, Kim DS, Ma JY. Acute Toxicity Study of the Hwangryunhaedok-tang Extract in ICR Mice. Herbal formula science. 2010;18(2):159-66.
-
Ki HP, Jang SI, Yun YG. Ameliorative Effects of Hwangnyeonhaedok-tang on Atopic Dermatitis. Herbal formula science. 2013;21(1):80-90.
[https://doi.org/10.14374/HFS.2013.21.1.080]

-
Hong CH. Two cases of Seborrheic Dermatitis treated by Hwangryunhaedok-tang Pharmacopuncture Therapy. J Korean Medicine Ophthalmology & Otolaryngology & Dermatology 2012;25(2):68-75.
[https://doi.org/10.6114/jkood.2012.25.2.068]

-
Yu Y, Dunaway S, Champer J, Kim J, Alikhan A. Changing our microbiome: probiotics in dermatology. Br J Dermatol. 2020;182(1):39-46.
[https://doi.org/10.1111/bjd.18659]

-
Shokryazdan P, Faseleh Jahromi M, Liang JB, Ho YW. Probiotics: From Isolation to Application. J Am Coll Nutr. 2017;36(8):666-76.
[https://doi.org/10.1080/07315724.2017.1337529]

-
Sniffen JC, McFarland LV, Evans CT, Goldstein JC. Choosing an appropriate probiotic product for your patient: An evidence-based practical guide. PLoS One. 2018;13(12):e0209205.
[https://doi.org/10.1371/journal.pone.0209205]

-
Azad MAK, Sarker M, Wan D. Immuno- modulatory Effects of Probiotics on Cytokine Profiles. Biomed Res Int. 2018:8063647.
[https://doi.org/10.1155/2018/8063647]

-
Molska M, Reguła J. Potential Mechanisms of Probiotics Action in the Prevention and Treatment of Colorectal Cancer. Nutrients. 2019;11(10):2453.
[https://doi.org/10.3390/nu11102453]

-
Valdes-Varela L, Gueimonde M, Ruas-Madiedo P. Probiotics for Prevention and Treatment of Clostridium difficile Infection. Adv Exp Med Biol. 2018;1050:161-176.
[https://doi.org/10.1007/978-3-319-72799-8_10]

- Lim SJ, Jang SS, Kang DK. Probiotic properties of Lactobacillus salivarius CPM-7 isolated from chicken feces. Kor. J. Microbiol. Biotechnol. 2007; 35:98-103.
-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic. Biol. Med. 1999; 26:1231-37.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Leong, LP. Shui G. An investigation of antioxidant capacity of fruits in Singapore markets. Food Chemistry 2002;76(1):69-75.
[https://doi.org/10.1016/S0308-8146(01)00251-5]

-
Mottin VHM, Suyenaga ES. An approach on the potential use of probiotics in the treatment of skin conditions: acne and atopic dermatitis. Int J Dermatol. 2018;57(12):1425-32.
[https://doi.org/10.1111/ijd.13972]

-
Platsidaki E, Dessinioti C. Recent advances in understanding Propionibacterium acnes (Cutibacterium acnes) in acne. 2018;7:F1000 Faculty Rev-1953.
[https://doi.org/10.12688/f1000research.15659.1]

-
Xu H, Li H. Acne, the Skin Microbiome, and Antibiotic Treatment. Am J Clin Dermatol. 2019 ;20(3):335-44.
[https://doi.org/10.1007/s40257-018-00417-3]

-
Dessinioti C, Dreno B. Acne treatments: future trajectories. Clin Exp Dermatol. 2020;45(8):955-61.
[https://doi.org/10.1111/ced.14239]

- Soliman YS, Horowitz R, Hashim PW, Nia JK, Farberg AS, Goldenberg G. Update on acne scar treatment. Cutis. 2018;102(1):21-25.
-
Clark AK, Haas KN, Sivamani RK. Edible Plants and Their Influence on the Gut Microbiome and Acne. Int J Mol Sci. 2017;18(5):1070.
[https://doi.org/10.3390/ijms18051070]

-
Kwon HH, Yoon JY, Park SY, Min S, Suh DH. Comparison of clinical and histological effects between lactobacillus-fermented Chamaecyparis obtusa and tea tree oil for the treatment of acne: an eight-week double-blind randomized controlled split-face study. Dermatology. 2014;229(2):102-9.
[https://doi.org/10.1159/000362491]

-
Islam SU. Clinical Uses of Probiotics. Medicine (Baltimore). 2016;95(5):e2658.
[https://doi.org/10.1097/MD.0000000000002658]

-
Suez J, Zmora N, Segal E, Elinav E. The pros, cons, and many unknowns of probiotics. Nat Med. 2019;25(5):716-29.
[https://doi.org/10.1038/s41591-019-0439-x]

- Yu PY, Kim HH, Lee YL, Park SY, Jung MY, Choi JH. Effects of Hot Water Extracts from Lonicera Japonica Flos Extracts on whitening using B16F10 cell lines J Korean Medicine Ophthalmology & Otolaryngology & Dermatology. 2017;30(2):38-50.
- Kim MJ, Lim KR, Yoon KS. Anti- inflammatory Effects of Prescription Extracts Containing Forsythia viridissima L. J. Soc. Cosmet. Scientists Korea. 2009;35(4):277-85.
-
Batiha GE, Alkazmi LM, Wasef LG, Beshbishy AM, Nadwa EH, Rashwan EK. Syzygium aromaticum L. (Myrtaceae): Traditional Uses, Bioactive Chemical Constituents, Pharmacological and Toxicological Activities. Biomolecules. 2020;10(2):202.
[https://doi.org/10.3390/biom10020202]

-
Wang GW, Hu WT, Huang BK, Qin LP. Illicium verum: a review on its botany, traditional use, chemistry and pharmacology. J Ethnopharmacol. 2011;136(1):10-20.
[https://doi.org/10.1016/j.jep.2011.04.051]

-
Chung Y, Chang SH, Martinez GJ, Yang XO, Nurieva R. Critical regulation of early Th17 cell differentiation by interleukin-1 signaling. Immunity 2009;30:576-87.
[https://doi.org/10.1016/j.immuni.2009.02.007]

-
Toshio T, Narazaki M, Kishimoto T. IL-6 in Inflammation, Immunity, and Disease. Cold Spring Harb PersPect. Biol. 2014;6:a016295.
[https://doi.org/10.1101/cshperspect.a016295]

-
Felson DT, Anderson JJ, Boers M, Bombardier C, Furst D, Goldsmith C, Katz LM, Lightfoot R Jr, Paulus H, Strand V. American college of rheumatology. Preliminary definition of improvement in rheumatoid arthritis. ArthritisRheum 1995;38:727-35.
[https://doi.org/10.1002/art.1780380602]

-
Moller B, Villiger PM. Inhibition of IL-1, IL-6, and TNF-alpha in immune-mediated inflammatory diseases. Springer Semin Immunopathol. 2006; 27(4):391-408.
[https://doi.org/10.1007/s00281-006-0012-9]

-
Lee DE, Huh CS, Ra J, Choi ID, Jeong JW, Kim SH, Ryu JH, Seo YK, Koh JS, Lee JH, Sim JH, Ahn YT. Clinical Evidence of Effects of Lactobacillus plantarum HY7714 on Skin Aging: A Randomized, Double Blind, Placebo-Controlled Study. J Microbiol Biotechnol. 2015;25(12):2160-8.
[https://doi.org/10.4014/jmb.1509.09021]