
H1975 세포에서 황금추출물에 의한 gefitinib 저항성 억제 효과
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Gefitinib, a first generation epidermal growth factor receptor tyrosine kinase inhibitor (EGFR TKI), provides obvious clinical benefit in patients with EGFR-mutant non-small cell lung cancer (NSCLC). However, patients ultimately develop gefitinib resistance which mainly caused by EGFR T790M secondary mutation. In the current study, we investigated whether the root extract of Scutellaria baicalensis (SB) overcomes gefitinib resistance. Gefitinib-resistant H1975 human NSCLC cells (EGFR L858R/T790M double mutant) were treated with gefitinib and/or ethanol extract of SB (ESB) to evaluate the effect of ESB on the gefitinib sensitivity. The cell viability was measured by MTT assay and trypan blue exclusion assay. The colony-forming ability was evaluated by anchorage-dependent colony formation assay. Combined treatment with gefitinib and ESB markedly decreased the cell viability and colony formation than single treatment with gefitinib or ESB in H1975 cells. In addition, cells treated with both gefitinib and ESB exhibited a significant increase of sub-G1 DNA content which indicates apoptotic cells compared with those treated with gefitinib or ESB alone. As a molecular mechanism, combined treatment with gefitinib and ESB strongly downregulated the phosphorylation of ERK and JNK than single treatment with gefitinib or ESB. Taken together, our results demonstrate that ESB sensitizes H1975 cells to gefitinib treatment. We cautiously propose that ESB can be used in combination with gefitinib for the advanced NSCLC patients with acquired resistance to EGFR TKIs.
Keywords:
Scutellaria baicalensis, Gefitinib, EGFR TKI resistance, Apoptosis, Non-small cell lung cancer서 론
폐암은 미국과 한국에서 남녀 공히 암으로 인한 사망률 1위를 차지하고 있다1,2). 2019년 한국의 폐암으로 인한 사망자는 18,574명으로 전체 암으로 인한 사망자의 22.9%를 차지하였다1). 미국에서는 2021년 131,880명이 폐암으로 인해 사망할 것으로 예상하고 있는데, 이는 전체 암으로 인한 사망자 중 22%에 해당하는 수치이다2). 폐암의 5년 생존율은 꾸준히 증가하는 추세이지만 여전히 한국은 32%1), 미국은 21% 수준으로 예후가 불량하다. 안타깝게도 57%의 폐암환자가 원격전이가 일어난 시점에 폐암을 진단받으며, 원격전이가 일어난 폐암의 5년 생존율은 6%에 그친다. 전이가 이루어지기 전이나 국소전이만 일어난 폐암은 상대적으로 예후가 양호하므로 효과적인 조기진단방법을 고안하고, 새로운 폐암치료제를 개발하는 것이 시급한 실정이다2).
지난 수십 년간 폐암의 주요한 돌연변이들이 발견됨에 따라 환자의 유전정보에 근거한 개인맞춤형 표적치료가 가능하게 되었으며, 이는 폐암의 치료율을 제고하는 데 일조하였다3). Epidermal growth factor receptor(EGFR, 상피성장인자 수용체) 유전자는 폐암에서 흔히 돌연변이가 일어나는 유전자로서 특히 아시아 지역의 비흡연자 및 여성 폐암환자에게 약 50% 비율로 돌연변이가 나타나는 것으로 보고되어 있다4). 폐암의 EGFR 변이는 EGFR의 과활성화를 일으켜 하위 신호전달체계인 RAS/RAF/MEK/ERK 경로나 phosphoinositide 3 kinase(PI3K)/AKT 경로 등을 통해 암의 증식과 전이를 촉진한다5). 이러한 EGFR 변이 폐암환자에게 EGFR을 표적으로 하는 gefitinib 등 1세대 EGFR TKI (tyrosine kinase inhibitor, 티로신키나제억제제)는 임상적으로 매우 탁월한 치료효과를 보였다6,7). 그러나 대부분의 환자에게 1년 이내 내성이 나타나는 것이 문제점으로 대두되고 있다8). 대표적인 내성획득 기전으로서 EGFR T790M 돌연변이(60%), MET 유전자 증폭 등 보상경로 활성화(20%), 상피간엽이행(epithelial-mesenchymal transition, EMT) 등 조직학적 변성과 세포사멸 경로 불활성화 등이 알려져 있다8). 이에 EGFR TKI 내성을 극복하기 위해 afatinib과 osimertinib 등 2·3세대 EGFR TKI가 개발되었으나, 임상적 효과가 제한적이며, 이들 역시 내성출현 문제에서 자유롭지 못한 실정이다9,10). 따라서 EGFR TKI 내성을 효과적으로 제어할 수 있는 약물을 개발하는 것은 폐암의 치료율 제고를 위해 필수적인 과제라 하겠다. 흥미롭게도 전이가 이뤄진 진행성 폐암에서 한약 치료가 EGFR TKI의 항암효과를 높이고 독성을 감소시키는 것이 다수 보고되었으므로11-17) EGFR TKI 내성을 조절하는 한의약 소재를 발굴하는 것이 유망한 전략이라고 할 수 있다.
황금(Scutellaria baicalensis, 黃芩)은 한의학의 대표적인 本草로서 苦寒한 성질을 가지며 淸熱燥濕, 瀉火解毒하여 전통적으로 肺熱咳嗽, 濕熱性 下利, 黃疸 등의 치료에 사용되어 왔다18). 최근 연구에 따르면 황금은 다양한 약리학적 활성을 가지고 있는데, 신경보호효과, 간보호효과, 항염증효과, 항균효과, 항산화 효과 및 항암효과 등이 그것이다18,19). 황금의 항암효과는 여러 암세포에서 보고된 바 있으며, 특히 폐암세포에서 세포주기 진행과 전이를 억제하고 apoptosis를 유발하여 항암효과를 나타내는 것으로 보고되었다20-24). 그러나 황금이 EGFR TKI 저항성을 극복할 수 있는지에 대한 연구는 이루어진 바 없다. 이에 본 연구에서는 황금추출물이 EGFR TKI 내성을 가진 H1975 인체폐암세포주에서 gefitinib에 대한 감수성을 높임으로써 내성극복효과를 가지는지 조사하였으며, 유의한 결과를 얻었기에 보고하는 바이다.
재료 및 방법
1. 시료 제조
본 실험에 사용된 황금은 ㈜본초마루(Seoul, Korea)에서 구입한 것으로서 지표성분인 baicalin의 함량이 18.8%에 달하여 대한약전의 기준(baicalin 함량 10% 이상)을 충족하는 것으로 나타났다24). 황금 에탄올 추출물(ethanol extract of Scutellaria baicalensis, ESB)을 얻기 위해 황금 50 g을 분말로 파쇄한 후 80% 에탄올을 800 ㎖ 첨가하여 40℃에서 150 rpm으로 교반시키며 72시간 동안 추출하였다. 추출액을 모은 후 다시 80% 에탄올 300 ㎖를 황금에 첨가하여 같은 방식으로 24시간 동안 2차 추출하였다. 1차 추출액과 2차 추출액을 모아 3000 rpm에 20분간 원심분리 후 상층액을 필터를 통해 여과하였다. 여과된 추출액을 감압농축 및 동결건조하여 최종 분말을 얻었으며(수율 42.48%), 이를 dimethylsulfoxide (DMSO; Amresco, Solon, OH, USA)에 200 ㎎/㎖ 농도로 용해시켜 –80℃에 보관 및 사용하였다.
2. 세포 배양
EGFR TKI 내성 세포주인 H1975 인체폐암세포주(EGFR L858R/T790M double-mutant)는 서울대학교 약학대학 이호영 교수님으로부터 제공받았다. 세포배양을 위해 RPMI-1640 (WelGENE, Seoul, Korea) 90%, fatal bovine serum (FBS; WelGENE) 10%, antibiotics (WelGENE) 1%로 구성된 세포배양액을 사용하였으며, 세포는 37℃, 5% CO2 조건 하에서 배양하였다.
3. MTT assay
H1975 세포를 3×103 cells/well 농도로 96 well plate에 분주한 후 24시간 안정화시킨 다음 ESB와 gefitinib (Cayman Chemical, Ann Arbor, MI, USA)을 단독 혹은 병합처리하였다. 72시간 후 MTT [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide; Duchefa, Haarlem, The Netherlands] solution을 0.5 ㎍/㎖ 농도가 되도록 각 well에 분주하였고, 37℃에서 2시간 동안 반응시켰다. 그 후 세포배양액을 모두 제거하고 DMSO 100 ㎕를 넣어 formazan을 용해시켰다. 각 well의 흡광도는 multiplate reader (SpectraMax M3; Molecular Devices, San Jose, CA, USA)를 사용하여 540 nm에서 측정하였다.
4. Trypan blue exclusion assay
H1975 세포를 3×104 cells/well 농도로 12 well plate에 분주한 후 24시간 안정화시킨 다음 ESB와 gefitinib을 단독 혹은 병합처리하였다. 72시간 후 세포를 모아 phosphate-buffered saline (PBS, WelGENE) 1 ㎖에 현탁하였으며, 세포현탁액 100 ㎕과 0.4% trypan blue solution (WelGENE) 100 ㎕을 섞은 후 hematocytometer를 사용하여 세포를 계수하였다. 푸른색으로 염색된 세포는 죽은 세포로 판단하여 계수에서 제외하였다.
5. Colony formation assay
H1975 세포를 2×102 cells/well 농도로 12 well plate에 분주한 후 24시간 안정화시킨 다음 ESB와 gefitinib을 단독 혹은 병합처리하였다. 세포는 37℃에서 2주간 배양하였으며. 3일마다 ESB 혹은 gefitinib을 새로 처리하였다. Colony는 PBS 세척 후 100% 메탄올로 5분간 고정하였으며, 헤마톡실린(Sigma-Aldrich, St.Louis, MO, USA)으로 30분간 염색하였다. 수차례 증류수로 세척한 다음 염색된 colony를 디지털카메라(EOS750D, Canon, Japan)로 촬영하였다.
6. Flow cytometry를 통한 sub-G1 분석
H1975 세포를 1×105 cells/well 농도로 6 well plate에 분주한 후 24시간 안정화시킨 다음 ESB와 gefitinib을 단독 혹은 병합처리하였다. 72시간 배양 후 H1975 세포들을 모아 80% 에탄올로 4℃에서 1시간 고정하였다. 고정된 세포는 PBS 세척 후 30 ㎍/㎖ RNase A가 포함된 50 ㎍/㎖ propidium iodide solution으로 암실에서 30분간 염색하였다. 상층액을 제거한 후 염색된 세포를 500 ㎕ PBS에 현탁하였으며, DNA flow cytometer (FACSCaliber, Becton Dickinson and Company, San Jose, CA, USA)를 사용하여 sub-G1 DNA 함량을 분석하였다.
7. Western blot
H1975 세포를 5×105 cells/well 농도로 60 ㎜ dish에 분주한 후 24시간 안정화시킨 다음 ESB와 gefitinib을 단독 혹은 병합처리하였다. 24시간 배양 후 H1975 세포들을 모아 4 ℃에서 lysis buffer [RIPA buffer (Thermo Fisher Scientific, San Jose, CA, USA), protease inhibitor cocktail (Thermo Fisher Scientific), phosphatase inhibitors (1 mM Na3VO4, 100 mM NaF)]에 1시간 동안 lysis시킨 후 bicinchoninic acid (BCA) protein assay kit (Pierce Biotechnology, Rockford, IL, USA)의 사용방법에 따라 정량하였다. 그 후 20 ㎍의 단백질을 SDS-polyacrylamide gel에 분주하여 전기영동시키고, electroblotting을 통해 PVDF 멤브레인(Millipore Corporation, Bedford, MA)으로 transfer한 후 3% bovine serum albumin (BSA, GenDEPOT, TX, USA)으로 30분간 blocking하고 1차 항체와 4℃에서 overnight 반응시켰다. 그 후 TBST [Tris‑buffered saline (TBS) supplemented with 0.1% Tween‑20]로 수차례 세척하고 상온에서 1시간 동안 2차 항체와 반응시켰다. 다시 멤브레인을 TBST로 세척한 후 D-Plus ECL Femto System (Donginbio, Seoul, Korea)을 사용하여 단백질 발현을 확인하였다. Phospho-ERK (Thr202/Tyr204), phospho-p38 (Thr180/Tyr182) 및 phospho-JNK (Thr183/Tyr185) 항체는 Cell Signaling Technology (Beverly, MA, USA)에서 구입하였으며, ERK, p38, JNK 및 actin 항체는 Santa Cruz Biotechnology Inc. (Santa Cruz, CA, USA)에서 구입하였다. Goat anti‑mouse 2차 항체와 goat anti‑rabbit 2차 항체는 각각 Bethyl Laboratories (Montgomery, TX, USA)와 Enzo Life Sciences (Farmingdale, NY, USA)에서 구입하였다.
8. 통계적 분석
모든 실험 결과는 평균±표준편차로 표시하였으며, 통계적 유의성 검증은 Student’s t-test를 이용하여 P < 0.05인 것을 유의성 있는 것으로 판단하였다.
결 과
1. ESB가 H1975 인체폐암세포주의 gefitinib 저항성에 미치는 영향 –세포증식을 중심으로
ESB가 H1975 세포의 gefitinib 내성에 미치는 영향을 세포증식을 중심으로 조사하기 위하여 ESB와 gefitinib을 72시간 동안 단독 혹은 병합처리한 후 세포생존율을 MTT assay를 통해 확인하였다. 그 결과 gefitinib (5 μM) 단독처리 시 세포생존율이 93.97±2.23%로 나타나 H1975 세포의 gefitinib에 대한 내성이 확인되었다. ESB를 농도별(25, 50, 100 ㎍/㎖)로 단독처리 시 세포생존율이 각각 77.47±0.93%, 66.22±4.3%, 48.06±3.72%로 나타나 농도의존적 세포증식 억제효과를 보였다. 흥미롭게도 gefitinib과 ESB 25, 50, 100 ㎍/㎖ 병합처리군에서 세포생존율이 각각 56.99±1.58%, 45.27±1.54%, 30.43±1.00%로 나타나 gefitinib 단독 혹은 ESB 단독처리군보다 탁월한 증식억제효과를 보였다(Fig. 1A). Trypan blue exclusion assay에서도 비슷한 결과를 확인할 수 있었다. Geifitinib 단독처리군에서는 세포생존율이 101.91±2.45%로서 gefitinib에 대한 저항성을 보여주었고, ESB 50, 100 ㎍/㎖ 단독처리군에서 각각 48.84±4.56%, 24.76±0.70%, gefitinib과 ESB 50, 100 ㎍/㎖ 병합처리군에서 각각 30.48±5.16%, 15.10±1.80%의 세포생존율을 보여 gefitinib 단독 혹은 ESB 단독처리보다 병합처리 시 세포증식 억제효과가 유의하게 상승하였다(Fig. 1B). 상기 결과들을 종합하면 ESB가 H1975 세포에서 gefitinib에 대한 감수성을 높여 세포증식을 상승적으로 억제할 수 있음을 보여준다.
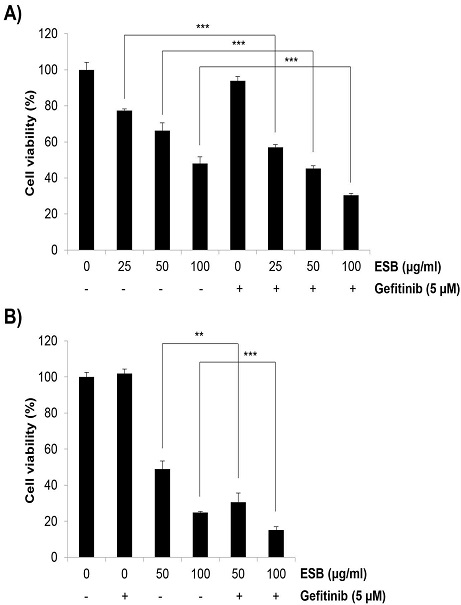
Effects of the combined treatment with ESB and gefitinib on the cell viability in H1975 cells. Gefitinib-resistant H1975 human lung cancer cells were incubated with 5 μM gefitinib and/or various concentrations of ESB (25-100 ㎍/㎖). (A) Cell viability was measured by MTT assay at 72 h post-treatment of gefitinib and/or ESB. (B) Cell viability was assessed by trypan blue exclusion assay at 72 h exposure time. Values are expressed as the mean ± SD of three independent experiments. Statistical calculations were performed using the Student's t-test. ** P < 0.01, *** P < 0.001 vs. respective controls. ESB, ethanol extract of Scutellaria baicalensis.
2. ESB가 H1975 인체폐암세포주의 gefitinib 저항성에 미치는 영향 –colony 형성을 중심으로
개별 암세포는 빠른 증식으로 colony를 만들면서 종양을 형성한다. ESB가 H1975 세포의 gefitinib 내성에 미치는 영향을 colony 형성 중심으로 조사하기 위하여 ESB와 gefitinib을 단독 혹은 병합처리한 후 2주간 배양하면서 colony 형성을 확인하였다. ESB는 기존 실험과 달리 10 ㎍/㎖의 저농도로 처리하였는데, 약물처리 시간이 매우 긴 점과 개별로 동떨어진 암세포는 약물에 보다 민감하게 반응하기 때문이다. 실험 결과 gefitinib(5 μM) 단독처리는 colony 형성에 전혀 영향을 미치지 않았으며, ESB 10 ㎍/㎖ 처리군에서 colony 형성이 47.19±3.37%로 감소하였다. 또한 gefitinib과 ESB 병합처리 시 colony 형성이 10.11±1.12%로 현저히 감소하여 ESB가 H1975 세포의 종양형성 과정에서도 gefitinib에 대한 감수성을 높일 수 있음을 확인하였다(Fig. 2A and 2B).
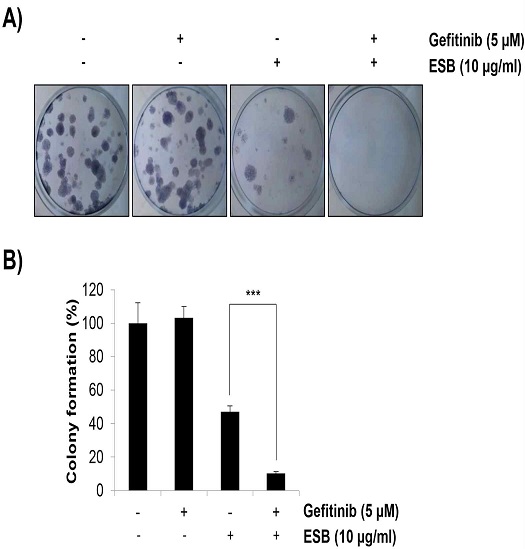
Effects of the combined treatment with ESB and gefitinib on the colony formation in H1975 cells. Gefitinib-resistant H1975 human lung cancer cells were seeded as a single‑cell suspension in 12‑well plates. Cells were grown for 2 weeks in medium containing gefitinib (5 μM) and/or ESB (10 ㎍/㎖). The colonies were visualized by a digital camera. The representative images are shown (A). The number of colonies were counted and normalized to untreated control cells (B). Values are expressed as the mean ± SD of three independent experiments. Statistical calculations were performed using the Student's t-test. *** P < 0.001 vs. respective control. ESB, ethanol extract of Scutellaria baicalensis.
3. ESB가 H1975 인체폐암세포주의 gefitinib 저항성에 미치는 영향 –apoptosis 유발을 중심으로
ESB가 gefitinib과 상승적으로 H1975 세포의 증식과 colony 형성을 억제하는 것이 apoptosis 유발에 의한 것인지 확인하기 위하여 ESB와 gefitinib을 72시간 동안 단독 혹은 병합처리한 후 flow cytometry로 sub-G1 DNA 함량 분석을 실시하였다. 그 결과 일반적으로 apoptosis를 일으킨 세포에서 증가하는 sub-G1 DNA 함량이 gefitinib(5 μM) 단독처리군에서는 전혀 증가하지 않아 gefitinib 저항성을 보여주었고, ESB 25, 50, 100 ㎍/㎖ 단독처리군에서는 각각 6.12±1.35%, 9.6±0.91%, 46.41±4.66%로 나타나 농도의존적인 증가를 보였다. 또한 gefitinib과 ESB 25, 50, 100 ㎍/㎖ 병합처리 시 sub-G1 DNA 함량이 현저히 증가하여 각각 10.46±1.71%, 31.94±2.49%, 91.61±2.61%로 나타났다(Fig. 3A and 3B). 이러한 결과는 ESB가 H1975 세포에 apoptosis를 유발하여 gefitinib에 대한 감수성을 높여줌을 증명하는 것이다.
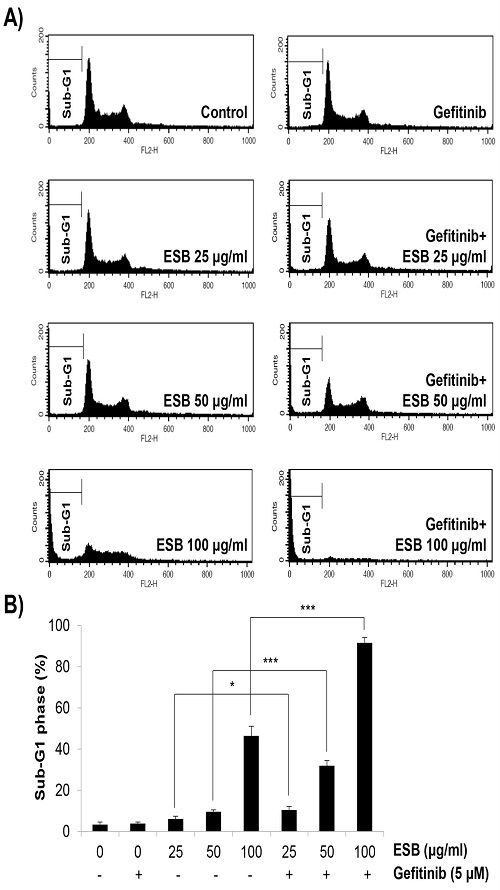
Effects of the combined treatment with ESB and gefitinib on the apoptosis induction in H1975 cells. Gefitinib-resistant H1975 human lung cancer cells were treated with gefitinib (5 μM) and/or ESB (25-100 ㎍/㎖) for 72 h. The cell cycle analysis was performed using a flow cytometer. The representative histogram plots are shown (A). The sub-G1 DNA content was measured by BD CellQuest Pro software (B). Values are expressed as the mean ± SD of three independent experiments. Statistical calculations were performed using the Student's t-test. * P < 0.05, *** P < 0.001 vs. respective controls. ESB, ethanol extract of Scutellaria baicalensis.
4. ESB가 H1975 인체폐암세포주의 gefitinib 감수성을 높이는 분자적 기전 연구
ESB가 H1975 세포에서 apoptosis를 유발하여 gefitinib에 대한 감수성을 증가시키는 분자적 기전을 밝히기 위해 ESB와 gefitinib을 24시간 동안 단독 혹은 병합처리한 후 웨스턴블롯 기법을 활용해 mitogen-activated protein kinase (MAPK) 단백질의 인산화를 확인하였다. 대표적인 MAPK 단백질로서 ERK, p38, c-Jun N-terminal kinases (JNK) 3가지가 있으며, 이들은 암의 발생과 진행 및 약물내성에 관여하는 대표적인 신호분자이다25). 실험 결과 ERK의 인산화는 gefitinib 혹은 ESB 단독처리만으로도 다소 감소하였으나, gefitinib과 ESB의 병합처리에 의해 보다 현저하게 감소하였다. JNK의 인산화는 ESB 단독처리 시 변화가 없었고, gefitinib 단독처리에 의해 미약하게 증가하였으며, 두 약물의 병합처리 시 상승적으로 감소하는 것을 볼 수 있었다. 마지막으로 p38은 gefitinib 단독처리에 의해 인산화가 현저히 증가하였으나, ESB와의 병합처리에 의해 다시 원래대로 감소하는 것을 확인하였다. 상기한 결과는 ESB가 gefitinib과 함께 ERK, JNK 및 p38의 인산화를 상승적으로 억제함으로서 H1975 세포의 gefitinib에 대한 감수성을 증가시켰을 가능성을 시사한다.
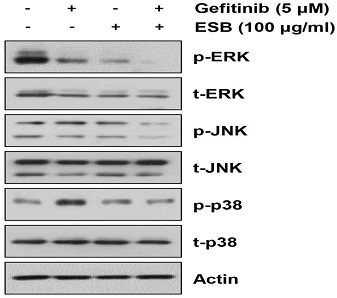
Effects of the combined treatment with ESB and gefitinib on the phosphorylation of MAPK proteins in H1975 cells. Gefitinib-resistant H1975 human lung cancer cells were treated with gefitinib (5 μM) and/or ESB (100 ㎍/㎖) for 24 h. The phosphorylation level and total expression of ERK, p38 and JNK were detected by western blot analysis. The representative immunoblots of 3 independent experiments are shown. Actin was used as an internal control.
고 찰
EGFR TKI에 대한 내성은 폐암의 예후를 불량하게 만드는 주요한 문제점으로서 내성을 극복하기 위한 다양한 전략과 후속 약물들이 개발되고 있으나 임상적인 효과는 불명확한 실정이다8-10). 한약 치료는 전이가 이뤄진 진행성 폐암에서 EGFR TKI의 항암효과를 높이고 독성을 감소시키므로11-17) EGFR TKI 저항성을 극복하는 새로운 한의약 소재를 발굴하는 것이 유망한 전략이 될 수 있다. 황금은 ‘속 썩은 풀’이라고도 불리며 가볍게 上焦로 올라가는 성질로 인해 열성 폐질환에 빈용되었고, 폐암세포에서 항암작용이 보고된 바 있다11-17). 이에 본 연구는 황금추출물이 EGFR TKI 내성을 극복하는 효과가 있을 것이라는 가설 하에 진행되었다. 실험결과 ESB는 gefitinib 저항성 H1975 인체폐암세포주에서 gefitinib과 함께 상승적으로 세포증식 및 colony 형성을 억제하였으며, apoptosis를 유발하였다. 이러한 결과는 ESB가 H1975 세포의 gefitinib 저항성을 극복함으로써 gefitinib의 항암효과를 증진시킬 수 있음을 보여준다.
그동안 EGFR TKI에 대한 내성을 극복하기 위한 다양한 연구가 진행되어왔다. 특히 EGFR TKI와 기존 항암제 및 새로운 약물들을 병용함으로써 EGFR TKI에 대한 감수성을 높이고자 하는 시도가 계속되었다. 예를 들어 EGFR TKI에 대한 내성을 가진 환자에게 2세대 EGFR TKI인 afatinib과 EGFR에 대한 단일클론항체인 cetuximab의 병용투여가 권고된 바 있다26). MET 유전자 증폭 등 보상경로 활성화에 의한 내성의 경우 해당 단백질에 대한 저해제나 단일클론항체를 EGFR TKI와 병용투여하는 임상연구가 진행되어 유효한 결과를 보고하였다27-29). 반대로 EGFR TKI 내성 폐암에서 기존 항암제와 EGFR TKI를 병용한 임상연구 결과는 논쟁적인데, TKI 단독투여군에 비해 병용투여군에서 무진행생존기간(disease free survival)이 증가하였다는 보고가 있는 반면30), 두 집단의 생존기간에 차이가 보이지 않거나 오히려 단독투여군보다 병용투여군의 생존기간 중앙값(median overall survival)이 낮다는 보고도 있다31,32). 이와 같이 불분명한 임상효과와 더불어 병용투여는 높은 독성과 부작용의 위험성을 내포하고 있어 새로운 combination 전략이 필요한 실정이다33). 황금은 오랫동안 한의약에서 빈용된 약재로서 신약에 비해 인체에 대한 독성이 비교적 적으므로 안전하게 EGFR TKI와 병용투여 가능할 것으로 사료되나, 이들의 병용투여에 대한 임상적 효과와 부작용은 추후 더 연구되어야 할 부분이다.
한편 본 연구에서 ESB와 gefitinib은 상승적으로 MAPK인 ERK, JNK 및 p38의 인산화를 억제하여 이들의 탈인산화가 gefitinib에 대한 감수성 증가에 관여한 것으로 사료된다. 일반적으로 ERK는 암세포의 apoptosis를 억제하여 세포생존에 기여하는 것으로 알려져 있으며34), 최근 연구에 따르면 EGFR TKI 내성에도 관여하는 것으로 보인다. 예를 들어 hypoxia가 ERK를 활성화시킴으로써 폐암세포의 EGFR TKI 내성을 유발하였으며35), PI3K/AKT와 MEK/ERK 경로를 차단함으로써 폐암세포의 EGFR TKI 저항성을 효과적으로 극복할 수 있음이 보고되었다36). JNK는 원래 암세포의 apoptosis를 유발한다고 알려져 있었으나, 암세포의 생존에도 기여할 수 있음이 점차 밝혀지고 있다37). JNK는 암세포의 증식을 촉진할 뿐만 아니라 5‐fluorouracil (5‐FU), gemcitabine, oxaliplatin 등 다양한 항암제에 대한 내성에도 관여한다37). 최근 연구에 따르면 interleukin-26이 JNK와 AKT의 인산화를 통해 EGFR TKI 저항성을 야기함이 보고되었다38). p38 역시 tamoxifen, cisplatin, paclitaxel 등 수종의 항암제 내성을 일으키며39), NSCLC 모델의 gefitinib 저항성에도 기여한다고 보고되어 있다40). 본 연구에서도 H1975 세포에 gefitinib 단독처리 시 p-p38과 p-JNK이 증가하는 패턴을 보였으므로 이들이 gefitinib 저항성에 기여할 것으로 생각된다. 비록 ERK는 gefitinib 처리에 의해 인산화가 증가하지 않았으나, ESB와 병합처리 시 상승적으로 인산화가 억제되어 ESB와 gefitinib 간 시너지 효과에 관여했을 것으로 사료된다. 따라서 이러한 연구결과들은 ESB가 ERK, JNK 및 p38을 불활성화시킴으로써 H1975 세포의 gefitinib 저항성을 억제할 것이라는 가설을 뒷받침한다.
본 연구의 한계점으로서 먼저 ESB가 어떤 upstream target을 통해 MAPK를 조절하였는지 밝히지 못했다. 지금까지 EGFR TKI 저항성을 조절할 수 있는 유망한 타겟이면서 동시에 MAPK를 조절할 수 있는 수용체로서 MET과 HER2가 활발히 연구되고 있으므로8) 추후 ESB가 이들을 조절할 수 있는지 여부를 연구할 필요가 있다. 또다른 한계점으로서 ESB의 다양한 활성성분 중 어떤 성분이 gefitinib 저항성을 억제했는지 밝히지 못했다. 황금의 대표 유효성분으로서 baicalin, baicalein, wogonin 및 oroxylin A 등이 보고되어 있으나18), 이들 중 EGFR TKI와 상승작용이 보고된 성분은 현재까지 전무하다. 따라서 이 부분에 대한 추후 연구가 필요하다.
결 론
Gefitinib 저항성 H1975 인체폐암세포주에서 황금 에탄올추출물(ESB)이 gefitinib에 대한 감수성을 증가시킬 수 있는지 조사한 결과 다음과 같은 결론을 얻었다. Gefitinib 단독 혹은 ESB 단독처리에 비해 병용처리 시 H1975 세포의 생존율과 colony 형성이 유의하게 감소하였고, apoptosis가 현저히 증가하였다. 이러한 결과는 ERK와 JNK의 활성감소와 관련 있을 것으로 사료된다. 이상의 결과는 황금이 EGFR 변이 폐암에서 EGFR TKI의 항암효과를 증진시킬 수 있음을 시사하며, 향후 EGFR TKI 내성 극복을 위한 한약재 발굴의 필요성과 가능성을 보여준다.
Acknowledgments
본 연구는 한국연구재단의 기본연구(No. NRF-2019R1F1A1059588) 및 우수신진연구(No. NRF-2021R1C1C100506211)의 사업비로 수행되었음.
References
- National Cancer Information Center. Available from: https://www.cancer.go.kr
-
Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer Statistics, 2021. CA Cancer J Clin. 2021;71(1):7-33.
[https://doi.org/10.3322/caac.21654]

-
Kris MG, Johnson BE, Berry LD, Kwiatkowski DJ, Iafrate AJ, Wistuba II, et al. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs. JAMA. 2014;311(19):1998-2006.
[https://doi.org/10.1001/jama.2014.3741]

-
Zhang YL, Yuan JQ, Wang KF, Fu XH, Han XR, Threapleton D, et al. The prevalence of EGFR mutation in patients with non-small cell lung cancer: a systematic review and meta-analysis. Oncotarget. 2016;7(48):78985-93.
[https://doi.org/10.18632/oncotarget.12587]

-
Scaltriti M, Baselga J. The epidermal growth factor receptor pathway: a model for targeted therapy. Clin Cancer Res. 2006;12(18):5268–72.
[https://doi.org/10.1158/1078-0432.CCR-05-1554]

-
Mok TS, Wu YL, Thongprasert S, Yang CH, Chu DT, Saijo N, et al. Gefitinib or carboplatin–paclitaxel in pulmonary adenocarcinoma. N Engl J Med. 2009;361(10):947-57.
[https://doi.org/10.1056/NEJMoa0810699]

-
Wu YL, Zhou C, Hu CP, Feng J, Lu S, Huang Y, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-lung 6): an open-label, randomised phase 3 trial. Lancet Oncol. 2014;15(2):213-22.
[https://doi.org/10.1016/S1470-2045(13)70604-1]

-
Chong CR, Jonne PA. The quest to overcome resistance to EGFR-targeted therapies in cancer. Nat Med. 2013;19(11):1389-400.
[https://doi.org/10.1038/nm.3388]

-
Tang ZH, Lu JJ. Osimertinib resistance in non-small cell lung cancer: Mechanisms and therapeutic strategies. Cancer Lett. 2018;420:242-6.
[https://doi.org/10.1016/j.canlet.2018.02.004]

-
van der Wekken AJ, Saber A, Hiltermann TJ, Kok K, van den Berg A, Groen HJ. Resistance mechanisms after tyrosine kinase inhibitors afatinib and crizotinib in non-small cell lung cancer, a review of the literature. Crit Rev Oncol Hematol. 2016;100:107-16.
[https://doi.org/10.1016/j.critrevonc.2016.01.024]

-
Zhang XW, Liu W, Jiang HL, Mao B. Chinese Herbal Medicine for Advanced Non-Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis. Am J Chin Med. 2018;46(5):923-52.
[https://doi.org/10.1142/S0192415X18500490]

- He W, Cheng M. Meta-analysis on effectiveness and safety of traditional Chinese medicine combined with first-generation EGFR-TKI in treating advanced non-small cell lung cancer. Zhongguo Zhong Yao Za Zhi. 2017;42(13):2591-98.
-
Hung HY, Tseng YH, Liao CM, Chen SY, Wu TP, Lee YC, et al. The Efficacy of Traditional Chinese Herbal Medicine in the Treatment of EGFR Mutated Stage IV Pulmonary Adenocarcinoma Patients Who Received First-Line EGFR-TKI Treatment. Integr Cancer Ther. 2017;16(1):126-31.
[https://doi.org/10.1177/1534735416645181]

- Yamaguchi O, Kawashima A, Shiono A, Maeno Y, Ishikawa R, Masumoto A, et al. Hange-Shashin-to for preventing diarrhea during afatinib therapy. Gan To Kagaku Ryoho. 2015;42(5):581-3.
-
Yang XB, Wu WY, Long SQ, Deng H, Pan ZQ, He WF, et al. Fuzheng Kang'ai decoction combined with gefitinib in advanced non-small cell lung cancer patients with epidermal growth factor receptor mutations: study protocol for a randomized controlled trial. Trials. 2015;16:146.
[https://doi.org/10.1186/s13063-015-0685-2]

-
Yang XB, Wu WY, Long SQ, Deng H, Pan ZQ. Effect of gefitinib plus Chinese herbal medicine (CHM) in patients with advanced non-small-cell lung cancer: a retrospective case-control study. Complement Ther Med. 2014;22(6):1010-8.
[https://doi.org/10.1016/j.ctim.2014.10.001]

-
Liu ZL, Zhu WR, Zhou WC, Ying HF, Zheng L, Guo YB, Chen JX, Shen XH. Traditional Chinese medicinal herbs combined with epidermal growth factor receptor tyrosine kinase inhibitor for advanced non-small cell lung cancer: a systematic review and meta-analysis. J Integr Med. 2014;12(4):346-58.
[https://doi.org/10.1016/S2095-4964(14)60034-0]

-
Zhao T, Tang H, Xie L, Zheng Y, Ma Z, Sun Q, et al. Scutellaria baicalensis Georgi. (Lamiaceae): A review of its traditional uses, botany, phytochemistry, pharmacology and toxicology. J Pharm Pharmacol. 2019;71(9):1353-69.
[https://doi.org/10.1111/jphp.13129]

-
Cheng CS, Chen J, Tan HY, Wang N, Chen Z, Feng Y. Scutellaria baicalensis and Cancer Treatment: Recent Progress and Perspectives in Biomedical and Clinical Studies. Am J Chin Med. 2018;46(1):25-54.
[https://doi.org/10.1142/S0192415X18500027]

-
Kim HI, Hong SH, Ku JM, Lim YS, Lee SJ, Song J, et al. Scutellaria Radix Promotes Apoptosis in Non-Small Cell Lung Cancer Cells via Induction of AMPK-Dependent Autophagy. Am J Chin Med. 2019;47(3):691-705.
[https://doi.org/10.1142/S0192415X19500368]

-
Gao J, Morgan WA, Sanchez-Medina A, Corcoran O. The ethanol extract of Scutellaria baicalensis and the active com-pounds induce cell cycle arrest and apoptosis including upregulation of p53 and Bax in human lung cancer cells. Toxicol Appl Pharmacol. 2011;254(3):221-8.
[https://doi.org/10.1016/j.taap.2011.03.016]

-
Park KI, Park HS, Kang SR, Nagappan A, Lee H, Kim JA, et al. Korean Scutellaria baicalensis water extract inhibits cell cycle G1/S transition by suppressing cyclin D1 expression and matrix-metalloproteinase-2 activity in human lung cancer cells. J Ethnopharmacol. 2011;133(2):634-41.
[https://doi.org/10.1016/j.jep.2010.10.057]

-
Wang Y, Cao HJ, Sun SJ, Dai JY, Fang JW, Li QH, et al. Total flavonoid aglycones extract in Radix scutellariae inhibits lung carcinoma and lung metastasis by affecting cell cycle and DNA synthesis. J Ethnopharmacol. 2016;194:269-79.
[https://doi.org/10.1016/j.jep.2016.07.052]

-
Hyun-Ji Park HJ, Park SH, Choi YH, Chi GY. The Root Extract of Scutellaria baicalensis Induces Apoptosis in EGFR TKI-Resistant Human Lung Cancer Cells by Inactivation of STAT3. Int J Mol Sci. 2021;22(10):5181.
[https://doi.org/10.3390/ijms22105181]

-
Braicu C, Buse M, Busuioc C, Drula R, Gulei D, Raduly L, et al. A Comprehensive Review on MAPK: A Promising Therapeutic Target in Cancer. Cancers (Basel). 2019;11(10):1618.
[https://doi.org/10.3390/cancers11101618]

-
Ettinger DS, Wood DE, Aisner DL, Akerley W, Bauman J, Chirieac LR, et al. Non-small cell lung cancer, version 5.2017, NCCN clinical practice guidelines in oncology. J Natl Compr Cancer Netw. 2017;15(4):504-35.
[https://doi.org/10.6004/jnccn.2017.0050]

-
Azuma K, Hirashima T, Yamamoto N, Okamoto I, Takahashi T, Nishio M, et al. Phase II study of erlotinib plus tivantinib (ARQ 197) in patients with locally advanced or metastatic EGFR mutation-positive non-small-cell lung cancer just after progression on EGFR TKI, gefitinib or erlotinib. ESMO Open. 2016;1(4):e000063.
[https://doi.org/10.1136/esmoopen-2016-000063]

-
Wu YL, Kim DW, Felip E, Zhang L, Liu X, Zhou CC, et al. Phase (Ph) II safety and efficacy results of a singlearm ph ib/II study of capmatinib (INC280) + gefitinib in patients (pts) with EGFR-mutated (mut), cMET-positive (cMET+) non-small cell lung cancer (NSCLC). J Clin Oncol. 2016;34(15_supple):9020.
[https://doi.org/10.1200/JCO.2016.34.15_suppl.9020]

-
Spigel DR, Ervin TJ, Ramlau RA, Daniel DB, Goldschmidt JJ, Blumenschein GJ, et al. Randomized phase II trial of onartuzumab in combination with erlotinib in patients with advanced non-small-cell lung cancer. J Clin Oncol. 2013;31(32):4105-14.
[https://doi.org/10.1200/JCO.2012.47.4189]

-
Mok T, Kim SW, Wu YL, Nakagawa K, Yang JJ, Ahn MJ, et al. Gefitinib plus chemotherapy versus chemotherapy in epidermal growth factor receptor mutation-positive non-small-cell lung cancer resistant to first-line gefitinib (IMPRESS): overall survival and biomarker analyses. J Clin Oncol. 2017;35(36):4027-34.
[https://doi.org/10.1200/JCO.2017.73.9250]

-
Goldberg SB, Oxnard GR, Digumarthy S, Muzikansky A, Jackman DM, Lennes IT, et al. Chemotherapy with Erlotinib or chemotherapy alone in advanced non-small cell lung cancer with acquired resistance to EGFR tyrosine kinase inhibitors. Oncologist. 2013;18(11):1214-20.
[https://doi.org/10.1634/theoncologist.2013-0168]

-
Soria JC, Wu YL, Nakagawa K, Kim SW, Yang JJ, Ahn MJ, et al. Gefitinib plus chemotherapy versus placebo plus chemotherapy in EGFRmutation-positive non-small-cell lung cancer after progression on first-line gefitinib (IMPRESS): a phase 3 randomised trial. Lancet Oncol. 2015;16(8):990-8.
[https://doi.org/10.1016/S1470-2045(15)00121-7]

-
Liao BC, Lin CC, Lee JH, Yang JC. Optimal management of EGFR-mutant non-small cell lung cancer with disease progression on first-line tyrosine kinase inhibitor therapy. Lung Cancer. 2017;110:7-13.
[https://doi.org/10.1016/j.lungcan.2017.05.009]

-
Lu Z, Xu S. ERK1/2 MAP kinases in cell survival and apoptosis. IUBMB Life. 2006;58(11):621-31.
[https://doi.org/10.1080/15216540600957438]

-
Lu Y, Liu Y, Oeck S, Zhang GJ, Schramm A, Glazer PM. Hypoxia Induces Resistance to EGFR Inhibitors in Lung Cancer Cells via Upregulation of FGFR1 and the MAPK Pathway. Cancer Res. 2020;80(21):4655-67.
[https://doi.org/10.1158/0008-5472.CAN-20-1192]

-
Li H, Schmid-Bindert G, Wang D, Zhao Y, Yang X, Su B, et al. Blocking the PI3K/AKT and MEK/ERK signaling pathways can overcome gefitinib-resistance in non-small cell lung cancer cell lines. Adv Med Sci. 2011;56(2):275-84.
[https://doi.org/10.2478/v10039-011-0043-x]

-
Wu Q, Wu W, Fu B, Shi L, Wang X, Kuca K. JNK signaling in cancer cell survival. Med Res Rev. 2019;39(6):2082-104.
[https://doi.org/10.1002/med.21574]

-
Itoh T, Hatano R, Horimoto Y, Yamada T, Song D, Otsuka H, et al. IL-26 mediates epidermal growth factor receptor-tyrosine kinase inhibitor resistance through endoplasmic reticulum stress signaling pathway in triple-negative breast cancer cells. Cell Death Dis. 2021;12(6):520.
[https://doi.org/10.1038/s41419-021-03787-5]

-
Lee S, Rauch J, Kolch W. Targeting MAPK Signaling in Cancer: Mechanisms of Drug Resistance and Sensitivity. Int J Mol Sci. 2020;21(3):1102.
[https://doi.org/10.3390/ijms21031102]

-
Yeung YT, Yin S, Lu B, Fan S, Yang R, Bai R, et al. Losmapimod Overcomes Gefitinib Resistance in Non-small Cell Lung Cancer by Preventing Tetraploidization. EBioMedicine. 2018;28:51-61.
[https://doi.org/10.1016/j.ebiom.2018.01.017]
