스코폴라민으로 유도한 기억력 손상 모델에서 소엽 추출물의 보호 효과
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Perilla frutescens (P. frutescens) is an important herb used for many purposes such as medicinal, aromatic, and functional food in Asian countries and has beneficial effects such as antioxidant activity, anti-inflammation activity, anti-depression activity, and anxiolytic activity. However, there have been no studies on the protective effect of P. frutescens extract (PFE) on amnesia in vivo. The present study aimed to investigate whether PFE protects memory deficit using a scopolamine-induced mice model and elucidate the underlying mechanisms involved. The protective effect of PFE against scopolamine-induced memory deficits was investigated using Y-maze, passive avoidance, and Morris water maze tests. Furthermore, the potential mechanisms of PFE in improving memory capabilities related to the cholinergic system and antioxidant activity were examined. PFE significantly increased spontaneous alternation in the Y-maze test, step-through latency in the passive avoidance test, and swimming time in the target quadrant in the probe test when compared to the scopolamine-treated group. Likewise, PFE significantly decreased escapes latency in the Morris water maze test. PFE could not regulate cholinergic function in acetylcholine level and acetylcholine esterase activity. However, PFE increased DPPH radical scavenging activity dose-dependently and total polyphenol content was 127.7±1.2 μg GAE/mg. The results showed that the PFE could be a preventive and/or therapeutic candidate for memory and cognitive dysfunction in Alzheimer's disease.
Keywords:
Cognitive, Dementia, Memory, Perilla frutescens, Scopolamine서 론
최근 급속히 진행되는 고령화 현상은 치매 노인 비율 증가를 의미하는 것으로 커다란 사회문제이다. 산업발달과 더불어 인구 고령화가 서서히 진행되어 온 선진국들에 비해 우리나라는 고령화가 매우 급격하게 진행되고 있으며, 이는 오랜 기간에 걸쳐 인구 고령화에 대처해 온 프랑스, 미국, 일본과는 달리 우리나라의 경우 고령화사회에 대한 준비가 시급함을 의미한다. 치매는 의식의 장애 없이 점진적으로 지능, 학습 능력, 기억력, 문제 해결 능력, 지남력, 주의 집중력, 판단력 등의 인지기능 장애와 불면, 초조, 불안, 우울, 충동, 망상, 환각 등의 정신병적 증상 및 이상행동이 나타나는 뇌의 퇴행성 질환으로1) 노년기의 치매는 뇌혈관성 치매, 알츠하이머병(Alzheimer's disease, AD) 등으로 구분되는데, 뇌혈관성 치매의 치료는 기본적으로 뇌혈관 장애를 배경으로 하는 것이므로 뇌 혈류를 개선해 뇌세포의 보호 및 부활을 목적으로 하는 약물이 사용된다2). 그러나 AD의 치료는 지금까지 그 발병 원인이 애매하며 치료 방법도 확립되어 있지 않은 상태이다. 주로 사용되는 약물치료는 뇌 신경 전달계의 이상을 개선시키는 뇌 대사 개선 약물인데, cholinesterase의 억제제가 주로 사용되고 있으며, 항산화제 등도 사용되고 있다3).
아세틸콜린(acetylcholine, Ach)은 신경계의 주요 신경전달물질이자 조절물질로 알려져 있으며 신경 근육 접합과 부교감 신경계에서 학습과 기억과 같은 인지기능에 중요한 역할을 담당하고 있다고 알려져 있다4). 뇌에서 acetylcholinesterase(AChE), butyrylcholinesterase(BuChE) 등의 효소 활성의 증가는 신경전달물질인 아세틸콜린(acetylcholine)을 콜린(choline)과 아세틸 CoA(acetyl CoA)로 분해시켜 콜린성 기능 장애를 유도하며, 이는 기억력 및 인지기능 손상에 영향을 미친다고 알려져 있다5). 무스카린성 콜린 수용체(muscarinic cholinergic receptor) 길항제인 스코폴라민(scopolamine)은 뇌에서 콜린성 기능 장애와 산화적 스트레스 등을 유도하여 기억력 손상을 유도하는 것으로 보고됨에 따라, 기억력 및 인지기능 개선 효과를 검증하고자 하는 콜린성 기억력 감퇴 동물모델에 주로 이용되고 있는 약물이다6).
현재까지 식품의약품안저처(KFDA)의 승인을 받은 치매 치료제는 4가지로, donepezil, rivastigmine, galantamine 등이 경도 및 중도 Alzheimer‘s 병에 사용되고 있다7). 그러나 이러한 약물들은 주로 증상을 완화시키는 용도로 쓰이고 있고 아세틸콜린 분해효소 저해제의 심각한 부작용 때문에 이를 극복할 수 있는 약물 개발에 대한 연구가 시급한 실정이다. 국내에서는 천연물을 이용한 항치매 연구가 활발히 진행되고 있으며 대표적으로 인삼에 대한 연구가 많이 보고되어 있으며10) 이외에도 동충하초, 감초, 원지 등 많이 약물들이 연구되고 있다11-13).
소엽은 꿀풀과(Labiatae)에 속하는 차조기(Perilla frutescens Britton var. acuta Kudo) 또는 기타 동속 근연식물의 잎 및 끝 가지를 말하며, 전통 한의약에서 해표산한(解表散寒), 행기관중(行氣寬中) 및 해어해독(解魚蟹毒)하는 효능으로 기침을 동반한 감기, 구토 및 기관지 천식을 치료하는 데 사용되고 있다. 소엽에는 정유 성분이 0.2~0.9% 정도 함유되어 있으며 정유 중에서는 perillaldehyde가 약 50~60% 정도로 가장 많이 함유되어 있고14) 이외에도 limonene, E,E-,α-farnesene 및 β-caryophyllene을 비롯하여15) oleanolic acid, ursolic acid, luteolin, apigenin, rosmarinic acid, caffeic acid 등이 함유되어 있다16). 소엽의 약리작용으로는 기관지 이완 작용을 통한 천식 치료에 효과가 있다고 알려져 있으며17) 이외에도 항염증, 항알러지 등의 효과가 있다18). 뇌 질환 관련에서는 소엽 추출물 및 rosmarinic acid가 베타아밀로이드 유도 모델에서 기억력 개선 효과가 보고되어 있으며19), perillaldehyde가 해마의 BDNF-extracellular signal-regulated kinase (ERK)의 신호전달에 관여하여 항우울 효과20)와 허혈성 뇌 질환에서 Akt/JNK 경로를 통해 염증성 사이토카인의 과다 발현을 억제하여 뇌 신경 보호 효과21)를 나타내며 limonene은 스트레스로 인한 항우울 효과를 염증22) 억제하며 나타냈고, dopamine과 GABA를 조절하며 항불안 효과23) 등이 보고되었다.
따라서, 본 연구에서는 소엽 추출물의 항산화 효과를 평가하고 기억력 및 인지기능 개선 효과를 체계적으로 검토하고자, 스코폴라민으로 기억력 손상을 유도한 실험동물을 사용하여 행동 실험으로 Y-미로 시험, 수동 회피 시험 및 모리스 수중 미로 시험을 수행하였으며 또한, 작용기전을 규명하기 위하여 아세틸콜린 가수분해 효소(acetylcholinesterase : AChE)의 억제능을 조사하여 소엽 추출물의 기억력 개선 효과 및 작용기전 연구를 통하여 개별인정형 건강기능식품 개발 가능성을 확인하고자 하였다.
재료 및 방법
1. 재료
4주령 수컷 ICR mouse를 대한바이오링크(Chungbuk, Korea)로부터 공급받아 1주일 동안 순화 후 실험에 사용하였다. 사육기간 중 식이와 물은 자유 섭취시켰으며 사육실 온도는 23±1℃, 습도 50 ± 5%, 조명시간 07:00-19:00(12시간 주기)로 환경을 유지하였다. 순화기를 거친 실험동물에게 시료인 소엽 또는 양성 대조군인 donepezil 5 mg/kg를 단회 경구 투여하고 30분 뒤 scopolamine 1 mg/kg를 복강 투여하여 실험동물의 기억을 손상시키고 30분 뒤 행동 실험을 진행하였다. 본 연구에서 진행된 동물실험 절차는 대구한의대학교 동물실험윤리위원회의 사전심의와 윤리 규정을 준수하여 수행하였다(승인번호:DHU2020-061).
연구에 사용된 소엽 에탄올 추출물은 SFC bio(Cheonan, Korea)에서 공급받아 사용하였다. 건조된 소엽을 분쇄한 1 kg에 95% 에탄올을 15 v/w로 가하여 24시간동안 50℃에서 추출하였으며 추출액은 1 μm nylon 필터로 여과한 후 45℃에서 농축하여 –18℃에 보관하며 실험에 사용하였다(수득율:7%).
2. 실험방법
단기 기억력을 측정하는 실험으로 순차적으로 행동하는 능력을 평가하기 위한 방법으로 Y-maze test 실시하였다. 측정 장비는 세 개의 가지로 구성되어 있으며 각 가지의 길이는 42 cm, 넓이는 3 cm, 높이는 12 cm이고 세 가지가 접히는 각도는 120°이다. 이 장치는 검정색의 polyvinyl plastic으로 구성되어 있고, 세 개의 가지를 각각 A, B, C로 정한 뒤에 실험을 진행하였다. 실험동물을 넣고 8분 동안 각 가지에 실험동물의 꼬리까지 가지에 들어갈 때의 횟수와, 각 가지에 차례로 들어간 경우를 헤아려 1점(실제변경, actual alternation)씩 부여하였다. 변경 행동력(alternation behavior)은 세 가지 모두에 겹치지 않게 들어가는 것으로 정의되며, 다음의 수학식에 의해 계산하였다.
변경 행동력(Spontaneous alteration, %)=실제변경(actual alternation)/최고변경(maximum alternation)×100(최고변경: 총 입장횟수-2)
해마의 조건화된 기억과 변연계와 관련 있는 기억에 관한 영향 및 working memory ability를 평가하기 위해 Gemini(San Diego Instruments, San Diego, USA)를 이용하여 실험을 하였다. 수동회피 상자는 어두운 방과 밝은 방으로 나누어져 있으며, 밝은 방에 실험동물을 넣으면 어두운 방으로 넘어가는데 그 순간 5초간 0.5 mA의 전기충격을 가한다. 전기충격을 가한 다음 날 실험동물을 밝은 방에 다시 넣었을 때 어두운 방에서의 전기충격을 기억하여 밝은 방에 머무르게 되는데, 이때 체류하는 시간(step-through latency)을 측정하여 기억력을 평가하였다.
해마 의존적 공간학습 및 장기 기억력 개선에 대한 실험으로 원형으로 된 지름 90 cm, 높이 45 cm의 수조의 사분면 한 구역에 지름 9 cm, 높이 25 cm의 도피대를 설치하고 20±2℃ 깨끗한 물을 도피대 보다 1 cm 정도 위로 채운 뒤 실험 동물이 도피대를 찾아가는데 걸리는 시간을 측정하였다. 원형 수조에서 4개의 표지판을 설치하여 4분면으로 나누어 입수하는 위치를 다르게 하여 하루 4번씩 반복하여 120초간 진행하였으며 실험 동물이 60초 안에 도피대를 찾으면 실험을 완료하였고 찾지 못한 경우 손으로 위치를 안내해주어 10초간 머무르게 하였다. 실험 마지막 날 도피대를 제거하고 학습능력을 측정하기 위해 60초간 도피대가 있었던 구역에 머무르는 시간을 측정하였고 모든 실험은 Ethovision program(Noldus, Netherlands)을 이용하여 기록 및 측정하였다.
뇌 내 acetycholine 양을 확인하기 위하여 acetylcholine assay kit(Abcam, Cambridge, UK)를 사용하여 제시하는 방법에 따라 측정하였다. 시료를 경구투여하고 1시간 뒤 적출한 해마를 Choline Assay Buffer로 균질화 후 상층액을 Choline Assay Buffer, Choline Probe, Acetycholinesterase, Choline Enzyme Mix와 혼합하여 total choline을 측정하였고 Choline Assay Buffer, Choline Probe, Choline Enzyme Mix와 혼합하여 free choline을 측정하였다. Acetylcholine의 양은 total choline에서 free choline을 뺀 값을 사용하였으며 단백질은 BCA kit(Pierce, Rockford, IL)로 정량하여 nmol/mg으로 나타내었다.
AChE 활성 억제능을 확인하기 위해서 Ellman GL24) 등의 방법인 acetylthiocholine iodide(ASCh)를 기질로 사용한 비색분석법으로 측정하였다. 실험에 사용하지 않은 실험 동물을 경추 탈골 후 전체 뇌를 적출하여 차가운 sodium phosphate buffer(100 mM, pH 8.0)를 이용하여 균질화하고, 14,000 rpm, 20분간 원심분리 후 얻은 상층액을 이용하여 AChE 활성을 측정하는데 효소로 사용하였다. Sodium phosphate buffer 850 μL, 20 mM Ellman's 용액(5,5'-dithiobis- 2-nitrobenzoic acid) 30 μL, 시료 또는 donepezil을 10 μL와 enzyme 100 μL를 넣어 혼합 후 상온에서 5분간 반응 후 50 mM ASCh 10 μL를 첨가하였다. 반응액을 상온에서 1시간 반응하고 405 nm에서 흡광도를 측정하여 시료를 넣지 않은 control에 대비하여 AChE 활성을 백분율로 나타내었다.
1,1-diphenyl-2-picrylhydrazyl (DPPH) 라디컬 소거능은 화학적으로 안정화된 자유 라디칼인 짙은 보라색의 DPPH를 방향족 아민류 등에 의해 환원되어 색이 탈색되는 것을 이용하여 항산화 물질의 활성을 측정하는 것으로 농도별로 희석한 시료와 0.2 mM DPPH 용액을 100 μL씩 동량으로 혼합하여 암실에서 30분간 반응시킨 후 517 nm에서 흡광도를 측정하였다. 양성 대조군은 ascorbic acid를 사용하여 비교 분석하였고 자유 라디컬 소거능은 아래의 식을 이용하여 계산하였다.
DPPH 라디컬 소거활성(%) = 100-[(시료 첨가구의 흡광도/무첨가구의 흡광도)×100]
시료 10 μL와 Folin-Ciocalteu reagent 10 μL, 10% Na2CO3 용액 200 μL를 가하여 상온에서 30분간 반응시키고 730 nm에서 흡광도를 측정하였음. 표준물질로써 gallic acid를 사용하여 얻어진 검량선으로 결과값은 추출물 g당 gallic acid equivalents(GAE) mg으로 polyphenol 함량을 산출하였다.
본 연구의 모든 실험 결과는 Prism 5(GraphPad Software, Inc., San Diego, USA)를 사용하여 산출하였다. 그룹 간 유의성 검정은 일원배치분산분석(one-way analysis of variance)를 실시하고 Newman-Keuls test에 의해 유의수준 p<0.05 이상에서 사후 검정을 실시하였다. 모든 결과는 mean±standard error of mean(SEM)으로 표시하였다.
결 과
1. 소엽의 Y-미로 시험 효과
정상군인 NOR군의 변경 행동력은 61.6±2.1%인 반면 scopolamine 투여한 CON군의 변경 행동력은 43.0±1.1%로 감소하였다. 소엽 100, 250 및 500 mg/kg 투여 후 scopolamine을 투여한 실험군에서는 57.9±1.2%, 59.7±2.2%, 59.9±1.8%로 농도 의존적으로 증가하였으며 양성대조군으로 사용한 donepezil 투여 후 scopolamine을 투여한 DNPZ군은 60.1±2.0%로 나타났다(Fig. 1A). 또한, 모든 실험군에서 각 가지에 입장한 총 횟수가 군간 차이가 나타나지 않았다(Fig. 1B).
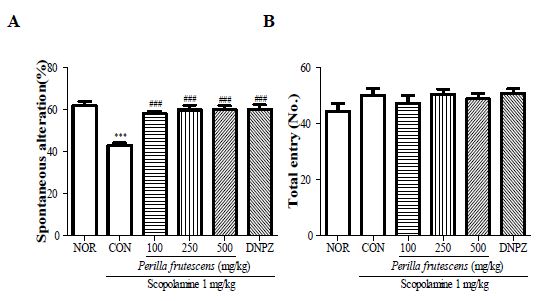
Effect of P. frutescens on Y-maze test using scopolamine (1 mg/kg, i.p)-induced memory impairment mice. Mice were treated with P. frutescens 1 h before the test. A: spontaneous alteration, B: total entry. Data represent means ± SEM(n=8). ***p<0.001 as compared with the NOR group, ###p<0.001 as compared with the CON group.
2. 소엽의 수동 회피 시험 효과
정상군인 NOR군의 밝은 방에 머무른 시간이 275.8±15.9초인 반면 scopolamine 투여한 CON군의 밝은 방에 머무른 시간이 89.9±8.7초로 감소하였다. 소엽 100, 250 및 500 mg/kg 투여 후 scopolamine을 투여한 실험군에서는 260.0±17.5초, 287.8±7.4초, 289.3±7.2초로 농도 의존적으로 증가하였으며 양성대조군으로 사용한 donepezil 투여 후 scopolamine을 투여한 DNPZ군은 293.5±6.5초로 나타났다(Fig. 2).
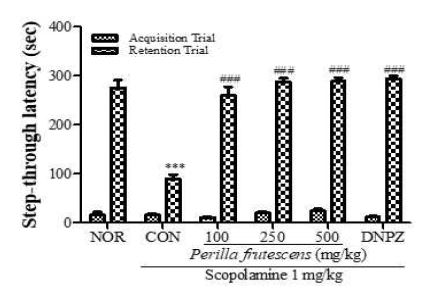
Effect of P. frutescens on the passive avoidance test using scopolamine (1 mg/kg, i.p)-induced memory impairment mice. P. frutescens were orally administered 1 h before the acquisition trial. Latency time was measured and the values shown the mean±SEM(n=7-8). ***p<0.001 as compared with the NOR group, ###p<0.001 as compared with the CON group.
3. 소엽의 수중 미로 시험 효과
정상군인 NOR군이 실험이 진행됨에 따라 도피대를 찾아가는데 걸리는 시간인 탈출 시간이 감소되는 것에 반하여 scopolamine 투여한 CON군의 탈출 시간은 실험 마지막날까지 첫째날과 비슷한 수준으로 변화가 없었다. 소엽 100, 250 및 500 mg/kg 투여 후 scopolamine을 투여한 실험군에서는 실험이 진행됨에 따라 감소하였고, 양성대조군으로 사용한 donepezil 투여 후 scopolamine을 투여한 DNPZ군은 역시 실험이 진행됨에 따라 감소하였다(Fig. 3A). 도피대를 제거하고 수행한 probe test에서 NOR군은 도피대가 있었던 구역에서 머무른 시간이 38.2±2.9초인 반면 CON군은 29.4±2.0초로 감소하였고, 소엽 100, 250 및 500 mg/kg 투여군에서 37.3±1.2초, 38.8±2.8초, 39.1±1.6초로 농도 의존적으로 증가하였으며 DNPZ군에서도 39.0±2.3초로 증가하는 것으로 나타났다(Fig. 3B).
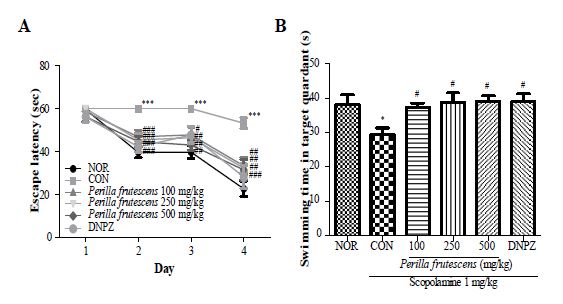
Effect of P. frutescens on the Morris water maze test using scopolamine (1 mg/kg, i.p)-induced memory impairment mice. Mice were orally administered with P. frutescens 1 h before the training trial sessions. A: escape latency, B: exploration time in target quadrant. The values shown the mean±SEM(n=6). *p<0.05, ***p<0.001 as compared with the NOR group, #p<0.05, ##p<0.01, ###p<0.001 as compared with the CON group.
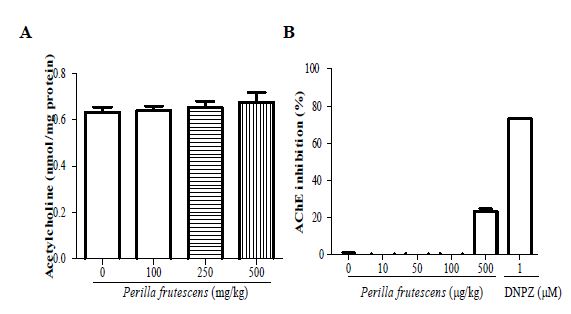
4. 소엽의 ACh와 AChE에 미치는 효과
소엽을 투여하지 않은 0군의 ACh의 양은 0.6±0.0 nmol/mg protein이고 소엽을 100, 250 또는 500 mg/kg을 투여한 100군, 250군, 500군은 0.6±0.0 nmol/mg protein, 0.7±0.0 nmol/mg protein, 0.7±0.0 nmol/mg protein로 각각 나타났으며 모든 군간 비슷한 수치로 나타났다(Fig. 4A). 또한 소엽이 0, 10, 50 및 100 μg/mL에서 AChE 저해 활성을 나타내지 않았으며 소엽 500 μg/mL에서만 23.1±1.5% 나타났고 양성대조군으로 사용한 DNPZ 1 μM에서 73.2±0.2%로 나타났다(Fig. 4B)
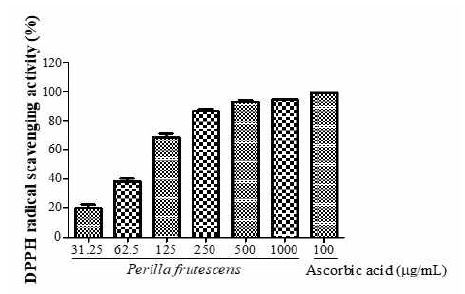
5. 소엽의 DPPH radical 소거능에 미치는 효과
소엽 31.25, 62.5, 125, 250, 500 또는 1000 μg/mL에서 DPPH radical 소거능이 19.3±2.8%, 37.9±2.5%, 68.7±2.3%, 86.4±1.8%, 92.3±1.0%, 94.7±0.2%로 농도의존적으로 증가하였고 양성대조군으로 사용한 ascorbic acid 100 μg/mL에서 99.2±0.3%로 나타났다(Fig. 5).
고 찰
한의학에서 치매는 치매(痴呆), 매병(呆病), 문치(文痴), 우치(愚痴), 전광(癲狂) 등으로 불리며25) 음(陰)이 성하여 생기는 전증(癲證)과 음(陰)이 허(虛)하고 양(陽)이 성하여 생기는 광증(狂證)이 함께 나타나 기억(記憶), 판단(判斷), 사유(思惟), 계산(計算), 감정(感情), 인격(人格) 등 정신적 장애가 나타나는 만성적인 퇴행성 질환을 일컫는다. 또한 건망증은 생각을 과하게 하여 心(심)과 脾(비)가 상한 상태를 일컫는데 소엽은 辛溫한 성미로 해표약(解表藥), 발산풍한약(發散風寒藥)에 속하는 한약재이자 방향성이 있어 향신료와 같이 음식에도 많이 사용하는 초목으로 위(胃), 심장(心臟), 간(肝)에서 기(氣)와 담(痰)이 뭉친 것을 풀어주고 외부로 육음(六淫)을 퍼뜨려 몰아내고, 내부로 칠정(七情)을 퍼뜨려 열어젖히는 효능26)으로 인지 및 기억력에 대한 효과를 확인하고자 하였다.
Scopolamine은 알츠하이머병 치매 환자와 유사한 양상으로 인지 및 기억력을 손상시켜 알츠하이머병 연구에 사용되는 대표적인 약물로 산화적 스트레스와 관련한 malondialdehyde(MDA) 수치를 증가시키고 Cu, Zn-superoxide dismutase(SOD), catalase, GSH 수치를 감소시켜 항산화능이 뛰어난 천연물을 이용한 인지 및 기억력 개선 연구가 진행되고 있다27-8). 이에 본 연구에서는 scopolamine으로 인지 및 기억력 손상을 유도한 실험동물에서 온중달표(溫中達表)하는 소엽 추출물의 인지 및 기억력에 미치는 영향을 항산화능 및 콜린신경계와 관련한 효과를 관찰하였다.
Y-maze는 기억력 및 인지 기능을 평가하기 위한 대표적인 방법으로 간단하게 측정 가능하며 실험동물의 단기 공간 기억력을 평가하는 방법이다. Y형 미로에 실험동물을 넣고 자유롭게 움직일 수 있게 하고 순차적으로 Y형 미로에 들어간 횟수를 측정하여 백분율로 나타낸 자발적 변경 행동력이 NOR군에 비하여 CON군에서 유의적으로 감소하였으나 DNPZ에서 NOR군과 비슷한 수준으로 회복된 것으로 기억력 및 인지 손상 모델이 잘 정립된 것을 확인할 수 있었고 소엽 100, 250 및 500 mg/kg 투여군에서도 자발적 변경 행동력이 농도의존적으로 증가하여 소엽이 농도의존적으로 단기 공간 기억력을 개선시키는 것을 확인하였다.
수동회피는 어두운 방에서 받은 전기 충격에 의한 공포 자극로 유도한 실험동물의 장기 기억을 평가하는 방법으로 밝은 방에 체류하는 시간이 NOR군에 비하여 CON군에서 유의적으로 감소하였으나 DNPZ에서 NOR군과 비슷한 수준으로 회복된 것으로 기억력 및 인지 손상 모델이 잘 정립된 것을 확인할 수 있었고 소엽 100, 250 및 500 mg/kg 투여군에서도 밝은 방에 체류하는 시간이 농도의존적으로 증가하여 소엽이 농도의존적으로 장기 기억력을 개선시키는 것을 확인하였다.
Morris 수중 미로는 장기 및 공간 기억력을 평가하는 방법으로 수중에 설치된 도피대를 찾아가는 훈련을 진행하여 그 시간을 측정하는데 CON군은 훈련이 진행됨에도 처음과 비슷한 수준인데 비하여 NOR군은 훈련이 진행될수록 도피대를 찾아가는데 걸리는 시간이 감소되었고 DNPZ도 NOR군과 비슷하게 감소하여 기억력 및 인지 손상 모델이 잘 정립된 것을 확인하였으며 소엽 100, 250 및 500 mg/kg 투여군에서도 훈련이 진행됨에 따라 도피대를 찾아가는데 걸리는 시간이 감소하였다. 또한 도피대를 제거하고 난 뒤 도피대가 머무른 구역에서 수영한 시간이 NOR군에 비하여 CON군에서 유의적으로 감소하였으나 소엽 100, 250 및 500 mg/kg 투여군과 DNPZ군에서 유의적으로 증가하는 것으로 소엽이 장기 공간 기억력을 개선시키는 것을 확인하였다.
콜린신경계는 인지 및 기억력과 관련한 대표적인 신경계로29-30) scopolamine은 AChE의 수치를 증가시키고 ACh와 ChAT의 수치를 감소시킨다31). 하지만 소엽 100, 250 및 500 mg/kg의 투여는 해마의 ACh 수치에 영향을 미치지 않았고 소엽 10, 50 및 100 μg/mL도 AChE 저해활성을 나타내지 않았으며 소엽 500 μg/mL에서만 미비한 AChE 저해활성을 확인하였다. 따라서 소엽은 콜린신경계가 아닌 다른 경로로 인지 및 기억력에 영향을 미치는 것으로 생각되었다.
Scopolamine은 항산화 효소의 활성을 저해하는 반면 산화 효소의 활성을 증가시키며 활성산소종의 생성을 유도하여 대뇌 피질과 해마에 손상을 유도한다32-4). 자유 라디컬은 지질의 산화를 억제하는 항산화제의 기전 중 하나로 DPPH 라디컬을 이용하여 시료의 라디컬 소거능을 빠르고 쉽게 측정하며 항산화 활성을 평가할 수 있다35). 소엽은 농도 의존적으로 DPPH 라디컬 소거능을 나타내며 125 μg/mL에서 약 70%의 DPPH 라디컬 소거능을 나타내는 것을 확인하였다. 이는 이전에 물 추출물에서 소엽 100 μg/mL에서 약 60%의 DPPH 라디컬 소거능을 나타낸 것과 비슷한 수준으로36) 소엽의 물과 에탄올 추출물에서 전자공여능 차이가 없다는 발표와 같은 수준으로 생각되었다37).
소엽은 cinnamic, flavonic, anthocyanic 유도체 등 다양한 polyphenol을 함유하고 있다38). 본연구에서 소엽의 총 polyphenol 함량을 127.7±1.2 μg GAE/mg로 확인되었는데 이는 이전 보고된 120.5 mg/g와 비슷한 수준으로 열수 추출물보다 높을 것으로37) 생각되고 메탄올 추출물 450.83±11.74 μg GAE/mg39) 보다 낮은 수준으로 나타났다. 꿀풀과 식물의 총 페놀 함량은 국화과와 미나리과 보다 높고 세계적으로 널리 이용되는 향신료의 평균 함량이 32.6 mg/g (dry weight base)인 것에40) 비하여 소엽 추출물은 높은 수준으로 나타났다.
결 론
소엽이 scopolamine으로 유도한 인지 및 기억력 감퇴 마우스 모델에서의 행동 변화와 그 기전으로 콜린신경계의 기능 및 항산화 활성에 미치는 영향에 대한 연구를 통하여 다음과 같은 결론을 얻었다.
소엽이 Y-미로 시험에서 동물의 행동량 변화 없이 농도 의존적으로 자발적 변경 행동력이 증가하여 단기 기억력을 개선시켰다.
소엽이 수동 회피 시험에서 환경에 따른 영향 없이 농도 의존적으로 체류 잠복기가 증가하여 장기 기억을 개선시켰다.
소엽이 Morris 수중 미로 시험에서 탈출 잠복기가 감소하였고 probe test에서 도피대가 있었던 구역에 머무른 시간이 증가하여 공간 학습 및 장기 기억을 개선시켰다.
소엽이 ACh의 수치 및 AChE 활성에 영향이 없었다.
소엽이 DPPH radical 소거능을 농도 의존적으로 증가시켜 항산화 효과를 나타냈다.
소엽의 총 polyphenol 함량이 향신료의 평균 함량에 비하여 높은 수준을 나타냈다.
이상의 결과로 소엽이 scopolamine으로 유도한 인지 및 기억력 감퇴 마우스 모델에서 단, 장기 및 공간 기억력을 증가시켜 항건망 효과가 있다고 생각되며 이러한 작용은 자유 라디컬 제거로 인한 항산화 및 높은 polyphenol 함량에 의한 것이라 생각된다. 따라서 소엽이 기억력 및 인지 손상에 대한 예방 및 이와 관련된 질환의 치료제로 응용 가능 할 것으로 사료된다.
Acknowledgments
본 성과물은 한국식품산업클러스터진흥원의 지원에 의해 이루어진 것입니다.
References
-
Tagai K, Nagata T, Shinagawa S, Shigeta M. Anosognosia in patients with Alzheimer's disease: current perspectives. Psychogeriatrics. 2020;20(3):345-52.
[https://doi.org/10.1111/psyg.12507]

-
Kuang H, Zhou ZF, Zhu YG, Wan ZK, Yang MW, Hong FF, Yang SL. Pharmacological Treatment of Vascular Dementia: A Molecular Mechanism Perspective. Aging Dis. 2021;12(1):308-26.
[https://doi.org/10.14336/AD.2020.0427]

-
Maliszewska-Cyna E, Lynch M, Oore JJ, Nagy PM, Aubert I. The Benefits of Exercise and Metabolic Interventions for the Prevention and Early Treatment of Alzheimer's Disease. Curr Alzheimer Res. 2017;14(1):47-60.
[https://doi.org/10.2174/1567205013666160819125400]

-
Nguyen VTT, Sallbach J, Dos Santos Guilherme M, Endres K. Influence of Acetylcholine Esterase Inhibitors and Memantine, Clinically Approved for Alzheimer's Dementia Treatment, on Intestinal Properties of the Mouse. Int J Mol Sci. 2021;22(3):1015.
[https://doi.org/10.3390/ijms22031015]

-
Darvesh S, Walsh R, Kumar R, Caines A, Roberts S, Magee D, Rockwood K, Martin E. Inhibition of human cholinesterases by drugs used to treat Alzheimer disease. Alzheimer Dis Assoc Disord. 2003;17(2):117-26.
[https://doi.org/10.1097/00002093-200304000-00011]

-
Konar A, Gupta R, Shukla RK, Maloney B, Khanna VK, Wadhwa R, Lahiri DK, Thakur MK. M1 muscarinic receptor is a key target of neuroprotection, neuroregeneration and memory recovery by i-Extract from Withania somnifera. Sci Rep. 2019;9(1):13990.
[https://doi.org/10.1038/s41598-019-48238-6]

-
Ghai R, Nagarajan K, Arora M, Grover P, Ali N, Kapoor G. Current Strategies and Novel Drug Approaches for Alzheimer Disease. CNS Neurol Disord Drug Targets. 2020;19(9):676-90.
[https://doi.org/10.2174/1871527319666200717091513]

-
Levin RA, Carnegie MH, Celermajer DS. Pulse Pressure: An Emerging Therapeutic Target for Dementia. Front Neurosci. 2020;14:669.
[https://doi.org/10.3389/fnins.2020.00669]

-
Hussain I, Hawkins J, Harrison D, Hille C, Wayne G, Cutler L, Buck T, Walter D, Demont E, Howes C, Naylor A, Jeffrey P, Gonzalez MI, Dingwall C, Michel A, Redshaw S, Davis JB. Oral administration of a potent and selective non-peptidic BACE-1 inhibitor decreases beta-cleavage of amyloid precursor protein and amyloid-beta production in vivo. J Neurochem. 2007;100(3):802-9.
[https://doi.org/10.1111/j.1471-4159.2006.04260.x]

-
Ju S, Seo JY, Lee SK, Oh J, Kim JS. Oral administration of hydrolyzed red ginseng extract improves learning and memory capability of scopolamine-treated C57BL/6J mice via upregulation of Nrf2-mediated antioxidant mechanism. J Ginseng Res. 2021;45(1):108-18.
[https://doi.org/10.1016/j.jgr.2019.12.005]

-
He MT, Lee AY, Kim JH, Park CH, Shin YS, Cho EJ. Protective role of Cordyceps militaris in Abeta(1-42)-induced Alzheimer's disease in vivo. Food Sci Biotechnol. 2018;28(3):865-72.
[https://doi.org/10.1007/s10068-018-0521-z]

-
Ban JY, Park HK, Kim SK. Effect of Glycyrrhizic Acid on Scopolamine-Induced Cognitive Impairment in Mice. Int Neurourol J. 2020;24:S48-55.
[https://doi.org/10.5213/inj.2040154.077]

-
Wang X, Zhang D, Song W, Cai CF, Zhou Z, Fu Q, Yan X, Cao Y, Fang M. Neuroprotective effects of the aerial parts of Polygala tenuifolia Willd extract on scopolamine-induced learning and memory impairments in mice. Biomed Rep. 2020;13(5):37.
[https://doi.org/10.3892/br.2020.1344]

-
Chen JH, Xia ZH, Tan RX. High-performance liquid chromatographic analysis of bioactive triterpenes in Perilla frutescens. J Pharm Biomed Anal. 2003;32:1175-9.
[https://doi.org/10.1016/S0731-7085(03)00160-2]

- Lee MS, Chung MS. Analysis of Volatile Compounds in Perilla frutescens var. acuta by Solid Phase Microextraction. Journal of the Korean Society of Food Culture. 2003;18(1):69-74.
- Asif M. Phytochemical study of polyphenols in Perilla Frutescens as an antioxidant. Avicenna J Phytomed. 2012;2(4):169-78.
-
Okamoto M, Mitsunobu F, Ashida K, Mifune T, Hosaki Y, Tsugeno H, Harada S, Tanizaki Y, Kataoka M, Niiya K, Harada M. Effects of perilla seed oil supplementation on leukotriene generation by leucocytes in patients with asthma associated with lipometabolism. Int Arch Allergy Immunol. 2000;122:137-42.
[https://doi.org/10.1159/000024369]

-
Makino T, Furuta A, Fujii H, Nakagawa T, Wakushima H, Saito K, Kano Y. Effect of oral treatment of Perilla frutescens and its constituents on type-I allergy in mice. Biol Pharm Bull. 2001;24:1206-9.
[https://doi.org/10.1248/bpb.24.1206]

-
Lee AY, Hwang BR, Lee MH, Lee S, Cho EJ. Perilla frutescens var. japonica and rosmarinic acid improve amyloid-β25-35 induced impairment of cognition and memory function. Nutr Res Pract. 2016;10(3):274-81.
[https://doi.org/10.4162/nrp.2016.10.3.274]

-
Zhu JX, Hu WQ, Dong SQ, Yi LT, Zeng JX, Li M. Hippocampal BDNF signaling is required for the antidepressant effects of perillaldehyde. Pharmacol Rep. 2019;71(3):430-7.
[https://doi.org/10.1016/j.pharep.2019.01.009]

-
Xu L, Li Y, Fu Q, Ma S. Perillaldehyde attenuates cerebral ischemia-reperfusion injury-triggered overexpression of inflammatory cytokines via modulating Akt/JNK pathway in the rat brain cortex. Biochem Biophys Res Commun. 2014;454(1):65-70.
[https://doi.org/10.1016/j.bbrc.2014.10.025]

-
Lorigooini Z, Boroujeni SN, Sayyadi-Shahraki M, Rahimi-Madiseh M, Bijad E, Amini-Khoei H. Limonene through Attenuation of Neuroinflammation and Nitrite Level Exerts Antidepressant-Like Effect on Mouse Model of Maternal Separation Stress. Behav Neurol. 2021;2021:8817309.
[https://doi.org/10.1155/2021/8817309]

-
Song Y, Seo S, Lamichhane S, Seo J, Hong JT, Cha HJ, et al. Limonene has anti-anxiety activity via adenosine A2A receptor-mediated regulation of dopaminergic and GABAergic neuronal function in the striatum. Phytomedicine. 2021;83:153474.
[https://doi.org/10.1016/j.phymed.2021.153474]

-
Ellman GL, Courtney KD, Andres Jr V, Featherstone RM. A new and rapid colorimetric determination of acetylcholinesterase activity. Biochemical pharmacology. 1961;7(2):88-95.
[https://doi.org/10.1016/0006-2952(61)90145-9]

- Lee DH. Analysis of Clinical Korean Medicine Studies on Dementia : Focused on Korean Literatures for 10 Years. Journal of Society of Preventive Korean Medicine. 2020;24(1):37-48.
- MEDICLASSICS [homepage on the Internet]. Korea Institute of Oriental Medicine; 2015 [cited 23 Apr 2021]. Available from: https://mediclassics.kr/books/154/volume/9#content_96
-
Sohn E, Kim YJ, Kim JH, Jeong SJ. Ficus erecta Thunb Leaves Alleviate Memory Loss Induced by Scopolamine in Mice via Regulation of Oxidative Stress and Cholinergic System. Mol Neurobiol. 2021.
[https://doi.org/10.1007/s12035-021-02358-1]

-
Yamagami H, Fuji T, Wako M, Hasegawa Y. Sulfated Polysaccharide Isolated from the Nacre of Pearl Oyster Improves Scopolamine-Induced Memory Impairment. Antioxidants (Basel). 2021;10(4).
[https://doi.org/10.3390/antiox10040505]

-
Shin EJ, Lee SH, Sharma N, Nguyen BT, Chung YH, Kang SW, et al. An adenoviral vector encoded with the GPx-1 gene attenuates memory impairments induced by beta-amyloid (1-42) in GPx-1 KO mice via activation of M1 mAChR-mediated signalling. Free Radic Res. 2020;1-15.
[https://doi.org/10.1080/10715762.2020.1854455]

-
Kim JM, Lee U, Kang JY, Park SK, Shin EJ, Kim HJ, et al. Anti-Amnesic Effect of Walnut via the Regulation of BBB Function and Neuro-Inflammation in Abeta1-42-Induced Mice. Antioxidants (Basel). 2020;9(10).
[https://doi.org/10.3390/antiox9100976]

-
Wang X, Zhang D, Song W, Cai CF, Zhou Z, Fu Q, et al. Neuroprotective effects of the aerial parts of Polygala tenuifolia Willd extract on scopolamine-induced learning and memory impairments in mice. Biomed Rep. 2020;13(5):37.
[https://doi.org/10.3892/br.2020.1344]

-
Ju S, Seo JY, Lee SK, Oh J, Kim JS. Oral administration of hydrolyzed red ginseng extract improves learning and memory capability of scopolamine-treated C57BL/6J mice via upregulation of Nrf2-mediated antioxidant mechanism. J Ginseng Res. 2021;45(1):108-18.
[https://doi.org/10.1016/j.jgr.2019.12.005]

-
Ademosun AO, Adebayo AA, Popoola TV, Oboh, G. Shaddock (Citrus maxima) peels extract restores cognitive function, cholinergic and purinergic enzyme systems in scopolamine-induced amnesic rats. Drug Chem Toxicol. 2020;1-8.
[https://doi.org/10.1080/01480545.2020.1808668]

-
Umukoro S, Okoh L, Igweze SC, Ajayi AM, Ben-Azu B. Protective effect of Cyperus esculentus (tiger nut) extract against scopolamine-induced memory loss and oxidative stress in mouse brain. Drug Metab Pers Ther. 2020;35(3).
[https://doi.org/10.1515/dmpt-2020-0112]

-
Gulcin I. Antioxidants and antioxidant methods: an updated overview. Arch Toxicol. 2020;94(3):651-715.
[https://doi.org/10.1007/s00204-020-02689-3]

-
Reddy NV, Li H, Hou T, Bethu MS, Ren Z, Zhang Z. Phytosynthesis of Silver Nanoparticles Using Perilla frutescens Leaf Extract: Characterization and Evaluation of Antibacterial, Antioxidant, and Anticancer Activities. Int J Nanomedicine. 2021;16:15-29.
[https://doi.org/10.2147/IJN.S265003]

- Kim JO, Lee GD, Im AG, Lee JT, Choe HJ, Kim DI. Antioxidant effects and physiological activity of Perilla frutescens extracts.. Proceedings of the Korean Society of Postharvest Science and Technology of Agricultural Products Conference. 2007;2007(11):233.1-.1.
- Asif M. Phytochemical study of polyphenols in Perilla Frutescens as an antioxidant. Avicenna J Phytomed. 2012;2(4):169-78.
-
Wang Z, Tu Z, Xie X, Cui H, Kong KW, Zhang L. Perilla frutescens Leaf Extract and Fractions: Polyphenol Composition, Antioxidant, Enzymes (alpha-Glucosidase, Acetylcholinesterase, and Tyrosinase) Inhibitory, Anticancer, and Antidiabetic Activities. Foods. 2021;10(2).
[https://doi.org/10.3390/foods10020315]

- Ryu NS. Antioxidant Activity and Active Components of Wild Vegetables from Korea. Chonbuk National University. 2018.