Tumor necrosis factor α - induced protein3의 발현과 NF-κB 활성 억제를 통한 동과자의 염증반응 억제 효과
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Donggwaja (Benincasae Semen), the seed of Benincasa hispida (Thunb.) Cogn., has been used in Korean traditional medicine to control the body heat and water retention caused by various diseases. Both the symptoms targeted by the herbal medicine in clinic and studies with disease mouse models support the potential anti-inflammatory effect of Donggwaja. However, it is less understood how Donggwaja exerts its possible anti-inflammatory effect. Here, we present evidence that Donggwaja suppresses macrophage inflammatory reactions via expressing tumor necrosis factor a-induced protein 3 (TNFAIP3 or A20) and suppressing NF-kB activity. The ethanol extract of Donggwaja (EED) showed no toxicity when added to RAW 264.7 cells less than 100mg/ml. When treating the cells for 16 h, EED significantly suppressed the nuclear localization of NF-kB, suggesting that EED suppresses NF-kB activity. Concordantly, a semi-quantitative RT-PCR analysis showed that EED decreased the expression of prototypic pro-inflammatory cytokines, such as tumor necrosis factor (TNF)-a, IL(interleukin)-6, and IL-1b. EED induced in RAW 264.7 cells the expression of A20, a ubiquitin modulator that suppresses inflammatory signaling cascades initiated from TLR4 and TNF and IL-1 receptors, while not affecting the induction of Nrf2, an anti-inflammatory factor that could suppress the effect of NF-kB. These results suggest that EED exerts its suppressive effect on inflammation, at least in part, by expressing anti-inflammatory factor A20 and suppressing pro-inflammatory factor NF-kB activity.
Keywords:
Donggwaja, anti-inflammation, TNFAIP3, NF-kB서 론
염증 (inflammation)은 선천면역 (innate immunity)의 주요 반응으로 세균 감염, 물리적, 화학적 자극에 의한 조직파괴로 부터 개체를 보호하는 중요한 생체 방어 기전이다. 염증은 급성, 만성 질환과 밀접하게 연관되어 있으므로 다양한 질환의 주요 병리 기전이라 할 수 있다1). 따라서 염증 반응의 조절은 질환 치료에 중요한 수단이 될 수 있다. 염증반응에서 가장 중요한 세포는 대식세포 (macrophage)다. 이 세포는 염증반응의 시작, 유지, 억제에 중요한 역할을 한다2). 예를 들어, 세균 감염이 발생할 경우 세균이 가지는 lipopolysaccharide (LPS)를 Toll-like receptor 4 (TLR4)를 통해 인식하고 세포내 signal cascade를 통해 염증촉진 전사인자인 nuclear factor κB (NF-κB)를 활성 한다3). 활성화된 NF-κB는 염증성 사이토카인 유전자의 mRNA 합성을 촉진하여 tumor necrosis factor-α (TNF-α), interleukin (IL)-6, IL-1β 등과 같은 사이토카인의 생산 증가에 기여한다. 염증성 사이토카인은 대식세포 밖으로 분비되어 다양한 염증관련 세포를 활성 함으로써 염증반응을 확산, 촉진한다4).
시작된 염증반응은 여러 기전으로 조절될 수 있다. 첫 번째는, NF-kB의 효과를 억제하는 대표적 단백질인 tumor necrosis factor α-induced protein 3 (TNFAIP3)의 활성을 통해 조절될 수 있다5). TNFAIP3는 A20으로도 알려져 있는데, 염증반응으로 활성화된 NF-κB에 의해 발현이 유도된다, 생성된 A20은 TNF receptor, IL-1β receptor, TLR4 receptor 등에 recruit되어 염증촉진 signaling을 조절하는 adaptor molecule을 ubiquitination 또는 de-ubiquitination한다. Adaptor molecule의 ubiquitination 변화는 receptor에서 시작되는 signaling을 억제하여 궁극적으로 과도한 염증 반응을 조절할 수 있다6). TLR4 signaling의 경우, A20은 TRAF6를 ubiquitination하여 기능을 저하시키고 TRAF6의 degradation을 유발함으로써 염증 촉진을 위한 signaling을 억제한다7). 염증반응을 억제하는 두 번째 예로 Nrf2를 들 수 있다8). Nrf2는 LPS와 같은 염증반응 자극물질이나 reactive oxygen species (ROS)에 의해 활성된다. 활성화된 Nrf2는 세포질에서 핵으로 이동하여 항산화와 관련된 유전자인 GCLC, HO-1 및 NQO-1의 발현을 촉진함으로써 염증 억제에 기여 한다9).
염증을 억제하는 한약재 종류는 많이 알려져 있으나 한약재에 의한 구체적인 염증억제 기전에 대한 이해는 부족한 편이다. 동과의 경우, 방약합편(方藥合編)에 이수(利水), 소담(消痰), 청열(淸熱), 해독(解毒)의 효능이 있으며, 수종(水腫), 창만(脹滿), 해천(咳喘), 소갈(消渴, 당뇨병), 옹종(癕腫) 치료에 효능이 있다고 하였고 활담배농(豁痰排膿)하며 청열화담(淸熱化痰), 소종배농(消腫排膿), 청열리습(淸熱利濕)의 효능이 있다고 기록되어 있다10). 이 기록은 동과가 염증이 동반되는 병리현상의 치료에 효력이 있음을 의미한다. 동과자는 동과 (Benincasa hispida (Thunb.) Cogn.)의 씨로11), 위궤양, 항산화, 항박테리아 활성을 가지고 있으며12), 항암13), 비알콜성 지방간 개선14)에도 효능이 있는 것으로 보고되었다. 세포와 질환 동물모델을 이용한 연구에서 동과자는 NO (nitric oxide), IL-6, TNF-α와 같이 염증 촉진 인자의 생성을 억제하고15,16) serum IgE, 히스타민, mast cell 활성을 억제하는 효과가 있음이 보고되었다17). 이런 결과는 동과자가 사이토카인과 염증촉진 인자의 생성을 억제하고 염증 세포에 작용함으로써 염증을 억제할 가능성을 시사한다. 그러나 동과자가 어떤 기전으로 사이토카인과 염증촉진 인자의 생성을 억제하는 지에 대해 잘 알려져 있지 않다. 본 연구에서는 동과자 에탄올 추출물을 이용하여 동과자가 TNFAIP3의 발현을 유도하고, NF-κB 활성을 억제함으로써 염증조절에 기여할 가능성에 대한 실험적 근거를 제시하고, 이를 통해 고전에 기록된 동과자 약효에 대해 실험적 근거를 마련하고자 한다.
재료와 방법
1. 동과자 추출물
동과자 (Benincasae Semen)를 ethyl alcohol 95.0 % 용매로 추출한 추출물 (CA04-010)을 한국식물추출물은행 (Korea Plant Extract Bank)으로 부터 분양 받아 사용하였다.
2. 재료와 항체
TLR4에 특이적으로 결합하는 대장균 내독소 (TLR4-specific LPS, Escherichia coli O55:B5)와 human TNF-α는 Alexis Biochemical (San Diego, CA, USA)와 R&D systems (Minneapolis, MN, USA)에서 각각 구입하였다. Nrf2 활성 물질인 sulforaphane은 Sigma-Aldrich Co. (St. Louis, MO, USA)에서 구입하여 사용하였다. Western blot에 사용된 Nrf2 항체는 Abcam (Cambridge, UK)에서 구입하였으며, 그 외 p65 RelA (NF-kB), A20 (TNFAIP3), actin, lamin B 항체와 2차 항체는 Santa Cruz Biotechnology (Santa Cruz, CA, USA)에서 구입하였다.
3. 세포 배양
RAW 264.7 세포는 American Type culture Collection (ATCC, Rockville, MD, USA)에서 구입하였다. RAW 264.7 세포 배양은 L-glutamine (200 mg/L), 10 % (v/v) heat-inactivated fetal bovine serum (FBS), 100 U/ml penicillin 과 100 μg/ml streptomycin (Thermo Fisher Scientific) 등이 첨가된 Dulbecco’s Modified Eagle’s Medium (DMEM)을 사용하였다. 세포는 37℃, 5 % CO2 조건의 배양기에서 배양하였고 계대 수 (passage number) 15 회 미만의 세포를 실험에 사용하였다.
4. 세포 독성 측정
동과자 추출물의 세포독성을 평가하기 위해 Cell Counting Kit-8 (CCK-8, Enzo)를 사용하였다. 96-well plate에 세포를 분주하고, 동과자 추출액을 농도별로 처리한 후, 24 시간 배양하였다. CCK-8 시약을 첨가한 후, 4 시간 동안 추가 배양하고 microplate reader (Model 550, Bio-Rad, Richmond, USA)를 이용하여 450 nm 흡광도에서 세포 독성을 측정하였다.
5. RNA 분리 및 RT-PCR
유전자의 발현은 semi-quantitative RT-PCR을 이용하여 확인하였다. Total RNA를 RNeasy Mini Kit (Qiagen, Hilden, Germany)를 이용하여 추출한 후 M-MLV Reverse Transcriptase (Promega, Madison, WI, USA)를 이용하여 cDNA를 합성하였다. cDNA는 1:5 end-point dilution한 후 TaqPCRx DNA Polymerase (Invitrogen, Carlsbad, CA, USA)와 유전자 특이적인 primer를 이용하여 각 유전자의 발현을 조사하였다. PCR에 사용된 primer는 COSMOGENETH (서울, 대한민국)에 주문제작하여 사용하였다. 유전자 특이적 primer sequence는 다음과 같다.
TNF-α: 5-CTACTCCTCAGAGCCCCCAG-3′, 5′-AGGCA ACCTGACCACTCTCC-3′; IL-1β: 5′-GTGTCTTTCCCGTGGACCTT-3′, 5′-TCGTTGCTTGG TTCTCCTTG-3’; IL-6: 5’-TCTGGGTTCAATCAGGCGAT-3’, 5’-TGCGTTCTTTACCCACTCG T-3’; GAPDH: 5′-GGAGCCAAAAGGGTCATCAT-3′, 5′-GTGATGGCATGGACTGTGGT-3′
PCR 반응은 95 ℃에서 5 분간 denaturation 반응 후, 95 ℃에서 30 초, 55 ℃에서 30 초 반응하여 primer와 cDNA의 결합을 유도하고 효소에 의한 polymerization 반응은 60 ℃에서 40 초간 이루어졌다. 총 cycle은 25였다. 증폭된 DNA는 1.2 % agarose gel에 전기영동하고 SYBR safe DNA gel stain (Invitrogen)으로 염색 후 blue light에서 band를 확인하였다. GAPDH를 유전자 발현의 control로 사용하였고, Image J (NIH, Bethesda, MD, USA) 소프트웨어를 이용하여 발현 정도를 수치화 하였다.
6. Luciferase reporter assay
Nrf2에 의해 유도되는 NQO1의 발현을 NQO1/luciferase reporter cell을 사용하여 확인하였다18). 24-well에 배양한 reporter 세포에 동과자 추출물을 처리하고 16 시간 후 Luciferase assay kit (Promega, USA)의 lysis buffer를 사용하여 용해시킨다. Kit에 소개된 방법에 따라 cell lysate 와 luciferase를 반응 시킨 후 luminometer로 측정하였다.
7. Western blot 분석
Total protein은 0.5 % NP-40 cell lysis buffer를 이용하여 추출하였고, nuclear protein은 NE-PER™ nuclear extraction kit (Thermo Fisher Scientific)를 이용하여 추출하였다. Bradford assay로 정량 후 동일 양의 단백질을 NuPAGE gel (Thermo Fisher Scientific)에서 전기영동 하였다. 전기영동 후 Polyvinylidene fluoride(PVDF) membrane에 transfer하여, 1 차와 2 차 antibody를 사용하여 단백질 발현을 분석하였다.
8. 통계분석
그룹 간 유의성 분석을 위해 one-way analysis of variance (ANOVA) (InStat, Graphpad Software, Inc., San Diego, CA)를 시행하였고, 사후분석은 Turkey test를 사용하였다. 모든 검정에서 p<0.05 인 경우 통계적으로 유의한 차이가 있는 것으로 판단하였다. 모든 실험은 3번 이상 독립적으로 시행하였다.
결 과
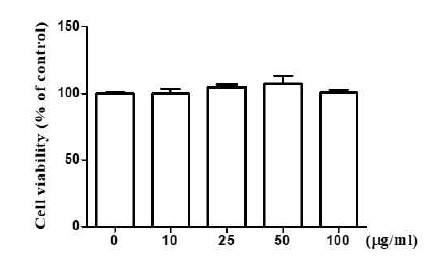
1. 동과자 추출물의 세포 독성 측정
실험에 적합한 동과자 에탄올 추출물의 농도를 결정하기 위해 먼저 세포 독성을 확인하였다. 24-well에 RAW 264.7 세포를 배양하고 동과자 추출물 0, 10, 25, 50, 100 μg/ml 농도로 처리하였다. 처리 24 시간 후, CCK-8 kit를 이용하여 세포의 생존율을 microplate reader를 이용하여 측정하였다. 실험결과, 최고 10 0 μg/ml의 농도로 처리한 세포의 생존률은 처리하지 않은 대조군 세포의 생존율과 유의적 차이가 없었다(Fig. 1). 이 결과는 동과자 추출물 100 μg/ml 농도 범위 내에서는 세포 독성을 거의 보이지 않았음을 보여준다.
2. 동과자 추출물에 의한 NF-kB의 핵 이동 억제 효과
NF-kB는 염증을 촉진하는 대표적 transcription factor 중의 하나 이다. 세균의 내독소 (endotoxin)인 LPS에 의해 TLR4 signaling이 활성 되면 상위 조절자인 I-kB kinase (IKK)에 의해 억제 단백질인 I-kB가 인산화 되고 분해되면서 NF-kB는 활성화 된다19). 활성화 된 NF-kB는 세포질에서 핵으로 이동하여 염증반응에 관여하는 다양한 유전자를 전사 한다19). 이 실험에서는 동과자 추출물이 NF-kB 활성을 억제함으로써 염증을 억제할 가능성을 조사하였다. RAW 264.7 세포를 10 μg/ml과 50 μg/ml의 동과자 추출액으로 16시간 처리한 후, 100 ng/ml 농도의 LPS로 15분과 30분 처리하여 NF-kB를 활성화시켰다. 활성 된 NF-kB는 핵으로 이동하므로 처리된 세포에서 nuclear protein을 추출하고 NF-kB의 대표적 subunit인 p65 RelA 단백질을 western blot으로 조사하고 (Fig. 2A) 그 결과를 densitometer를 이용하여 분석하였다 (Fig. 2B). Fig 2A에서 보는 바와 같이, 아무런 처리를 하지 않은 세포(lane 1)나 동과자 추출액 만을 처리한 세포 (lane 2와 3)에서는 NF-kB의 활성이 보이지 않았다. LPS를 15분 처리할 경우, NF-kB의 핵 이동이 크게 증가했으나 (lane 4), 50 μg/ml 동과자 추출물을 처리할 경우, NF-kB의 핵 이동을 통계적으로 유의미하게 감소시켰다 (lane 6, Fig. 2B). LPS를 30분 처리할 경우, NF-kB의 핵 이동 역시 크게 증가했으나 (lane 7), 동과자 10 μg/ml과 50 μg/ml을 처리할 겨우, NF-kB 핵 이동이 모두 유의적으로 감소하였다(lane 8과 9, Fig. 2B). 이 결과는 동과자가 NF-kB 활성을 억제하여 염증을 억제할 가능성을 나타낸다.
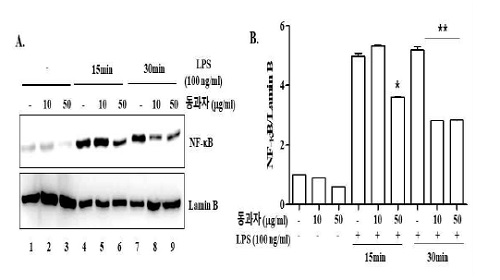
Donggwaja interferes with the nuclear translocation of NF-kB. RAW 264.7 cells were treated with 10 μg/ml or 50 μg/ml of Donggwaja for 16 h and then with LPS (100 ng/ml) for 15 min or 30 min. Nuclear NF-kB was measured by western blotting of p65 RelA, a key component of NF-kB (A), the blot of which was analyzed by densitometor (B). *P was < 0.05 compared to the control treated with LPS for 15 min, and **P was < 0.05 compared to the control treated with LPS for 30 min. Data represent the mean ± SEM of three independent measurements.
3. 동과자 추출물에 의한 염증촉진 사이토카인 유전자 발현 억제 효과
NF-kB가 핵으로 이동하면 염증반응을 촉진하는 대표적 사이토카인(cytokine) 유전자인 TNF-α, IL-1β, IL-6 등을 transcription 한다. 동과자 추출물은 NF-kB의 핵 이동을 억제하였으므로 NF-kB가 조절하는 염증성 사이토카인의 발현을 억제할 가능성이 있다. 이를 확인하기 위해 동과자를 RAW264.7 세포에 10 μg/ml 또는 50 μg/ml의 농도로 16시간 처리한 한 후 100ng/ml의 LPS를 2시간 처리하였다. 처리 후, total RNA를 추출하고 semi-quantitative RT-PCR 방법으로 TNF-α, IL-1β, IL-6의 mRNA 발현을 확인하고 (Fig. 3A) 이를 densitometric 분석하여 통계적 유의성을 조사하였다(Fig. 3B). Fig. 3A에서 보듯이 LPS를 처리할 경우 TNF-α, IL-1b, IL-6 등 유전자의 발현이 증가한다(lane 4). 그러나 동과자 추출액을 처리할 경우 사이토카인의 발현이 유의적으로 감소되었다(lane 4와 5). TNF-α의 경우, 10μg/ml의 동과자 추출액의 처리로 TNF-α 발현이 줄지 않았으나(lane 4, Fig. 3B) 50μg/ml의 동과자 추출액을 처리할 경우, 유의미하게 TNF-α 발현이 감소되었다(lane 5, Fig. 3B). IL-1β의 발현은 보다 유의미한 효과가 관찰되었다. LPS에 의해 발현된 IL-1β mRNA는 10μg/ml의 동과자 추출액을 처리할 경우 유의미하게 감소되었다(lane 4와 5). 보다 높은 농도인 50 μg/ml의 동과자 추출액을 처리할 경우, IL-1β의 발현은 더욱 감소하였다(lane 4, 5, 6). 동과자에 의해 IL-6 발현도 억제되었다. IL-1β 발현과 유사하게 10 μg/ml의 동과자 추출액을 처리할 경우 IL-6 발현이 억제되었으나 그 정도는 약했다(lane 4와 5), 그러나 50 μg/ml의 동과자 추출액을 처리할 경우, IL-6 발현을 강하게 억제하였다(lane 6). 동과자 추출물에 의한 사이토카인 발현억제는 densitometric 분석으로 재확인하였다(Fig. 3B). 이 결과는 동과자가 염증촉진 인자인 NF-kB 활성을 억제하여 NF-kB에 의해 조절되는 염증촉진 사이토카인 유전자의 발현을 억제할 수 있음을 보여 준다.
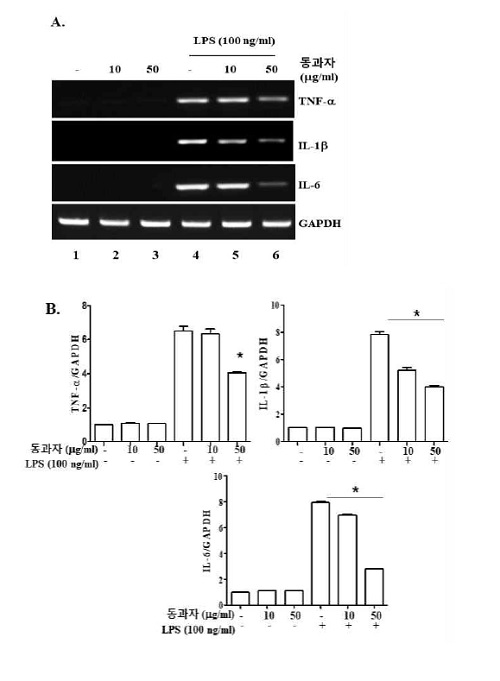
Donggwaja suppresses the expression of prototypic inflammatory cytokines. RAW 264.7 cells were treated with two different amounts of Donggwaja for 16 h and then 100 ng/ml of LPS. Two hours after LPS treatment, total RNA was extracted and the mRNAs of TNF-α, IL-1β, IL-6 mRNA were amplified by semi-quantitative RT-PCR (A). PCR products were run on an agarose-gel, the image of which was subject to densitometric analysis (B). *P was < 0.05 compared to the LPS-treated control. Data represent the mean ± SEM of three independent measurements.
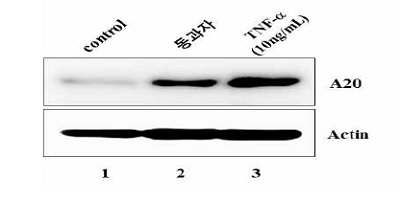
4. 동과자 추출물에 의한 TNFAIP3 (A20) 발현
위 결과에서 동과자 추출물이 NF-kB의 활성을 억제하였으므로 이번 실험에서는 동과자 추출액이 상위 억제 signal을 활성하여 NF-kB 활성을 억제할 가능성을 조사하였다. TNFAIP3 (A20)는 TLR4에 결합하는 adaptor molecule을 조절하여 NF-kB 활성을 억제하므로 동과자 추출물이 A20의 발현을 조절할 가능성을 조사하였다. RAW264.7 세포를 TNF-α (10 ng/ml, 8h) 또는 동과자 추출물 (50 μg/ml, 16h)로 처리한 후, A20 단백질의 발현을 western blot으로 조사하였다. Fig. 4에서 보는 바와 같이, 동과자 추출액은 TNF-α와 유사하게 A20의 발현을 유발하였다 (lane 2와 3). 이 결과는 동과자가 A20의 발현을 촉진함으로써 NF-kB 활성을 억제하는데 기여했을 가능성을 보여준다.
5. 동과자 추출물의 Nrf2 활성에 대한 효과
염증반응은 염증억제 인자의 발현으로 억제될 수 있다. Nrf2는 대표적인 염증 억제인자이다. 따라서 이 실험에서는 동과자 추출물이 염증억제 인자 Nrf2의 발현을 촉진함으로써 염증을 억제할 가능성을 조사하였다. RAW 264.7 세포를 동과자 추출액 (10 μg/ml 또는 50 μg/ml)과 Nrf2 활성물질인 sulforaphane (SFN, 5mM)으로 16시간 처리하였다. Nrf2가 활성화되면 핵으로 이동하므로 nuclear protein을 추출하여 western blotting으로 nuclear Nrf2를 확인하였다. Fig. 5A에서 보듯이 동과자는 Nrf2 발현을 유도하지 못했다. 이 결과를 재확인하기 위해 Nrf2-reporter cell line을 이용하여 Nrf2의 활성 여부를 조사했다. RAW 264.7 세포에 Nrf2에 의해 조절되는 NQO1 유전자의 promoter와 luciferase reporter 유전자를 가지는 plasmid를 stable transfection하여 만든 NQO1-luciferase reporter cell line을 두 가지 농도의 동과자 추출액으로 처리하고 16시간 후에 luciferase activity를 측정하였다. Fig. 5B에서 보는 바와 같이 SFN를 처리할 경우 luciferase activity가 증가하는 반면 (column 2), 동과자 추출액은 luciferase activity를 유발시키지 못했다(column 3과 4). 이는 동과자의 염증억제 효과는 Nrf2 활성과는 관련성이 없음을 시사한다.
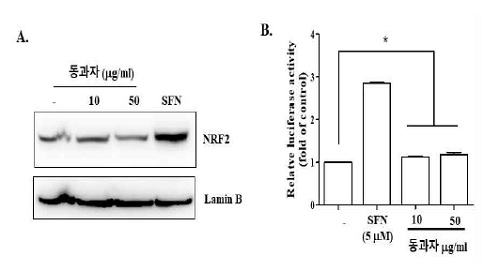
Effect of Donggwaja on anti-inflammatory factor Nrf2. RAW 264 cells (A) and reporter cell line (B) were treated with two different amounts of Donggwaja and sulforaphane (5 mM) for 16 h. The nuclear localization of Nrf2 and the induction of Nrf2-dependent luciferase expression were measured by western blot and luciferase reporter assay, respectively. * No statistical significance was found, compared to untreated control. Data in the graph (B) represent the mean ± SEM of three independent measurements.
고 찰
본 연구에서는 동과자의 항염증 효과를 세포 실험으로 확인하고, 구체적인 염증억제 기전을 규명하고자 하였다. 대식세포인 RAW 264.7을 동과자 에탄올 추출물로 처리할 경우, 대표적인 염증촉진 전사 인자인 NF-κB의 활성이 억제되었으며 NF-κB에 의해 발현이 조절되는 염증성 사이토카인 유전자 TNF-α, IL-6, IL-1b의 발현이 통계적으로 유의미하게 감소되었다. 동과자 에탄올 추출물은 NF-κB 활성을 억제하는 A20의 발현을 유발시켰으나 항염증인자인 Nrf2는 활성 시키지 않았다. 이 결과는 동과자가 A20의 발현을 촉진하고 NF-κB의 활성을 억제함으로써 염증반응 억제에 기여할 가능성을 보여준다.
동과자의 염증억제 효과 가능성은 의서에 기록되어 왔다. 신농본초경에 따르면 동과자는 기침, 황색의 담, 농양에 사용하고, 소변곤란, 대하에도 효과가 있다고 하였다20). 호흡기 질환에 동반하는 기침과 담, 농양 억제는 동과자의 염증억제 효과를 의미한다. 이 외, 동과자는 항산화 효과12), 항균 효과12), 항암 효과13) 등을 갖는 것으로 보인다. 최근 연구에 따르면 동과자 메탄올 추출물은 위궤양 동물 모델에서 항산화 효과를 보이고 그람 양성균의 수를 감소시켰다14). 동과자 열수 추출물을 이용한 실험에서는 면역세포의 분화를 촉진하였고 항암 효과21)를 나타냈다. 동과자 메탄올 또는 에탄올 추출물은 NO (nitric oxide), IL-6, TNF-α와 같은 염증 촉진 인자의 생성을 억제하였고15,16) IgE 생성과 mast cell 활성 억제를 통해 히스타민 분비 등을 감소시켜 알레르기성 질환에도 효과가 있음을 보고하였다17). 비록 이 연구 결과들이 동과자의 항염증 효과를 비롯하여 다양한 효능을 가지고 있을 가능성을 제시하지만, 구체적이고 다양한 항염증 기전을 제시하지는 못하였다. 본 연구 결과는 동과자가 A20의 발현을 유도하고 NF-kB의 활성을 억제함으로써 염증을 억제할 가능성을 구체적으로 제시한다.
염증반응을 유발하는 대표적인 병원체는 세균이다. 특히 세균이 가지는 LPS는 그람 음성균의 막을 구성하는 성분으로 대식세포를 자극하여 면역반응을 유도하는 것으로 잘 알려져 있다22). LPS는 대식세포의 막에 존재하는 TLR4에 의해 인식되는데, LPS가 CD14를 통해 TLR4와 결합하면 TRAF6 등 다양한 adaptor molecule이 TLR4에 결합하면서 세포내 신호전달 체계 (signal cascade)를 활성화하고 궁극적으로 NF-κB를 활성하여 다양한 염증 관련 유전자의 발현을 유도 한다23). 생성된 TNF-α, IL-6, IL-1β 등은 autocrine 경로 거쳐 활성화된 대식세포에 작용하거나 paracrine 효과를 통해 주위의 다른 염증세포에 작용한다. 이들이 세포 표면에 존재하는 사이토카인 특이적 receptor에 결합하면 receptor를 통한 signaling cascade를 거쳐 NF-κB가 활성화되고 활성화된 NF-κB는 TNF-α, IL-6, IL-1β 생성을 유도한다. 이런 과정을 통해 염증반응은 증폭되고 빠른 속도로 진행하게 된다21). 이때, A20은 염증반응의 확산을 효과적으로 억제하는데 중요한 역할을 할 수 있다. A20은 TLR4 signaling 외, TNF receptor나 IL-1 receptor의 signaling을 모두 억제할 수 있기 때문이다. 본 연구 결과에 따르면 동과자는 A20의 생성을 유발한다. 따라서 동과자는 다양한 염증유발 signaling을 동시에 억제함으로써 효과적으로 염증반응을 조절할 가능성이 있다.
동과자 추출액은 A20의 활성과 무관힌 독립적인 다른 기전을 통해 NF-κB 활성을 억제할 수 있다. 예를 들어, 동과자에 의해 A20이 발현되면 A20은 IKK의 기능을 억제하고 결과적으로 NF-κB 활성을 억제하는 것으로 알려져 있지만 동과자가 직접 IKK의 기능을 억제함으로써 NF-κB 활성을 억제할 가능성도 배제할 수 없다. 동과자에 의해 IKK의 활성이 직접적으로 억제되는 지 여부를 조사하면 동과자에 의한 A20의 발현과 NF-κB 활성 억제가 독립적으로 발생하는지 또는 A20 발현의 결과로 NF-κB 활성이 억제되는지 여부를 규명할 수 있을 것이다. 한편, NF-κB 활성은 대표적인 항염증인자 Nrf2에 의해 감소될 수 있다. 그러나 동과자 추출물은 Nrf2를 활성하지 않았다. 따라서 동과자 추출물에 의한 염증성 사이토카인 생성 억제는 A20의 발현과 NF-κB 활성 억제와 깊은 연관성이 있는 것으로 생각된다.
염증은 대식세포를 포함하여 중성구 (neutrophil), 단핵구 (monocyte) 등 대표적인 염증세포를 중심으로 질환의 형태에 따라 eosinophil, T 림프구 (lymphocyte)등이 관여하며, 염증의 진행 정도에 따라 조직과 혈관의 변형을 동반 한다24). 염증세포들의 고유한 반응과 상호작용, 조직 내 주변 세포에 미치는 영향 등의 조합이 병리현상인 염증으로 나타나게 될 것이다. 그러므로 동과자의 염증성 질환 치료효과는 다양한 질환 동물 모델을 이용한 연구를 통해 규명이 필요하다. 본 연구의 한계는 염증성 질환 동물 모델을 사용하는 대신, 대식세포에 의한 염증반응 조절에 중점을 두고 있다는 점일 것이다. 그러나 대식세포는 염증반응의 시작, 유지, 종결의 과정을 조절하는 염증반응 조절자이다. 동과자 추출물이 대식세포의 염증반응을 억제할 수 있다는 실험 결과는 동과자의 항염증 효과 가능성을 제시하는데 충분하다고 생각된다. 대식세포를 이용한 실험에서 주요 염증촉진 기전을 억제하였으므로 염증성 질환 마우스 모델을 이용한 유사 연구에서도 염증 질환을 억제할 가능성이 높다고 추정된다.
본 연구는 동과자가 염증억제인자 A20의 발현을 유발하고 염증촉진인자 NF-κB의 활성을 억제함으로써 대식세포의 주요 염증성 사이토카인의 발현을 억제할 수 있음을 보여준다. 이 결과는 동과자가 적어도 대식세포의 염증반응을 억제함으로써 염증질환 치료에 기여할 수 있음을 시사한다.
Acknowledgments
이 논문은 부산대학교 기본연구지원사업 (2년)으로 연구되었습니다.
References
-
Fujiwara N, Kobayashi K. Macrophages in Inflammation. Curr Drug Targets Inflamm Allergy. 2005;4(3):281-6,
[https://doi.org/10.2174/1568010054022024]

-
Kimbrell DA, Beutler B. The evolution and Genetics of Innate Immunity. Nat Rev Genet. 2001;2(4):256-67.
[https://doi.org/10.1038/35066006]

-
Zhang H, Wu ZM, Yang YP, Shaukat A, Yang J, Guo YF, Zhang T, Zhu XY, Qiu JX, Deng GZ, Shi DM. Catalpol Ameliorates LPS-induced Endometritis by Inhibiting Inflammation and TLR4/NF-kappaB Signaling. J Zhejiang Univ Sci B. 2019;20(10):816-27.
[https://doi.org/10.1631/jzus.B1900071]

-
Israel A. The IKK Complex, a Central Regulator of NF-kappaB Activation. Cold Spring Harb Perspect Biol. 2010;2(3):a000158.
[https://doi.org/10.1101/cshperspect.a000158]

-
Wertz IE, O'Rourke KM, Zhou H, Eby M, Aravind L, Seshagiri S, Wu P, Wiesmann C, Baker R, Boone DL, Ma A, Koonin EV, Dixit VM. De-ubiquitination and Ubiquitin Ligase Domains of A20 Downregulate NF-kappaB Signalling. Nature. 2004;430(7000):694-9.
[https://doi.org/10.1038/nature02794]

-
Catrysse L, Vereecke L, Beyaert R, van Loo G. A20 in Inflammation and Autoimmunity. Trends Immunol. 2014;35(1):22-31.
[https://doi.org/10.1016/j.it.2013.10.005]

-
Lin SC, Chung JY, Lamothe B, Rajashankar K, Lu M, Lo YC, Lam AY, Darnay BG, Wu H. Molecular Basis for the Unique Deubiquitinating Activity of the NF-kappaB Inhibitor A20. J Mol Biol. 2008;376(2):526-40.
[https://doi.org/10.1016/j.jmb.2007.11.092]

-
Robledinos-Anton N, Fernandez-Gines R, Manda G, Cuadrado A. Activators and Inhibitors of NRF2: A Review of Their Potential for Clinical Development. Oxid Med Cell Longev. 2019;2019:9372182.
[https://doi.org/10.1155/2019/9372182]

-
Yan C, Zhang X, Miao J, Yuan H, Liu E, Liang T, Li Q. Farrerol Directly Targets GSK-3beta to Activate Nrf2-ARE Pathway and Protect EA.hy926 Cells against Oxidative Stress-Induced Injuries. Oxid Med Cell Longev. 2020;2020:5967434.
[https://doi.org/10.1155/2020/5967434]

- Hwang DY. Banyakhapeon. Seoul:Yonglim Books, 2010. p. 548-9.
- Ministry of Food and Drug Safety. The Korean Herbal Pharmacopoeia. Republic of Korea:Ministry of Food and Drug Safety; 2020.
- Al-Snafi AE. The Pharmacological Importance of Benincasa hispida. A review. International Journal of Pharma Sciences and Research (IJPSR). 2013;4(12):165-70.
-
Lee KH, Choi HR, Kim CH. Anti-angiogenic Effect of the Seed Extract of Benincasa Hispida Cogniaux. J Ethnopharmacol. 2005;97(3):509-13.
[https://doi.org/10.1016/j.jep.2004.12.008]

- Choi JY KS, Kwun MJ, Kim K.H., Joo M, Han C. Effects of Ethanol Extract of Benincasa Seeds on the Experimental Cellular Model of Nonalcholic Fatty Liver Disease. Korean J Orinet Int Med. 2012;33(4):438-47.
-
An SM, Kim HG, Choi EJ, Hwang HH, Lee E, Baek JH, Boo YC, Koh JS. Screening for Anti-inflammatory Activities in Extracts from Korean Herb Medicines. J Soc Cosmet Scientists Korea. 2014;40(1);95-108.
[https://doi.org/10.15230/SCSK.2014.40.1.95]

- Park Gi, Lee JA. Anti-oxidant, Anti-inflammatory and Whitening Effect of Benincasa hispida Seed Extract. Journal of Convergence for Information Technology. 2020;10(7):249-56.
- Park SK, Kim JJ, Sung SMi, Lee MY. Suppressive Effects of Benincasae hispida on Allergic Inflammation. Molecular & Cellular Toxicology 2009;5(4):304-9.
-
Kim KH, Kim DH, Jeong N, Kim KI, Kim YH, Lee M, Choi JY, Jung HJ, Jung SK, Joo M.: Therapeutic Effect of Chung-Pae, an Experimental Herbal Formula, on Acute Lung Inflammation Is Associated with Suppression of NF-κB and Activation of Nrf2, Evid Based Complement Alternat Med. 2013;2013:659459.
[https://doi.org/10.1155/2013/659459]

-
Zhang Q, Lenardo MJ, Baltimore D.30 Years of NF-kappaB: A Blossoming of Relevance to Human Pathobiology. Cell. 2017;168(1):37-57.
[https://doi.org/10.1016/j.cell.2016.12.012]

- Sinnongbonchogyeong. Seoul: Euisungdang; 2012.
-
Kumazawa Y, Nakatsuru Y, Yamada A, Yadomae T, Nishimura C, Otsuka Y, Nomoto K. Immunopotentiator Separated from Hot Water Extract of the Seed of Benincasa cerifera Savi (Tohgashi). Cancer Immunol Immunother. 1985;19(2):79-84.
[https://doi.org/10.1007/BF00199713]

-
Broad A, Jones DE, Kirby JA. Toll-like Receptor (TLR) Response Tolerance: a Key Physiological "Damage Limitation" Effect and an Important Potential Opportunity for Therapy. Curr Med Chem. 2006;13(21):2487-502.
[https://doi.org/10.2174/092986706778201675]

-
Miller SI, Ernst RK, Bader MW. LPS, TLR4 and Infectious Disease Diversity. Nat Rev Microbiol. 2005;3(1):36-46.
[https://doi.org/10.1038/nrmicro1068]

-
M Bhatia, S Moochhala. Role of Inflammatory Mediators in the Pathophysiology of Acute Respiratory Distress Syndrome. J Pathol. 2004;202:145-56.
[https://doi.org/10.1002/path.1491]