항암화학요법 유발 말초신경병증에 대한 봉독 약침 요법의 효과 및 기전에 대한 실험연구 고찰
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Chemotherapy-induced peripheral neuropathy (CIPN) is one of the most common dose-limiting side effects of neurotoxic chemotherapeutic agents that lead to decreased quality of life and dose reduction, delay or even cessation of treatment. The purpose of this systematic review is to evaluate the effect and the underlying mechanisms of bee venom (BV) pharmacopuncture therapy for CIPN in animal models. We searched for the available experimental literature using BV for CIPN through the Pubmed databases. Ten experimental studies were finally included in this review. In the oxaliplatin or paclitaxel-induced CIPN animal model, BV significantly relieved pain caused both mechanical and cold stimulation. It was suggested that the effect of BV is mediated by the stimulation effect of spinal α1- and α2-adrenergic receptors as a potential mechanism. In the future, more experimental studies are needed.
Keywords:
Chemotherapy-induced peripheral neuropathy, Bee venom, Pharmacopuncture, Experimental research, Review서 론
항암화학요법 유발 말초신경병증(chemotherapy-induced peripheral neuropathy, CIPN)은 platinum, taxane, vinca alkaloids 계열을 포함한 여러 항암화학요법제의 신경 독성으로 인해 발생하는 주된 용량 제한적 부작용으로1), CIPN의 유병률 (prevalence)을 살펴보기위해 4000명 이상의 환자를 포함한 국외의 보고에 따르면 일반적으로 항암제를 투여 받는 환자의 68.1%에서 발생하여 6개월이후에도 30%가 지속된다고 알려져 있으며2), 암이 국민 사망원인 1위인 우리나라에서도 많은 암 환자들이 가장 다빈도로 겪는 항암제 부작용 중 하나이다. CIPN의 경우 ‘glove and stocking’ 양상으로 대표되는 양 손과 발의 신경병성 통증을 포함하는 감각장애를 비롯하여 감각, 운동, 자율신경 영역에서 다양한 증상을 호소하는데, 항암화학요법 중 또는 치료 수주에서 수개월 후에 발생할 수 있으며, 화학요법 종료 후 회복되는 경우도 있지만, 많은 경우에 있어 비가역적이며 수 년, 혹은 영구적으로 지속될 수 있다3).
기존에 항암화학요법 유발 말초신경병증의 예방 및 치료를 위해 gabapentin, pregabalin, duloxetine, Ca/Mg, Vitamin E, glutathione, amifostine, amitriptyline 등이 임상적으로 사용되고 있으나 아직 일관된 효과에 대해서는 논란의 여지가 있으며, 2020년에 업데이트된 ASCO (American Society of Clinical Oncology) guideline에서도 현재 예방에 대해 추천되는 약제는 없고4), 치료 관련해서도 duloxetine이 유일하게 통증성 CIPN에 근거가 있는 약물이지만 그 임상적 효과의 크기에 대해서는 제한적인 면이 있음을 보고하고 있다4). 그러나 CIPN으로 인한 증상이 지속되는 경우 환자의 일상생활 및 삶의 질을 저해할 뿐만 아니라, 항암치료의 용량을 감량하거나 지연, 중단하게 되는 등 치료 효과에도 영향을 미치게 되므로3), 단순한 부작용이 아니라 신경병증에 대한 적극적인 평가와 현재 치료의 한계를 해결하기 위한 새로운 치료 방법이 지속적으로 요구되는 상황이다.
봉독 약침 요법 (bee venom pharmacopuncture therapy)은 melittin, apamin, adolapin 등의 펩티드, phospholipase A2 (PLA2), hyaluronidase 등의 효소 등 40여 성분으로 구성된 봉독을 추출 및 정제 가공하여 환부 및 질병과 관련된 경혈에 주입하는 한의학적 치료방법으로, 근골격계 질환 및 통증5), 염증성 질환6), 자가면역 질환7) 뿐 아니라 다양한 암 종 및 관련한 수반 증상 등의 임상 질환에서 활용되고 있으며8), 이 중 CIPN에 대해서도 임상적 효과가 일부 보고된 바 있다9-11). 그러나 그 치료 기전에 대해서는 명확하게 밝혀지지 않았으며, 현재 CIPN에 대한 봉독의 기전 탐색을 위한 실험 논문에 대한 리뷰는 보고된 바가 없다.
따라서 본 연구에서는 암 환자들이 다빈도로 호소하는 난치성 증상 중 하나인 항암화학요법 유발 말초신경병증 동물 모델에서 봉독 약침 요법을 시행한 국외 SCI급 저널에 보고된 실험 논문을 고찰하여, 봉독 약침 요법의 실험실적 근거 및 치료 기전을 탐색하고, 향후 실험 및 임상 연구의 기초 자료를 제공하고자 한다.
연구대상 및 방법
1. 문헌 수집 및 검색 전략
국외 저널에 게재된 봉독 관련 실험 연구 문헌들의 포괄적 검색을 위해 Pubmed (www.pubmed.com) 데이터베이스를 중심으로 체계적인 검색을 시행하였다. 출간 연도에 제한을 두지 않고, 검색을 수행한 2020년 8월 10일까지 검색 데이터베이스에서 제공하는 모든 문헌을 포함하였으며, 검색어는 질환 관련하여 antineoplastic agents, neoplasms, peripheral nervous system disease 등 MeSH term과 중재 관련하여 bee venoms, apitherapy, melitten, phospholipases A2 등의 MeSH term 및 title, abstract에서 chemotherapy induced peripheral neuropathy, neuralgia, allodynia, venom, pharmacopuncture 등의 해당 검색어를 가능한 조합으로 변형 적용하여 문헌 검색을 수행하였다.
2. 분석 대상 논문의 선정
문헌의 선택 배제는 사전에 정한 기준에 따라 두명의 연구자 (KJH, KBI)가 독립적으로 수행하였는데, 출간 언어의 제한을 두지 않고, in vivo 및 in vitro를 포함하여 모든 실험실적 연구를 대상으로 하여, 암 종이나 항암화학요법제의 종류 또는 사용한 동물 모델에 상관없이 CIPN을 대상으로 봉독 약침 소재를 활용한 경우 선정하였다. 임상 논문 및 리뷰 논문 등은 제외하였으며, 다만 CIPN에 대한 봉독의 리뷰 논문의 경우, 포함된 연구 목록을 참조하여, 실험 논문의 포함 여부 및 본 연구의 선택 배제 기준 해당 여부를 확인하였다.
3. 데이터 추출 및 분석 방법
최종 선정된 문헌에 대해 전문을 검토하여 사전에 정해진 양식에 따라 추출하였으며, 각 논문의 저자, 출판 연고, 연구 목적, 동물 모델 및 표본수 (sample size), CIPN 유발 항암화학요법제 및 유발 방법, 치료군 및 대조군의 중재 방법, 봉독 약침 요법 관련하여 농도, 치료 횟수, 경혈 등의 세부 사항 및 평가 도구와 추정 기전 들을 포함하였다.
결 과
1. 문헌 선정 결과
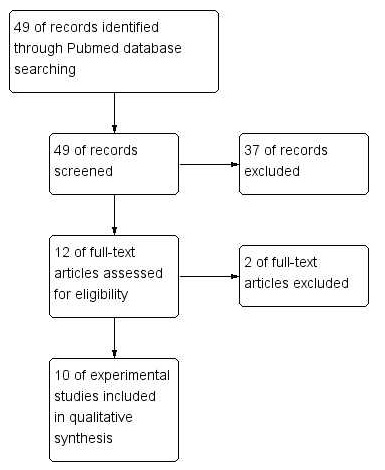
Pubmed 데이터베이스에서 검색식을 통해 총 49편의 논문이 검색되었으며, 제목과 초록을 검토한 1차 선택 배제에서 질환이 CIPN을 대상으로 하지 않았거나, 중재가 봉독이 아닌 사독 등 다른 venom을 처치한 문헌, 실험 연구가 아닌 임상 문헌 등 37편의 문헌을 배제하고, 가능성이 있는 12편의 논문 전문을 확인하여 총 10개의 대상 논문을 선정하였다(Fig. 1).
2. 문헌 분석 결과
최종 선정된 논문10편 모두 한국에서 수행된 연구였으며, 출간 연도별로는 2013년 2편, 2014년 1편, 2015년 2편, 2016년 3편, 2017년 1편, 2019편에 1편이 보고되었다. 게재된 저널은 ‘toxins’가 5편으로 가장 많았고, ‘Biological and Pharmaceutical Bulletin’이 2편, ‘The Journal of Pain’, ‘BMC Complementary and Alternative Medicine’, ‘Evidence-Based Complementary and Alternative Medicine’이 각 1편이었다. 연구 목적으로는 CIPN에 대한 치료 효과를 보고한 연구가 8편이고, 예방적 효과를 보고한 연구가 2편12,13)이었다. 각 논문의 저자 및 게재 년도, 실험에 사용된 동물 종, 동물 주령, 표본수 및 연구 디자인, 적용 중재, 대조군, 평가방법, 주요 결과 등 추출한 핵심 정보들을 정리하여 서술하였다(Table 1).
실험 동물은 rat 또는 mouse가 사용되었는데, 5편의 연구에서 Spargue-Dawley (SD) rat, 5편의 연구에서는 C57BL/6 mouse를 대상으로 하였으며 모두 6-8주령을 사용하였다. 두 실험종 모두 침, 전침 및 약침 등의 실험 연구에서 가장 다빈도로 사용되는 실험종으로 두 종간에서 유의미한 유도방법 및 정도의 차이는 발견되지 않았다. CIPN 유발 약물로는 oxaliplatin이 9편으로 대부분의 연구에서 사용되었고, paclitaxel이 1편14) 있었으며, 유발 방법은 모두 해당 항암화학요법제를 복강으로 단회 투여하여 CIPN을 유발한 것이다. 항암화학요법제의 농도는8편의 연구에서 mouse와 rat등 동물종이나 항암요법 약물에 상관없이 6mg/kg의 용량이 투여되었고, 2편의 논문에서 10 mg/kg의 oxaliplatin이 사용되었다.
치료군 중재로서 가장 다빈도로 활용된 전봉독 (Whole Bee venom, WBV)은 8편의 논문에서 사용되었는데, 한편을 제외하고 모두 Sigma (St. Louis, MO, USA)에서 구입하였고, 0.25~1.0 mg/kg의 용량으로 항암화학요법 3~7일 후 1회 피하투여 되었다. 1편15)에서는 항암화학요법 투여 15일후 1일 1회로 총 18회 피하투여 하여 장기치료 효과를 확인하였다. mellitin은 2편의 논문에서 사용되었는데, Sigma에서 구입하였으며 모두 0.5 mg/kg의 용량으로, 1편에서는 oxaliplatin 처치 3~7일 후 1번 피하투여 하였고, 다른 1편에서는 paclitaxel 처치 10~21일 후 1번 피하투여 하였다. PLA2는 3편의 논문에서 사용되었는데, 모두 Sigma 제품이었고, 1편은 치료효과를 확인하기 위해 palitaxel 10~21일 후 0.12 mg/kg의 용량을 1번 피하투여 하였다. CIPN에 대한 예방효과를 확인하기 위한 2편의 연구에서는 항암화학요법 5일전부터 0.2 mg/kg의 용량을 5번 복강투여 하였다. 연구 목적에 있어 봉독의 CIPN에 대한 치료 효과를 살펴본 8편의 논문에서는 모두 경혈점에 피하투여로 진행되었으며, 치료 경혈로는 ST36 또는 GV3이 사용되었다. 예방 효과를 검증하기 위한 2편의 논문에서는 복강에 투여되었다.
봉독 약침을 중재로 제공한 후 그 효능을 평가하는 방법으로, 치료 또는 예방효과 모두 CIPN유도 후 물리적 자극 또는 한냉 자극에 의한 통각과민반응의 완화 효과를 행동학적 평가(behavioral test)를 통해 분석하는 것으로 진행되었으며, 각 중재방법에 따라 정도의 차이는 있으나 모두 유의한 효과를 보였다. 그 외 기전의 탐색을 위해 전기생리학적 검사 (electrophysiological method)를 병행한 연구가 2편, spinal cord에서 serotonin level을 본 연구가 1편 있었다.
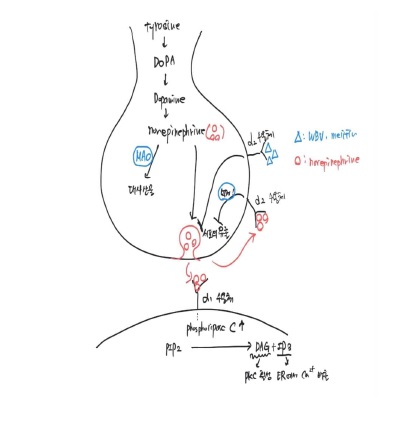
6편의 논문에서 신경전달물질로 통각 상실을 증가시킨다고 알려져 있는 아드레날린 호르몬의 수용체에 대한 작용제로서 기능을 하는지에 대해 살펴보았다. 특히 WBV투여시 항암제 종류, 경혈 및 투여 목적에 관계없이 자가 수용체(autoreceptor)로 불리며 신경섬유의 접합전에 존재하여 신경전달물질(norepinephrine)의 유리를 억제하는 α2 수용체의 작동제로 작용하는 것을 제시하였다. 또한 α2 수용체 길항제를 선처리 한 경우 그 효과가 제한되는 것을 확인하여 봉독이 α2 수용체 작동제로 기능하는 것을 재 확인 하였다. Mellitin 투여시 α1, α2 수용체 작동제로 기능을 제시하였으며, PLA2 투여시 치료는 WBV과 같은 기전으로 중개됨을 보고하였고, 예방 효과의 경우 대식세포의 침윤 및 염증성 싸이토카인의 감소를 기전으로 제시하였다. 또한 WBV과 morphine 병용투여시 오피오이드 (opioid) 수용체 및 세로토닌 수용체(5-HT3)의 작용제로 기능하는 것을 제시하였다(Fig. 2).
고 찰
봉독 약침 요법은 침 치료와 더불어 한의학 임상에서 매우 광범위하게 활용되는 치료 수단으로, 실제 암 환자들에게서 다빈도로 발생하며 삶의 질 및 항암치료의 지속과 치료효과에도 영향을 미칠 수 있는 난치성 증상인 CIPN에 대한 임상적 효과 및 안전성에 대한 근거들이 보고된 바 있다9-11). 최근 보고된 암 환자를 대상으로 봉독 약침 치료를 한 임상 문헌 고찰 연구8)에서 따르면, 포함된 13편의 임상 논문에서 다양한 암종 및 증상에 대해 봉독 치료 후 호전된 결과를 보고하였으며, 이 중 CIPN 관련 논문은 3편에서 보고되었는데, 대부분 case series 형태의 연구들로서 아직 연구 디자인이나 적절한 표본수 등 보다 양질의 임상 근거가 많이 요구되는 실정이다. 봉독 요법은 이미 난소암16), 유방암17), 폐암18,19), 대장암20), 췌장암21), 전립선암22) 등 다양한 암 종에 있어 암세포에 대한 세포독성 기전 및 성장과 증식 억제 기전 등을 통해 항염증 및 항암 효과를 가진다는 실험실적 근거들이 다수 보고되어 있으며, 또한 암성 골통증23), 말초신경병증24) 등과 같은 암 관련 난치성 증상들에 대한 봉독의 통증 조절 및 치료/예방 효과에 대한 연구들도 보고된 바 있다. 이에 본 연구에서는 pubmed 데이터베이스를 중심으로 체계적인 문헌 검색을 통해 현재까지 보고된 CIPN에 대한 봉독의 실험실적 연구들을 고찰하여 그 효과 근거 및 치료 기전을 탐색하고, 향후 실험 및 임상 연구의 기초 자료를 제시하고자 하였다.
본 리뷰에 포함된 논문들에서 사용된 CIPN 동물 모델은 9편이 oxaliplatin, 1편이 paclitaxel로 유발되었는데, 실제 임상에서 platinum계열의 oxaliplatin은 대장암, 직장암 등에 다빈도로 처방되며 신경병성 통증 및 냉이질통 등과 같은 부작용을 흔하게 일으키는 항앙요법화학제이고, taxane계열인 paclitaxel은 난소암, 유방암, 폐암 등의 치료에 단독으로 혹은 병용하여 사용되는 약제로, 이러한 임상 상황을 실험에 반영하여 상기 약제로 유발된 CIPN 모델에 대한 봉독의 효과 및 기전이 제시되었다.
mellitin 및 PLA2는 봉독의 주요성분으로서 약40%, 10%이상의 비중을 차지하며25), 이들의 항염증효과, 통증억제효과, 항산화효과에 대한 연구결과가 보고된 바 있다26,27). 본 연구에 포함된 총 10편의 논문 중 전봉독을 처치한 경우가 8편, melltin을 처치한 경우가 2편, PLA2를 처치한 경우가 3편 확인되었으며, CIPN에 대한 효과 및 그 작용기전에서 유의한 차이는 보이지 않은 것으로 보고되었다. 다만 전봉독과 PLA2가 아드레날린 수용체 (α2)의 작용제로 작동하는 기전만 주로 제시된 반면 melltin은 아드레날린 수용체 (α1α2)의 작용제로 작동하는 기전이 제시되었다. 또한 전봉독은 세로토닌 수용체 (5-HT3) 및 니코틴성 아세틸콜린 수용체 (α4β2) 작용제로서의 기능 또한 규명한 연구가 있었다. 구체적으로는 2014년에 보고된 Lee 등28)의 논문에서는 BV에 의해 serotonin의 발현이 척수에서 직접적으로 증가하는 결과를 보고하였으며, 2016년 보고된 Li 등12)의 논문에서는 PLA2의 CIPN에 대한 예방적 효과를 규명했는데 이는 신경염증을 유발하는 대식세포의 침윤과 염증유발 싸이토카인의 분비를 감소시킨 것을 주요 기전으로 설명하였다. 또한 대식세포의 활성억제는 면역반응을 억제하는 조절T세포 유도에 의한 것임을 제시하였다. 2016년 Kim 등29)의 연구에서는 마약성 진통제인 morphine과 전봉독을 병용투여한 결과 전봉독 단독투여에 비해 통각과민반응의 완화효과가 오래 지속되는 것을 규명하였다. 2017년14)과 2019년24)에 출판된 Choi 등의 연구에서는 각각 전봉독과 melittin투여에 의한 척수신경의 과흥분 (hyperexcitation)을 억제하는 것을 보고하였다.
향후 연구 수행을 위한 제언으로 치료 경혈의 적용에 있어 임상 다빈도 경혈 및 CIPN 기전에 근거한 경혈을 고려해 볼 수 있다. 현재 포함된 연구들에서 ST36 또는 GV3가 사용되었는데, 임상에서 팔풍 팔사혈 등 환부에 가까운 근위부 경혈에 대한 효과도 보고되고 있는 바 이를 적용한 동물모델과 CIPN의 발생 기전을 고려한 치료 및 예방에 대한 경혈의 효과 및 기전이 탐색될 수 있을 것이다. 또한 대부분 봉독을 1회 처치 후 단기 효과를 살펴보았고 1편에서 18회 처치하는 동안의 결과를 확인하여 비교적 장기 효과를 살펴보았는데 이러한 봉독의 장기 효과에 대한 탐색을 통해 실제 임상 치료에 대한 기초 근거를 제공할 수 있을 것이다. 현재 봉독의 기전을 살펴봄에 있어 대부분 아드레날린 혹은 세로토닌 수용체의 길항제 (antagonist)를 선처리하여 봉독의 효과가 제한되는 방식으로 봉독의 작용제로서의 역할을 규명하였으며, 이와 더불어 수용체의 직접작동효과 즉 수용체 매개 하위 시그널에 대한 결과에 대한 탐색을 통해 봉독의 효과에 대한 직접적인 근거를 얻을 수 있을 것이다. 그리고 실제 종양 환경에서 항암화학요법에 의한 말초신경병증을 구현한 동물 모델에서 봉독의 효과 탐색도 고려될 수 있다. 개체 내 종양세포의 증식에 의해서 면역체계, 내분비계 등 다양한 변화가 유발되고 이러한 환경을 반영한 실험 연구 결과를 통해 실제 임상 상황과의 외적 타당도를 높이는 결과를 얻을 수 있을 것이다.
결 론
본 연구는 CIPN에 대한 봉독 약침 요법의 효과 및 기전에 대한 동물실험 연구 동향을 파악하기 위해 데이터베이스 검색을 통해 수집하여 선정된 총 10편의 실험 논문을 분석하였다. 그 결과 oxaliplatin또는 paclitaxel유도 CIPN동물 모델에서 봉독의 유의한 물리적 및 한냉 자극에 의한 통증완화 효과를 확인할 수 있었다. 또한 아드레날린 수용체 길항제를 사용한 기전연구에서 전봉독과 PLA2 투여시 α2 수용체의 자극을 일으키는 작용제로서 효과가 관찰되었고, melittin 투여는 α1, α2 수용체의 자극 효과가 제시되었다. 향후 다양한 임상적용 경혈에 따른 치료 효과의 관찰, 수용체 자극 이후에 발생하는 하위 시그널의 관찰 및 실제 종양환경에서의 CIPN에 대한 봉독의 효과 검증 등의 추가적인 연구가 진행되기를 기대한다.
Acknowledgments
본 연구는 2018년 상지대학교 교내연구비 지원을 받아 수행된 연구입니다.
References
-
Gordon-Williams R, Farquhar-Smith P, Recent advances in understanding chemotherapy-induced peripheral neuropathy. F1000Research, 2020;9.
[https://doi.org/10.12688/f1000research.21625.1]

-
Seretny M, Currie GL, Sena ES, Ramnarine S, Grant R, MacLeod MR, et al. Incidence, prevalence, and predictors of chemotherapy-induced peripheral neuropathy: A systematic review and meta-analysis. Pain, 2014;155(12):2461-70.
[https://doi.org/10.1016/j.pain.2014.09.020]

-
Windebank AJ, Grisold W, Chemotherapy-induced neuropathy. Journal of the peripheral nervous system : JPNS, 2008;13(1):27-46.
[https://doi.org/10.1111/j.1529-8027.2008.00156.x]

-
Loprinzi CL, Lacchetti C, Bleeker J, Cavaletti G, Chauhan C, Hertz DL, et al. Prevention and Management of Chemotherapy-Induced Peripheral Neuropathy in Survivors of Adult Cancers: ASCO Guideline Update. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 2020:Jco2001399.
[https://doi.org/10.1200/JCO.20.01399]

- Lee JY, Kang SS, Kim JH, Bae CS, Choi SH Inhibitory effect of whole bee venom in adjuvant-induced arthritis. In vivo (Athens, Greece), 2005;19(4):801-5.
-
Son DJ, Lee JW, Lee YH, Song HS, Lee CK, Hong JT. Therapeutic application of anti-arthritis, pain-releasing, and anti-cancer effects of bee venom and its constituent compounds. Pharmacology & therapeutics, 2007;115(2):246-70.
[https://doi.org/10.1016/j.pharmthera.2007.04.004]

-
Lee JA, Son MJ, Choi J, Jun JH, Kim JI, Lee MS. Bee venom acupuncture for rheumatoid arthritis: a systematic review of randomised clinical trials. BMJ open, 2014;4(11):e006140.
[https://doi.org/10.1136/bmjopen-2014-006140]

-
Kim J-H, A clinical literature review and research-trends analysis of bee venom pharmacopuncture for cancer patients. Journal of Korean Medicine, 2020;41(3):247-59.
[https://doi.org/10.13048/jkm.20038]

- Park B, Kim J, Cho C, Shin S, Yoo H. Effect of Bee Venom Ointment Treatment for Chemotherapy-induced Peripheral Neuropathy : A Case Series. 2014;22(2):111-7.
-
Park J-W, Jeon J-H, Yoon J, Jung T-Y, Kwon K-R, Cho C-K, et al. Effects of sweet bee venom pharmacopuncture treatment for chemotherapy-induced peripheral neuropathy: a case series. Integrative cancer therapies, 2012;11(2):166-71.
[https://doi.org/10.1177/1534735411413265]

-
Jeungwon Yoon, Ju-Hyun Jeon, Yeon-Weol Lee, Chong-Kwan Cho, Ki-Rok Kwon, Ji-Eun Shin, et al. Sweet Bee Venom Pharmacopuncture for Chemotherapy-Induced Peripheral Neuropathy. Journal of Acupuncture and Meridian Studies, 2012;5(4):156-65.
[https://doi.org/10.1016/j.jams.2012.05.003]

-
Li D, Kim W, Shin D, Jung Y, Bae H, Kim SK. Preventive Effects of Bee Venom Derived Phospholipase A₂ on Oxaliplatin-Induced Neuropathic Pain in Mice. Toxins, 2016;8(1).
[https://doi.org/10.3390/toxins8010027]

-
Li D, Lee Y, Kim W, Lee K, Bae H, Kim SK. Analgesic Effects of Bee Venom Derived Phospholipase A(2) in a Mouse Model of Oxaliplatin-Induced Neuropathic Pain. Toxins, 2015;7(7):2422-34.
[https://doi.org/10.3390/toxins7072422]

-
Choi J, Jeon C, Lee JH, Jang JU, Quan FS, Lee K, et al. Suppressive Effects of Bee Venom Acupuncture on Paclitaxel-Induced Neuropathic Pain in Rats: Mediation by Spinal α₂-Adrenergic Receptor. Toxins, 2017;9(11).
[https://doi.org/10.3390/toxins9110351]

-
Yeo JH, Yoon SY, Kwon SK, Kim SJ, Lee JH, Beitz AJ, et al. Repetitive Acupuncture Point Treatment with Diluted Bee Venom Relieves Mechanical Allodynia and Restores Intraepidermal Nerve Fiber Loss in Oxaliplatin-Induced Neuropathic Mice. The journal of pain : official journal of the American Pain Society, 2016;17(3):298-309.
[https://doi.org/10.1016/j.jpain.2015.10.018]

-
Jo M, Park MH, Kollipara PS, An BJ, Song HS, Han SB, et al. Anti-cancer effect of bee venom toxin and melittin in ovarian cancer cells through induction of death receptors and inhibition of JAK2/STAT3 pathway. Toxicology and applied pharmacology, 2012;258(1):72-81.
[https://doi.org/10.1016/j.taap.2011.10.009]

- Ip SW, Liao SS, Lin SY, Lin JP, Yang JS, Lin ML, et al. The role of mitochondria in bee venom-induced apoptosis in human breast cancer MCF7 cells. In vivo (Athens, Greece), 2008;22(2):237-45.
-
Gajin Han, Haegue Shin, Sin Seong, Kim S, Systematic Review of Case Reports about Korean Medicine for Lung Cancer. J Korean Med, 2018;39(4):136-57.
[https://doi.org/10.13048/jkm.18041]

-
Jeong YJ, Park YY, Park KK, Choi YH, Kim CH, Chang YC. Bee Venom Suppresses EGF-Induced Epithelial-Mesenchymal Transition and Tumor Invasion in Lung Cancer Cells. The American journal of Chinese medicine, 2019;47(8):1869-83.
[https://doi.org/10.1142/S0192415X19500952]

-
Zheng J, Lee HL, Ham YW, Song HS, Song MJ, Hong JT, Anti-cancer effect of bee venom on colon cancer cell growth by activation of death receptors and inhibition of nuclear factor kappa B. Oncotarget, 2015;6(42):44437-51.
[https://doi.org/10.18632/oncotarget.6295]

-
Wang X, Li H, Lu X, Wen C, Huo Z, Shi M, et al. Melittin-induced long non-coding RNA NONHSAT105177 inhibits proliferation and migration of pancreatic ductal adenocarcinoma. Cell death & disease, 2018;9(10):940.
[https://doi.org/10.1038/s41419-018-0965-3]

-
Park MH, Choi MS, Kwak DH, Oh KW, Yoon DY, Han SB, et al. Anti-cancer effect of bee venom in prostate cancer cells through activation of caspase pathway via inactivation of NF-κB. The Prostate, 2011;71(8):801-12.
[https://doi.org/10.1002/pros.21296]

-
Ryu HK, Baek YH, Park YC, Seo BK. Current studies of acupuncture in cancer-induced bone pain animal models. Evidence-based complementary and alternative medicine : eCAM, 2014;2014:191347.
[https://doi.org/10.1155/2014/191347]

-
Choi S, Chae HK, Heo H, Hahm DH, Kim W, Kim SK. Analgesic Effect of Melittin on Oxaliplatin-Induced Peripheral Neuropathy in Rats. Toxins, 2019;11(7).
[https://doi.org/10.3390/toxins11070396]

-
Moreno M, Giralt E. Three valuable peptides from bee and wasp venoms for therapeutic and biotechnological use: melittin, apamin and mastoparan. Toxins, 2015;7(4):1126-50.
[https://doi.org/10.3390/toxins7041126]

-
Ceremuga M, Stela M, Janik E, Gorniak L, Synowiec E, Sliwinski T, et al. Melittin-A Natural Peptide from Bee Venom Which Induces Apoptosis in Human Leukaemia Cells. Biomolecules, 2020;10(2).
[https://doi.org/10.3390/biom10020247]

-
Lee G, Bae H. Anti-Inflammatory Applications of Melittin, a Major Component of Bee Venom: Detailed Mechanism of Action and Adverse Effects. Molecules (Basel, Switzerland), 2016;21(5).
[https://doi.org/10.3390/molecules21050616]

-
Lee JH, Li DX, Yoon H, Go D, Quan FS, Min BI, et al. Serotonergic mechanism of the relieving effect of bee venom acupuncture on oxaliplatin-induced neuropathic cold allodynia in rats. BMC complementary and alternative medicine, 2014;14:471.
[https://doi.org/10.1186/1472-6882-14-471]

-
Kim W, Kim MJ, Go D, Min BI, Na HS, Kim SK. Combined Effects of Bee Venom Acupuncture and Morphine on Oxaliplatin-Induced Neuropathic Pain in Mice. Toxins, 2016;8(2):33.
[https://doi.org/10.3390/toxins8020033]

-
Yoon H, Kim MJ, Yoon I, Li DX, Bae H, Kim SK. Nicotinic Acetylcholine Receptors Mediate the Suppressive Effect of an Injection of Diluted Bee Venom into the GV3 Acupoint on Oxaliplatin-Induced Neuropathic Cold Allodynia in Rats. Biological & pharmaceutical bulletin, 2015;38(5):710-4.
[https://doi.org/10.1248/bpb.b14-00797]

-
Lim BS, Moon HJ, Li DX, Gil M, Min JK, Lee G, et al. Effect of bee venom acupuncture on oxaliplatin-induced cold allodynia in rats. Evidence-based complementary and alternative medicine : eCAM, 2013;2013:369324.
[https://doi.org/10.1155/2013/369324]

-
Yoon SY, Yeo JH, Han SD, Bong DJ, Oh B, Roh DH. Diluted bee venom injection reduces ipsilateral mechanical allodynia in oxaliplatin-induced neuropathic mice. Biological & pharmaceutical bulletin, 2013;36(11):1787-93.
[https://doi.org/10.1248/bpb.b13-00469]