
흰쥐에서 고용량 아질산이온 함유 마늘 발효농축액에 의한 뇌혈류 변화
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Nitrate–nitrite–nitric oxide (NO) pathway is a major alternative source of NO and is essential for NO - dependent physiological functions in body. Food supplements having nitrate/nitrite can improve metabolic syndromes including hypertension through antioxidant activity or vasodilation. The purpose of this study was to observe the effects of fermented garlic (F. garlic) having high concentration of NO2- on changes in blood flow and nitric oxide synthesis in the cerebral cortex of rodents. The generation of nitric oxide detected by a chemi-luminescence detector was higher in F. Garlic compared with NaNO2 solution under artificial gastric juice with pH 2.0. Ether F. garlic or NaNO2 diluted with artificial cerebrospinal fluid was directly applied into around the needle probe of laser Doppler flow meter that was located on epidural surface of the cortex. Direct application of F. garlic resulted in increase of cerebral blood flow detected by a laser Doppler flow meter with a dose-dependent manner. Compared with NaNO2 solution, F. garlic produced changes in cerebral blood flow at lower concentration of NO2-. Pretreatment of methylene blue, a guanylyl cyclase inhibitor prevented upregulation of cerebral blood flow by the treatment of F. garlic. In addition, the application of F. garlic with 250, 500ppm of NO2- caused significantly the production of NO in the cortical tissue but NaNO2 solution with 500ppm of NO2- did not. In summary, these results suggested that F. garlic with high content of NO2- induce increase in cerebral blood flow through nitric oxide-dependent signal pathway.
Keywords:
Nitrite, Nitric oxide, Cerebral blood flow, Garlic, Fermentation서 론
산화질소(NO, nitric oxide)는 반감기가 3초로 매우 짧은 기체분자이며 혈관 확장작용, 신경전달물질 및 면역기능에 관여하여 인체의 항상성(homeostasis) 유지에 중요한 역할을 한다1). 신체에서 NO의 생성이상은 심혈관계 질환, 호흡기계 질환, 혈소판 기능장애, 면역기능 장애, 성기능장애 등 여러 질병들의 병리기전에 영향을 준다1,2). 신체에서의 NO 생성은 일반적으로 신경세포, 혈관내피세포 및 지방세포 등에서 L-arginine 아미노산에서 NO 합성효소에 의해 이루어진다. NO는 매우 불안정한 기체로 산화되어 아질산이온(nitrite, NO2-)으로 변화되고 이는 다시 질산이온(NO3-)으로 쉽게 전환된다. 반대로 NO2- 및 NO3-은 NO의 전 단계 물질로 환원반응을 거쳐 NO로 변환될 수 있다3,4). 따라서 NO2-은 NO의 전구체 또는 대사체(metabolite)로 알려져 있고 인체 혈액에서 NO2-의 농도는 NO 농도를 반영한다.
최근 NO2- 섭취 시 위(胃)에서 NO 가 생성되어 혈압을 낮추며, 정맥투여 시 항산화 효과를 보여 허혈성 심장 및 뇌손상에 보호 효과가 알려졌다5,6). 또한, NO2- 투여가 혈관내 NO 효능을 상승시키는 효과가 있음을 보였다7). 실험동물에서 NO2-/NO3- 섭취 제한을 하였을 때 대사성 질환들이 초래되어 음식을 통한 NO2-/NO3- 섭취가 생명유지에 중요함이 밝혀졌다8).
Chun(2016)은 마늘을 고초균(bacillus subtilis)으로 액상상태에서 1~2개월 간 발효하였을 NO 대사체인 NO2-을 장시간 일정한 농도로 유지하는 NO 대사체를 생성·고정화하는 기술을 개발하였다9). 인공위액조건(pH<2)에서 마늘발효액으로부터 NO가 6시간 이상 생성되었는데10), 이는 NO2-가 산성조건(pH<5)에서 NO가 되는 화학적 반응을 고려하였을 때3) 인공위액조건에서 NO2-가 NO로 전환되는 것을 의미한다.
마늘의 효능은 항균활성, 항암, 항혈전성, 혈압강하, 콜레스테롤 저하, 노화방지 작용 및 항산화 등이 대표적이다11,12). 마늘 성분의 특징은 유기황화합물의 함량이 많으며 이는 독특한 향을 제공하고 이들의 99.5%는 황 함유 아미노산인 cysteine 아미노산을 함유하고 있다12). 마늘의 황화합물은 반응성 산소종(reactive oxygen species)을 제거하여 단백질, 지질의 산화를 억제하여 항산화 효과가 우수하다. 또한 항산화 효과를 보이는 다양한 페놀 화합물과 플라보노이드가 존재한다13). 한편 마늘의 항산화 능력은 마늘의 숙성 온도가 높을수록, 숙성 기간이 경과할수록 증가하는 데 마늘의 숙성 온도가 높을수록 페놀 화합물과 플라보노이드 함량의 증가에 기인한다.
Park 등(2016)은 고혈압 쥐에서 NO2- 함유 마늘 발효액의 경구 투여 시 30분 이내에 용량 의존적으로 혈압이 감소하고, 10일 이상 장기 투여한 경우 지속적 혈압 감소를 보였으며 동맥에서 NO의 활성화를 보였다고 하였다14). 또한 monocrotaline 유도 폐고혈압 모델에서 3주 동안 NO2- 함유 마늘 발효액 경구 투여 시 폐에서 NO관련 신호전달계의 활성이 유도되었다고 하였다14). 시험관에서 심장에 허혈/재관류 손상을 초래했을 때 NO2- 함유 마늘 발효액 처치군에서 재관류동안 심장에서 산소분압이 유의하게 증가됨이 보고 되었다15).
그러나 뇌 혈류에 대한 연구는 진행되지 않아 본 연구에서는 대뇌 피질에서 NO 발생 및 뇌 혈류 변화에 대한 NO2- 함유 마늘 발효액과 NaNO2을 대뇌 피질 경막에 직접 투여하여 비교 관찰하였다.
재료 및 방법
1. 실험동물
Sprague-Dawley계 수컷 쥐(~250g)(n=20)(Samtako, Osan, Korea)를 실험동물로 사용하였으며, 실험 1주일 전부터 실험실 환경에 적응시켜 환경변화에 따른 영향을 최소화하였다. 모든 동물실험은 원광대학교 실험동물관리위원회 규정에 의거하여 시행하였다(WKU20-29). 사육실의 평균온도는 22 ± 1℃, 습도는 55%로 유지하였으며 12시간 간격으로 조명을 조절하였고, 물 섭취는 제한하지 않았다. 실험군은 마늘 발효액 투여군 (n=10)과 NaNO2 투여군 (n=10)으로 구분하였다.
2. 마늘 발효액의 제조 및 투여
본 연구에서 사용한 마늘 발효액은 휴먼에노스사(Wanju-gun, Korea)에서 공급받았으며, Park 등(2016)이16) 사용한 마늘발효액과 동일한 제조과정을 거쳐서 만들었다. 대략적인 제조과정은 생마늘의 껍질을 제거한 다음 세척하여 멸균하고 분쇄기로 분쇄하여 24시간 후에 물에 일정한 비율로 희석한다(1:9 (w/v)). 이 후 활성화된 고초 균주를 넣고 37℃ 환경에서 1개월 동안 호기 발효하였다. 발효액에 NO2-을 측정하여 150ppm 이상 농도에 도달 하였을 때 발효를 중단하였다. 원심분리기로 부유물로부터 상층액을 분리하여 농축기를 이용하여 아질산이온의 농도가 2,000 ppm 이상이 되도록 마늘발효액을 농축하였다.
3. 마늘 발효액 및 NaNO2 용액에서 아질산 이온 및 NO 측정
Griess 시약을 이용한 Nitrate/Nitrite Colorimetric Assay Kit (Cayman Chemical Co., Ann Arbor, USA)를 이용하여 발효액에서 NO2-을 정량하였다. 반응액과 동일한 양의 Griess 시약[2.5%(v/v) phosphoric acid, 1%(w/v) sulfanilamide, 0.1%(w/v) naphylethylenediamine]을 첨가하였다. 실온에서 10분 동안 반응시킨 후 흡광분도계 (Ultrospec 2100Pro, Amersham Phamacia Biotech, Cambridge, UK)을 이용하여 540 nm에서 흡광도를 측정하였다. 마늘발효액의 NO2-양을 정량하기 위하여 표준물질로 NaNO2 (Sigma, USA)을 증류액에 희석한 다음, 희석된 NaNO2 용액과 Griess시약을 반응 후 흡광분도계로 흡광도를 측정하여 표준곡선을 산출한 다음 마늘 발효액의 흡광도 값을 적용하여 NO2-을 정량하였다.
마늘발효액 또는 NaNO2로부터 NO의 방출 특성의 측정은 Shin 등(2007)17)의 연구방법을 적용하였다. NO의 방출을 위해 pH가 낮은 조건에서 NO2-이 수소와 결합하고 이후 NO로 전환되는 원리를 적용하였다6). 신체의 위산(gastric acid) 조건에서 NO의 방출을 확인하기 위하여 인공 위액 (pH 2, 0.05 M HCl, 75 mM NaCl, 13 mM KCl, 37℃) 1L를 제조하고 마늘 발효액과 NaNO2 1 ml을 각각 주입하였다. 화학반응에 의해 방출되는 NO는 화학발광법 분석기 (Sievers 280 Nitric Oxide Analyzer; Boulder, CO, USA)를 이용하여 측정하였다. 장비의 검정은 NO zero filter와 24.1 ppm NO 표준기체 (balance N2)를 이용하였으며, 방출된 NO의 장비로의 운반 기체는 N2, 운반속도는 80 mL/min으로 조정하였다. 각 시료의 NO 발생량(µmol), 최대발생 후 발생량이 1/2 감소하는 시간(t1/2), 최대 발생시점(tm), 및 [NO]/[NO2-] (%)을 측정하였다. 각 시료를 3회 측정하여 각 지표의 평균값을 산출하였다.
4. 대뇌피질에서 국소 혈류 및 산화질소(NO) 측정
실험동물을 urethane(750 mg/kg, i.p.)으로 마취시키고 체온유지 장치를 이용하여 체온을 37 ~ 38 ℃ 로 유지할 수 있도록 하였다. 두부를 뇌정위장치(Narishige Co., Tokyo, Japan)에 고정시키고 정중선을 따라 두피를 절개하여 두정골을 노출시킨 후 수술현미경하에서 미세 전동드릴을 이용하여 정수리(bregma)의 4 ~ 6 mm 측방, -2 ~ 1 mm 전방에 직경 5 ~ 6 mm의 크기로 두정골 절개(craniotomy)를 실행하였다. 이때 두정골의 두께를 최대한 얇게 남겨 경막외 출혈을 방지토록 하였다. 대뇌피질의 국소 뇌혈류량의 측정은 레이저도플러 혈류계(Laser-Doppler flowmeter system, Moor Instrument, London, UK)를 이용하였다18). 혈류계의 탐침봉(needle probe, 직경 0.8 mm)을 미세전동조작기(Narishige Co., Tokyo, Japan)를 이용하여 두정엽 피질 표면에 수직이 되도록 대뇌피질에 근접시켰으며 이때 현미경하에 큰 혈관들이 없는 곳에 위치하였다.
일정시간 동안 안정상태에서 국소 뇌 혈류를 기록한 다음 마늘 발효액 및 NaNO2 용액을 인공뇌척수액 (NaCl 126, KCl 5, KH2PO4 1.3,MgSO4 1.3, CaCl2 2.4, NaHCO3 26, dextrose 10 (mol/L))에 희석하여 100 ㎕를 혈류계의 탐침봉이 위치한 경막에 투여하고 30분 동안 각각 변화되는 국소 뇌혈류량(regional cerebral blood flow, rCBF)을 측정하였다. 한편 레이저도플러 혈류계에서 발생한 혈류에 대한 전기신호를 A/D 변화기(CED 1401, Cambridge Research, London UK)로 디지털화하고, 디지털 신호를 기록 및 분석 프로그램(Spike2 version 4, Cambridge Research Ltd, London UK)에 저장하였다. 각 실험군에서 흰쥐 5마리를 대상으로 하였으며 매 실험동물을 측정할 시료들을 농도별(32.5, 65, 150, 250, 500, 1000 ppm)로 1회만 투여하여 뇌 혈류를 측정하고 그 평균값을 평균 국소 뇌 혈류량으로 하였다.
한편 NO의 세포내 신호전달계가 마늘 발효액의 효과에 영향을 미치는 지 확인하기 위하여 cyclic GMP의 생성효소인 guanylyl cyclase 억제제인 methylene blue (Sigma, USA)을 생리식염수에서 3 mg/ml로 희석하여 3 mg/kg의 농도로 꼬리정맥 내에 투여한 다음 마늘 발효액(500, 1000 ppm)과 NaNO2 용액(500, 1000 ppm)을 투여한 다음 피질 혈류의 변화를 기록하였다. 한편 마늘 발효액과 NaNO2 용액의 투여 방식과 다르게 methylene blue을 정맥으로 투여한 것은 methylene blue 정맥투여에 의해 혈관내 NO 신호전달계를 억제한 다는 선행연구결과에 근거하였다19).
대뇌피질에서 NO 농도를 측정하기 위하여 실험동물을 마취시킨 후 두부를 뇌정위 고정장치에 고정하고 두피를 제거하여 두정골을 노출 시켰다. 수술현미경하에서 미세전동드릴로 두정골을 제거 후 대퇴피질의 경막을 미세수술가위로 절개하여 피질을 노출하였다. 미세전동조작기(Narishige Co., Tokyo, Japan)을 이용하여 NO 센서 유리전극(15-20 µm, tip diameter; NO-15, Unisense, Aarhus, Denmark)을 대뇌피질에 삽입하였고 이때 깊이는 0.1 mm 안쪽에 전극을 삽입하였다. 이때 제조사에 따르면 센서 유리전극은 NO가 2~3 nM 농도의 변화를 측정할 수 있는 민감도를 가지고 있다. 센서에서 발행한 미세전류는 4채널 신호증폭기(Fx-5, UniAmp MultiChannel Systems, Unisense, Aarhus, Denmark))로 전류를 증폭한 다음 신호증폭기에 내장된 A/D 변환 장치를 이용하여 신호를 디지털화하고 컴퓨터에 설치된 기록 프로그램(SensorTrace Suite, Unisense, Aarhus, Denmark)으로 센서의 전류 변화량을 기록, 저장하였다. 30분 이상 안정 상태에서 NO 신호를 기록한 다음 유리전극이 위치하고 있는 곳에 100 µl의 마늘 발효액(250, 500 ppm) 또는 NaNO2 용액(500 ppm)을 투여한 다음 NO의 변화를 관찰 하였다(Fig. 1). 각 실험군에서 흰쥐 3마리를 대상으로 하였으며 매 실험동물을 측정할 시료들을 농도별로 1회만 투여하여 NO 변화를 측정하였다.

A photographs showing the insertion of a glass sensor with 20μm of diameter for nitric oxide (NO) and needle probes with 0.1mm of diameter for laser Doppler flow meter on the cerebral cortex of rat. The glass sensor was located in the cortex with 0.6 mm of depth from cortical surface. The needle probes were located on the dura surface of the cortex.
5. 실험결과 분석 및 통계
마늘 발효액과 NaNO2 의 투여에 의한 혈류 변화량은 투여 전 10분 동안 기록된 혈류의 변화에 의한 신호(전압) 변화값의 평균값을 산출하여 기저값(baseline, 100%)으로 정하였다. 마늘 발효액 및 NaNO2의 투여로 혈류량이 최대로 변화하는 1분 동안의 신호 변화값의 평균값을 산출하였다. 혈류의 최대 변화량은 기저값 기저에 대한 최대 변화 평균값을 퍼센트로 표현하였다. 또한 발효액 및 NaNO2 투여에 의한 NO의 변화량도 혈류 변화량과 같은 방식으로 분석하였다.
마늘 발효액과 NaNO2 투여 간에 혈류 및 NO 변화는 Mann-Whitney U test를 통하여 통계분석을 실시하였으며 실험군 간의 통계적 유의성은 p 값이 0.05 이하로 간주하였다.
결 과
1. 인공 위액 조건에서 마늘발효액의 NO 생성
인공 위액 조건에서 화학발광 분석기법을 이용하여 마늘 발효액 또는 NaNO2 로부터 NO의 방출 특성을 측정하였다. NO2- 농도가 14.5 ± 0.1 µmol의 NaNO2을 인공 위액에 투여하였을 때 투여 직후 NO 발생이 가장 많았으며 이후 시간이 지나면서 감소하는 경향을 보였다(Fig. 2). 이때 총 NO 발생량은 6.09 ± 1.4 µmol, 최대 발생시점(tm)은 2.75 ± 0.6 min, [NO]/[NO2-] 비율은 42 ± 7.6%로 측정되었다. 한편 NO2- 농도가 4.5 ± 0.3 µmol의 마늘 발효액을 인공위액에 투여하였을 때 NO 발생량은 8.89 ± 2.5 µmol, 최대 발생시점(tm)은 4.25 ± 0.4 min, [NO]/[NO2-] 비율은 97 ± 15.3%로 측정되었다(Table 1). 따라서 [NO]/[NO2-] 비율은 마늘 발효액과 NaNO2 사이에 통계적 유의성을 보였으며(p<0.01), 마늘 발효액이 위산조건에서 NO를 잘 발생시켰다(Table 1).
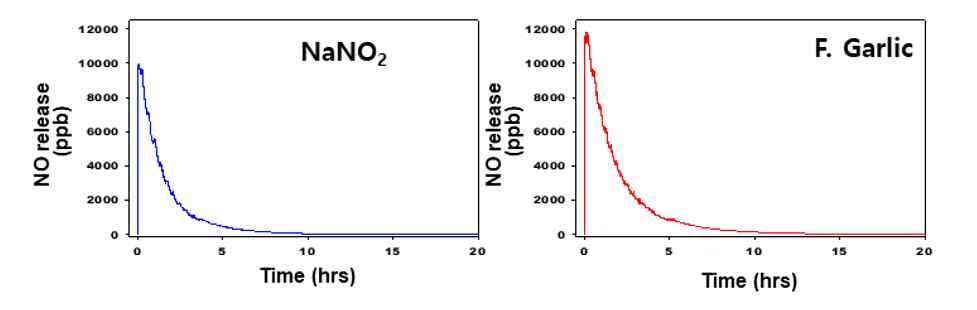
Time-dependent changes in production of NO detected by a chemiluminescence detector from NaNO2 solution with 15 μmol of NO2- and F. Garlic with 5 μmol of NO2 under artificial gastric juice with under pH 2.0, respectively.
2. 마늘 발효액에 의한 대뇌피질 혈류량 변화
마늘 발효액의 NO2- 량을 32.5 ppm, 65 ppm 150 ppm, 250 ppm, 500 ppm, 1,000 ppm 농도로 인공뇌척수액에 희석하여 희석된 마늘 발효액을 100 ㎕ 용량으로 탐침봉이 위치한 대뇌피질 경막에 투여하였다. 32.5 ppm 농도의 마늘 발효액에서 피질 혈류에 유의한 변화가 없으며 65~125 ppm 마늘 발효액 투여 시 5분 이후부터 뇌 혈류가 약간 증가하는 경향을 보였으나 통계적으로 유의한 차이가 없었다. 한편 250 ppm에서 3분 이후부터 뇌 혈류가 증가하기 시작하여 30분 이내에 최대로 증가하고 이후 감소하였으며 이때 최대 혈류증가 정도는 기저치 값보다 109.5 ± 3.2% 였다. 500 ppm 마늘 발효액 투여 시 250 ppm 투여보다 국소 뇌 혈류량이 현저하게 증가하였으며, 이때 투여 15분 이내에 최대값으로 증가하였고 118.5 ± 4.8%로 기저치에 비해 유의하게 증가되었다(p<0.05). 1,000 ppm 마늘 발효액 투여 시 500 ppm 마늘 발효액 투여보다 증가하였으며 이때 2분 이내에 증가하여 128.4 ± 4.0% 최대값으로 유의한 증가를 보였다(p<0.01) (Fig. 3, 5).
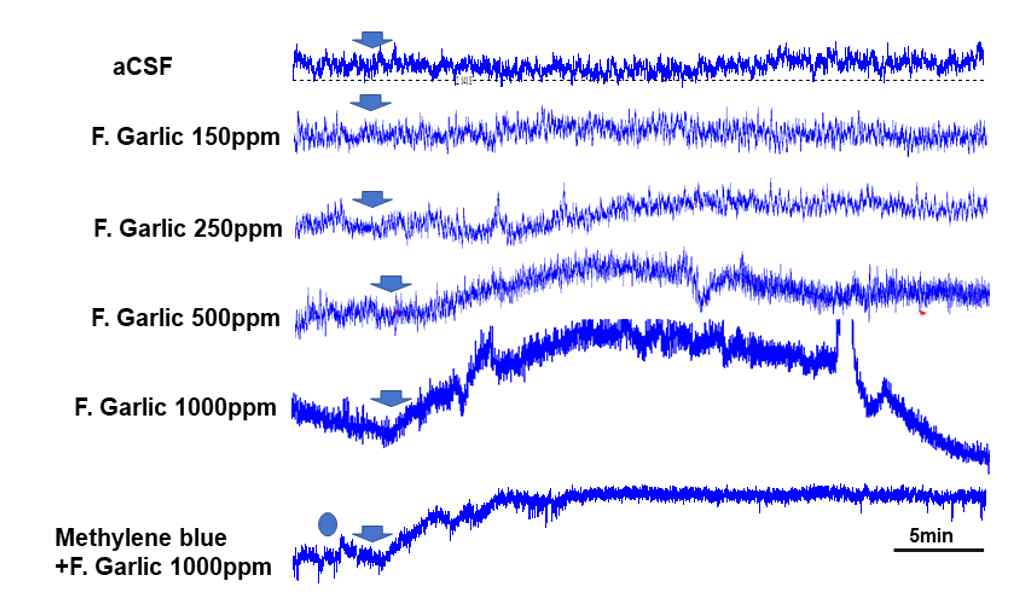
Representative diagrams showing changes of blood flow recorded by a laser Doppler flow meter from cerebral cortex following the direct application of F. garlic diluted with artificial cerebrospinal fluid (aCSF) with different dose of NO2- into cortical surface. Arrow head indicates the time point of F. garlic treatment and a dot treatment of methylene blue, a guanylyl cyclase inhibitor.
한편 NaNO2을 125 ppm, 250 ppm, 500 ppm, 1,000 ppm 농도로 인공뇌척수액에 희석하여 100µl NaNO2 희석액을 대뇌피질에 투여하였다. 150 ppm 과 250 ppm NaNO2 투여 시 대뇌피질의 국소 뇌 혈류량의 증가가 관찰되지 않았으며, 피질 혈류가 500 ppm투여시 107 ± 3.7%, 1,000 ppm NaNO2 투여시 115.3 ± 3.3% 증가하였다. 한편 250 ppm, 500 ppm, 1,000 ppm 농도에서 마늘 발효액과 NaNO2 간에 국소 뇌 혈류량에 통계적 유의성을 보여 마늘 발효액이 NaNO2 보다 더 많은 혈류 증가를 초래하였다(p<0.05, 0.01)(Fig. 4, 5).

Representative diagrams showing changes of blood flow recorded by a laser Doppler flow meter from cerebral cortex following the direct application of NaNO2 diluted with aCSF with different dose of NO2- into cortical surface. Other notations are the same as the previous figure.
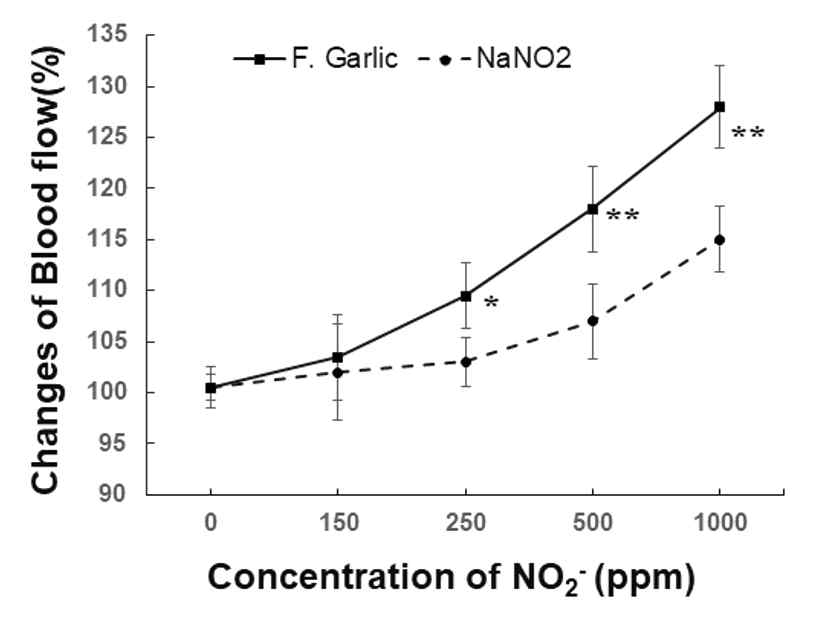
Line diagrams showing dose-dependent changes in cerebral blood flow following direct application of F. garlic and NaNO2 into cortical surface, respectively. Values are mean ± S.E. from 3 samples in each group. *Denotes statistically significant difference of between NaNO2 solution and F. Garlic. Values are mean ± S.E. from 5 cases in each group. *Denotes statistically significant difference of between NaNO2 solution and F. Garlic (*p<0.05, **p<0.01).
뇌혈관에 미치는 마늘발효액이 NO에 세포내 신호전달계를 통하여 혈류를 증가시키는 지 규명하기 위해 cyclic GMP의 생성효소인 guanylyl cyclase 억제제인 methylene blue를 3 mg/kg의 농도로 하여 정맥 내에 투여한 후 피질 혈류가 현저하게 증가하였던 500 ppm, 1,000 ppm 마늘 발효액을 대뇌피질 표면에 투여하였다. Methylene blue 전처치 후 1000 ppm 마늘발효에 의한 국소 뇌혈류 증가 현상은 현저하게 감소하여 뇌혈류가 기저값의 105.2 ± 3.1%을 보였다(p<0.01). 또한 methylene blue 전처치가 1000 ppm NaNO2에 의한 뇌 혈류 증가 현상도 유의하게 감소시켰다(p<0.05)(Fig. 3, 4, 6).
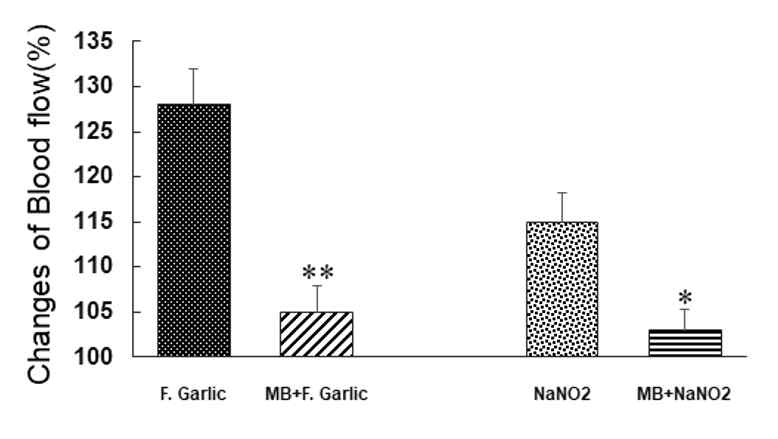
A histogram showing effects of pretreatment of methylene blue on cerebral blood flow following direct application of F. garlic and NaNO2, respectively. MB, methylene blue. Values are mean ± S.E. from 5 cases in each group. *Denotes statistically significant difference of between F. Garlic. and M) + F. Garlic.
3. 대뇌피질에서 마늘발효액의 NO 생성
혈류량의 증가가 NO의 변화에 의하여 이루어지는지를 확인하기 위하여 경막을 제거한 후 NO 측정 유리센서를 대뇌피질에 삽입하고 마늘 발효액의 250 ppm, 500 ppm 농도로 희석된 인공뇌척수액을 대뇌피질에 직접 투여하였다.
마늘 발효액의 250 ppm, 500 ppm 농도 모두에서 NO가 증가하는 경향을 보여 주었다. 특히 200 ppm의 경우 투여 5분이후부터 NO가 증가하여 투여 20 분 이내에 점진적으로 증가한 다음 이후 감소하였으며 이때 투여 전과 비교하여 최대 109.3 ± 4.5%까지 증가 하였다(p<0.05). 500 ppm 농도 마늘 발효액을 투여하였을 2분이내에 NO가 증가하기 시작하여 30분까지 지속적으로 증가하였으며 이때 최대 증가 폭은 투여 전과 비교하여 117.5 ± 3.3% 증가였다(p<0,01). 그러나 500 ppm NaNO2을 투여한 경우에는 대뇌피질에서 NO가 유의하게 변화하지 않았다(Fig. 7).
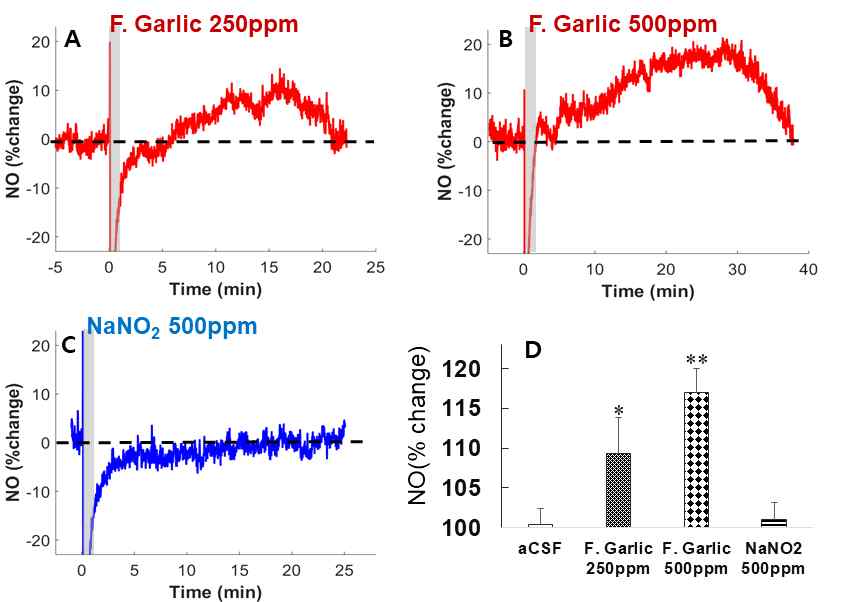
Production of nitric oxide (NO) in the cortical tissue following the direct application of F. garlic and NaNO into cortical surface, A & B, reprehensive temporal changes of NO induced by F. garlic with 250, 500ppm of NO2-, respectively. C, no changes of NO after application NaNO2 solution with 500ppm of NO2-. C A histogram showing maximal changes of NO production following direct application of F. garlic and NaNO2, respectively. Values are mean ± S.E. from 5 cases in each group. *Denotes statistically significant difference of between F. Garlic. and M) + F. Garlic. Other notations are the same as fig. 6.
고 찰
본 연구에서 사용한 마늘 발효액은 NO2-이 많이 함유된 발효물로 Chun(2016)9)이 고초균을 이용하여 특수 발효조건에서 마늘을 30 - 40일 동안 발효하여 암모니아성 질소로 부터 NO2-을 생성한 것이다. 일반적으로 NO2-은 액상에서 매우 불안정하여 산소와 결합하여 NO3-로 전환되는 질산화 과정을 거치는데, 본 발효액이 이러한 과정을 차단하여 NO2-를 액상에서 고정화 하였다. 이렇게 제작한 마늘 발효액의 NO2- 함량이 보관 기간이 길어질수록 일부 감소되는 것으로 관찰되었다. 그러나 각 천연물의 최적화된 발효 종결 시점에서 일정한 화학적 산소요구량 구간에서는 NO 대사체의 함량 감소 추세가 미미한 것으로 확인되었다10).
NO2-은 염산의 수소이온과 결합하여 HNO2가 생성되고 이후 NO로 전환됨이 잘 알려져 있으며6,20), 본 연구결과에서도 인공위액 조건에서 마늘 발효액과 NaNO2에서 NO가 모두 발생하였다. 그러나 마늘 발효액에서 NaNO2보다 단위 NO2- 량에 비교하여 NO 발생이 1.5배 이상 많아 위산 조건에서 마늘 발효액이 NaNO2 용액 보다 NO를 잘 발생할 수 있음을 의미할 수 있다. 이는 마늘 발효액에 NO2- 이외에 NO2- 및 NO가 결합된 NO 공여체 (donor)가 존재할 수 있고 위산 조건에서 NO 공여체에서 NO을 방출할 수 있음을 예측할 수 있다21).
이와 함께 본 연구의 결과들 중 250 ppm, 500 ppm NaNO2 농도의 마늘 발효액을 대뇌피질에 직접 투여하였을 때 대뇌 피질에서 NO가 증가하였으며 특히 500 ppm 농도 마늘 발효액을 투여하였을 30분까지 지속적으로 증가하여 최대 117.5% 증가였다. 그러나 500 ppm NaNO2을 투여한 경우에는 대뇌피질에서 NO가 유의하게 변화하지 않았다.
인공뇌척수액과 혈액이 pH 7.4와 유사한 상태임을 감안할 때 중성상태에서도 마늘발효액이 NaNO2에서 유래한 NO2- 보다 NO를 잘 발생할 수 있음을 의미할 수 있다. 따라서 추후 연구를 통하여 마늘 발효액에 강산 및 중성 조건에서 NaNO2 보다 NO 발생이 잘 되는 기전을 규명하고 마늘 발효액에서 NO을 유리할 수 있는 NO 공여체의 존재를 규명해야 할 것으로 사료된다.
마늘 발효액의 NO2- 량 250 - 1,000 ppm에서 뇌혈류가 증가하며 최대 124.8% 값으로 유의한 증가를 보였다(p<0.01). 그러나 500 ppm NaNO2 희석액에서는 혈류가 변화하지 않았고 다만 1,000 ppm NaNO2을 투여하였을 때 대뇌피질 혈류가 115.3 % 증가하였다. Cyclic GMP의 생성 효소인 guanylyl cyclase 억제제인 methylene blue 정맥 투여 후 500 ppm 마늘 발효액에 의한 뇌 혈류 증가 현상은 현저하게 감소되었다. 이상의 실험결과들은 마늘 발효액의 혈류 증가는 NO2- 농도를 기준으로 NaNO2보다 낮은 농도에서 이루어졌으며 NO 신호전달계을 통하여 작용하는 것을 간접적으로 증명한다.
본 연구 결과와 유사하게 마늘 발효액에 관련된 선행연구에서 Park 등 (2016)16)은 고혈압 쥐에서 마늘 발효액 (9.75 mg NO2-/ml) 경구 투여 시 30분 이내에 용량 의존적으로 혈압이 감소하고, 10일 이상 장기간 투여한 경우 지속적 혈압감소를 보고하였다. 대동맥에서 endothelial nitric oxide synthase (eNOS), protein kinase G (PKG) 단백이 증가되고, 이러한 생리학적 및 분자생물학적 현상들이 soluble guanylyl cyclase (sGC) 억제제에 의하여 감소됨으로써 마늘발효액이 NO에 의한 세포 내 sGC-cGMP-PKG 신호전달계를 활성화 시키는 약리작용이 있음을 확인하였다16). 또한 Park 등 (2017)14)은 monocrotaline 유도 폐고혈압 모델에서 3주 동안 마늘발효액(9.75 mg NO2-/ml)을 경구 투여한 군과 음용수를 투여한 폐고혈압 실험군과 비교했을 때 마늘발효액 투여군에서 혈관내피세포의 손상, 폐소동맥의 비대 및 폐조직의 섬유화가 유의하게 감소함을 보고하였다. 또한 마늘 발효액의 경구 투여로 폐에서 염증 관련 vascular cell adhesion molecule-1, matrix metalloprotease-9 단백은 감소하고 PKG, eNOS 단백은 증가됨으로써 폐에서 NO 관련 신호전달계의 활성을 유도하고 염증을 억제되었다.
사람과 원숭이를 대상으로 NaNO2을 정맥 투여하였을 때, 1분 이내에 용량 의존적으로 상완동맥의 혈류가 증가되었고 혈압 감소가 나타나 동맥혈관의 이완 효과가 관찰되었다22,23). 이러한 NaNO2 의 혈관이완 효과는 혈관 내에서 NO2- 가 NO로 전환됨으로써 나타나는 데 이때 NO 전환에 적혈구의 헤모글로빈, 혈액 내 환원제 (비타민 C), xanthine oxidoreductase 등이 중요한 역할을 하는 것이 알려져 있다23,24).
이상의 연구결과를 고려하였을 때, 본 NO2- 함유 마늘발효액은 경구 투여뿐 만 아니라 뇌에 직접 투여하여 혈관 이완을 유도하고 NO를 발생하여 NO 신호전달계에 직접 작용하는 것으로 사료된다. 또한 인공뇌척수액과 혈액이 pH 7.4와 유사한 상태임을 감안할 때 적혈구의 헤모글로빈, 혈과 내 환원제(비타민 C), xanthine oxidoreductas 등이 NO2- 을 NO로 전환시킬 수 있을 것으로 추측할 수 있다.
야채에 존재하는 NO3을 섭취하면 구강 미생물의 nitrate reductase에 의해 NO2- 으로 환원되고 다시 NO2- 은 위에서 염산에 의해 환원되어 NO가 된다. 또한 혈액에 흡수된 NO2- 은 헤모글로빈, 항산화제, 몰리브덴 함유 효소 등에 의하여 NO로 전환될 수 있다3,4). 따라서 질산염-아질산염-산화질소 (nitrate-nitrite-nitric oxide) 합성 경로는 신체에 NO의 새로운 합성경로로 NO3-과 NO2- 을 신체에 NO를 보충하는 중요한 대사체로 간주되고 있다3). 그러나 아질산염(nitrite, NO2)는 식품 보존재로 사용하고 있으며 위에서 2차 및 3차 아민과 결합하여 나트로소아민 (nitrosoamine)을 생성하여 세포독성을 초래하여 위암을 발생시킬 수 있을 수 있다고 인식되어 왔다. 그러나 최근 연구에서 소량의 NO2- 섭취가 위암을 발생한 다는 근거가 희박하고 특히 식물에 포함된 파이토케이컬 (phytochemicals)을 같이 섭취하는 경우 나트로소아민 생성이 이루어지지 않은 것이 밝혀졌다5,25). 최근 아질산염/질산염이 제거된 물과 음식을 섭취한 생쥐에서 결핍 3개월 후 내장지방, 고지혈증, 당내성이 보였고 8개월후에 비만 고혈압 인슐린 저하 및 내피세포손상이 관찰되었고 22개월에 심근경색으로 사망하였다8). 최근 적정량의 아질산염 및 질산염의 섭취가 다양한 질환을 호전할 수 있으면 급성 심정지 실험모델에서 수명을 연장시킬 수 있고 실험동물모델에서 심장 및 뇌에서 허혈-재순환 손상 모델에서 NO를 생성하여 산화성 손상을 억제하고 세포손상을 억제하여, 장기의 혈류를 증가시킨다26-28). 따라서 NO2- 의 생리적 약리적 작용에 의한 연구가 활발하게 진행되고 있다.
마늘 추출액이 NO 신호전달계을 작용하여 항고혈압 효과가 잘 알려져 있다11,12). 즉, 마늘 추출액을 섭취한 경우 혈압 강하가 있으며 특히 발효 마늘을 섭취한 경우에 이러한 현상은 저명한데 이는 마늘에서 유리하는 polysulfide 가 혈관내 기체신호전달자인 hydrogen sulfide (H2S) 생성을 초래하고 H2S는 NO와 함께 평활근이관을 촉진한다. 또한 마늘 추출물은 안지오텐신 전환효소을 억제하여 혈관 수축을 억제할 수 있다29,30).
마늘에는 p-coumaric (10.79 mg/100 g), caffeic acids, (9.50 mg/100 g), ferulic acid(2.6 mg/kg)와 같은 페놀성 물질(phenolic compounds)이 다량 함유하고 있으며13), 이중 caffeic acid는 친수성 항산화 물질로 NO를 소거하는 능력이 항산화제인 glutathione보다 높다31). 또한 caffeic acid 와 ferulic acid 위산조건에서 NO2- 을 NO로 전환할 수 있으며 발생한 NO와 결합할 수 있다28,32). 더불어 Ferulic acid와 caffeic acid은 물질은 항산화 능력뿐 만 아니라 혈관을 이완시키는 효과도 보이는 데 이때 혈관 내피세포 내 NO 신호전달계을 직접 작용하는 것으로 밝혀져 있다33). 이들 선행연구결과들을 고려하였을 때 본 연구에서 사용한 마늘 발효액에서 혈관이완 효과 및 NO 발생은 마늘에 있는 polysulfide 및 다양한 페놀성 물질들도 중요한 역학을 할 것으로 사료된다.
이상의 연구결과를 종합하면 본 마늘 발효액을 대뇌피질에 직접 투여하였을 때 마늘 발효물에 함유된 NO2- 및 마늘의 기능성 유효성분들이 혈관이완 및 NO 발생에서 시너지 효과를 보였을 것으로 사료되면 중요하면 NaNO2 보다 마늘 발효액이 혈관이관을 잘 유도 힐 수 있을 것으로 사료된다.
Acknowledgments
본 논문은 원광대학교 교내연구비(2019)의 지원에 의해 이루어짐.
References
-
Bryan NS. Nitric oxide enhancement strategies. Future Sci OA. 2015;1:Fso48.
[https://doi.org/10.4155/fso.15.48]

-
Bryan NSLefer DJ. Update on Gaseous Signaling Molecules Nitric Oxide and Hydrogen Sulfide: Strategies to Capture their Functional Activity for Human Therapeutics. Mol Pharmacol. 2019;96:109-14.
[https://doi.org/10.1124/mol.118.113910]

-
Lundberg JO, Gladwin MT, Ahluwalia A, Benjamin N, Bryan NS, et al. Nitrate and nitrite in biology, nutrition and therapeutics. Nat Chem Biol. 2009;5:865-9.
[https://doi.org/10.1038/nchembio.260]

-
Bryan NS, Fernandez BO, Bauer SM, Garcia-Saura MF, Milsom AB, et al. Nitrite is a signaling molecule and regulator of gene expression in mammalian tissues. Nat Chem Biol. 2005;1:290-7.
[https://doi.org/10.1038/nchembio734]

-
Blood AB. The Medicinal Chemistry of Nitrite as a Source of Nitric Oxide Signaling. Curr Top Med Chem. 2017;17:1758-68.
[https://doi.org/10.2174/1568026617666161116145046]

-
Amdahl MBDeMartino AW. Inorganic nitrite bioactivation and role in physiological signaling and therapeutics. 2019;401:201-11.
[https://doi.org/10.1515/hsz-2019-0349]

-
Carlström M, Liu M, Yang T, Zollbrecht C, Huang L, et al. Cross-talk Between Nitrate-Nitrite-NO and NO Synthase Pathways in Control of Vascular NO Homeostasis. Antioxid Redox Signal. 2015;23:295-306.
[https://doi.org/10.1089/ars.2013.5481]

-
Kina-Tanada M, Sakanashi M, Tanimoto A, Kaname T, Matsuzaki T, et al. Long-term dietary nitrite and nitrate deficiency causes the metabolic syndrome, endothelial dysfunction and cardiovascular death in mice. Diabetologia. 2017;60:1138-51.
[https://doi.org/10.1007/s00125-017-4259-6]

- Chun HS. Manufacturing methods of natural fermented products containing nitric oxide metabolites and composites of their products. 2016: Korea. p. 10.
- Chun HS. Manufacturing method of fixation and stabilization of nitric oxide metabolites through fermentation of natural products having nitrogen. 2019: Korea. p. 18.
- Ginter ESimko V. Garlic (Allium sativum L.) and cardiovascular diseases. Bratisl Lek Listy. 2010;111:452-6.
-
Rana SV, Pal R, Vaiphei K, Sharma SKOla RP. Garlic in health and disease. Nutr Res Rev. 2011;24:60-71.
[https://doi.org/10.1017/S0954422410000338]

-
Imai J, Ide N, Nagae S, Moriguchi T, Matsuura H, et al. Antioxidant and radical scavenging effects of aged garlic extract and its constituents. Planta Med. 1994;60:417-20.
[https://doi.org/10.1055/s-2006-959522]

-
Park BM, Chun H, Chae SWKim SH. Fermented garlic extract ameliorates monocrotaline-induced pulmonary hypertension in rats. Journal of Functional Foods. 2017;30:7.
[https://doi.org/10.1016/j.jff.2017.01.024]

-
Lee YJ, Lee D, Shin SM, Lee JS, Chun HS, et al. Potential protective effects of fermented garlic extract on myocardial ischemia-reperfusion injury utilizing in vitro and ex vivo models. Journal of Functional Foods. 2017;33:8.
[https://doi.org/10.1016/j.jff.2017.03.058]

-
Park BM, Cha SA, Kim HY, Kang DK, Yua K, et al. Fermented garlic extract decreases blood pressure through nitrite and sGC-cGMP-PKG pathway in spontaneously hypertensive rats. Journal of Functional Foods. 2016;22:10.
[https://doi.org/10.1016/j.jff.2016.01.034]

-
Shin JH. Metzger SKSchoenfisch MH. Synthesis of nitric oxide-releasing silica nanoparticles. J Am Chem Soc. 2007;129:4612-9.
[https://doi.org/10.1021/ja0674338]

- Park BM, Kim MS, Yee GH, Moon MJ, Kim HJ, et al. Changes in Vestibular Nerve Activity Following Acute Hypotension in Rats. Korean J Physiol Pharmacol. 2003;7:5.
-
Soares de Moura RS, Leão MC, Castro Resende AC, Moreira CF, Sena KM, et al. Actions of L-NAME and methylene blue on the hypotensive effects of clonidine and rilmenidine in the anesthetized rat. J Cardiovasc Pharmacol. 2000;35:791-5.
[https://doi.org/10.1097/00005344-200005000-00017]

-
Münzel TDaiber A. Inorganic nitrite and nitrate in cardiovascular therapy: A better alternative to organic nitrates as nitric oxide donors? Vascul Pharmacol. 2018;102:1-10.
[https://doi.org/10.1016/j.vph.2017.11.003]

-
Gori T. Exogenous NO Therapy for the Treatment and Prevention of Atherosclerosis. Int J Mol Sci. 2020;21.
[https://doi.org/10.3390/ijms21082703]

-
Pluta RM, Oldfield EH, Bakhtian KD, Fathi AR, Smith RK, et al. Safety and feasibility of long-term intravenous sodium nitrite infusion in healthy volunteers. PLoS One. 2011;6:e14504.
[https://doi.org/10.1371/journal.pone.0014504]

-
Dejam A, Hunter CJ, Tremonti C, Pluta RM, Hon YY, et al. Nitrite infusion in humans and nonhuman primates: endocrine effects, pharmacokinetics, and tolerance formation. Circulation. 2007;116:1821-31.
[https://doi.org/10.1161/CIRCULATIONAHA.107.712133]

-
Maia LBMoura JJ. Nitrite reduction by molybdoenzymes: a new class of nitric oxide-forming nitrite reductases. J Biol Inorg Chem. 2015;20:403-33.
[https://doi.org/10.1007/s00775-014-1234-2]

-
Bryan NS, Alexander DD, Coughlin JR, Milkowski ALBoffetta P. Ingested nitrate and nitrite and stomach cancer risk: an updated review. Food Chem Toxicol. 2012;50:3646-65.
[https://doi.org/10.1016/j.fct.2012.07.062]

-
Uray T, Empey PE, Drabek T, Stezoski JP, Janesko-Feldman K, et al. Nitrite pharmacokinetics, safety and efficacy after experimental ventricular fibrillation cardiac arrest. Nitric Oxide. 2019;93:71-7.
[https://doi.org/10.1016/j.niox.2019.09.003]

-
Dezfulian C, Kenny E, Lamade A, Misse A, Krehel N, et al. Mechanistic characterization of nitrite-mediated neuroprotection after experimental cardiac arrest. Journal of neurochemistry. 2016;139:419-31.
[https://doi.org/10.1111/jnc.13764]

-
d'Ischia M, Napolitano A, Manini PPanzella L. Secondary targets of nitrite-derived reactive nitrogen species: nitrosation/nitration pathways, antioxidant defense mechanisms and toxicological implications. Chem Res Toxicol. 2011;24:2071-92.
[https://doi.org/10.1021/tx2003118]

-
Ried K, Fakler P. Potential of garlic (Allium sativum) in lowering high blood pressure: mechanisms of action and clinical relevance. Integr Blood Press Control. 2014;7:71-82.
[https://doi.org/10.2147/IBPC.S51434]

-
Fahim MAEl-Sabban FF. Garlic prevents ultrastructural alterations caused by dehydration in mouse cerebral microvessels. Anat Rec. 2001;263:85-90.
[https://doi.org/10.1002/ar.1080]

-
Sueishi Y, Hori M, Kita MKotake Y. Nitric oxide (NO) scavenging capacity of natural antioxidants. Food Chem. 2011;129:866-70.
[https://doi.org/10.1016/j.foodchem.2011.05.036]

-
Takahama UHirota S. Possible Reactions of Dietary Phenolic Compounds with Salivary Nitrite and Thiocyanate in the Stomach. Antioxidants (Basel). 2017;6.
[https://doi.org/10.20944/preprints201706.0125.v1]

-
Suzuki A, Yamamoto M, Jokura H, Fujii A, Tokimitsu I, et al. Ferulic acid restores endothelium-dependent vasodilation in aortas of spontaneously hypertensive rats. Am J Hypertens. 2007;20:508-13.
[https://doi.org/10.1016/j.amjhyper.2006.11.008]

