미세먼지로 유도된 기관지염증에 다시마가 함유된 복합물의 효과
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
The purpose of this study was to investigate the effects of natural herb mixture containing Laminaria japonica Areschoung (LAM) on fine dust-induced bronchitis in mice. Laminaria japonica Areschoung is main content of LAM, which is including fucoidan. Fucoidan extracted from phaophyta is known to prevent bronchitis and to defend against bacteria and virus infection. In this study, we experienced the effect of LAM on bronchitis and investigated gene expressions (e.g ; IL-8, COX-2, MCP-1) and bio-markers (e.g ; IL-8, PGE2, MUC5AC) associated with bronchitis by using A549 cells. Also, we investigated whether LAM can suppress the bronchitis in fine dust-induced animal models. We injected fine dust (50 ㎕) twice as INT (Intra-Nasal-Trachea) method. Then LAM (200 ㎎/㎏ and 400 ㎎/㎏) were oral administered for 14 days. We analyzed the number of immune cells, immunoglobulin E, bio-markers level associated with bronchitis. LAM significantly decreased bio-marker (IL-1β, IL-6, IL-8, TNF-α, Histamine, PGE2), immune cells (white blood cell, neutrophil, lymphocyte, monocyte), and immunoglobulin E, that are increased by fine dust. Taken together, this study suggest that LAM can be used as effective herbal extract for bronchitis.
Keywords:
Alcohol, Antioxidant, Azadirachta Indical, Pyllanthus emblicand, Hangover서 론
사회의 발전과 함께 증가하는 대기오염에 의해 매년 2백만 명 이상이 호흡기 질환으로 사망하며, 그중 미세먼지는 전 세계가 대면한 환경성 질환 위험요인 중 하나로서 다양한 질병을 유발시키면서 국민의 건강을 위협하는 요소다1,2). 2013년 세계보건기구 산하 국제 암연구소 (International agency for research on cancer; IARC)는 미세먼지를 사람에게 확인된 1군 발암물질 (Group1)로 지정하였다3). 현재 우리나라는 미세먼지 농도가 가장 높은 국가로 지정되어 있으며, 경제협력개발기구 (Organization for economic cooperation and development; OECD)에서 발표한 자료에 의하면 다른 선진국들에 비해 우리나라의 미세먼지 농도는 상당히 높은 편으로 나타났다4,5). 대기에 있는 총 부유 분진 (Total suspended; TSP) 중 직경 10 ㎛ 이하인 미세먼지 (PM10)와 직경 2.5 ㎛ 이하인 초미세먼지 (PM2.5)는 호흡 시 체내로 침입 가능한 흡입성 먼지 (Respirable dust)로 알려져 있다6,7). 미세먼지는 질산염 (NO3-), 황산염 (SO42-), 암모늄 (NH4+)등의 이온 성분과 탄소화합물, 금속 화합물 등으로 이루어져 있으며, 침적된 미세먼지는 점액섬모 청소 및 기침 등의 호흡기 방어기작에 의하여 체외로 배출되지만 대부분의 미세먼지는 강한 염증을 유발시키고, 흡입 시 하부 기관지 및 폐의 가스-교환 부분까지 침착되어 호흡 기계에 손상을 일으킬 수 있다7-9). 최근 들어 미세먼지는 심혈관계에 위험요인으로서 심근경색, 뇌졸중, 협심증 질환을 일으킨다고 보고되고 있다10).
복합물에 가장 많은 비중을 차지하는 다시마 (Laminaria japonica Areschoung)는 우리나라 해역에서 생산되는 대표적인 갈조류로 fucoidan을 함유하고 있다11). Fucoidan은 미역, 다시마, 톳 등의 갈조류의 세포벽 성분인 점질 다당에 함유되어 있는 수용성 다당류다. 혈액 중에 존재하는 heparin과 생리적 특성이 비슷하여 thrombin의 활성을 억제하여 혈액응고 억제작용을 하며 항혈액응고, 항암작용, 암세포 증식을 억제, 면역조절작용, 신장 개선 등의 기능적 특성이 밝혀졌다12-17). 또한 주요 성분인 길경 (Platycodon grandiflorum A. De Candolle), 사삼 (Adenophora triphylla var. japonica Hara), 맥문동 (Liriope platyphylla Wang et Tang), 오미자 (Schisandra chinensis Turcz. Baillon)는 기관지염, 호흡곤란 등 호흡기 질환에 많이 사용되며, 혈당강화작용, 항염작용, 면역효과 및 항산화 효과 연구들이 진행되어 있다18-24).
그 외 갈근 (Pueraria lobata Ohwi), 백출 (Atractylodes macrocephala Koidzumi)은 항산화 작용, 항천식 작용, 항암효과가 있다고 보고되고 있으며25,26), 백복령 (Wolfiporia extensa), 연자육 (Nelumbo nucifera Gaertner), 진피 (Citrus reticulata Blanco)는 면역증강 및 항암제 치료, 항산화 작용으로 보고되어 있다27-32).
다시마가 함유된 복합물은 기관지염, 면역증강 및 항암제 치료에 많이 쓰이고 있는 한약재들을 함께 혼합하여 만든 약재로서 아직 미세먼지로 유발한 기관지 염증에 대한 효과를 비교한 연구는 보고된 바가 없다.
이에 본 저자는 페포상피 세포주인 A549 세포주 모델과 생쥐의 기도 내 미세먼지 흡입을 한 동물 모델을 이용하여 복합물의 미세먼지 유발 기관지 염증 보호 및 치료약물로서 기능성을 제시하고자 한다.
재료 및 방법
1. 시료제작
다시마가 함유된 복합물 (Laminaria japonica Areschoung mix 이하, LAM으로 표기)의 구성 약재들은 대전한약국 (Daejeon, Korea)에서 구입하여 사용하였으며, 한 첩의 내용 및 분량은 Table 1과 같다.
2. 시료 추출
LAM 1첩 분량 (55 g)에 1000 ㎖의 증류수를 넣어 100℃에서 3시간동안 추출하였다. 추출물을 여과지로 여과한 후, rotary vacuum evaporator를 통해 감압농축하고 freeze dryer를 사용하여 동결건조를 진행하여 11.6 g (수득률 : 21.2%)의 분말을 얻었으며, -20℃에 보관하면서 사용하였다.
3. 시약 및 기기
사용된 시약은 F-12K medium (ATCC, U.S.A.), lipopolysaccharide (LPS : Sigma, U.S.A.), fetal bovine serum (FBS : Gibco BRL, U.S.A.), penicillin-streptomycin (Sigma, U.S.A.), trypan blue (Sigma, U.S.A.), trypsin-EDTA solution (1X) (Welgene, Korea), dulbecco's phosphate buffered saline (D-PBS : Welgene, Korea), total RNA prep kit (Intronbio, Korea), accupower cyclescript RT premix (Bioneer, Korea), SYBR Green (Qiagen, Germany), diethyl pyrocarbonate distilled water (DEPC-D.W : Bioneer, Korea), human prostaglandin E2 ELISA kit (Mybiosource, U.S.A.), human interleukin 8 ELISA kit (Mybiosource, U.S.A.), human mucin-5AC ELISA kit (Mybiosource, U.S.A.), aluminium hydroxigen gel (Sigma, U.S.A), diethyl-ether (Sigma, U.S.A.), phenol red (Sigma, U.S.A.), sodium hydroxide (Sigma, U.S.A.), coal fly ash (Sigma, U.S.A.), diesel particulate matter (Sigma, U.S.A.), dimethyl sulfoxide (DMSO : Sigma, U.S.A.) 등을 사용하였으며, 사용된 기기는 CO2 incubator (Sanyo, Japan), clean bench (Vision scientific, Korea), autoclave (Sanyo, Japan), vortex mixer (Vision scientific, Korea), centrifuge (Hanil, Korea), deep-freezer (Sanyo, Japan), plate shaker (Lab-Line, U.S.A.), micro plate reader (Molecular Devices, U.S.A.), nanodrop (Thermo Fisher, U.S.A.), alpha cycler 1 PCRmax (PCRmax, U.K.) real time PCR (Qiagen, Germany), luminex (Millipore, U.S.A.), optical microscope (Carl ZEISS, Germany)등을 사용하였다.
4. 세포배양
A549 세포는 10% fetal bovine serum와 1% penicillin-streptomycin으로 구성된 F-12K 배지를 사용하였고 37℃, 5% CO2 조건이 유지되는 세포배양기에서 배양하였으며, 2-3일 주기로 계대 배양하여 실험을 진행하였다.
5. 세포독성 측정
A549 세포를 48 well plate에 1×105 cells/well로 분주하여 24시간 동안 배양 하였다, 이후 LAM을 50, 100, 200, 400 ㎍/㎖의 농도로 처리하여 다시 24시간 동안 배양하였다. 배양 후 배양액 100 ㎕당 10 ㎕의 EZ-Cytox 용액을 첨가하여 세포배양기에서 30분간 반응시켰다. 반응 후 450 ㎚에서 흡광도의 변화를 측정하여 대조군에 대한 세포생존율을 백분율로 표시하였다.
6. 유전자 발현량 측정
6 well plate에 A549 세포를 2×105 cells/well로 분주하여 24시간 동안 배양하였다. 배양 후 LAM을 100, 200 ㎍/㎖의 농도로 처리하고 30분 뒤, 각각 10 ㎍/㎖의 LPS를 추가하여 다시 24시간 동안 배양하였다. 이후, 1200 rpm에서 5분 동안 원심분리하여 얻은 세포에 easy blue 1 ㎖와 chloroform 200 ㎕를 넣고 vortexing 해준 후, 13000 rpm, 4℃에서 10분 동안 원심분리 하였다. 상층액 400 ㎕와 binding buffer 400 ㎕를 실온에서 1분 동안 반응시킨 뒤 반응액 700 ㎕를 column에 주입하여 13000 rpm에서 30초 동안 원심분리 하였다. Column에 washing buffer A를 700 ㎕ 넣고 13000 rpm에서 30초 동안 원심분리 후, washing buffer B를 700 ㎕ 넣고 동일하게 원심분리하였다. Column 하단을 1.5 ㎖ tube로 교체한 후, column에 elution buffer를 30 ㎕ 넣고 1분 동안 반응시킨 뒤 13000 rpm에서 1분 동안 원심분리 하여 total RNA를 추출하였다.
역전사 (Reverse transcription) 반응은 RT premix kit의 mixture (Reaction buffer, dNTPs mixture, RNase inhibitor, stabilizer, oligo dT15 primer)와 total RNA를 1 ㎍ 넣고 DEPC-DW을 최종 부피가 20 ㎕가 되도록 첨가하였다. 이 혼합액을 잘 섞은 후, 45℃에서 60분 반응시켜 first-strand cDNA를 합성하고, 95℃에서 5분 동안 방치하여 M-MLV RT를 불활성화 시켜 합성이 완료된 cDNA를 polymerase chain reaction (PCR)에 사용하였다.
7. 세포 바이오마커 생성량 측정
6 well plate에 A549 세포를 2×105 cells/well로 분주하여 24시간 동안 배양하였다. 배양 후 LAM을 50, 100, 200 ㎍/㎖의 농도로 처리하고 30분 뒤, 각각 10 ㎍/㎖의 LPS를 추가하여 다시 24시간 동안 배양하였다. 배양액을 1200 rpm에서 5분간 원심분리하여 얻은 상등액을 얻은 후 human interleukin 8 ELISA kit, human prostaglandin E2 ELISA kit, human mucin-5AC ELISA kit를 이용하여 IL-8, PGE2, MUC5AC 생성량을 측정하였다.
8. 실험동물
실험에 사용한 5주령의 수컷 ICR mouse는 라온바이오 (Yongin, Gyeonggi-do, Korea)에서 분양받아 사용하였다. 실험동물은 2주간의 안정기를 가지면서 순화를 시켰으며, 안정기 및 실험기간에 모든 실험동물에는 rodent diet (Envigo, Huntingdon, U.K.)를 자유식이 하며 물을 충분히 공급하였다. 동물 사육실의 조건은 conventional system으로 22±2℃, 1일 중 12시간은 200-300 Lux로 조명하고, 12시간은 모든 빛을 차단하였다. 본 실험은 대전대학교 동물실험윤리 위원회의 승인 (승인번호 DJUARB2019-033)을 받아 동물윤리 준칙에 의거하여 실험하였다.
9. 모델 제작 및 시료 투여
미세먼지 유도 모델을 제작하기 위해 먼저, coal fly ash와 diesel particulate matter를 각 5 ㎎/㎖ 농도로 DMSO에 용해 시킨 후 최종 농도가 coal fly ash는 0.5 ㎎/㎖, diesel particulate matter은 0.75 ㎎/㎖가 되도록 PBS로 희석한 후 수산화알루미늄 겔이 8 %가 되게 첨가하여 미세먼지 혼합물을 제조하였다. 미세먼지 혼합물의 투여는 시료 투여 시작 후 3일, 6일 후에 총 2회로 INT (Intra-Nasal-Trachea) 방법을 이용하여 미세먼지 혼합물을 50 ㎕씩 주입하였다. 실험은 미세먼지를 주입하지 않은 정상군, 미세먼지 유도 마우스에 증류수를 경구 투여하는 대조군, 미세먼지 유도 마우스에 LAM을 200, 400 ㎎/㎏/day으로 경구투여 하는 실험군 등으로 분류 하였으며, 각 그룹은 8수씩 무작위로 배정하였다. 2주간의 동물 적응기를 거친 후, 14일간 1일 1회 오전 10시에 경구투여 하였다(Fig. 1).
10. 혈액분리
Diethyl-ether를 사용하여 마취한 후, 심장천자법으로 채혈한 혈액을 EDTA tube 와 microcentrifuge tube에 나누어 초저온 냉동고 (-80 ℃)에 보관하였다.
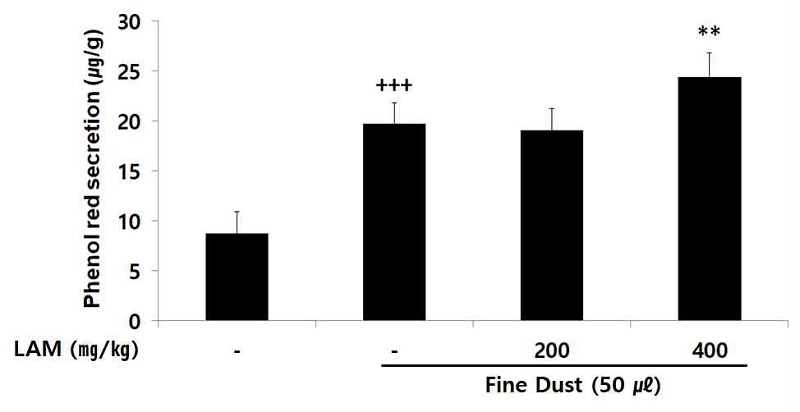
11. 점액분비량 측정
점액분비 촉진효과는 Engler와 Szelenyi의 방법에 따라 기도 내로 분비되는 phenol red (PR)함량을 측정하였으며, 실험 종료 30분 전에 phenol red (10 ㎎/㎏)를 200 ㎕씩 실험동물 복강에 주사하였으며, 이후 ethyl ether로 마취한 상태에서 심장천자법으로 채혈한 다음 기관 전체를 절제하였다. 분리된 기관을 1 ㎖의 생리식염수에 넣어 30분간 조직을 vortexing 한 후, 5 분간 10000 rpm에서 원심분리 하였으며 분리한 상층액 900 ㎕와 1M NaOH 100 ㎕를 넣어 발색시키고 546 ㎚에서 흡광도를 측정하였다.
12. 면역세포 측정
EDTA tube에 보관되어있는 혈액은 hematology system ADVIA 2120i를 이용하여 백혈구 (white blood cell), 호중구 (neutrophil),림프구 (lymphocyte), 단핵구 (monocyte) 수를 분석하였다.
13. 혈액 바이오마커 생성량 측정
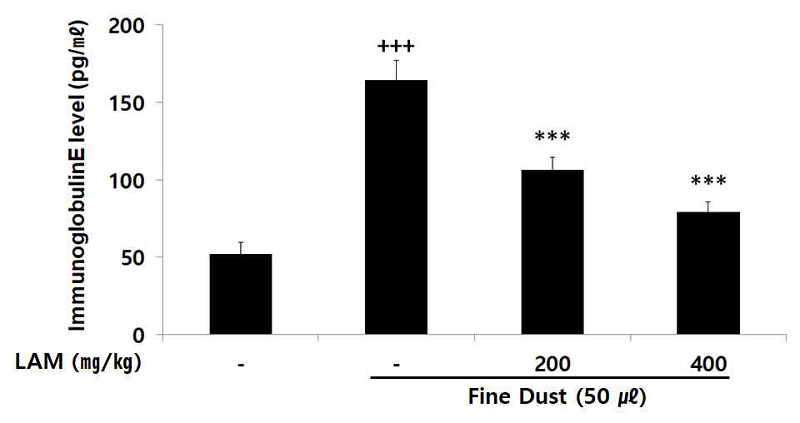
Microcentrifuge tube에 보관되어있는 혈액을 상온에서 30분간 응고 시킨 후, 3000 rpm으로 10분 동안 원심분리하여 혈청을 획득하였다. 분리한 혈청은 MILLIPLEX® Multiplex Assays kit (Millipore, Burlington, Massachusetts, U.S.A.)와 Luminex 200 System (Luminex, Austin Texas, U.S.A.)를 이용하여 인터루킨-1β (interleukin-1β; Il-1β), 인터루킨-6 (interleukin-6; IL-6), 인터루킨-8 (interleukin-8; IL-8), 종상괴사인자 알파 (Tumor necrosis factor alpha; TNF-α), 히스타민 (histamine), 프로스타글란딘 E2 (Prostaglandin E2; PGE2), 면역글로불린E (immunoglobulin E; IgE) 수준을 측정하였다.
14. 통계처리
실험 결과는 SPSS 21.0를 이용하여 mean±standard error of mean으로 나타내었으며, ANOVA를 사용하여 다중 비교하였고 Tukey’s HSD test를 통해 p<0.05, p<0.01 및 p<0.001 수준에서 유의성을 검정하였다.
결 과
1. 세포생존율
A549 세포에서 세포 생존율을 측정한 결과, LAM 400 ㎍/㎖ 농도를 제외한 모든 농도에서 대조군만큼 높은 생존율을 나타내었다 (Fig. 2).
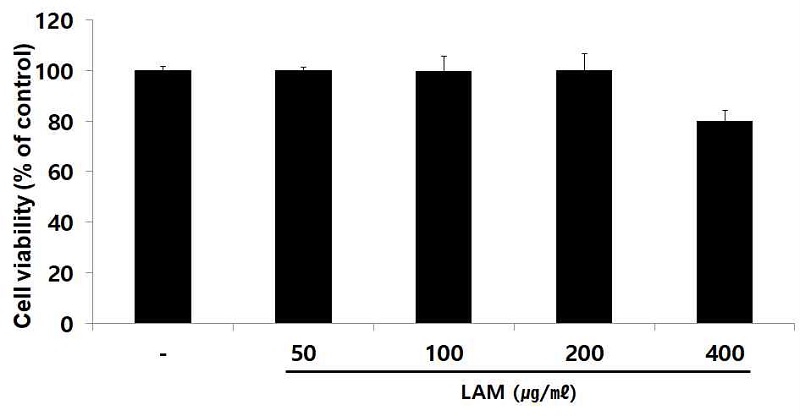
Cell viability test of LAM in A549 cells. A549 cells were treated by 50, 100, 200 and 400 ㎍/㎖ of LAM for 24 h. Treated cells were reacted by EZ-Cytox for 30 min and then absorbance were measured at 450 ㎚ using micro plate reader. Cell viability were calculated as percentage relative to the control. The result were presented by the mean ± S.D from three independent experiments.
2. 세포 내 유전자 발현량
LPS를 이용한 알레르기 염증 유발 후, 기관지 상피세포에서 발현이 증가되는 IL-8, COX-2, MCP-1 유전자 발현량을 측정한 결과, LAM는 농도 의존적으로 대조군에 비해 유의성 있는 (** ; p < 0.01, *** ; p < 0.001) 유전자 발현 감소가 나타났다(Fig. 3).
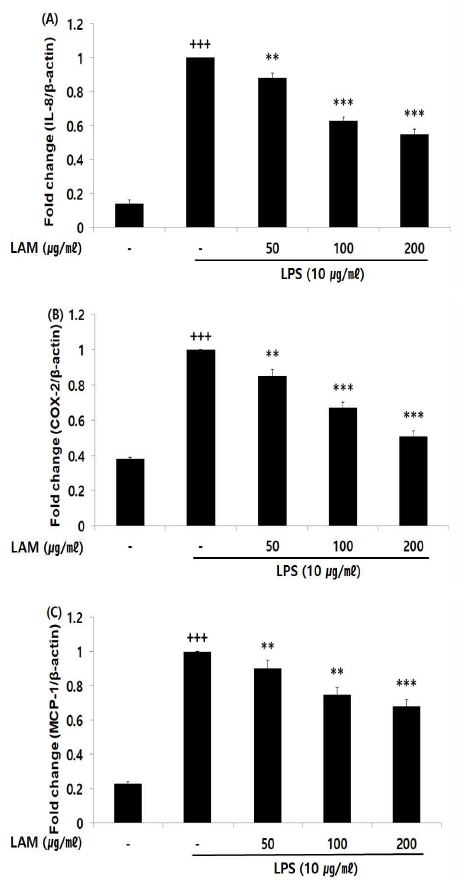
Effect of LAM on mRNA expression level in A549 cells. A549 cells were treated 50, 100, and 200 ㎍/㎖ of LAM with 10 ㎍/㎖ LPS for 12 h. The mRNA expression level were measured by polymerase chain reaction. The result were presented by the mean ± S.D from three independent experiments (Significance of results, +++ ; p < 0.001 compared to normal, ** ; p< 0.01, *** ; p< 0.001 compared to control). (A); IL-8, (B); COX-2, (C); MCP-1
3. 세포 내 바이오마커 생성량
IL-8은 활성화 되어진 호산구 화학 주성에 작용하여 기도 염증을 유발 시키는 역할을 하며, IL-8 생성량을 측정한 결과 LAM 200 ㎍/㎖의 농도에서 대조군에 비해 유의성 있는 (** ; p <0.01) 감소가 나타났다. 염증에 의해 자극되는 COX-2에 의해 생성된 PGE2와 직접적으로 기도과민성을 유도하는 MUC5AC 생성량을 측정한 결과, LAM는 농도 의존적으로 대조군에 비해 유의성 있는 (* ; p< 0.05, ** ; p < 0.01, *** ; p < 0.001) 바이오마커 생성량 감소가 나타났다(Fig. 4).
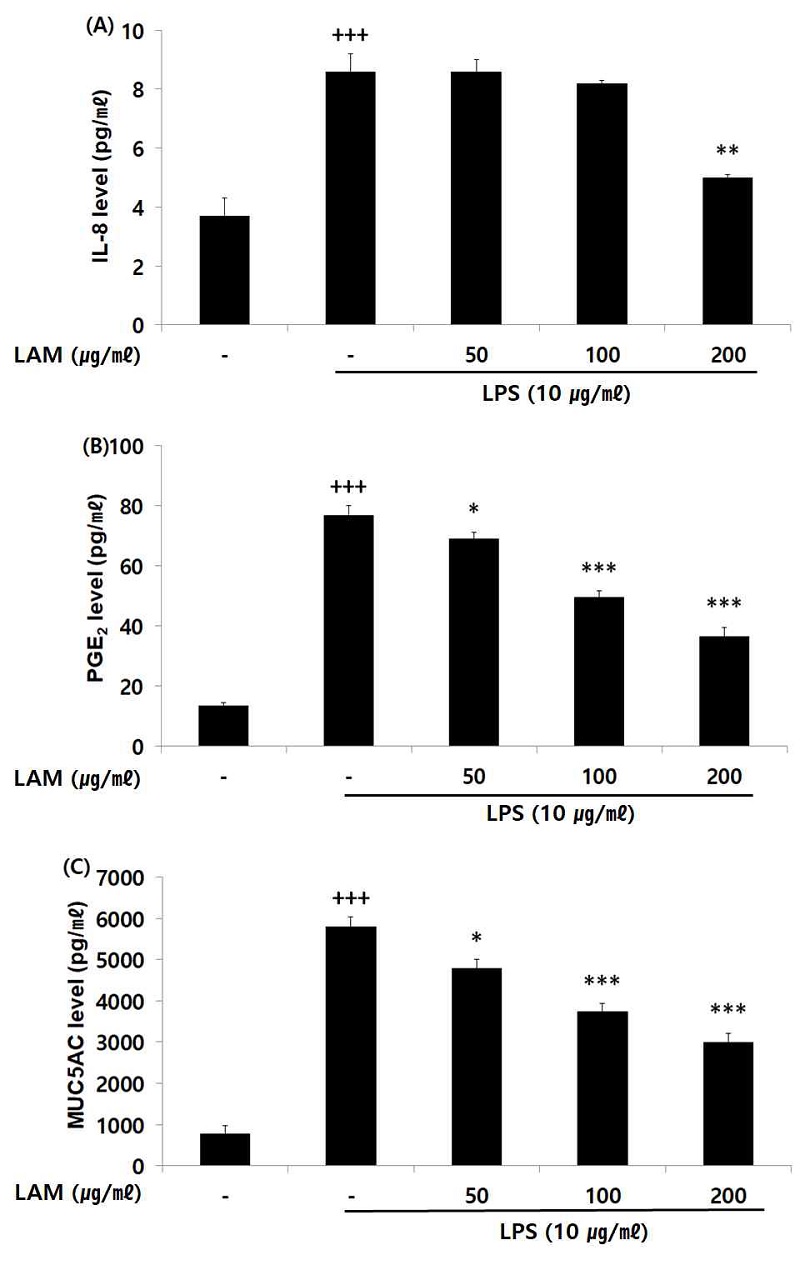
Effect of LAM on biomarker level in A549 cells. A549 cells were treated 50, 100, and 200 ㎍/㎖ of LAM with 10 ㎍/㎖ LPS for 12 h. The biomarker level were measured using a ELISA kit. The result ere presented by the mean ± S.D from three independent experiments (Significance of results, +++ ; p <0.001 compared to normal, * ; p< 0.05, ** ; p < 0.01, *** ; p < 0.001 compared to control). (A); IL-8, (B); PGE2, (C); MUC5AC
4. 점액분비량
호흡기 내의 이물질 배출과 점막을 보호하는 역할을 하는 점액의 분비량 측정 결과, LAM 400 ㎎/㎏ 투여군에서 대조군에 비해 점액 분비량을 유의성 있게 (** ; p< 0.01) 증가하였다(Fig. 5).
5. 면역세포 수
세균 감염 및 바이러스 감염 등 염증반응 유도 시 증가되는 백혈구, 림프구, 단핵구, 백혈구 속 가장 많은 비중을 차지하는 호중구는 LAM을 투여한 모든 투여군에서 농도의존적으로 대조군에 비해 유의성 있는 (* ; p< 0.05, ** ; p < 0.01, *** ; p < 0.001) 면역세포 수 감소가 나타났다(Fig. 6).
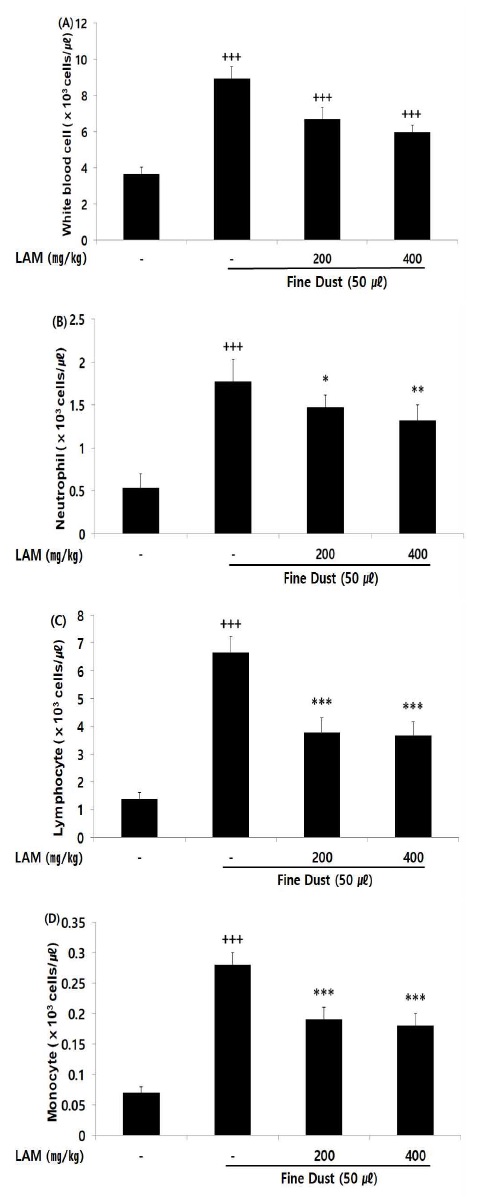
Effect of LAM on immunocyte count in fine dust-injected mice. The result were presented by the mean ± S.D (n=6). (Significance of results, +++ ; p < 0.001 compared to normal, and * ; p< 0.05, ** ; p < 0.01, *** ; p < 0.001 compared to control). (A); white blood cell, (B); neutrophil, (C); lymphocyte, (D); monocyte
6. 혈청 내 바이오마커 생성량
기도 내 염증성 cytokine인 IL-1β, IL-6, IL-8, TNF-α, Histamine, PGE2의 혈청 내 바이오 마커 생성량을 측정한 결과, LAM의 모든 투여군에서 대조군에 비해 유의적인 (* ; p< 0.05, ** ; p < 0.01, *** ; p < 0.001) 염증성 cytokine 감소가 나타났다(Fig. 7).
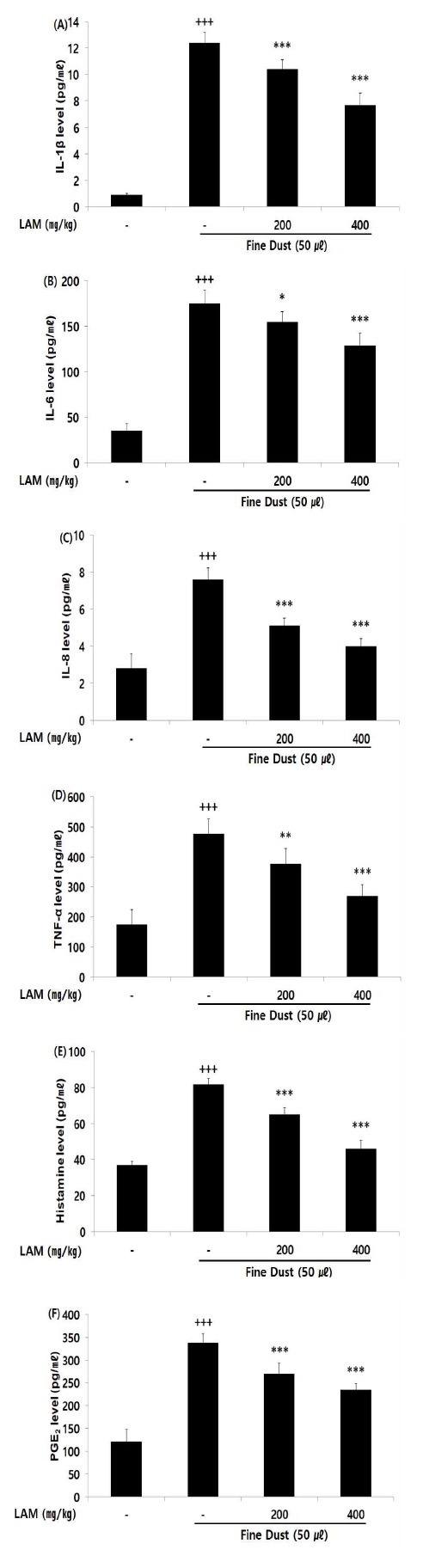
Effect of LAM on biomarker level in fine dust-injected mice. The result were presented by the mean ± S.D (n=6). (Significance of results, +++ ; p < 0.001 compared to normal, and * ; p<0.05, ** ; p < 0.01, *** ; p < 0.001 compared to control). (A); interleukin-1 beta, (B); inerleukin-6, (C); interleukin-8, (D); tumor necrosis factor alpha, (E); histamine, (F); prostaglandin E2
7. 면역글로불린 수준
면역글로불린E는 비만세포 표면에 있으며 면역글로불린E와 결합된 항원은 천식을 유발하는 화학물질 배출을 유도시킨다. 면역글로불린E 수준을 확인한 결과 LAM은 모든 농도의 투여군에서 농도의존적으로 대조군에 비해 유의적인 (*** ; p < 0.001) 감소가 나타났다(Fig. 8).
고 찰
우리나라는 1960년대부터 시작된 산업화와 경제 성장으로 인하여 에너지 사용량이 증가하고 있으며, 자동차, 빌딩, 사업장의 대기 오염물질 배출 증가로 인하여 인체에 미치는 영향에 대한 사회적 관심이 증가하고 있다33). 미세먼지는 입자의 크기에 따라 PM10, PM2.5로 나누며, 주로 기관지에 염증반응을 일으키면서 호흡기 장애를 발생하게 되며, 흡입 시에 하부기관지 및 폐의 가스-교환부분까지 침착하게 되어 밀착 (Impaction), 침전 (Sedimentation), 확산 (Diffusion)으로 흡수 된다10,34). 대기 중 미세먼지의 노출에 의해 호흡기증상의 증가, 심혈관계 부정적 영향, 어린이 폐 기능 감소, 만성폐쇄성 폐질환 (Chronic obstructive pulmonary disease: COPD)환자 증가 등을 초래한다고 보고되었다35,36). 미세먼지의 입자 크기가 작을수록 기저 호흡기 질환을 악화시키고 활성산소 생성을 통해 염증성 사이토카인을 증가 시킨다37).
한의학에서는 호흡기 질환을 장부변증, 팔간변증을 이용하여 변증 분류하고 있으며, 喀痰은 痰飮의 범주로 체내의 한 부분에 과다한 수분이 정취 된 것으로 질병의 원인 및 질병의 결과로 발생되는 병적 상태다38). 喀痰 및 痰과 관련하여 ≪素問‧通評虛實論≫에서 喘息은 “幼者中風熱 喘鳴肩息”이라 하여 風熱邪氣에 의하여 유발될 수 있다고 보고하고 있다39).
昆布, 沙蔘, 麥門冬, 五味子은 기관지 염증 증상의 치료에 더불어 다양한 증상에 활용되며, 葛根, 沙蔘, 白茯苓, 白朮, 蓮子肉, 陳皮의 부산물 역시 염증 증상의 치료에 사용되고 있다고 보고되고 있으나18-32), 이들의 복합처방인 LAM은 문헌적으로 효능이 기록되지 않고 실험적 연구 역시 진행된 바가 없다.
먼저 A549 세포를 이용하여 LAM 50, 100, 200, 400 ㎍/㎖ 처리한 결과, 400 ㎍/㎖을 제외한 모든 농도에서 세포증식이 일정하게 유지되어 약물 자체에 독성이 없는 것으로 판단되었다(Fig. 2). LPS (Lipopolysaccharide)는 염증 매개 물질에 생성과 분비를 유도하는 중요한 인자로 TLR 수용체의 활성화를 통해 염증을 유도 하는 물질이다40). 이에 본 실험은 A549 세포 염증 유발 물질로 LPS를 사용하였다.
염증반응에서 Th1 (T-helper type 1) 타입은 Th type 1 cytokine의 IL-12 (Interleukin-12), IFN-γ (Interferon- γ) 등을 생산하여 박테리아 감염과 같은 intracellular pathogen에 대항하는 면역반응에 관여하지만, Th2 (T- helper type 2) 타입의 면역반응 증가는 천식 및 호흡기 질환 진행에 있어 매우 중요한 원인이다41,42). Th2 타입은 IL-1 (Interleukin-1), IL-3 (Interleukin-3), IL-4 (Interleukin-4), IL-5 (Interleukin-5), IL-6 (Interleukin-6), IL-13 (Interleukin-13) 및 TNF-α (Tumor necrosis factor α) 등 Th2 cytokine을 생산하여 면역글로불린E 합성과 염증이 유발된 기도에서 호산구의 축적에 중요한 역할을 한다43). 이러한 cytokine 중 IL-1, IL-6, TNF-α 등은 증가된 히스타민 분비와 염증성 세포의 반응에 관여하는 chemokines을 포함하여 기도 내의 염증을 유발하는 cytokine이다44). IL-8은 CXC chemokine subfamily에 속하며 기도에서 염증 부위로의 세포 이동을 매개하는 chemokine으로 주공급 세포는 기관지 상피세포로서 알레르기 염증 반응에 밀접한 관련을 가지며, 천식 환자의 기관지 상피세포에서 발현이 증가한다45). Cyclooxygenase (COX) 중 COX-2는 염증 자극에 의해 발현되고, COX-2에 의해 생성된 Prostaglandin E2 (PGE2)이 염증반응과 세포증식에 관여한다46). 특히 chemokines은 기도과민성 및 기관지 염증반응에 상관관계가 있으며 이들 중 MCP-1 (Monocyte chemoattractant protein 1)은 비만세포를 활성화시키고 기도로 leukotriene C4가 분비되도록 하여 기도과민성을 직접적으로 유도한다47). 기도 상피 세포내의 점액 유전자 중 MUC5AC 유전자에 의해 합성되는 당단백은 정상인과 천식 환자에서 기도 분비액의 주된 성분으로 알려져 있으며 기도 내 배상세포 증식 및 화생과 가장 관련성이 있다고 보고되었다48,49). 호산구는 천식 알레르기 반응에 중요하게 작용하며, 조직을 직접 파괴하여 히스타민 분비를 촉진시킨다. 이후 기관지 과민성을 증가시켜 기관지를 수축시키고 모세혈관 확장을 일으킨다50). 리아진 항체인 면역글로불린E는 helper T cell과 suppressor T cell의 조절 기능에 의해 그 생성이 결정되며, 알레르기 반응에 중요한 역할을 한다50).
A549 세포에 LPS 염증 처리를 한 후 LAM의 염증 개선 효과를 확인한 결과 IL-8, COX-2, MCP-1의 유전자 발현량은 농도 의존적으로 감소하였고 세포 내 바이오마커 생성량을 비교했을 때 IL-8, PGE2, MUC5AC의 발현량 모두 농도의존적으로 감소함을 보였다(Fig. 3, 4). 또한 미세먼지로 폐 염증반응을 유도하여 LAM을 경구투여한 동물의 혈청 바이오마커 생성량을 측정한 결과 IL-1β, IL-6, IL-8, TNF-α, histamine, PGE2의 발현량과 면역글로불린E 발현량 모두 농도의존적으로 감소함을 보였다(Fig. 7, 8). 따라서 LAM은 미세먼지가 탐식세포나 상피세포를 자극하여 증가된 염증성 cytokine을 감소시키며, 염증 반응을 촉발 하는 면역글로불린E를 감소 시킴으로서 기도염증과 폐질환 및 폐 감염을 예방하는 것을 예상할 수 있다.
점액은 몸 밖에서 유입되는 유해물질에 대한 세포의 독성물질을 비활성화 시키는 역할을 하며. 호흡기 내의 이물질 배출과 점막을 효과적으로 보호하는 역할을 한다고 보고되어져 있다.51). 점액 분비량을 측정한 결과 LAM 400 ㎎/㎏ 투여군에서 대조군에 비해 유의성 있는 증가가 나타났다(Fig. 5).
또한 면역세포수를 비교한 결과, 미세먼지를 유도한 대조군에 비해 LAM을 투여한 실험군에서 백혈구, 호중구, 림프구, 단핵구 수가 유의적으로 감소하였다(Fig. 6).
이상의 결과들을 종합해 볼 때, 미세먼지를 유도한 ICR mouse에 LAM 투여는 정상군에 비해 감소된 면역세포 수, 염증 관련 바이오마커 및 면역글로불린 함량을 낮춰주며 호흡기 질환 발현에 효과적인 기능성 소재로서의 가능성이 확인되었다.
결 론
본 연구는 미세먼지로 유발한 호흡기 질환에 대한 LAM의 치료 및 효능을 과학적으로 검증하고자 폐포상피세포주인 A549 세포에 LAM을 50, 100, 200 ㎎/㎖ 농도로 처리한 후 염증 관련 세포 내 유전자 발현량과 바이오마커를 확인하였을 때 모두 농도 유의적으로 감소하였으며, 생쥐의 기도 내 미세먼지 흡입을 통한 동물 모델을 이용하여 LAM을 200, 400㎎/㎏ 농도로 실험동물에게 총 14일간 경구투여 함으로서 점액분비량, 면역세포 수 및 혈청 내 바이오 마커 분석을 통해 확인한 결과, 점액분비량을 증가시켰으며, 바이오마커 생성량 및 면역세포 수를 농도 의존적으로 감소시켰다. 이러한 결과를 통해 LAM은 미세먼지로 인해 발생하는 호흡기질환을 억제함을 보여주었다. 이후, 인체 적용 시험 및 품질 개선에 대한 연구가 진행된다면 효과적인 천연물 소재로서 활용이 가능할 것으로 사료된다.
Acknowledgments
이 논문은 2018학년도 대전대학교 교내학술연구비 지원에 의해 연구되었습니다.
References
- Choi JK, Choi IS, Cho KK, Lee SH. Harmfulness of Particulate Matter in Disease Progression. Journal of Life Science. 2020;30(2):191-201.
-
Jung YJ, Yang WM, Jung YJ, Yang WM. Analysis of Korean Medical status of Acute Bronchitis, Chronic Bronchitis and Allergic Rhinitis patients. Journal of Korean Medicine. 2019;40(3):87-98.
[https://doi.org/10.13048/jkm.19029]

-
Loomis D, Huang W, Chen G. The International Agency for Research on Cancer (IARC) evaluation of the carcinogenicity of outdoor air pollution: focus on China. Chinese journal of cancer. 2014;33(4):189.
[https://doi.org/10.5732/cjc.014.10028]

- OCDE O. Economic Consequences of Outdoor Air Pollution: Organisation for Economic Co-operation and Development; 2016.
-
Kim Y, Lee H, Kim H, Moon H. Exploring message strategies for encouraging coping behaviors against particulate matter. Korea J Commun Inf. 2018;92:7-44.
[https://doi.org/10.46407/kjci.2018.12.92.7]

- JY S. Effects of ambient air particulate matter on the airway inflammation in murine model of asthma Department of Biomedical Science, Hanyang University 2007.08.
- DH K. Human Respiratory System. Korea Institute of Architectural Sustainable Environment and Building Systems. 2017.04;51-52.
- Jang YW, Kim JY, Kim HK, Lim SH. The Correlation between Fine Dust (PM10, PM2. 5) and The Number of Acute/Chronic Sinusitis Patients. The Journal of Korean Medicine Ophthalmology & Otolaryngology & Dermatology. 2018;31(3):1-11.
-
Kim HK, Kim MJ, Cho HY, Kim EK, Shin DH. Antioxidative and anti‐diabetic effects of amaranth (Amaranthus esculantus) in streptozotocin‐induced diabetic rats. Cell Biochemistry and Function: Cellular biochemistry and its modulation by active agents or disease. 2006;24(3):195-9.
[https://doi.org/10.1002/cbf.1210]

-
Shin DC. Health effects of ambient particulate matter. Journal of the Korean Medical Association. 2007;50(2):175-82.
[https://doi.org/10.5124/jkma.2007.50.2.175]

-
Kang KS, Nam CS, Park EK, Ha BJ. The Enzymatic Regulatory Effects of Laninaria japonica Fucoidan Extract in Hepatotoxicity. Journal of Life Science. 2006;16(7):1104-8.
[https://doi.org/10.5352/JLS.2006.16.7.1104]

-
Yamasaki-Miyamoto Y, Yamasaki M, Tachibana H, Yamada K. Fucoidan induces apoptosis through activation of caspase-8 on human breast cancer MCF-7 cells. Journal of agricultural and food chemistry. 2009;57(18):8677-82.
[https://doi.org/10.1021/jf9010406]

-
Nishino T, Nishioka C, Ura H, Nagumo T. Isolation and partial characterization of a noval amino sugar-containing fucan sulfate from commercial Fucus vesiculosus fucoidan. Carbohydrate Research. 1994;255:213-24.
[https://doi.org/10.1016/S0008-6215(00)90980-7]

-
Kim DJ, Song KE, Park JW, Cho HK, Lee KW, Huh KB. Clinical characteristics of Korean type 2 diabetic patients in 2005. Diabetes research and clinical practice. 2007;77(3):S252-S7.
[https://doi.org/10.1016/j.diabres.2007.01.067]

- Itoh H, Noda H, Amano H, Zhuaug C, Mizuno T, Ito H. Antitumor activity and immunological properties of marine algal polysaccharides, especially fucoidan, prepared from Sargassum thunbergii of Phaeophyceae. Anticancer research. 1993;13(6A):2045-52.
-
Zhang Q, Li Z, Xu Z, Niu X, Zhang H. Effects of fucoidan on chronic renal failure in rats. Planta medica. 2003;69(06):537-41.
[https://doi.org/10.1055/s-2003-40634]

- KOO JG, CHOI YS, KWAK JK. Blood-anticoagulant activity of fucoidans from sporophylls of Undaria pinnatifida, Laminaria religiosa, Hizikia fusiforme and Sargassum fulvellum in Korea. Korean Journal of Fisheries and Aquatic Sciences. 2001;34(5):515-20.
- Lee JH, Choi YH, Choi BT. The Aqueous Extract from Platycodi radix Attenuates Lipopolysaccharide-Induced NF-ՊB Activation in RAW 264.7 Cell and Acute Lung Injury in Rats. 2002.
- Kim SS, Lee SC, Shin HD, Shin MK, Kim JH, Song HJ. Studies on the allergy asthma effect of radix platicodi. The Korea Journal of Herbology. 2004;19(2):61-.
- Park CY, Hong KE. The Experimental Study on the suppression effect of Asthma and Immune response improvement of Platycodi Radix Herbal-acupuncture. Journal of Korean Institute of Herbal Acupuncture. 2006;9(3):23-35.
- Kim CH, Chung MH. Pharmacognostical studies on Codonopsis lanceolata. Korean Journal of Pharmacognosy. 1975;6(1):43-7.
- Suh J. Effect of Codonopsis lanceolata radix water extract on immunocytes. Korean J Food Nutr. 1996;9:379-84.
- Park SD, Lee GH, Lee YS, Kwon YK, Park JH, Choi SM, et al. Comparison of immunomodualtory effects of water-extracted Adenophorae radix, Liriopis tuber, Dendrobii Herba, Polygonati odorati Rhizoma and Polygonati Rhizoma. Journal of Physiology & Pathology in Korean Medicine. 2007;21(2):414-24.
- Jung JY, Jung SK, Jung HJ, Rhee HK. Microarray analysis of gene expression profile by treatment of Schizandrae fructus extract in inflammation-induced human epithelial A549 Cells. The Journal of Internal Korean Medicine. 2008;29(3):543-53.
- Han YK, Park YK. Effect of Atractylodis Rhizoma Alba water extract on streptozotocin-induced diabetes in rats. The Korea Journal of Herbology. 2011;26(4):23-30.
-
Kim SN, Kim HS, Nam GS, Hwang SW, Hwang SY. Inhibition of Inflammatory-cytokines Production and Prostaglandin E2 Activity by Puerariae Radix Extracts. Journal of the Korean Society of Food Science and Nutrition. 2006;35:28-34.
[https://doi.org/10.3746/jkfn.2006.35.1.028]

- Park JH, Lee BG, Byun GI, Kim DW. Antioxidant activities and inhibitory effect on oxidative DNA damage of Nelumbinis semen extracts. The Korea Journal of Herbology. 2010;25(4):55-9.
- Lee KS, Lee MW, Lee JY. Studies on the antibacterial activity of Poria cocos. The Korean Journal of Mycology. 1982;10(1):27-31.
-
Ling ZQ, Xie BJ, Yang EL. Isolation, characterization, and determination of antioxidative activity of oligomeric procyanidins from the seedpod of Nelumbo nucifera Gaertn. Journal of agricultural and food chemistry. 2005;53(7):2441-5.
[https://doi.org/10.1021/jf040325p]

-
Choi SH, Lee SJ, Jo WS, Choi JW, Park SC. Comparison of ingredients and antioxidant activity of the domestic regional wolfiporia extensa. The Korean Journal of Mycology. 2016;44(1):23-30.
[https://doi.org/10.4489/KJM.2016.44.1.23]

-
Jo HK, Han MH, Hong SH, Choi YH, Park C. Ethanol extracts of citrus peel inhibits adipogenesis through AMPK signaling pathway in 3T3-L1 preadipocytes. J Life Sci. 2015;25(3):285-92.
[https://doi.org/10.5352/JLS.2015.25.3.285]

- Jung JK, Son KH, Kim YS, Park YK. Effect of Citri Pericarpium ethanol extract on collagen-induced arthritis in mice. The Korea Journal of Herbology. 2011;26(3):1-6.
-
Woo JH. Review of PM-related Air Quality Improvement Policies of United States for PM-related Air Quality Improvement of Metropolitan Region in Korea. Journal of Korean Society for Atmospheric Environment. 2009;25(6):579-93.
[https://doi.org/10.5572/KOSAE.2009.25.6.579]

-
Stuart BO. Deposition and clearance of inhaled particles. Environmental health perspectives. 1984;55:369-90.
[https://doi.org/10.1289/ehp.8455369]

- Organization WH. Air pollution including WHO's 1999 guidelines for air pollution control. Geneva: World Health Organization. 2000.
-
Yang HJ, Kim SH, Jang AS, Kim SH, Song WJ, Kim TB, Ye Ym, You Y, Yu Jh, Yoon JS, Jee HM, Suh DI, Kim CW. Guideline for the prevention and management of particulate matter/yellow dust-induced adverse health effects on the patients with bronchial asthma. J Korean Med Assoc. 2015;58(11):1034-43.
[https://doi.org/10.5124/jkma.2015.58.11.1034]

-
Donaldson K, Stone V, Borm PJ, Jimenez LA, Gilmour PS, Schins RP, et al. Oxidative stress and calcium signaling in the adverse effects of environmental particles (PM10). Free Radical Biology and Medicine. 2003;34(11):1369-82.
[https://doi.org/10.1016/S0891-5849(03)00150-3]

- Hwang JH, Yang SY, Byun JS, Park YC. Effect of Mahwangyunpye-tang on Secretion of Airway Mucin and Tracheal Smooth Muscle. The Journal of Internal Korean Medicine. 2007;28(4):797-807.
- Park WY, Seo UK. Effects of Cheongjogupye-tang (淸燥救肺湯) and Yieum-jeon (理陰煎) on Secretion of Mucin from Respiratory Epithelial Cells. The Journal of Internal Korean Medicine. 2008;29(2):318-33.
-
Imai Y, Kuba K, Neely GG, Yaghubian-Malhami R, Perkmann T, van Loo G, et al. Identification of oxidative stress and Toll-like receptor 4 signaling as a key pathway of acute lung injury. Cell. 2008;133(2):235-49.
[https://doi.org/10.1016/j.cell.2008.02.043]

-
Bloemen K, Verstraelen S, Van Den Heuvel R, Witters H, Nelissen I, Schoeters G. The allergic cascade: review of the most important molecules in the asthmatic lung. Immunology letters. 2007;113(1):6-18.
[https://doi.org/10.1016/j.imlet.2007.07.010]

-
Busse WW, Rosenwasser LJ. Mechanisms of asthma. Journal of allergy and clinical immunology. 2003;111(3):S799-S804.
[https://doi.org/10.1067/mai.2003.158]

-
Laberge S, Pinsonneault S, Varga EM, Till SJ, Nouri-Aria K, Jacobson M, et al. Increased expression of IL-16 immunoreactivity in bronchial mucosa after segmental allergen challenge in patients with asthma. Journal of allergy and clinical immunology. 2000;106(2):293-301.
[https://doi.org/10.1067/mai.2000.108112]

-
Kim DH, Baek SY, Ki MR. Quality characteristics and antioxidant activities of aged black Liriope platyphylla. Korean J Food Preserv. 2019;26:505-12.
[https://doi.org/10.11002/kjfp.2019.26.5.505]

-
Sohn MH, Lee KE, Choi SY, Kwon BC, Kim WK, Jang GC, Chang MW, Kim KE. Effect of Mycoplasma pneumoniae on IL-8 Gene Expression in Human Respiratory Epithelial Cells. Pediatric Allergy and Respiratory Disease. 2004( Mar 1;14(1)):38-45.
[https://doi.org/10.1016/S0012-3692(15)37964-2]

- Ji JD, Lee YH, Song GG. Prostaglandin E2 (PGE2): Roles in Immune Responses and Inflammation. he Journal of the Korean Rheumatism Association. 2004;11(4):307-16.
- Hwang WS, Jeong SY, Kim JJ, Jung HJ, Jung SK. Analysis of Monocyte Chemoattractant Protein 1 (MCP-1) Polymorphism in Korean Patients with Asthma. The Journal of Internal Korean Medicine. 2008;29(1):32-41.
-
KIM YH, et al. Muc5ac Gene Expression Induced by Cigarette Smoke is Mediated Via a Pathway Involving ERK1/2 and p38 MAPK. Tuberculosis and Respiratory Diseases. 2005;58(6):590-9.
[https://doi.org/10.4046/trd.2005.58.6.590]

-
ZUHDI ALIMAM M, et al. Muc-5/5ac mucin messenger RNA and protein expression is a marker of goblet cell metaplasia in murine airways. American journal of respiratory cell and molecular biology. 2000;22(3):253-60.
[https://doi.org/10.1165/ajrcmb.22.3.3768]

- Lee CS, Rhee YS, Park YK, Rhee YK, Lee YC. Effect of Immunotherapy in Bronchial Asthma - Changes of Clinical Symptoms, Peripheral Eosinophil C. Korean Journal of Medicine. 1990;39(4):516-24.
-
Kang Y. Effect of Benincasa hispida Extract on Mucus Secretion in Rat Tracheobronchial Lumen. Journal of Physiology & Pathology in Korean Medicine. 2016;30(5):314-9.
[https://doi.org/10.15188/kjopp.2016.10.30.5.314]