양단탕 추출물의 항염증 효과에 대한 연구
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Yangdan-tang (YD) is recorded as a treatment to treat exterior-related fever illness in the Korean medicine. In this study, we examined the anti-inflammatory effects of YD, using YD water extract and lipopolysaccharide (LPS)-induced RAW 264.7 cells. First of all, we measured the amount of nitric oxide (NO) and prostaglandin E2 (PGE2), the products of inflammatory metabolism. Also, we measured enzymes such as inducible nitric oxide synthase (iNOS) and cyclooxygenase-2 (COX-2), as well as cytokines such as tumor necrosis factor alpha (TNF-α), interleukin 6 (IL-6), interleukin 1 alpha (IL-1α), and interleukin 1 beta (IL-1β). YD suppressed the production of NO and PGE2 in a dose dependent manner and reduced the amount of protein and the mRNA expression of iNOS and COX-2. Also, YD reduced the mRNA expression of TNF-α, IL-6, IL-1α and IL-1β. In conclusion, YD decreased production of LPS-induced inflammatory factor, which could be a clinical basic subject for inflammatory diseases.
Keywords:
Yangdan-tang (YD)(陽旦湯), Anti-inflammatory, Inflammatory factor, NO, PGE2서 론
항노화에 대한 관심이 날로 높아지고 있는 현대 사회에서 노화의 주범으로 손꼽히는 염증에 대한 관리 또한 그 중요도가 계속 증가하고 있다. 치매를 일으키는 가장 흔한 퇴행성 뇌질환인 알쯔하이머병과 혈관성 질환의 경우 항염증제의 투약으로 증세가 개선됨이 잘 알려져 있듯, 최근 연구를 통해 염증반응이 노화 과정과 노인성 질환에 밀접한 관련을 맺고 있음이 계속해서 밝혀지고 있다1).
염증(inflammation)은 병원균이나 상해와 같은 유해한 자극에 대한 생체의 방어 반응이지만, 상해 물질이나 자극이 제거되지 않고 지속되어 발생하는 만성 염증의 경우, 주된 염증세포인 대식세포가 분비한 물질들이 병원체뿐만 아니라 자신의 조직에도 상해를 주게 되므로, 궁극적으로 노화촉진이나 노인성 질환을 초래하게 된다2).
治未病을 중시하는 한의학에서 노화를 예방하거나 지연시키는 기능성 소재 발굴의 일환으로 다양한 한방 처방의 항염 효능 입증을 위한 기초 연구는 지속적으로 필요하지만, 실제 그 효과가 입증된 처방은 소수에 불과한 실정이다.
「醫學入門」에 수록된 陽旦湯(Yangdan-tang, YD)은 桂枝·芍藥·黃芩·甘草·生薑·大棗로 구성된 처방으로 傷寒陽證으로 신체 발열이 심하며 옷을 입지 않으려는 것을 치료한다. 傷寒陽證은 열이 나고, 얼굴이 붓고, 목이 마르는 등의 증상이 5-7일이 넘도록 지속되거나, 혹은 熱性의 약을 지나치게 복용하여 열이 성해지고, 몸이 굳으며, 번조로워 안절부절 못하고, 膿血性 泄瀉를 하는 증상군을 의미하는데3), 이는 현대의학에서 염증의 징후로 언급하는 국소의 腫脹, 發熱, 發赤, 疼痛 및 機能障害의 증상들과 유사성을 띤다. 그러나 현재 陽旦湯에 대한 실험연구는 진행되지 않은 상태로, 본 저자는 항염효능을 가질 것으로 사료되는 陽旦湯에 대한 본 실험을 진행하였으며 유의한 결과를 얻어 이에 보고하는 바이다.
재료 및 방법
1. 시료 제조
YD 2첩(88 g)은 세명대학교부속한방병원에서 구매하였다. 세척된 시료에 880 ㎖의 증류수를 넣은 뒤 3시간을 끓여 유효성분을 추출하였다. 추출액은 원심분리기를 사용하여 침전물을 제거하고, 회전농축기를 사용하여 200 ㎖가 되도록 감압 농축한 뒤, -70℃ 냉동고에서 동결시켰다. 이후 동결건조기를 사용하여 7일간 건조과정을 거쳐 최종적으로 18.2 g의 분말을 얻었다. 획득한 시료는 -20℃에서 보관하였다가 실험 시작 전 배지에 희석하여 사용하였다.
2. 세포 배양
RAW 264.7 cell은 한국세포주은행(Seoul, South Korea)에서 분양받았으며, 10% heat-inactivated fetal bovine serum (FBS)과 1% penicillin-streptomycin (P/S)을 포함한 Dulbeco's Modified Eagle's Media (DMEM)를 이용하여 37℃, 5% CO2 incubator에서 배양시켰다. 세포는 주기적으로 계대배양을 함으로써 증식으로 인한 과밀도 현상을 예방하였다.
3. MTT assay
5 × 105 cells/㎖로 분포된 RAW 264.7 cell을 500 ㎕씩 24 well plate에 분주한 후 24시간 배양하였다. 다음날, YD를 0, 50, 100, 200, 400 ㎍/㎖의 concentration으로 희석한 배지로 교환하고 1시간 다시 배양한 후, 700 ng/㎖의 concentration으로 LPS를 추가한 다음 하루 동안 추가 배양하였다. 5 ㎎/㎖의 Methylthiazol-2-yl-2,5-diphenyl tetrazolium bromide (MTT) 시약을 100 ㎕씩 각 well에 넣고 암청색의 포마잔(formazan)이 생성되도록 3시간 배양하였다. 그 후 각 well의 배지를 제거하고, Dimethyl sulfoxide (DMSO)를 500 ㎕씩 넣은 뒤 포마잔이 잘 녹도록 30분간 shaking 하였다. 그 후 새로운 96 well plate에 50 ㎕씩 옮겨 담은 뒤 570 ㎚ 조건에서 흡광도를 측정하였다.
4. NO assay
5 × 105 cells/㎖로 분포된 RAW 264.7 cell을 2 ㎖씩 6 well plate에 분주한 후 24시간 배양하였다. 다음날, YD를 0, 50, 100, 200, 400 ㎍/㎖의 concentration으로 희석한 배지로 교환하여 1시간 다시 배양한 후 LPS를 700 ng/㎖의 concentration으로 추가한 다음 하루 동안 추가 배양하였다. 그 후 새로운 96 well plate에 세포가 없는 상등액 100 ㎕을 각각 넣은 뒤 Nitric Oxide Detection kit (Intron Biotechnology, Korea)의 A, B 시약을 각각 50 ㎕씩 넣고 540 ㎚에서 흡광도를 측정하였다. 동일 plate에 넣은 Nitrite standard의 농도별 흡광도 값을 바탕으로 표준용량곡선을 작성하고 최종적으로 질소산화물(nitrite, NO2-)의 농도를 계산하였다.
5. PGE2 assay
5 × 105 cells/㎖로 분포된 RAW 264.7 cell을 2 ㎖씩 6 well plate에 분주한 후 24시간 배양하였다. 다음날 YD를 0, 50, 100, 200, 400 ㎍/㎖의 concentration으로 희석한 배지로 교환하여 1시간 다시 배양한 후 LPS를 700 ng/㎖의 concentration으로 추가한 다음 하루 동안 추가 배양하였다. 그 후 세포가 없는 상등액을 수거하여 R&D systems (USA)의 PGE2 assay kit의 지시에 따라 처리한 후 450 ㎚에서 흡광도를 측정하였다. 동시에 측정한 PGE2 standard의 흡광도 값을 바탕으로 표준용량곡선을 작성하고 최종적으로 PGE2의 농도를 계산하였다.
6. Western blot
5 × 105 cells/㎖로 분포된 RAW 264.7 cell을 10 ㎖씩 100 ㎜ dish에 분주한 후 24시간 배양하였다. 다음날, 200, 400 ㎍/㎖의 concentration으로 희석한 배지로 교환하여 1시간 다시 배양한 후 LPS를 700 ng/㎖의 concentration으로 추가한 다음 하루 동안 추가 배양하였다. 그 후 세포를 수거하여 단백질을 추출․정량한 후 각각 20 ㎍의 단백질을 Bio-Rad Laboratories (USA)의 l0-20% Mini-PROTEAN TGX™ precast gel과 NC membrane으로 분리․이송하였다. 그 후 10% skim milk에 NC membrane을 담가 blocking 과정을 거친 후, Tris-buffered saline Tween 20 (TBS-T)에 각각 1 : 1000, 1 : 2000, 1 : 5000으로 희석한 iNOS, COX-2, β-actin의 primary antibody를 16시간 부착시킨 뒤, TBS-T 용액에 1 : 5000으로 희석된 HRP-conjugated secondary antibody를 1시간 부착시켰다. 이후 Dogen (Korea)의 EZ-Western Detection kit를 사용하여 지시대로 처리한 후 웨스턴이미지분석시스템으로 분석하였다.
7. Real Time PCR
5 × 105 cells/㎖로 분포된 RAW 264.7 cell을 10 ㎖씩 100 ㎜ dish에 분주한 후 24시간 배양하였다. 다음날, 200, 400 ㎍/㎖의 concentration으로 희석한 배지로 교환하고 1시간 다시 배양한 후 LPS를 700 ng/㎖의 concentration으로 추가한 다음 6시간 추가 배양하였다. 염증 관련 사이토카인의 mRNA 발현량을 비교하기 위하여 Ambion (USA)의 TRIzol reagent을 사용하여 total RNA를 추출한 뒤 Toyobo (Japan)의 Revertra ACE kit를 사용하여 cDNA를 합성하였다. 합성된 cDNA는 Corning cellgro (USA)의 Tris/EDTA buffer를 첨가하여 1/5로 희석한 후 사용하였다. RT-PCR 실험은 Applied Biosystems (USA)의 real-time PCR system과 Thermo Fisher (USA)의 Taqman probe를 이용(Table 2)하여 실시간으로 유전자별 mRNA 발현량을 분석하였다.
8. 통계분석
각 결과값은 SPSS 12.0 통계 프로그램을 사용하여 one way-ANOVA로 군 간 분석을 시행하였으며 유의수준은 p < 0.05로 정하였다.
결 과
1. 陽旦湯의 세포독성
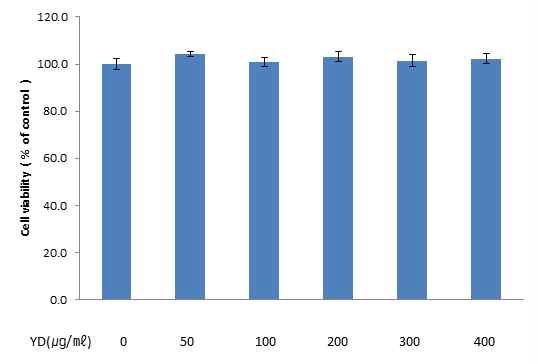
YD의 대식세포 생존율 저해 여부를 확인하기 위하여 MTT assay를 실시하였다. YD 무처리군의 흡광도 평균을 100%의 세포 생존율로 설정한 뒤, 이를 기준으로 YD 처리군들의 흡광도 값을 계산한 결과, 0, 50, 100, 200, 300, 400 ㎍/㎖의 concentration인 YD 처리군들의 세포 생존율은 100.0 ± 6.6, 104.2 ± 3.0, 100.9 ± 5.0, 103.2 ± 5.5, 101.5 ± 6.4, 102.3 ± 5.3%로, YD 처리군 모두에서 무처리군과의 유의미한 차이는 발생하지 않았다.
2. 陽旦湯의 NO 생성 및 iNOS 발현 변화
YD 및 LPS 무처리군의 NO 생성량은 4.37 ± 1.41 ㎛이었으며, 대조군(LPS 단독 처리)의 경우에는 20.30 ± 2.22 ㎛이었다. 50, 100, 200, 400 ㎍/㎖의 concentration으로 YD를 전처리 한 후 LPS를 넣은 실험군의 NO 생성량은 각각 18.55 ± 1.30, 12.40 ± 1.42, 6.55 ± 1.22, 6.77 ± 1.49 ㎛로 대조군과 비교하여 전 농도에서 유의성 있는 감소 양상을 보였다(Fig. 2a).
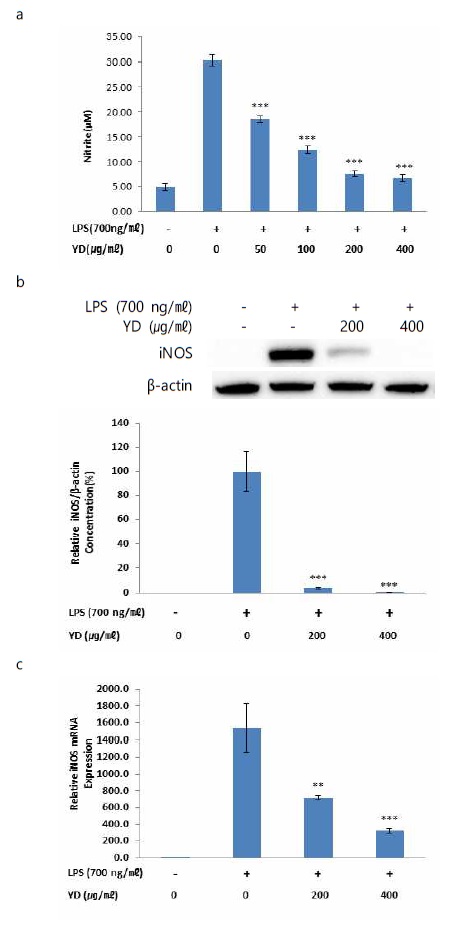
Effects of YD on LPS-stimulated NO production and iNOS protein and mRNA expression in RAW 264.7 cells. (a) Cells were co-treated with YD extracts (50, 100, 200 and 400 ㎍/㎖) and LPS (700 ng/㎖) for 24 h. Levels of NO in culture supernatants was determined by the Griess reaction. (b) Cells were co-treated with YD extracts (200 and 400 ㎍/㎖) and LPS (700 ng/㎖) for 24 h. Total iNOS proteins were isolated and analyzed by Western blot. (c) Cells were co-treated with YD extracts (200 and 400 ㎍/㎖) and LPS (700 ng/㎖) for 6 h. The mRNA level of iNOS was evaluated by real time PCR. GAPDH was used as an internal control for realtime PCR. Data were presented as the means ± SEM of triplicate experiments (** p < 0.01, *** p < 0.001 vs. the LPS alone treated group).
YD의 NO 생성 억제 효과와 iNOS간의 관련성을 확인하기 위하여 iNOS의 protein 및 mRNA 발현을 관찰하였다. 대조군(LPS 단독 처리)의 iNOS protein 생성량을 기준으로 실험군(YD 처리)들의 상대적인 생성량을 확인한 결과, 약물 및 LPS 무처리군의 경우에는 iNOS protein이 관찰되지 않았으며, 200, 400 ㎍/㎖의 concentration으로 YD를 처리한 실험군의 iNOS protein 생성량은 각각 3.91 ± 0.9%, 0.47 ± 0.1%로 대조군과 비교하여 모두 유의성 있는 감소 양상을 보였다(Fig. 2b). iNOS mRNA의 상대적 발현은 무처리군과 비교하여 대조군에서 1541.0 ± 286.9배 증가하였으며, 200, 400 ㎍/㎖의 concentration으로 YD를 처리한 실험군의 경우 각각 720.8 ± 24.0배, 323.8 ± 27.1배의 값을 나타내어 대조군과 비교하여 모두 유의성 있는 감소 양상을 보였다(Fig. 2c).
3. 陽旦湯의 PGE2 생성 및 COX-2 발현 변화
YD 및 LPS 무처리군의 PGE2 생성량은 461 ± 160 pg/㎖이었으며, 대조군의 경우에는 1973 ± 130 pg/㎖이었다. 50, 100, 200, 400 ㎍/㎖의 concentration으로 YD를 처리한 실험군의 PGE2 생성량은 각각 1802 ± 139, 1745 ± 188, 1684 ± 157, 1595 ± 157 pg/㎖로 대조군과 비교하여 200, 400 ㎍/㎖의 concentration으로 YD를 처리한 실험군에서 유의성 있는 감소 양상을 보였다(Fig. 3a).
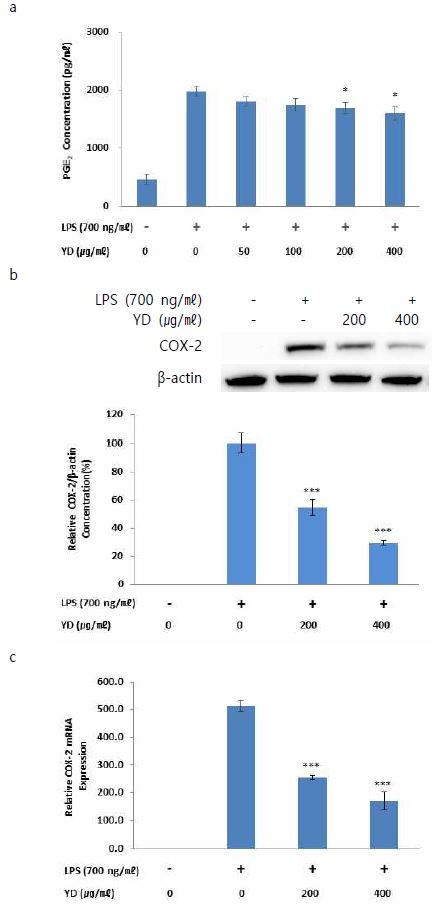
Effects of YD on LPS-stimulated PGE2 production and COX-2 protein and mRNA expression in RAW 264.7 cells. (a) Cells were co-treated with YD extracts (50, 100, 200 and 400 ㎍/㎖) and LPS (700 ng/㎖) for 24 h. Levels of PGE2 in culture supernatants were measured by ELISA. (b) Cells were co-treated with YD extracts (200 and 400 ㎍/㎖) and LPS (700 ng/㎖) for 24 h. Total COX-2 proteins were isolated and analyzed by Western blot. (c) Cells were co-treated with YD extracts (200 and 400 ㎍/㎖) and LPS (700 ng/㎖) for 6 h. The mRNA level of iNOS was evaluated by real time PCR. GAPDH was used as an internal control for realtime PCR. Data were presented as the means ± SEM of triplicate experiments (* p < 0.05, *** p < 0.001 vs. the LPS alone treated group).
또한 PGE2 생성 과정에 기여하는 COX-2 효소와의 관련성을 확인하고자 COX-2의 protein 및 mRNA 발현을 관찰하였다. 대조군의 COX-2 protein 생성량을 기준으로 실험군들의 상대적인 생성량을 확인한 결과, 무처리군의 경우에는 COX-2 protein이 관찰되지 않았으며, 200, 400 ㎍/㎖의 concentration으로 YD를 처리한 실험군의 COX-2 protein 생성량은 각각 54.72 ± 8.2, 29.61 ± 2.1%로 대조군과 비교하여 모두 유의성 있는 감소 양상을 보였다(Fig. 3b). COX-2 mRNA의 상대적 발현은 무처리군과 비교하여 대조군에서 514.0 ± 19.1배 증가하였으며, 200, 400 ㎍/㎖의 concentration으로 YD를 처리한 실험군의 경우 각각 254.3 ± 6.7배, 170.8 ± 33.4배의 값을 나타내어 대조군과 비교하여 모두 유의성 있는 감소 양상을 보였다(Fig. 3c).
4. 陽旦湯의 IL-1α, IL-1β, IL-6, TNF-α mRNA 발현 저해
YD가 대식세포에서의 pro-inflammatory cytokine 발현에 어떠한 영향을 미치는지 확인하기 위하여 RT-PCR 실험을 진행하였다. IL-1α mRNA의 상대적 발현은 약물 및 LPS 무처리군과 비교하여 대조군에서 46282.7 ± 2018.3배 증가하였으며. 200, 400 ㎍/㎖의 concentration으로 YD를 처리한 실험군의 경우 각각 34216.8 ± 1726.7배, 9184.5 ± 1077.9배의 값을 나타내어 대조군과 비교하여 모두 유의성 있는 감소 양상을 보였다(Fig. 4a). IL-1β mRNA의 상대적 발현은 약물 및 LPS 무처리군과 비교하여 대조군에서 24902.5 ± 24.4배 증가하였으며, 200, 400 ㎍/㎖의 concentration으로 YD를 처리한 실험군의 경우 각각 15127.2 ± 1222.0배, 4910.5 ± 1207.9배의 값을 나타내어 대조군과 비교하여 모두 유의성 있는 감소 양상을 보였다(Fig. 4b). IL-6 mRNA의 상대적 발현은 약물 및 LPS 무처리군과 비교하여 대조군에서 71008.4 ± 3131.3배 증가하였으며, 200, 400 ㎍/㎖의 concentration으로 YD를 처리한 실험군의 경우 각각 32725.4 ± 3043.2배, 11631.1 ± 512.9배의 값을 나타내어 대조군과 비교하여 모두 유의성 있는 감소 양상을 보였다(Fig. 4c). TNF-α mRNA의 상대적 발현은 약물 및 LPS 무처리군과 비교하여 대조군에서 119.5 ± 10.1배 증가하였으며, 200, 400 ㎍/㎖의 concentration으로 YD를 처리한 실험군의 경우 각각 82.2 ± 4.9배, 57.3 ± 13.9배의 값을 나타내어 대조군과 비교하여 모두 유의성 있는 감소 양상을 보였다(Fig. 4d).
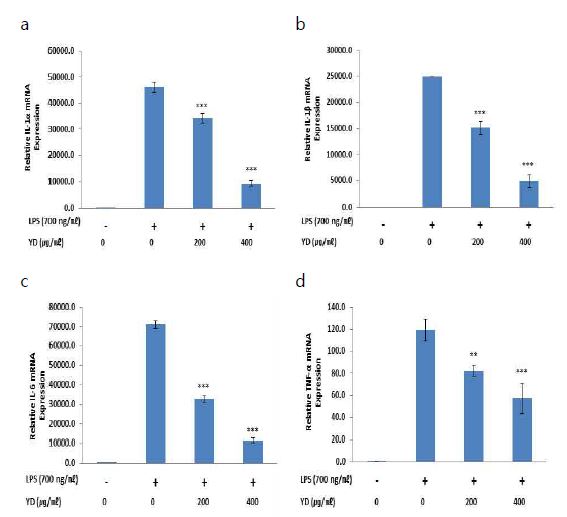
Effects of YD on LPS-stimulated IL-1α, IL-1β, IL-6 and TNF-α mRNA expression in RAW 264.7 cells. Cells were co-treated with YD extracts (200 and 400 ㎍/㎖) and LPS (700 ng/㎖) for 6 h. The mRNA levels of IL-1α (a), IL-1β (b), IL-6 (c) and TNF-α (d) were evaluated by real time PCR. GAPDH was used as an internal control for realtime PCR. Data were presented as the means ± SEM of triplicate experiments (** p < 0.01, *** p < 0.001 vs. the LPS alone treated group).
고 찰
陽旦湯(Yangdantang, YD)이라는 명칭은 3C세기 초 張仲景이 저술한 「金匱要略」에서 처음 나타났으나 이때는 桂枝·芍藥·甘草·生薑·大棗로 구성된 桂枝湯의 별칭으로 사용되었으며4), 이후 7C 중엽 孫思邈이 저술한 「備急千金要方」, 752년에 王燾가 저술한 「外臺秘要」, 1108년 朱肱이 편찬한 「類證活人書」, 1345년 危亦林이 편찬한 「世醫得效方」 등에서 黃芩이 더해진 陽旦湯을 언급하였다3,5-7). 현재 임상가들의 多用 의학서적으로 손꼽히는 「東醫寶鑑」(1610년)과 「方藥合編」(1884년)에 수록된 陽旦湯8,9)은 桂枝·芍藥 각 3돈, 黃芩 2돈, 甘草 1돈, 生薑 3片, 大棗 2枚로 구성8,9)되어 있으며 원출전인「醫學入門」外集卷之四 傷寒用藥賦에는 表寒裏熱한 傷寒陽證을 치료한다3)고 기재되어 있다. 陽旦湯에 대한 실험연구는 현재 진행된 바가 없으나, 陽旦湯의 구성약물인 桂枝의 경우, 항산화, 항염, 항주름, 미백 효과가 있는 것으로 보고10)되었으며, 芍藥은 항산화11) 효과가, 黃芩은 항염12) 및 항산화13) 효과가 확인되었으며, 甘草․生薑․大棗14-19)도 모두 항염증 및 항산화 효과가 밝혀져 있다. 또한 陽旦湯의 근간이 되는 桂枝湯은 頭痛, 惡風, 發熱, 汗出 등 太陽 中風證에 사용되는 대표처방6)으로 항염 효능을 보여주는 다양한 결과들이 보고20-22)되었으며, 瀉實火․除濕熱의 효능을 가지고 있는 黃芩 또한 항염 효능이 보고12)되었다. 따라서 陽旦湯의 개별 약재들이 모두 항염․항산화의 효능을 가지고 있을 뿐만 아니라, 桂枝湯 加 黃芩으로 구성된 陽旦湯의 去風淸熱 효능 또한 현대의학적으로는 항염 효과를 지칭하는 것으로 사료되어 본 실험을 진행하였다.
RAW 264.7 cell은 BALB/c 마우스 유래 대식세포 유사 세포주로, 다양한 약물들의 세포유래 염증매개물질의 생성 및 염증 신호전달체계 조절 여부를 확인하는 항염증실험의 기초 모델로서 염증 감소 효능 약물을 밝혀내기 위하여 다용되고 있다23,24). 본 연구에서 실험하고자 하는 YD의 concentration에서 RAW 264.7 cell의 생존율이 저해되는지 여부를 확인한 결과, YD 처리군은 400 ㎍/㎖ 이하의 전 농도에서 세포생존율에 영향을 받지 않음이 관찰되었다.
NO (nitric oxide)는 산화질소합성효소(nitric oxide synthase, NOS)에 의해 L-아르지닌으로부터 합성된다. NOS에는 내피세포성(endothelial, eNOS), 신경성(neuronal, nNOS) 유도성(inducible, iNOS)의 3가지 종류가 존재하는데, 이 중 iNOS는 그람음성 세균의 세포벽 구성성분 중 하나인 lipopolysaccharide (LPS)와 같은 미생물 생성물이나 시토카인(cytokines) 등에 의해 대식세포가 활성화될 때 유도되어 NO 생성을 초래한다25,26). NO 및 이의 유도체들은 살균성을 가지고 있어서 감염에 대한 숙주의 방어적 매개체로 작용하지만, NO로부터 유래되는 자유라디칼은 세포 독성을 초래하여 숙주에 손상을 입힌다27).
본 연구에서 YD의 NO 생성에 미치는 효과를 확인한 결과, LPS만 단독 처리한 대조군과 비교하여 YD를 처리한 모든 실험군에서 유의성 있는 NO 생성 저해 효과가 관찰되었으며, 또한 200, 400 ㎍/㎖의 concentration으로 YD를 처리한 실험군에서 유의성 있는 iNOS protein 생성 저하 및 iNOS mRNA 발현 억제도 나타났다.
염증의 혈관 및 전신반응에 관여하는 프로스타글란딘(prostaglandins, PGs)은 아라키돈산(arachidonic acid, AA) 대사물질로 대식세포, 비만세포, 내피세포 및 다양한 세포들에서 분비되는데 cyclooxygenase (COX) 효소의 작용에 의해 합성된다. COX는 인체 내에서 항상 발현되는 COX-1과 다양한 염증 자극에 의해 유도되는 COX-2의 2가지 형태로 존재하는데, 이 중 COX-2는 LPS, 박테리아 독소, 시토카인 등의 염증 자극 인자나 매개 물질로 인하여 촉진되어 대량의 prostaglandin E2 (PGE2)를 생산케 한다28-31). 본 연구에서 YD의 PGE2 생성에 미치는 효과를 확인한 결과, LPS만 단독 처리한 대조군과 비교하여 200, 400 ㎍/㎖ 농도의 YD 처리군에서 PGE2 생성 저하 효과가 유의성 있게 관찰되었으며, COX-2의 단백질 생성 저하 및 mRNA 발현 억제도 200, 400 ㎍/㎖ 농도의 YD 처리군에서 유의성 있게 나타났다.
NO, PGE2와 더불어 염증반응에서 주요 세포-유래 매개물질 중 하나인 시토카인(cytokines)은 오랫동안 세포 면역반응에 관여하는 것으로 알려진 폴리펩티드로 급성 및 만성 염증 모두에서 중요한 역할을 담당하고 있다. 급성 염증에서는 interleukin (IL)-1α, IL-1β, IL-6, tumor necrosis factor (TNF)-α 등이, 만성 염증에서는 interferon-γ와 IL-12가 대표적인 시토카인이다25,32). 이중 본 연구에서는 RAW 264.7 cell에서의 IL-1α, IL-1β, IL-6, TNF-α mRNA 발현 변화를 관찰하여, 염증성 질환에 대한 YD의 효과를 확인하고자 하였다.
실험 결과, YD는 200, 400 ㎍/㎖의 concentration에서 LPS로 촉진된 IL-1α, IL-1β, IL-6, TNF-α mRNA의 발현을 농도 의존적으로 억제하는 유의성 있는 효과를 보였는데, 이는 YD가 염증반응에서 세포-유래 매개물질의 생성에 관여하는 세포 내 신호회로를 조절함으로써 염증 억제 효능을 가진다는 것을 시사하고 있는 것이다.
상기 결과들을 통해 YD는 NO 및 PGE2 발생 억제, iNOS 및 COX-2의 protein 생산과 mRNA 발현 저하, IL-1α, IL-1β, IL-6, TNF-α의 mRNA 발현 저하를 바탕으로 항염증 효과를 갖고 있다는 것을 확인할 수 있었다. 따라서 YD는 염증성 질환의 치료제제 및 다양한 기능성 제품의 유효성분으로 활용될 수 있을 것으로 사료된다.
결 론
YD의 항염증 효과를 확인하고자 LPS로 자극한 RAW 264.7 cell을 이용하여 NO 및 PGE2 발생, COX-2 및 iNOS의 protein 생산과 mRNA 발현, 주요 시토카인인 IL-1α, IL-1β, IL-6, TNF-α의 mRNA 발현에 대하여 실험한 결과, 다음과 같은 결론에 도달하였다.
YD는 NO와 PGE2의 생성을 억제한다.
YD는 COX-2 및 iNOS의 protein 생산과 mRNA 발현을 감소시킨다.
YD는 IL-1α, IL-1β, IL-6, TNF-α의 mRNA 발현을 감소시킨다.
상기의 결과를 바탕으로 YD는 항염증 효과가 있을 것으로 사료된다.
Acknowledgments
이 논문은 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(NRF-2017R1C1B5077080).
References
- Jung HY, Kim JM, Lee EK, Choi YJ. Molecular inflammation as the underlying mechanism of aging process and vascular diseases. KSBMB News. 2010;30(3):41-52.
-
Chung HY, Sung B, Jung KJ, Zou Y, Yu BP.The molecular inflammatory process in aging. Antioxid Redox Signal. 2006;8(3-4):572-81.
[https://doi.org/10.1089/ars.2006.8.572]

- Li C. Yixuerumen. Seoul:Bubin books;2009. p. 1122-3.
- Kim JB. Interpretation of ‘Synopsis of Prescriptions of the Golden Chamber'. Yongin:Hanuimunhwasa;2003. p. 564.
-
Korean Institute of Oriental Medicine. Yangdantang B [Internet]. Korean Intellectual Property Office;2007.
[https://doi.org/10.20929/KTKP.PRE.0000090541]

- Moon JJ. An GS. Kim JB, Park WS, Park JH, Kim DH et al. Precise Interpretation of ‘Treatise on Cold Damage Diseases'. Yongin:Hanuimunhwasa;2017. p. 71-6, 108,
-
Korean Institute of Oriental Medicine. Yangdantang D [Internet]. Korean Intellectual Property Office;2007
[https://doi.org/10.20929/KTKP.PRE.0000094537]

- Heo J. Donguibogam. Hadong:Donguibogam Publishing Inc;2005. p. 1069.
- Hwang DY. Bangyakhappyun. Seoul:Namsandang;2003. p. 304.
- Lee TH. Effects of Cinnamomum cassia, Cucumismelo and Thuja orientalis extract on the anti-oxidant, anti-inflammatory, anti-allergy, anti-wrinkle and whitening. Daejeon:Daejeon University;2008. 65 p.
- Lim CS, Kim KS. Antioxidant Effects of P. R. ( Paeoniae Radix ) Aqua - acupuncture Solution in Vitro. Journal of Acupuncture Research. 1997;14(2):191-8.
- Yoon SB, Han HS, Lee YJ. Effect of Scutellariae Radix Extract on the Proinflammatory Mediators in Raw 264.7 Cells Induced by LPS. Kor. J. Herbology. 2011;26(2):75-81.
- Cho SI, Oh WW. Anti-Oxidative Effects of Scutellariae Radix. Kor. J. Herbology. 2005;20(3):67-74.
- Lee YK, Roh SS. The Experimental Study of Glycyrrhiza uralensis on Wound Healing by Antioxidant Effect. Journal of Oriental Medicine Research Institute in Daejeon University. 2016;25(1):145-53.
- Bak JP, Son JH, Kim YM, Lee EY, Leem KH, Kim EH. Suppression of Inflammatory Macrophage Responese by Glycyrrhiza Uralensis Herbal Acupuncture Extract. Korean Journal of Acupuncture. 2011;28(4):49-58.
- Ryu HS. The Effects of Zingiber officinale Roscoe Extracts on Mouse IFN-γ and IL-10 Production. Korean J. Food&Nutr. 2007;20(3):259-64.
- Kim EJ, Ahn MS. Antioxidative Effect of Ginger Extracts. Korean Journal of Food and Cookery Science. 1993;9(1):37-42.
- Jung JE, Cho EJ. Enhancement of Anti-inflammatory Effect of Zizyphus jujuba var. inermis Fruits by Fermentation. Cancer prevention research. 2011;16(3):263-8.
- Hong CE, Chun YH, Lyu SY. Anti-inflammatory and Antioxidant Effects of Zizyphus jujuba Miller var. inermis extracts. Kor. J. Pharmacogn. 2019;50(2):86-95.
-
Yoo SR, Kim Y, Lee MY, Kim OS, Seo CS, Shin HK, Jeong SJ. Gyeji-tang water extract exerts anti-inflammatory activity through inhibition of ERK and NF-κB pathways in lipopolysaccharide-stimulated RAW 264.7 cells. BMC Complement. Altern. Med. 2016;16:390-9.
[https://doi.org/10.1186/s12906-016-1366-8]

- Jiao H, Ma J, Chen Y, Ju D, Xiang L. and Wang S. Effects of guizhi tang on inflammatory cytokines in myocardial ischemia and hyperlipidemia rats. Zhongguo Zhong Yao Za Zhi. 2012;37:1634-7.
-
Kutsuwa M, Nakahara, N, Kubo M, Hayashi K, Ohizumi Y. A comparative study of Kakkon-to and Keishi-to on prostaglandin E(2) release from rabbit astrocytes. Phymedicine. 1998;5: 275-82.
[https://doi.org/10.1016/S0944-7113(98)80066-4]

- Kindt TJ, Goldsby RA, Osborne BA. Innate immunity : Tenney S. Kuby Immunology. 6th ed. New York:Freeman press;2007. p. 52-73.
- Kim BH, Lee YT, Kang KH. Codonopsis Lanceolata Inhibits Inflammation through Regulation of MAPK in LPS-stimulated RAW264.7 cells. J Physiol Pathol Korean Med. 2010;24(1):80-4.
-
Dawson TM, Dawson VL, Snyder SH. A novel neuronal messenger molecule in brain:The free radical, nitric oxide. Ann Neurol. 1992;32:297-311.
[https://doi.org/10.1002/ana.410320302]

-
Wang MJ, Lin WW, Chen HL, Chang YH, Ou HC, Kuo JS, et al. Silymarin protects dopaminergic neurons against lipopolysaccharide-induced neurotoxicity by inhibiting microglia activation. Eur J Neurosci. 2002;16(11):2103-12.
[https://doi.org/10.1046/j.1460-9568.2002.02290.x]

-
Hanisch UK. Microglia as a source and target of cytokines. Glia. 2002;40(2):140-55.
[https://doi.org/10.1002/glia.10161]

-
Chen W, Tang Q, Gonzales MS, Bowden GT. Role of p38 MAP kinases and ERK in mediating ultraviolet-B induced cyclooxygenase-2 gene expression in human keratinocytes. Oncogene. 2001;20(29):3921-6.
[https://doi.org/10.1038/sj.onc.1204530]

-
Marina L, Kamal RM, Andrew F, Gary B, Jeremy S, Andrew RC. Regulation of Cyclooxygenase 2 mRNA Stability by the Mitogen-Activated Protein Kinase p38 Signaling Cascade. Mol Cell Biol. 2000;20(12):4265-74.
[https://doi.org/10.1128/MCB.20.12.4265-4274.2000]

-
Mitchell JA, Larkin S, Williams TJ. Cyclooxygenase-2: regulation and relevance in inflammation. Biochemical Pharmacology. 1995;50(10):1535-42.
[https://doi.org/10.1016/0006-2952(95)00212-X]

-
Crofford LJ, Lipsky PE, Brooks P, Abramson SB, Simon LS, Van de Putte LB. Basic biology and clinical application of specific cyclooxygenase-2 inhibitors. Arthritis Rheum. 2000;43(1):4-13.
[https://doi.org/10.1002/1529-0131(200001)43:1<4::AID-ANR2>3.0.CO;2-V]

-
Raabe T, Bukrinsky M, Currie RA. Relative contribution of transcription and translation to the induction of tumor necrosis factor-alpha by lipopolysaccharide. J Biol Chem. 1998;273(2):974-80.
[https://doi.org/10.1074/jbc.273.2.974]