시스템 약리학적 분석에 의한 황금의 항균효과
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
This study was performed to find antibacterial substances contained in Scutellariae Radix (SR) using a systems pharmacological analysis method and to establish an effective strategy for the prevention and treatment of infectious diseases. Analysis of the main active ingredients of SR was performed using Traditional Chinese Medicine Systems Pharmacology (TCMSP) Database and Analysis Platform. 36 active compounds were screened by the parameter values of Drug-Likeness (DL), Oral Bioavailability (OB), and Caco-2 permeability (Caco-2), which were based on the drug absorption, distribution, metabolism, and excretion indicators. The UniProt database was used to obtain information on 159 genes associated with active compounds. The main active compounds with antibacterial effects were wogonin, β-sitosterol, baicalein, acacetin and oroxylin-A. Target proteins associated with the antibacterial action were chemokine ligand 2, interleukin-6, tumor necrosis factor, caspase-8,9 and mitogen-activated protein kinase 14. In the future, systems pharmacological analysis of traditional medicine will be able to make it easy to find the important mechanism of action of active substances present in natural medicines and to optimize the efficacy of medicinal effects for combinations of major ingredients to help treat certain diseases.
Keywords:
Scutellariae Radix, Antibacterial action, Gene ontology analysis, Systems pharmacological analysis서 론
현대사회는 방사능, 각종 환경오염 물질, 음주, 흡연, 스트레스를 통하여 단백질과 세포들의 변형이 일어남에 따라 암, 동맥경화, 당뇨, 그리고 현재 창궐하고 있는 감염성 질환 등과 같은 질병으로 고통 받는 환자들이 날마다 증가하고 있는 추세에 있으며, 이에 따른 치료를 위한 약물들의 부작용 또한 심각하게 증가하고 있어 이들을 치료하거나 예방하기 위한 천연화합물의 소재에 관심이 높아지고 있다1,2).
특히 세균성 식중독의 치료를 위한 항생제의 지속적인 사용과 남용에 따른 항생제 안전성 및 저항성 문제를 근본적으로 극복하기 위하여 자연친화적인 식품 보존과 천연 항균물질 개발에 대한 연구는 필수적이다3).
천연물에 함유되어 있는 생리활성 물질은 생체 내에서 선천 면역세포를 활성화하고, 외부에서 유입되는 항원에 대한 항체의 생성을 촉진시키며, 체내 생화학적 수치들을 정상화하는 등 생체방어 시스템을 증가시켜 면역기능을 정상화시킴으로써 여러가지 질환을 예방하고 치료하는 기능을 가진다4).
오늘날에 사용되고 있는 약물의 50%정도는 천연물에서 유래된 것으로 선진국에서는 전 세계에 분포하고 있는 자원식물에 대한 경제적 효용가치를 높게 평가하여 유용 천연 생물자원 활용에 관한 기술개발이 진행되어지고 있다5).
이에 국내에서도 인체에 좀 더 자연 친화적이고 안전한 한약재 추출물에 대한 관심이 높아지고 있는데, 다성분으로 구성된 한약재에서 단일 타깃을 연구하는 방식은 한계가 많은 접근법이다. 본 연구는 축적된 빅데이터를 이용하여 한약재의 주요 성분 및 지표성분, 그리고 특정 성분의 항균작용 기전을 신속하고 명확하게 파악하여 추후 감염병의 예방과 치료 전략에 효율적으로 이용할 수 있는 기반을 제시하고자 한다.
속썩은풀(Scutellaria baicalensis G.)은 주로 한국, 중국의 하동, 사천, 만주, 그리고 몽골 및 동시베리아 등에 분포하며, 초본식물인 꿀풀과에 속하는 여러해살이풀이다. 높이는 20~60 cm이며, 잎은 마주 나는데 길이 4.5cm 정도이다. 봄 혹은 9-10월에 채취한 뿌리의 껍질을 벗겨 말린 것이 黃芩(Scutellariae Radix, SR)이다6-8). 黃芩의 성미는 苦, 寒, 無毒하고 苦로 燥濕하고 寒으로 淸熱하여 肺, 膽, 胃, 大腸의 濕熱을 淸利하여 熱病의 煩熱不退, 濕熱로 인한 痞滿, 瀉痢腹痛, 黃疸등에 常用하며, 瀉火解毒하는 효능이 있어 熱積에 의한 下瀉下血혹은 癰疽疔瘡, 目赤腫痛에도 유효하다9).
黃芩의 주요 성분은 flavonoid계 화합물인 oroxylin-A, oroxylin-α-7-O-glucuronide, baicalin, baicalein, chrysin, wogonin, wogonoside, 등 30 여종이 알려져 있으며, sterol계로는 β-sitosterol, campesterol, stigmasterol 등으로 구성되어 있다. 또한 당류로서 D-glucose와 sucrose 등이 함유되어 있다. 그 외 14종의 아미노산, 정유 등이 있으며, 다양한 antibacterial 혹은 antiviral 효과, 항산화, 항염, 항과민, 진정작용 및 혈압강하 그리고 항암 효과가 보고되고 있다. 黃芩의 광범위한 항산화 및 항염증 작용은 baicalein, baicalin, wogonin, wogonoside 등의 flavone에서 유래한다10,11). 또한, 많은 인간 유래의 암세포에서 세포의 성장을 억제하여 세포고사를 유도하는 항암기전이 보고되어 있다12).
이렇듯 黃芩에 대한 연구 성과가 많이 보고되어 있고, 다양한 활성 성분을 함유하고 있음에도 활성 성분과 관련된 타깃 유전자에 관한 연구는 이루어진바 없다. 본 연구에서는 黃芩의 잠재적 활성성분과 관련 타깃 유전자를 네트워크 약리학적 분석을 이용하여 밝혀내었다. 나아가서 黃芩과 관련된 유전자들의 생체 작용을 예측한 후, 그 중 항균작용에 초점을 맞춰 분석을 진행하였다. 본 연구로 항균, 항암효과로 주목받아 온 黃芩의 효능을 재조명하고, 생물정보학적 기초자료를 제시하고자 한다.
재료 및 방법
1. 활성 성분의 동정
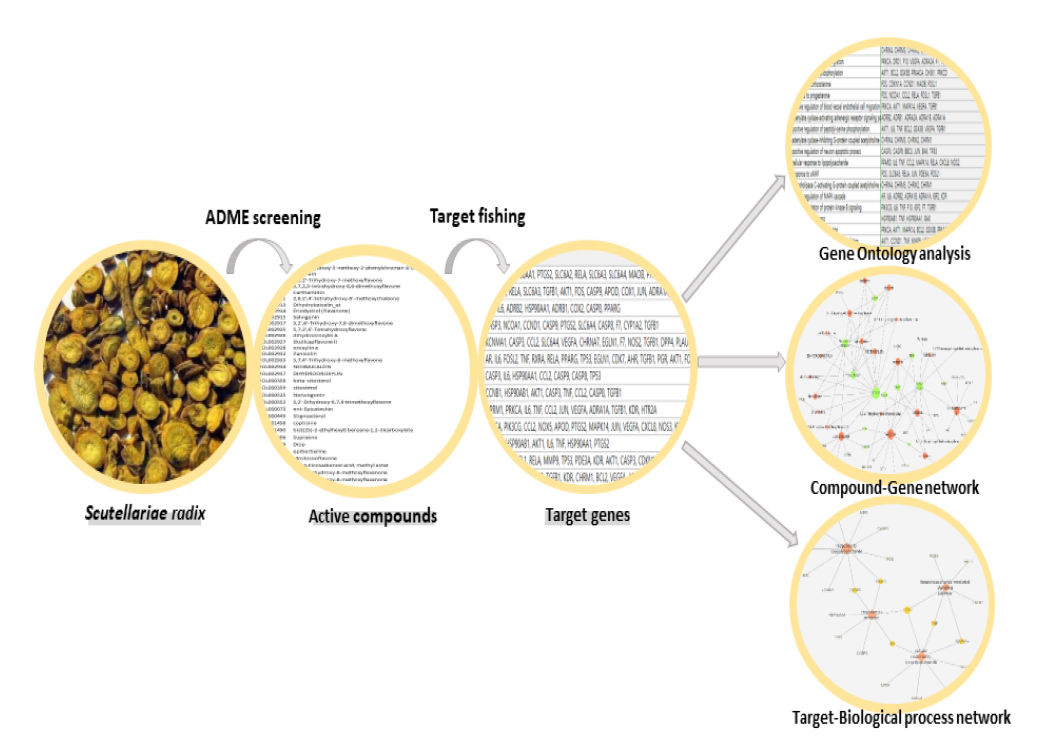
Traditional Chinese Medicine Systems Pharmacology (TCMSP, http://ibts.hkbu.edu.hk/LSP/tcmsp.php) Database and Analysis Platform을 이용하여 黃芩의 활성성분을 스크리닝하였다13). 본 연구의 전체적 흐름도는 Fig. 1에 요약하였다. 약물의 흡수와 분포, 대사, 배설(ADME: absorption, distribution, metabolism, extraction) 지표에 근거를 둔 약리화(Drug-Likeness, DL), 생리활성도(Oral bioavailability, OB), 장내흡수도(Caco-2 permeability, Caco-2) 값을 기준으로 스크리닝하였다. DL 값은 생체 내에서 예측되는 약리 활성에 대한 값으로 값이 높을수록 생리 활성이 높다. 본 논문에서는 DL값을 0.18 이상으로 설정하였다. OB값은 구강 투여된 물질이 위장관, 간, 소장 등 생체 내에서 용해되어 활성성분으로 흡수되는 수치로 약동학에서 가장 중요한 척도이다. 본 연구에서는 OB값 30% 미만은 제외하였다. Caco-2는 구강 투여된 약물이 가장 많이 흡수되는 소장에서의 흡수도로 약물의 체내 흡수력을 예측하는 척도이다. 본 연구에서는 Caco-2 값 -0.4 미만은 제외하였다14,15).
2. 타깃 단백질 수집 및 관련 생체대사 분석
활성성분과 연관된 모든 타깃 유전자는 UniProt database (http://www.uniprot.org)를 이용하여 각 유전자의 정보를 확보하였다. DAVID 6.8 Gene Functional Classification Tool (https://david.ncifcrf.gov/)을 사용하여 수집한 유전자에 연관된 생체대사 과정(biological process)을 찾기 위한 유전자 온톨로지 분석(gene ontology analysis)을 수행하였다. P값은 0.01 미만으로 설정하였으며, Benjamini-Hochberg 방법으로 P값을 보정하였다16,17).
3. 수집된 타깃에 대한 네트워크 분석
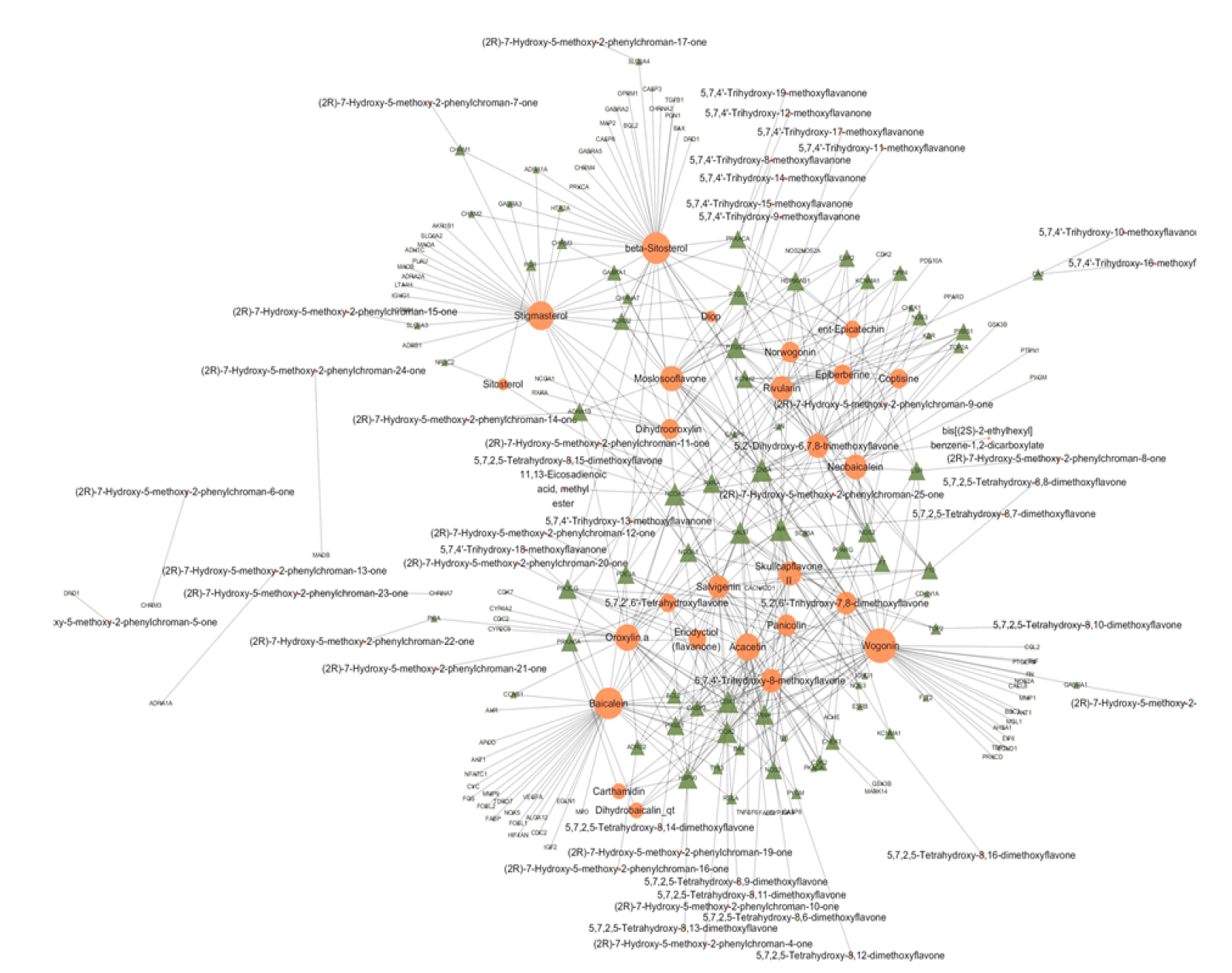
Cytoscape 3.7.2 (https://cytoscape.org/)를 이용하여 黃芩의 다양한 활성성분과 타깃 유전자들과의 관련성을 알아보기 위해 타깃 정보가 있는 33개의 활성성분과 수집된 타깃에 대한 네트워크(Compound-Target network, C-T network)와 항균관련 활성성분과 타깃 유전자와의 네트워크를 만들었다(Fig. 2, Fig. 4A). 항균관련 생물학적 대사과정을 선별하여 생체대사와 타깃 유전자에 관한 네트워크(Process-Target network, P-T network)를 구성하였다(Fig. 4B).
결 과
1. 활성성분 동정
TCMSP 분석에서 총 143개의 성분 중 OB≧30%, caco-2≧–0.4, DL≧0.18의 조건에 부합하는 黃芩의 활성성분 36개를 확보하였다(Table 1).
2. 타겟 단백질 수집 및 관련된 생체대사 분석
활성성분 36개 중 5,8,2'-Trihydroxy-7-methoxyflavone, Dihydrooroxylin A, Supraene을 제외한 33개 성분이 타깃 정보를 가지고 있었다. 중복을 제외하고 159개의 타깃 단백질을 수집하였고 UniProt을 통해 각 단백질의 유전자를 확인하였다. Fig. 2는 33 활성성분과 관련된 타깃 유전자간의 네트워크를 보여준다.
유전자 온톨로지 분석을 통하여 黃芩의 타깃 유전자들이 관여하는 총 171개의 생물학적 과정을 확보하였다. 이 중에서 상대적으로 많은 유전자가 관련된 생물학적 과정을 그룹화 하여 보니, gene expression (n=108), metabolism (n=104), cell cycle (n=100), apoptosis (n=98), antibiotic (n=86), immunity (n=85), response to environment (n=77) 순으로 분류되었다(Fig. 3).
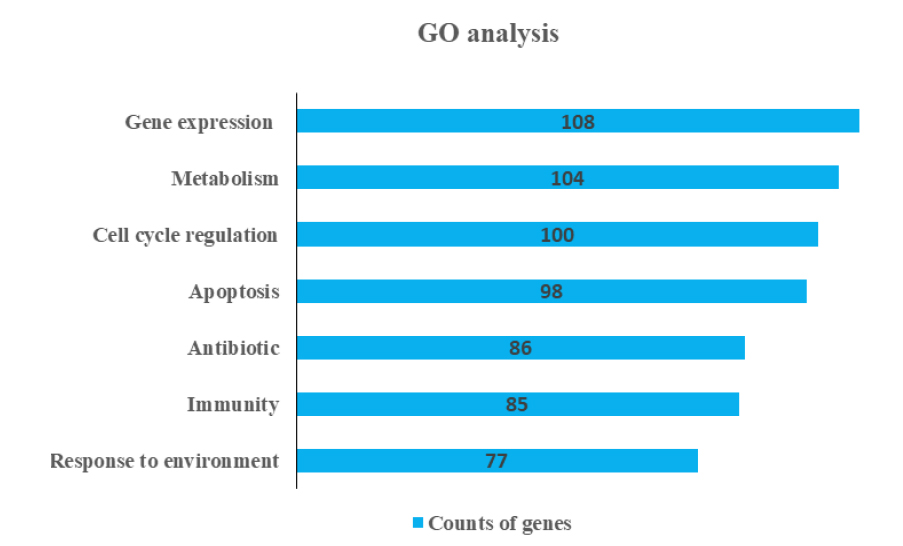
Gene Ontology (GO) analysis shows 7 groups of biological processes. The y-axis represents the terms of biological groups divided by the properties of biological processes, and the x-axis represents the counts of target genes associated with each biological process group ( P value < 0.01).
이는 黃芩에 대한 기존의 연구 결과를 뒷받침해 주는 의미 있는 결과였으며, 가장 많은 유전자가 관여한 과정은 gene expression으로, 유전자 108개가 연관된 생체대사였다. 본 논문에서는 黃芩의 항균 관련 대사에 주목하였다. 연구의 주제인 항균 작용 그룹은 5번째로 많은 유전자의 관련성이 높았으며, 항균에 관련된 유전자들 중 2개 이상의 과정에 관여하는 유전자는 86개 중 6개로 chemokine ligand2 (CCL2), interleukin-6 (IL-6), tumor necrosis factor (TNF), caspase-8 (CASP8), caspase-9 (CASP9) 그리고 mitogen-activated protein kinase 14 (MAPK14) 이었다(Fig. 4B).
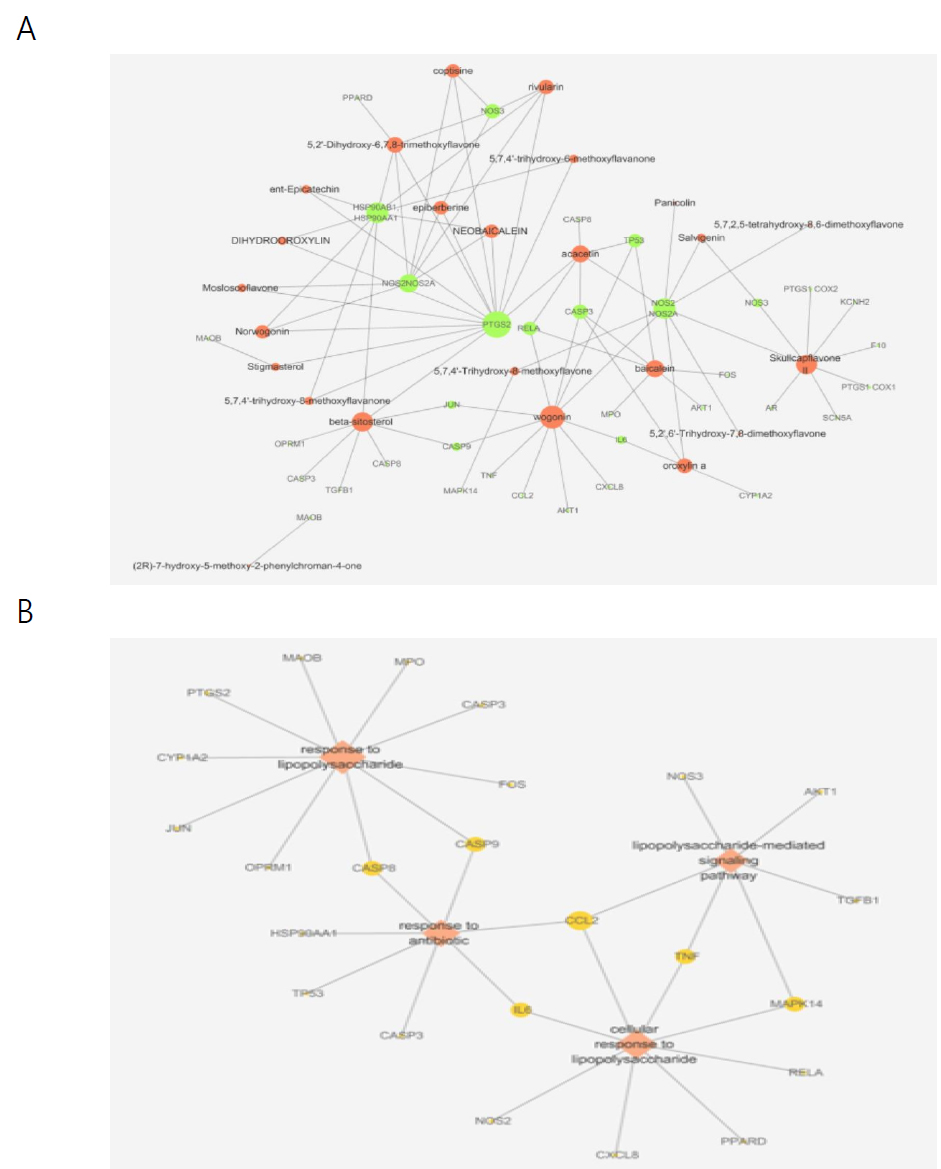
The network of Scutellariae Radix. (A) Compound-target network, red nodes; active compounds, green nodes; target genes. (B) Process-target network, red diamond shaped nodes; biological processes, yellow circular nodes; target genes. Node size depends on the degree value.
항균작용과 관련된 추가 네트워크 분석을 한 결과, 주요 활성성분으로 wogonin (11 genes), baicalein (6 genes), β-sitosterol (6 genes), acacetin (6 genes), oroxylin-A (4 genes) 등이 관여한다는 것을 알 수 있었다(Fig. 4A).
위의 결과들을 통해, 黃芩의 주요 활성 성분이 항균에 중요한 작용을 할 수 있음을 확인하였으며, 주요 타깃과 활성성분을 선별하여 효율적으로 실험적 검증을 진행할 수 있는 기반을 마련하였다.
고 찰
TCMSP Database and Analysis Platform은 한약재의 시스템 약리학적 플랫폼으로 약물과 표적물질 및 질병 사이의 상관관계를 파악하게 해준다. 데이터베이스에는 약물-표적 네트워크 및 관련 약물-표적-질환 네트워크, 그리고 oral bioavailability, drug-likeness, intestinal epithelial permeability 등 천연 화합물의 약동학적 특성이 포함되어 있어 다양한 종류의 전통적인 한약의 후보 약물의 검색이 시스템 네트워크 수준에서 가능한 획기적인 in silico 접근법이다.
성분 분석 결과에서 보면 항균작용에 관여하는 대표활성 성분은 wogonin, baicalein, β-sitosterol, acacetin, oroxylin-A이었다(Fig. 4A). 황금의 지표성분으로 알려진 wogonin, baicalein, baicalin 중 baicalin은 OB=29.53%, Caco2=-1.10, DL=0.77로 설정한 활성성분의 기준인 OB≧30%, caco-2≧–0.4, DL≧0.18에 Caco-2 값이 부합되지 않아 활성성분에 포함시키지 않았다. 나머지 지표성분인 wogonin (OB=30.68, Caco-2=0.79, DL=0.23), baicalein (OB=33.52, Caco-2=0.63, DL=0.21)은 안정된 약동학적 수치를 보여 주었다.
Wogonin (5,7-Dihydroxy-8-methoxy-2-phenyl-4H-chromen-4-one)은 O-methylated flavone의 일종으로 과산화지질의 생성을 억제하는 항산화작용이 있다18). 또한 antirespiratory syncytial virus, antihepatitis B virus 및 항암 효과를 나타낸다19-22).
Baicalein (5,6,7-trihydroxy-2-phenyl-4H-1-benzopyran-4-one)은 flavonoid 성분중 하나로써 lipoxygenase의 저해, microsome의 지질과산화반응 억제, oxygen radicals 생성의 저해, 그리고 hydrogen peroxide (H2O2), hydroxyl radical (OH) 및 superoxide anions (O2-)과 같은 활성산소종으로 유도된 fibroblast의 손상을 억제하는 것으로 보고되고 있다23-27).
β-Sitosterol은 식물계에 널리 분포되어 있으며 견과류, 아보카도 등에서 얻을 수 있는 식물성 스테롤 중의 하나이다28). β-Sitosterol 배당체는 pH 3~8 범위에서 높은 항균력을 나타내었으며, 살모넬라 균주에 대한 돌연변이원성 연구에서도 안정성이 입증되었다29).
Acacetin은 식물에 함유되어 있는 플라보노이드 계열 중 하나이며, 다양한 생리활성을 가지고 있다고 알려져 있다30). 또한, 위암세포에서 caspase를 활성화하여 세포고사를 일으킨다고 보고되었으며, 전립선암에서는 G1 및 G2/M기 arrest와 세포고사 유도에 의해 세포증식을 억제한다고 보고된 바 있다31,32).
Oroxylin A (5,7-dihydroxy-6-methoxy-2-phenylchromen-4-one)는 flavonoid의 일종으로서 지질다당체에 의한 염증반응을 억제하는 것에 대해서 알려져 있으며33), anti-respiratory syncytial virus 활성을 나타낸다19).
기존 문헌에서 보여 준 바와 같이 본 TCMSP 분석을 통해 밝혀진 황금의 활성 성분 중 특히 항균작용에 뛰어난 효능을 보이는 것으로 분석된 wogonin, baicalein, β-sitosterol, acacetin, oroxylin-A의 작용기전을 통한 黃芩의 다양한 세균감염 예방 및 항균작용을 기대 할 수 있을 것이다.
黃芩의 항균 활성성분과 관련성이 높은 타깃들은 CCL2, IL-6, TNF, CASP8, CASP9, MAPK14이었다. CCL2는 혼합 백혈구의 보충을 주된 작용으로 하는데 감염상태에 있는 조직 세포들이 CCL2를 발현하면 CCL2를 발현하는 단핵구들이 염증부위로 보충되어 면역작용을 한다34). IL-6는 대식세포와 혈관 내피 세포에서 분비되는 사이토카인으로 B림프구 계열의 증식과 항체분비를 도와 적응면역에 영향을 준다. TNF는 염증과 면역의 강한 매개물질로서 단핵구, 대식세포, T림프구, B림프구, NK세포 등에서 분비된다. 호중구의 활성 산소 생성을 자극하고 포식작용을 증가시켜 항균작용을 할 수 있다35).
세포고사는 염증매개물질을 분비하지 않고 세포가 수축하여 대식세포에 의해 염증의 동반 없이 제거되며, caspase가 인체세포의 자멸사에 중요한 역할을 하는 것으로 알려졌다36). Caspase-8은 TNF-α 또는 Fas ligand와 같은 세포사멸 유도 물질에 의해 활성화되며, 활성화된 caspase-8은 일련의 다른 caspase를 활성화시키면서 세포사멸을 유발시킨다37,38). 방출된 cytochrome C는 apaf-1, caspase-9, dATP와 결합하여 caspase-9를 활성화시키고, 이렇게 활성화된 caspase-9는 caspase-3을 활성화시켜 세포사멸을 유도하는 것으로 보고되고 있다39).
MAPK는 mitogen activated protein의 약자로 또는 extracellular signal regulating kinase로 일컬어지며, 세포의 성장, 증식, 분화 및 세포 자연사 등을 조절하는 기능을 수행한다40). MAPK pathway는 세포 외부로부터의 신호들을 세포내, 특히 세포핵으로 전달하여 gene expression을 조절하게 된다41).
이와 같이 본 연구에서 밝혀낸 黃芩의 시스템 약리학적 분석으로 도출된 결과와 기존의 연구 보고와 상응함을 알 수 있다. 또한, 黃芩의 항균 효과에 대한 분석은 임상에서 濕熱을 淸利하고 瀉火解毒하는 기능으로 폭넓게 응용해온 黃芩의 전통적 기능과도 부합됨을 알 수 있다7). 시스템 네트워크를 이용해서 약재의 약리작용에 대한 분석을 하는 경우, 질병에 대한 해결책을 찾기 위한 약재를 물색함에 있어서 시간, 비용, 노력과 무수한 시행착오를 줄일 수 있다. 나날이 방대하게 축적되어가는 빅데이터를 활용하여 약재의 함유된 성분과 그 성분에 반응하는 단백질, 더 나아가 이에 관련된 질병까지 확보된 데이터는, 추후 실험적 검증에 중요한 기반을 제공할 것이다.
결 론
본 연구에서는 시스템 약리학적 분석 방법을 사용하여 황금의 활성 화합물을 탐색하여 항균 효과에 중점을 둔 표적 유전자 및 질병을 분석하였다. 黃芩의 특정 성분은 TCMSP 데이터베이스 및 분석 플랫폼을 통해 확보하였다. 여기에는 활성 화합물 및 관련 약물 표적 질환 네트워크의 약동학적 특성이 포함되며, 네트워크 수준에서 가능한 in silico 접근 방식의 가능하다. 표적의 유전자 정보를 UnitProt 데이터베이스로부터 수집하고 유전자 온톨로지 분석을 David 6.8 유전자 기능 분류 도구를 사용하여 수행한 결과, 33 개의 스크리닝된 활성 화합물에 상응하는 총 159개의 표적 단백질을 수집하였고, 86 개의 유전자가 항균성 활성과 관련된 생물학적 과정에 작용하는 것으로 밝혀졌다. 항균 작용에 관여하는 대표적인 활성 화합물은 wogonin, β-sitosterol baicalein, acacetin, oroxylin-A였으며, chemokine ligand2, interleukin-6, tumor necrosis factor, caspase-8, 9 그리고 mitogen-activated protein kinase 등이 두가지 이상의 항균 관련 생물학적 과정에 연관된 표적인자였다. 본 연구결과를 토대로 실험적 증거를 보여준다면 감염병 예방 및 치료 전략에 중요한 데이터를 제공할 수 있을 것이다.
Acknowledgments
본 연구는 부산대학교 기본연구지원사업(2년)의 지원을 받아 수행되었음.
References
- Jung MJ, Yin Y, Heo SI, Wang MH. Antioxidant and anticancer activities of extract from artemisia capillaries. Kor. J. Pharmacogn. 2008;39:194-8.
-
Morrissey PA, O’Brien NM. Dietary antioxidants in health and disease. Int. Diary J. 1998;8:463-72.
[https://doi.org/10.1016/S0958-6946(98)00070-3]

-
Neu HC. The crisis in antibiotic resistance. Science. 1992;257:1064-73.
[https://doi.org/10.1126/science.257.5073.1064]

-
Burns JJ, Zhao L, Taylor EW. Spelman K. The influence of traditional herbal formulas on cytokine activity. Toxicol. 2010;278:140-59.
[https://doi.org/10.1016/j.tox.2009.09.020]

- Kim NY, Kim HJ, Lee JH, Lee EK, Kang OH. Comparison of the anti-inflammatory effects of water fermented and ethanol fermented extracts from Rhei Radix et Rhizoma. Kor. J. Herbol. 2001;25:227-33.
-
Choi MR, Lee JS, Lim HS. Changes in physiological activities of Scutellariae baicalensis by heating. J Life Sci. 2007;17(10):1381-6.
[https://doi.org/10.5352/JLS.2007.17.10.1381]

- Herbology Textbook Committee for Nationwide School of Korean Medicine Complilation. Herbology. 2nded. Seoul: Yeongnimsa. 2016.p.216.
- Ministry of Food and Drug Safety. The 12th revision of the Korean Pharmacopoeia, Part 2 of each drug article. Ministry of Food and Drug Safety Notice No. 2019-102.
- Hwang DY. New Bangyakhabpyun. Seoul: Young-Lim publisher. 2003. p. 396.
- Bae JH, Lee MJ, Lee SM. Antimicrobial effect of Cutellaria Baicalensis george extracts on Food-Borne pathogens. J Kor Micribiol Biotechnol. 2005;33(1):35-40.
-
Woo IT, Park KN, Lee SH. Antimicrobial activities of Scutellaria baicalensis Georgi against various pathogens and spoilage bacterial isolated from Tofu. J Kor Soc Food Sci Nutr. 2007;36(4):470-5.
[https://doi.org/10.3746/jkfn.2007.36.4.470]

-
Gao J, Morgan WA, Sanchez-Medina A, Cororan O. The ethanol extract of Scutellaria baicalensis and the active compounds induce cell cycle arrest and apoptosis including upregulation of p53 and Bax in human lung cancer cells. Toxicol Appl Pharmacol. 2011;254:221-8.
[https://doi.org/10.1016/j.taap.2011.03.016]

- Lim YH, Kim IH, Seo JJ. In vitro activity of kaempferol isolated from the impatiens balsamina alone and in combination with erythromycin or clindamycin against Propionibacterium acnes. J. Microbiol. 2007;45:473-7.
-
Ru J, Li P, Wang J, Zhou W, Li B, Guo Z, Tao W, Yang Y, Xu X, Li Y, Wang Y, Yang L. TCMSP: a database of systems pharmacology for drug discovery from herbal medicine. Journal of Cheminformatics. 2014;16(6);13.
[https://doi.org/10.1186/1758-2946-6-13]

-
Suh SY, An WG. Systems pharmacological approach of pulsatillae radix on treating crohn’s disease, Evidence-Based Complementary and Alternative Medicine. Article ID 4198035, 2017. p. 21.
[https://doi.org/10.1155/2017/4198035]

-
Huang DW, Sherman BT, Lempicki RA. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources. Nat. Protoc. 2009;4:44-57.
[https://doi.org/10.1038/nprot.2008.211]

-
Huang DW, Sherman BT, Lempicki RA. Bioinformatics enrichment tools: paths toward the comprehensive functional analysis of large gene lists. Nucleic Acids Res. 2009;37:1-13.
[https://doi.org/10.1093/nar/gkn923]

- Lee MJ, Kim YO, Lee K, Yu YB, Kim SY, Kim SS, Kim HC. Neuroprotective Effect of Hwangryunhaedok-tang on the Brain Ischemia Induced by Four-Vessel Occlusion in Rats, J of Korean Med. 2002;23(4):161-8.
-
Ma SC, Du J, But PPH, Deng XL, Zhang YW, Ooi VEC, Xu HX, Lee SHS, Lee SF. Antiviral Chinese medicinal herbs against respiratory syncytial virus, J. Ethnopharmacol. 2002;79:205.
[https://doi.org/10.1016/S0378-8741(01)00389-0]

-
Huang RL, Chen CC, Huang HL, Chang CG, Chen CF, Chang C, Hsieh MT. Anti-hepatitis B virus effect of wogonin isolated from Scutellia bicalensis. Planta Med. 2000;66:694.
[https://doi.org/10.1055/s-2000-9775]

-
Ikemoto S, Sugimura K, Yoshida N, Yasumoto R, Wada S, Yamamoto K, Kishomoto T. Antitumor effect of Scutellariae radix and its components baicalein, baicalin, and wogonin on bladder cancer cell lines. Urology. 2002;55:951.
[https://doi.org/10.1016/S0090-4295(00)00467-2]

- Shieh DE, Liu LT, Lin CC. Antioxidant and free radical scavenging effects of baicalein, baicalin, and wogonin. Anticancer Res. 2002;20:2861.
-
Sekiya K, Okuda, H. Selective inhibition of platelet lipoxygenase by baicalein. Biochem Biophys Res Cormmun. 1982;105:1090-5.
[https://doi.org/10.1016/0006-291X(82)91081-6]

-
Gao D, Sakurai K, Katoch M, Chen J, Ogiso T. Inhibition of microsomal lipid peroxidation by baicalein : A possible formation of an ironbaicalein complex. Biochem Mol Biol Int. 1996;39:215-25.
[https://doi.org/10.1080/15216549600201221]

-
Yoshino M, Murakami K. Interaction of iron with polyphenolic compounds: application to antioxidation characterization. Anal Biochem. 1998;257:40-4.
[https://doi.org/10.1006/abio.1997.2522]

-
Zhang, S, Ye J, Dong G. Neuroprotective effect of baicalein on hydrogen peroxide-mediated oxidative stress and mitochondrial dysfunction in PC12 cells. J Mol Neurosci. 2010;40(3):311-20.
[https://doi.org/10.1007/s12031-009-9285-5]

-
Gao D., Tawa, R., Masaki, H., Okano, Y., Sakurai H. Protective effects of baicalein against cell damage by reactive oxygen species. Chem Pharm Bull. 1998;46:1383-7.
[https://doi.org/10.1248/cpb.46.1383]

- "Nutrition data: Foods highest in beta-sitosterol per 200 calorie serving". Conde Nast, USDA National Nutrient Database, version SR-21. 2014. Retrieved 25 September 2015.
- Lee DK, Choi MS, Shim K, Kwon OW, Son SH. The Stability and Mutagenecity of β-Sitosterol Glycoside, Antimicrobial Compound from Schima wallichii sp. liukiuensis. The Journal of Applied Pharmacology. 1999;7:204-9.
-
Miyazawa M, Hisama M. Antimutagenic activity of flavonoids from Chrysanthemum morifolium. Biosci. Biotechnol. Biochem. 2003;67:2091.
[https://doi.org/10.1271/bbb.67.2091]

-
Pan MH, Lai CS, Hsu PC, Wang YJ. Acacetin induces apoptosis in human gastric carcinoma cells accompanied by activation of caspase cascades and production of reactive oxygen species. J. Agric. Food Chem. 2005;53:620.
[https://doi.org/10.1021/jf048430m]

-
Singh RP, Agrawal P, Yim D, Agarwal C, Agarwal R. Acacetin inhibits cell growth and cell cycle progression, and induces apoptosis in human prostate cancer cells: structure-activity relationship with linarin and linarin acetate. Carcinogenesis. 2005;26:845.
[https://doi.org/10.1093/carcin/bgi014]

-
Chen Y, Yang L, Lee TJ. Oroxylin A inhibition of lipopolysaccharide -induced iNOS and COX-2 geneexpression via suppression of nuclear factor- kappaB activation. Biochem Pharmacol. 2000;59(11):1445-57.
[https://doi.org/10.1016/S0006-2952(00)00255-0]

- Abbas AK, Lichtman AH, Pillai S. Cellular and Molecular Immunology, Elsevier, Philadelphia, USA. 2018;9:43-4.
- Kint TJ, Goldsby RA, Osborne B A, Kuby J. Immunology, Macmillan, New York, USA, 6th ed. 2006. p. 307.
-
Alnemri ES, Livingston DJ, Nicholson DW, Salvesen G, Thornberry NA, Wong WW. Human ICE/CED-3 protease nomenclature. Cell. 1996;87:171.
[https://doi.org/10.1016/S0092-8674(00)81334-3]

-
Boldin MP, Goncharov TM, Goltsev YV, Wallach D. Involvement of MACH, a novel MORTI/FADD-interacting protease, in Fas/APO-1-and TNF receptor-induced cell death. Cell. 1996;85:803-15.
[https://doi.org/10.1016/S0092-8674(00)81265-9]

-
Lim ML, Lum MG, Hansen TEM, Roucou X, Nagley P. On the release of cytochrome c from mitochondria during cell death signaling, J Biomed Sci. 2002;9:448-506.
[https://doi.org/10.1159/000064722]

-
Li P, Nijhawan, D. Budihardjo, I., Srinivasula, S.M., Ahmad, N., Alnemri, E.S. Cytochrom c and dATP-dependant formation of Apal-1/caspase-9 complex initiates an apoptotic protease cascade. Cell. 1997;91:479-89.
[https://doi.org/10.1016/S0092-8674(00)80434-1]

- Jung BG. Molecular Cell Biology. Seoul: hanwooribook. 2002. p. 49.
- Choi UJ. Regulation of the stress Activated MAPK. 3rd symposium of the Korean society of Applied Pharmacology. 1995;1:23-7.