八味地黃湯의 ROS 생성 및 p53 활성 조절을 통한 시스플라틴 신장독성 완화효과
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Palmijihwang-tang is an herbal formula frequently used to treat many symptoms, such as lumbago, pollakiuria, cold hands and feet, nephritis, sterilitas virilis, and prostatic disorders. The aim of this study was to investigate the effects of Palmijihwang-tang on cisplatin-induced nephrotoxicity in rat kidney proximal tubular NRK-52E cells. NRK-52E cells were treated with Palmijihwang-tang in absence or presence of 30 μM cisplatin for 12 or 24 h. Palmijihwang-tang at concentrations of 50-800 μg/ml did not change the cell viability in NRK-52E cells, and showed no significant toxicity. Palmijihwang-tang at concentrations of 400 and 800 μg/ml significantly increased the cell viability and reduced apoptotic cells in NRK-52E cells exposed to cisplatin. Also, Palmijihwang-tang markedly inhibited cisplatin-induced caspase-3 activation, PARP cleavage, ROS production and p53 activation in NRK-52E cells. Furthermore, Palmijihwang-tang did not interfere with the antitumor activity of cisplatin in AGS and A549 cancer cells. Particularly, Palmijihwang-tang enhanced antitumor activity of cisplatin in A549 cells. Taken together, these results suggest that Palmijihwang-tang ameliorated cisplatin-induced nephrotoxicity through reduction of ROS production and p53 activation, and did not interrupt antitumor efficacy of cisplatin against cancer cells.
Keywords:
A549, AGS, Antitumor activity, Cisplatin, Nephrotoxicity, NRK-52E, Palmijihwang-tang서 론
항암제의 페니실린이라고 불리는 시스플라틴(Cisplatin, cis-Diammineplatinum(II) dichloride)은 암 치료에 널리 사용되는 항암제 가운데 하나로 백금 원자에 2개의 염소와 암모니아가 배위된 화합물이다1,2). 그렇지만 시스플라틴의 항암 화학요법은 신장독성, 신경독성, 위장관독성, 골수억제와 같은 심각한 부작용 때문에 제한적인 치료 효과를 보여왔으며, 특히 신장독성은 암 환자에게 시스플라틴 화학요법을 적용하는데 중요한 제한적 요인이 되고 있다3-6). 그러나 암 환자에게서 시스플라틴의 화학요법은 중요하기 때문에 시스플라틴의 신장독성을 완화하기 위한 연구가 다양하게 진행되고 있으며7), 국내에선 한방소재를 이용하여 항암제 부작용을 억제하기 위한 연구가 이루어지고 있다8,9).
地黃(Rehmannia glutinosa Liboschitz)은 玄蔘科에 속하는 多年生 草本이며, 生地黃을 황주, 백주 또는 사인주로 九蒸九曝한 것을 熟地黃이라고 하는데10), 熟地黃은 藥性이 微溫하고 甘하며 滋陰補血과 益精塡髓의 효능을 가지고 있다11). 특히 熟地黃은 항암제 부작용을 완화하는 것으로 보고되었는데, in vitro 연구에서 熟地黃 에탄올 추출물이 시스플라틴에 의한 耳독성 및 腎독성를 완화하는 것으로 보고되었다12,13). 특히 熟地黃을 군약으로 복미처방에서도 항암제 부작용을 완화하는 것으로 보고되었는데, 獨活地黃湯은 시스플라틴에 의한 위장관장애를 개선하는 것으로 보고되었으며14), 六味地黃湯도 다양한 악성종양을 가진 환자의 항암 화학요법 치료시 항암제 부작용을 완화하는 것으로 보고되었다15).
八味地黃湯은 張仲景16)의 《金廣要略》에 八味腎氣丸으로 처음 수록되어 그 適應證을 “虛勞腰痛, 少腹拘急, 少便不利者 八味腎氣主之”라고 한 이래 많은 醫家들에 의해 腎陽虛로 因한 일체의 질병에 溫補腎陽의 기초 방제로 활용되어 온 처방으로 熟地黃, 山藥, 山茱萸, 牧丹皮, 白茯苓, 澤瀉, 肉桂 및 附子의 여덟 가지 약재로 구성되어 있다17). 八味地黃湯은 남성 불임과 전립선 장애 치료에도 사용되며18,19), 항당뇨 및 면역조절 효과가 있는 것으로 보고되었으며20,21), 특히 신장기능장애를 개선하는 효과를 가지는 것으로 보고되었다22).
따라서 본 연구에서는 항암제 부작용을 완화하는 효능을 가진 熟地黃을 군약으로 하는 처방 중 신장보호 효과를 나타내는 八味地黃湯 물추출물을 제조하여 시스플라틴으로 유도한 정상 쥐 신장세포주인 NRK-52E 세포의 신장독성에 대한 보호 효능을 분석하였고, AGS 위암세포 및 A549 폐암세포에서 시스플라틴 항암 활성에 대한 효과를 분석하여 유의한 결과를 얻었기에 보고하는 바이다.
재료 및 방법
1. 시약 및 항체
Cisplatin (cis-Diammineplatinum(II) dichloride), 2’,7’-Dichlorofluorescin diacetate (DCFH-DA), dimethyl sulfoxide (DMSO), 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT), propidium iodine (PI), ribonuclease A (RNase A), anti-β-actin 항체 등은 Sigma-Aldrich Chemical (St. Louis, MO, USA)로부터 구입하였다. Halt protease&phosphatase inhibitor cocktail와 RIPA lysis buffer 등은 Pierce Biotechnology (Rockford, IL, USA)로부터 구입하였다. Anti-cleaved caspase-3, anti-PARP, anti-p53, anti-phospho-p53 (Ser15) 등의 항체들은 Cell Signaling Technology INC. (Beverly, MA, USA)로부터 구입하였다.
2. 八味地黃湯 물추출물의 제조
본 실험에 사용한 八味地黃湯의 구성약재인 熟地黃, 山藥, 山茱萸, 白茯苓, 澤瀉, 牧丹皮, 肉桂, 炮附子는 인삼당제약(목포, 한국)에서 구입한 후 정선하여 사용하였고, 八味地黃湯의 구성 약재는 漢代 張仲景의 『金匱要略』에 준하였으며, 총 1첩 분량 54g을 사용하였다(Table 1).
八味地黃湯 54g에 증류수 1.5L를 가하여 100℃에서 3시간 1회 추출하였고, 추출된 전탕액은 여과지(Whatmann No. 4)를 이용하여 여과하였다. 여과된 八味地黃湯 전탕액을 동결건조기를 통해 동결 건조하여 6.92g (수득률(W/W)=12.8%)를 획득하여 사용 전까지 -20℃에 보관하였다.
NRK-52E, AGS, A549 세포는 American Type Culture Collection (ATCC, Rockville, MD, USA)로 부터 분양받았고, 10% FBS (Invitrogen, Burlington, ON, Canada), 100 U/ml penicillin, 100 μg/ml streptomycin이 포함된 DMEM 배지 및 F-12K 배지(Gibco/Thermo Fisher Scientific, Inc., Grand Island, NY, USA)를 사용하여 37℃와 5% CO2 상태에서 배양하였다. 세포는 1×105 cells/ml로 seeding 하여 24시간 전배양 후, 10% FBS가 포함된 DMEM 및 F-12K 배지에서 八味地黃湯 물추출물과 함께 시스플라틴을 처리하였다.
八味地黃湯 물추출물에 대한 세포의 생존율을 측정하기 위해 MTT 방법을 이용하여 측정하였다. 세포는 24 well 플레이트에 24시간 전배양 후, 八味地黃湯 물추출물을 50, 100, 200, 400, 800 μg/ml 농도로 24시간 처리하였다. 0.5 mg/ml MTT용액을 각각의 well에 500 μl 첨가하여 37℃에서 4시간 배양한 후에, 상층액을 제거하고 비수용성의 MTT-formazan 결정들은 DMSO용액 200 μl 첨가하여 용해하였다. Formazan의 양은 SpectraMAX 250 microplate spectrophotometer (Molecular Devices, Sunnyvale, CA)를 이용하여 570 nm에서 흡광도를 측정하였다. 세포생존율은 다음과 같이 계산하여 백분율(%)로 나타내었다.
Cell viability (%) = (OD570 of treated cells/OD570 of control cells) ×100
八味地黃湯 물추출물에 대한 세포독성을 측정하기 위해 lactose dehydrogenase (LDH) cytotoxicity assay kit (Pierce, Rockford, IL, USA)를 이용하여 측정하였다. 세포는 24 well 플레이트에 24시간 전배양 후, 八味地黃湯 물추출물을 50, 100, 200, 400, 800 μg/ml 농도로 24시간 처리하였다. 제조사의 방법에 따라 각각의 샘플배지 50 μl와 Reacture Mixture 용액 50 μl를 혼합하여 암실 조건에서 30분간 방치시킨 후, 50 μl의 Stop 용액을 첨가하여 반응을 종료하였다. 그 후 SpectraMAX 250 microplate spectrophotometer (Molecular Devices, Sunnyvale, CA)를 이용하여 490 nm와 680 nm에서 흡광도를 측정하였다. 세포독성은 다음과 같이 계산하여 백분율(%)로 나타내었다.
Cytotoxicity (%) = [(OD490-680 of treated-cells - OD490-680 of spontaneous control cells)/(OD490-680 of maximum control cells - OD490-680 of spontaneous control cells)] ×100
세포는 八味地黃湯 물추출물을 400 μg/ml과 800 μg/ml 농도로 1시간 전처리 후, 시스플라틴을 30 μM 농도로 24시간 배양 후, 세포 모두를 수확하여 PBS (pH 7.4)로 세척하였다. 세척한 세포는 냉각된 70% 에탄올로 4℃에서 1시간 고정 후, 고정된 세포는 PBS (pH 7.4)로 2회 세척하여 1 ml의 PI (10 μg/ml)/RNase A (100 μg/ml) 용액으로 재부유시켜 37℃에서 암실 조건으로 1시간 배양하였다. DNA 양은 FACS-Calibur (BD Biosciences, CA, USA)를 사용하여 측정하였다. 세포주기는 CellQuest Pro (BD Biosciences, CA, USA) 소프트웨어를 이용하여 분석하였다.
Caspase-3 활성측정은 Colorimetric caspase-3 assay kit를 이용하여 측정하였다. 제조사의 방법에 따라서 세포용해물을 추출하였고, Bradford 검사법을 이용하여 단백질농도를 측정하였다. 50 μl의 세포용해물(총 50 μg의 단백질)과 50 μl의 2× Reaction buffer 및 5 μl의 4 mM DEVD-p-NA substrate를 혼합하여 37℃에서 1시간 배양하였다. Enzyme-catalyzation 되어 방출된 p-nitroanilide를 SpectraMAX 250 microplate spectrophotometer (Molecular Devices, Sunnyvale, CA)를 이용하여 405 nm에서 측정하였다.
Caspase-3 activity = (OD405 of treated cells/OD405 of control cells) ×100
활성산소종(ROS)는 DCFH-DA fluorescence assay에 의해 측정하였다. NRK-52E 세포는 HBSS (pH 7.4)에 한 번 세척한 후, 25 μM DCFH-DA/HBSS (pH 7.4) 용액을 첨가하여, 37℃에서 1시간 배양하였다. 배양 후, 용액을 제거하고 八味地黃湯 물추출물을 1시간 전처리 한 후, 시스플라틴을 처리하여 12시간 배양하였다. Flurescence intensity는 excitation 파장 485 nm와 emission 파장 524 nm에서 측정하였다.
세포는 얼음으로 냉장된 PBS (pH 7.4)로 세척하고, 1% halt protease&phosphatase inhibitor cocktail이 포함된 RIPA lysis buffer로 부유시킨 후 얼음 위에서 30분간 용해하였다. 세포용해물들은 4℃에서 14,000 rpm으로 15분간 원심분리하였고, 단백질농도는 Bradford 검사법을 이용하여 측정하였다. 총 40 μg의 단백질 샘플을 SDS-PAGE 젤로 분리하였고, 40V에서 3시간 nitrocellulose막 위로 단백질을 전이시켰다. 단백질이 전이된 막은 5% skim milk가 포함된 Tris-buffered saline+Tween-20 (20 mM Tris-HCl, pH 7.6, 150 mM NaCl, 0.05% Tween-20)으로 비특이 결합을 차단시킨 후, 1차 항체(1:1000)를 결합시켰다. 면역 활성은 peroxidase가 붙어있는 anti-rabbit 또는 anti-mouse 2차 항체(1:2000)를 사용하여 SuperSignal West Pico PLUS Chemiluminescent Substrate (Thermo Fisher Scientific, Inc., Waltham, MA, USA)에 의해 탐지하였고, FluorChem E System (ProteinSimple, San Jose, CA, USA)을 이용하여 이미지화하였다. 특정단백질 밴드의 강도는 Quantity One 4.6.6 software (Bio-Rad, Hercules, CA, USA)를 이용하여 수치화하였다.
모든 데이터의 결과는 그래프패드 프리즘 6(La Jolla, CA) 프로그램을 통하여 통계처리 하여 mean±standard deviation (SD)로 기록하였다. 실험군간의 유의성 검정은 Student’s t-test를 통해 분석하였으며, p<0.05의 경우에서 통계적 유의성이 있는 것으로 간주하였다.
결 과
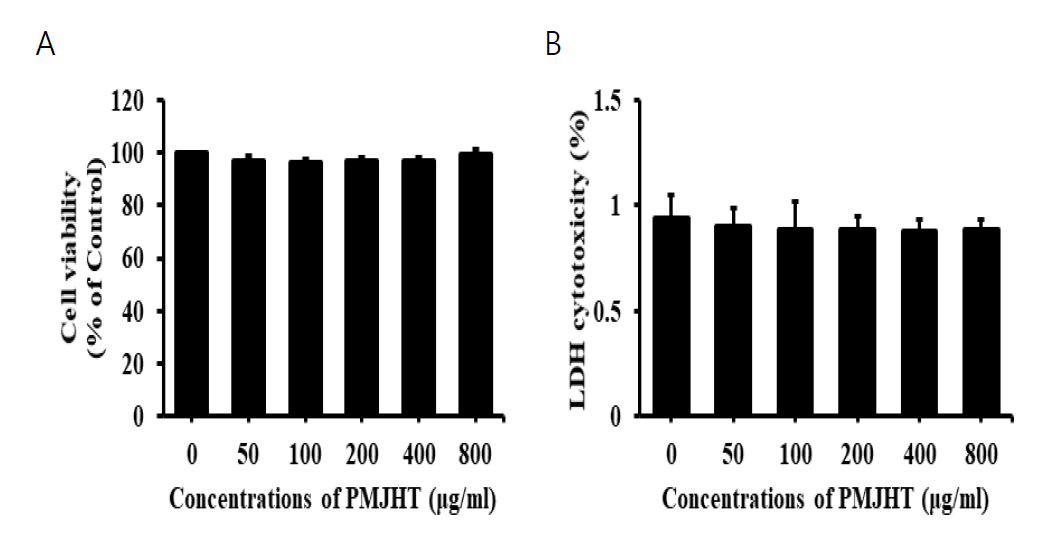
1. NRK-52E 신장세포에 대한 八味地黃湯의 독성효과
八味地黃湯 물추출물에 대한 NRK-52E 신장세포에 대한 세포생존율 및 세포독성을 평가하기 위해 세포는 24 well 플레이트에 24시간 전배양 후, 八味地黃湯 물추출물을 50, 100, 200, 400, 800 μg/ml 농도로 24시간 처리하여 MTT 환원검사와 LDH 활성검사를 실시하였다. 八味地黃湯 물추출물은 NRK-52E 신장세포의 세포생존율에 대해 대조군과 비교하여 유의적인 감소를 나타내지 않았으며(Fig. 1A), LDH 활성에서도 八味地黃湯 물추출물의 농도증가에 따른 NRK-5E 신장세포의 세포독성 증가가 나타나지 않았다(Fig. 1B).
2. 시스플라틴 유도된 NRK-52E 신장세포의 세포사멸에 대한 八味地黃湯의 효과
시스플라틴에 의한 NRK-52 신장세포의 세포사멸에 대한 八味地黃湯의 효과를 조사하기 위해 NRK-52E세포는 八味地黃湯 물추출물을 400 μg/ml과 800 μg/ml 농도로 1시간 전저리 후, 30 μM 농도의 시스플라틴을 24시간 처리하였다. MTT 환원 검사를 통한 세포생존율 측정 결과에서 八味地黃湯 물추출물은 시스플라틴에 의해 감소된 세포생존율을 증가시켰다(Fig. 2A). 시스플라틴을 처리한 세포에서 八味地黃湯 물추출물은 시스플라틴만 처리한 세포의 세포생존율(48.2%)과 비교하여 400 μg/ml과 800 μg/ml 농도에서 각각 68.3%와 79.0%로 세포생존율을 유의하게 증가시켰다. 유세포분석을 통한 아폽토시스 세포비율 정도에서도 八味地黃湯 물추출물은 시스플라틴에 의해 증가된 아폽토시스 세포수(Sub-G1 peak)를 감소시켰으며(Fig. 2B), 시스플라틴만 처리한 세포의 아폽토시스 세포비율(45.4%)과 비교하여 八味地黃湯 물추출물의 400 μg/ml과 800 μg/ml 농도에서 각각 29.7%와 23.4%로 아폽토시스 세포비율을 유의적으로 감소시켰다. 또한, 시스플라틴에 의해 증가한 caspase-3 활성은 八味地黃湯 물추출물에 의해 감소하였으며, 시스플라틴만 단독처리한 세포의 caspase-3 활성(777.5%)과 비교하여 400 μg/ml과 800 μg/ml 농도의 八味地黃湯 물추출물에서 각각 475.6%와 259.1%로 유의하게 caspase-3 활성이 감소하였다(Fig. 2C). Caspase-3 단백질 발현분석에서도 caspase-3 활성 분석결과와 동일하게 cleaved caspase-3 발현이 八味地黃湯 물추출물에 의해 감소하였으며, caspase-3 활성에 의한 PARP 절편화에서도 八味地黃湯 물추출물은 시스플라틴에 의해 증가한 cleaved PARP 발현을 감소시켰다(Fig. 2D).
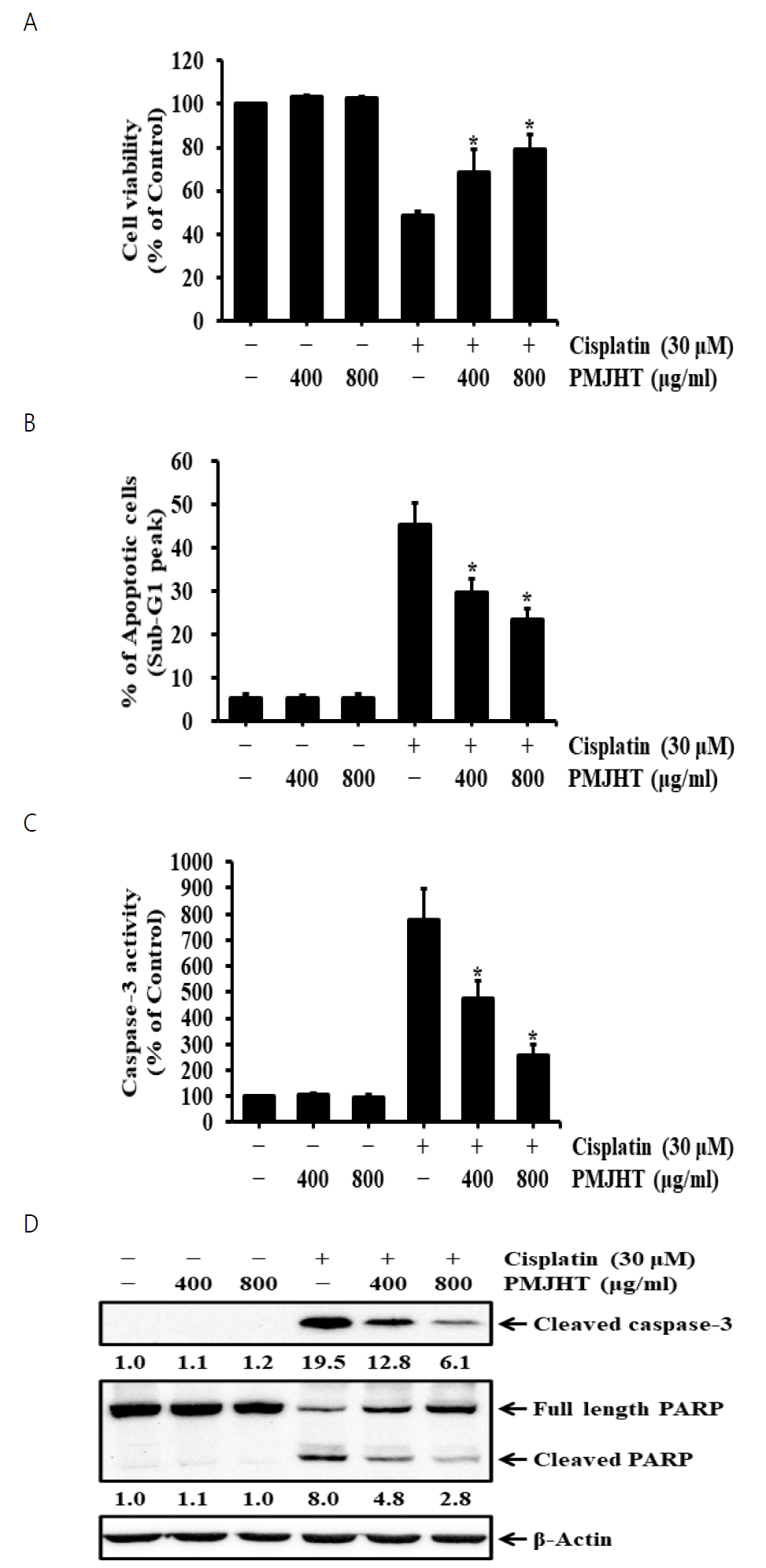
The effects of Palmijihwang-tang on cisplatin-induced apoptosis in NRK-52E cells. The cells were treated with 400 and 800 μg/ml Palmijihwang-tang (PMJHT) in the absence or presence of 30 μM cisplatin for 24 h. (A) Cell viability was measured by MTT reduction assay. (B) Apoptotic cells were quantified by flow cytometry following staining with propidium iodide. Values are means ± SD, N = 3. The statistically significant differences compared with cisplatin-treated cells were calculated by Student’s t-test. *p<0.05. (C) Caspase-3 activity was measured using Colorimetric caspase-3 assay kit. The activation was measured as the increase in activity (%) with respect to untreated cells (100%). Values are means ± SD, N = 3. The statistically significant differences compared with cisplatin-treated cells were calculated by Student’s t-test. *p<0.05. (D) Whole cell lysates were subjected to SDS-PAGE followed by Western blot analysis with anti-cleaved caspase-3 (p20) and anti-PARP antibodies. The numbers below the bands indicate the relative density ratio of the respective protein normalized to the internal control (β-actin).
3. NRK-52E 신장세포에서 시스플라틴 유도된 reactive oxygen species 생성과 p53 활성에 대한 八味地黃湯의 효과
시스플라틴의 신장독성은 reactive oxygen species (ROS) 생성 및 p53 활성과 밀접하게 관련되어 있으며, ROS 생성 및 p53 활성 억제는 시스플라틴의 신장독성을 완화하는 것으로 보고되었다23,24). 따라서 八味地黃湯 물추출물의 시스플라틴 신장독성에 대한 억제효과가 ROS 생성 및 p53 활성과 연관되어 있는지 조사하기 위해 NRK-52E 세포는 八味地黃湯 물추출물을 400 μg/ml과 800 μg/ml 농도로 1시간 전저리 후, 30 μM 농도의 시스플라틴을 12시간 처리하여 ROS 생성과 p53의 인산화 및 발현을 분석하였다. 시스플라틴만 처리한 세포에서 ROS 생성은 1.7배 증가하였지만, 400 μg/ml과 800 μg/ml 농도의 八味地黃湯 물추출물에서 각각 1.3배와 1.1배로 유의하게 감소하였다(Fig. 3A). p53 인산화 및 총발현량 분석에서도 시스플라틴에 의한 p53의 인산화 수준(12배) 및 총 발현수준(4.5배)이 400 μg/ml과 800 μg/ml 농도에서 p53 인산화는 각각 8.8배와 7.4배로 감소하였으며, p53 총발현은 3.2배와 2.7배로 감소하였다(Fig. 3B).
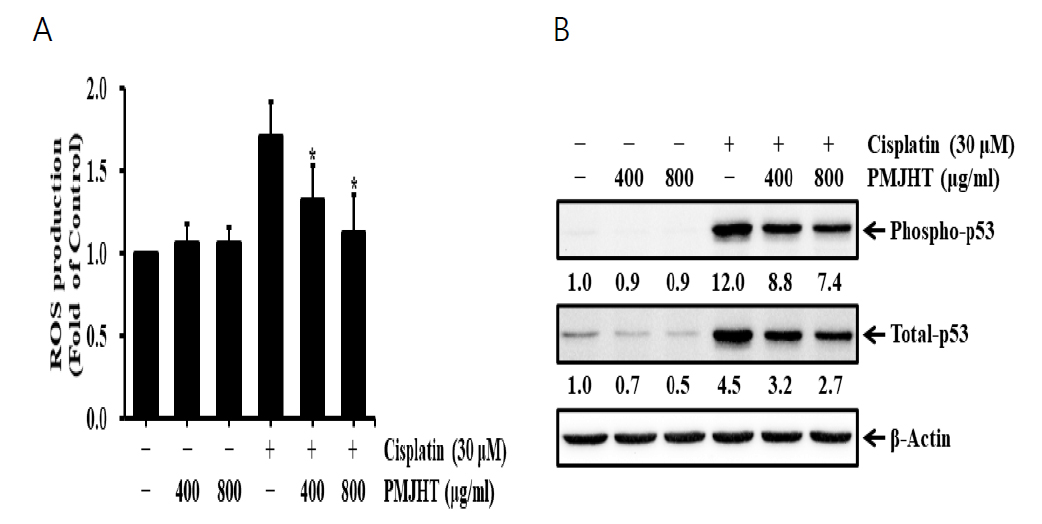
The effects of Palmijihwang-tang on ROS production and p53 activation in cisplatin-treated NRK-52E cells. The cells were treated with 400 and 800 μg/ml Palmijihwang-tang (PMJHT) in the absence or presence of 30 μM cisplatin for 12 h. (A) ROS production was determined by DCFH-DA fluorescence assay. Values are means ± SD, N = 3. The statistically significant differences compared with cisplatin-treated cells were calculated by Student’s t-test. *p<0.05. (B) Whole cell lysates were subjected to SDS-PAGE followed by Western blot analysis with anti-phospho-p53, anti-p53 antibodies. The numbers below the bands indicate the relative density ratio of the respective protein normalized to the internal control (β-actin).
4. AGS 위암세포 및 A549 폐암세포에서 시스플라틴의 항암 활성에 대한 八味地黃湯의 효과
NRK-52E 신장세포에서 시스플라틴과 八味地黃湯 물추출물을 병용 처리하였을 경우, 시스플라틴의 신장독성이 완화되는 것으로 나타났다. 그러나 八味地黃湯의 시스플라틴 신장독성에 대한 완화효과가 시스플라틴의 항암활성을 저해하는 효과를 나타낼 수 있기 때문에 八味地黃湯이 시스플라틴의 항암 활성에 어떤 영향을 주는지 조사하였다. AGS 위암세포와 A549 폐암세포는 八味地黃湯 물추출물을 400 μg/ml과 800 μg/ml 농도로 1시간 전처리 후, 40 μM 농도의 시스플라틴을 24시간 처리하여 caspase-3의 활성 및 발현과 PARP 절편화를 분석하였다. 八味地黃湯 물추출물은 AGS 위암세포 및 A549 폐암세포에서 시스플라틴에 의해 유도된 caspase-3 활성과 PARP 절편화를 감소시키지 않았다(Fig. 4). 특히, A549 폐암세포에서 caspase-3 활성과 PARP 절편화는 八味地黃湯 물추출물에 의해 증가하였는데, 시스플라틴만 처리한 A549 폐암세포의 caspase-3 활성(518.9%)이 400 μg/ml과 800 μg/ml 농도의 八味地黃湯 물추출물에서 각각 589.0%와 651.6%로 증가하였다(Fig. 4A). 또한, A549 페암세포의 caspase-3 및 PARP 절편화 분석에서도 시스플라틴만 처리한 세포의 cleaved caspase-3 발현수준(33.8배)과 cleaved PARP 발현수준(15.2배)이 400 μg/ml 농도의 八味地黃湯 물추출물에서는 각각 36.6배와 17.2배로 증가하였으며, 800 μg/ml 농도의 八味地黃湯 물추출물에서는 각각 38.5배와 20.3배로 증가하였다(Fig. 4B).
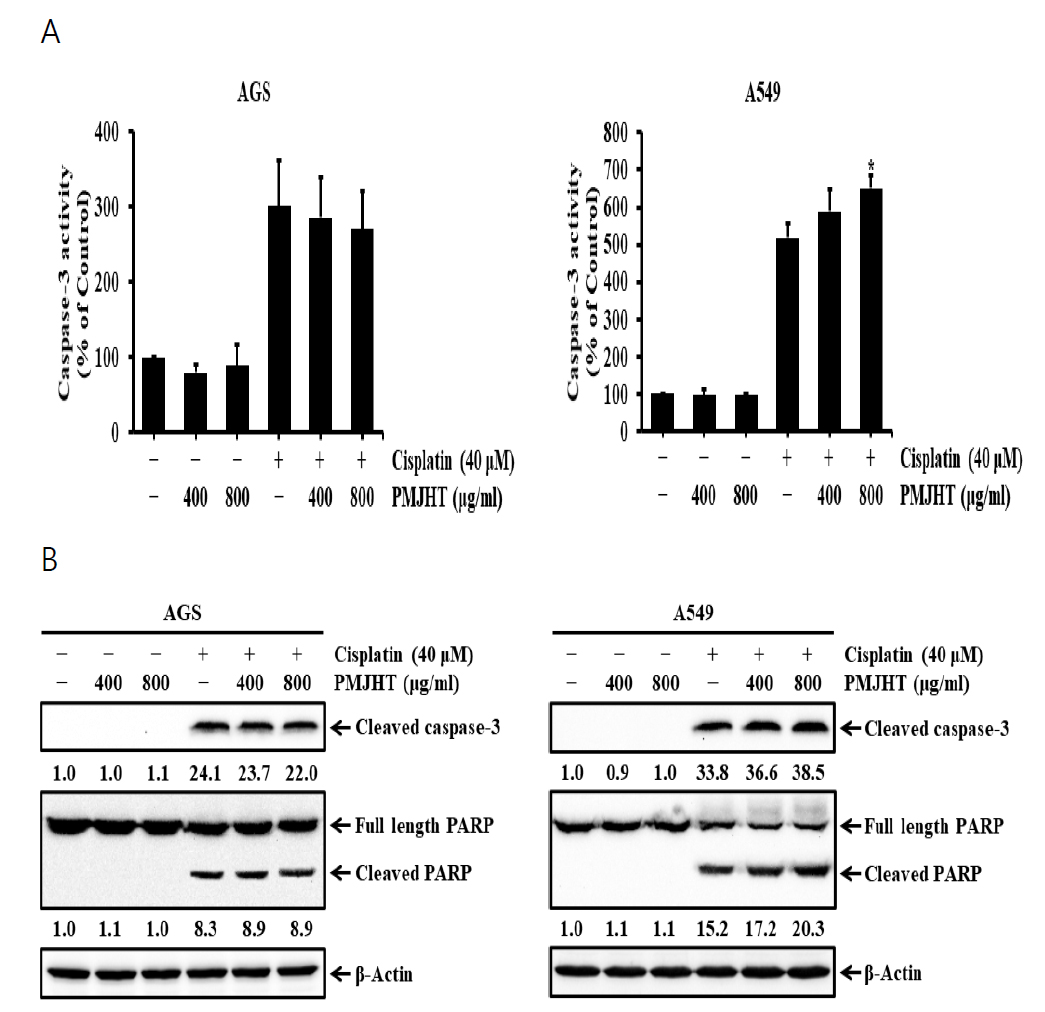
The effects of Palmijihwang-tang on cisplatin-induced apoptosis in AGS and A549 cells. The cells were treated with 400 and 800 μg/ml Palmijihwang-tang (PMJHT) in the absence or presence of 40 μM cisplatin for 24 h. (A) Caspase-3 activity was measured using Colorimetric caspase-3 assay kit. The activation was measured as the increase in activity (%) with respect to untreated cells (100%). Values are means ± SD, N = 3. The statistically significant differences compared with cisplatin-treated cells were calculated by Student’s t-test. *p<0.05. (B) Whole cell lysates were subjected to SDS-PAGE followed by Western blot analysis with anti-cleaved caspase-3 (p20) and anti-PARP antibodies. The numbers below the bands indicate the relative density ratio of the respective protein normalized to the internal control (β-actin).
고 찰
1970년대에 개발된 항암제 시스플라틴은 가장 강력한 항암제 중의 하나로 항암화학치료 요법에 광범위하게 사용되고 있다25,26). 그러나 시스플라틴의 주요 부작용인 신장독성은 항암치료에 있어서 시스플라틴의 사용과 효능을 제한하는 주요한 요인이다1,2). 시스플라틴은 신세뇨관 세포의 손상과 아폽토시스를 유도하는 다양한 세포내 신호전달경로를 활성화함으로써 강력한 염증반응을 유도하여 신장조직의 손상을 악화시키며, 신장혈관에 손상을 유도하여 신장의 혈류감소와 허혈성 상해로 인해 사구체여과율을 감소시킨다27). 결국 시스플라틴에 의한 신장기능의 축적 손상이 신장기능을 상실시킴으로써 급성신부전을 초래하게 한다27). 수년간 시스플라틴 신장독성을 경감시키기 위하여 다양한 보조제가 사용됐지만, 신장보호효과가 대체로 부분적이어서 대안적인 접근의 필요성이 대두되고 있다. 최근 10년간 다수의 연구에서 시스플라틴의 신장독성에 대해 보호효과를 나타내는 다양한 천연화합물들이 발견되면서 급성신부전에 대한 새로운 치료제로 전통 한약이 관심을 받고 있다28).
八味地黃湯은 漢代 張仲景16)의 『金匱要略』에 八味腎氣丸으로 처음 기록된 처방으로 현재 한의학에서 대표적인 補腎, 補陰劑로 사용되고 있다29). 한국, 중국, 일본에서 요통, 빈요증, 수족냉증, 신장염, 갑상샘기능저하증 등과 같은 다양한 증상을 치료하기 위해 임상적으로 사용되어 왔으며22), 당뇨 및 관련 합병증의 자각증상을 경감시키기 위해서도 사용되어 왔다20). 특히 당뇨성 신증 및 腎절제된 동물모델에서 신장 기능이상 및 신부전의 진행을 억제한다는 실험적 연구가 보고되었다30,31). 그러나 신장 기능이상 및 신부전에 대해 우수한 신장보호 효과를 나타내는 八味地黃湯은 시스플라틴의 신장독성에 미치는 효과에 대해선 현재까지 알려지지 않았다. 따라서 본 연구에서는 八味地黃湯이 시스플라틴에 의해 유도된 NRK-52E 신장세포의 손상에 미치는 영향을 평가하기 위하여 독성이 거의 없는 400 μg/ml과 800 μg/ml 농도의 八味地黃湯 물추출물과 시스플라틴을 NRK-52E 세포에 병용 처리하여 세포생존율, Sub-G1 세포수, caspase-3 활성, PARP 절편화의 변화를 관찰하였다. 시스플라틴만 처리한 세포에서 현저한 세포생존율 감소 및 Sub-G1 세포수 증가와 caspase-3 활성 및 PARP 절편화 증가가 관찰되었지만, 八味地黃湯 물추출물에 의하여 시스플라틴에 의해 감소한 세포생존율을 유의하게 증가시킴으로써 sub-G1 세포수의 감소가 확인되었으며, 시스플라틴의 아폽토시스 유도에 따른 caspase-3 활성 및 발현과 PARP 절편화 증가는 八味地黃湯 물추출물에 의해 감소하는 것이 확인되었다. 따라서 이 결과들은 八味地黃湯 물추출물이 시스플라틴에 의해 유도된 NRK-52E 신장세포의 아폽토시스를 효과적으로 억제함으로써 신장독성을 완화 시킬 수 있다는 것을 제시하고 있다.
시스플라틴의 신장독성은 산화적 스트레스, MAPKs, p53 암 억제 단백질, 염증반응 등이 수반되는 복잡한 다원적인 과정으로 그 중 ROS와 p53은 시스플라틴의 신장독성에 주요 원인으로 작용하는 요인이다27). 시스플라틴은 신장세포에서 ROS를 생성하여 산화적 스트레스를 유도해 아폽토시스 경로를 활성화시키며32,33), p53은 시스플라틴의 신장독성으로 인해 활성화되어 신장세포 손상 및 사멸을 유도하는 원인이 된다34). 특히, 이전에 보고된 연구에 의하면 신장세포에서 시스플라틴에 의해 유도된 p53 활성은 ROS 생성과 밀접한 관련이 있는 것으로 보고되었으며, ROS 소거효과는 시스플라틴에 의해 유도된 p53의 활성을 감소시켜 신장세포에 대한 보호효과를 가지는 것으로 보고되었다23,24). 따라서 산화적 스트레스 감소는 시스플라틴에 의해 유도된 신장독성을 완화하는 효과적인 전략으로 제시되고 있다. 본 연구에서는 八味地黃湯 물추출물이 시스플라틴에 의해 유도되는 ROS 생성과 p53 활성 및 발현에 미치는 효과를 평가하기 위해 ROS 생성량과 p53 인산화 및 총발현량을 분석하였다. NRK-52E 신장세포에서 시스플라틴에 의해 유도된 ROS 생성은 八味地黃湯 물추출물에 의해 유의적으로 감소하는 것이 관찰되었으며, 八味地黃湯 물추출물의 p53 인산화 억제에 따른 p53의 총발현량이 감소하는 것이 확인되었다. 따라서 이 결과들은 八味地黃湯 물추출물이 시스플라틴 처리된 NRK-52E 세포에서 ROS 생성과 p53의 활성 및 발현 감소를 통해 신장독성을 완화한다는 것을 제시하고 있으며, 八味地黃湯 물추출물의 p53의 활성 및 발현 감소 효과는 ROS 생성 억제와 관련되어 있을 것으로 판단되고 있다.
항암제 대부분은 암세포에 선택적이지 않으며, 세포분열하는 정상세포도 공격하기 때문에 그에 따른 부작용이 나타나게 된다. 따라서 항암제의 부작용을 경감시키면서 화학요법의 항암효능을 저해시키지 않는 항암 보조제의 개발하는 것이 매우 중요하다. 따라서 본 연구에서는 종양세포에서 八味地黃湯이 시스플라틴의 항암 활성에 미치는 효과를 평가하기 위해 AGS 위암세포 및 A549 폐암세포를 이용하여 caspase-3 활성 및 발현과 PARP 절편화의 변화를 관찰하였다. 양쪽 AGS 위암세포와 A549 폐암세포에서 시스플라틴에 의해 유도된 caspase-3 활성 및 발현과 PARP 절편화는 八味地黃湯 물추출물에 의해 감소하는 것이 관찰되지 않았으며, 특히 A549 폐암세포에서는 八味地黃湯 물추출물이 시스플라틴에 의해 증가한 caspase-3 활성 및 발현과 PARP 절편화보다 더욱 증가하는 것이 관찰되었다. 따라서 이 결과들은 八味地黃湯이 시스플라틴의 항암 활성을 저해하지 않으면서 신장독성을 완화할 수 있다는 것을 제시하고 있다.
지금까지의 결과들을 통해 八味地黃湯은 ROS 생성 및 p53 활성을 조절함으로써 시스플라틴의 신장독성을 완화할 수 있으며, 또한 시스플라틴의 항암효과를 저해시키지 않거나 더욱 증진 시킬 수 있다는 것을 보여주었다. 그러나 八味地黃湯을 항암 화학요법의 보조제로서 임상에 적용하기 위해서는 적절한 동물모델을 통해 in vivo 효능연구가 반드시 수반되어야 할 것이다.
결 론
본 연구는 腎陽虛證의 한방방제로 사용되는 八味地黃湯을 이용하여 시스플라틴의 신장독성에 대한 완화 효과를 규명하고자 하였다. 八味地黃湯 물추출물은 시스플라틴 처리된 NRK-52E 신장세포에서 ROS 생성 및 p53 활성을 감소시켜 신장독성을 완화했으며, AGS 위암세포 및 A549 폐암세포에서 시스플라틴의 항암 활성을 방해하지 않았다. 이와 같은 결과는 八味地黃湯이 시스플라틴 기반의 항암 화학요법을 통한 치료에서 부작용을 감소시키면서 항암치료를 효과적으로 할 수 있는 항암치료 보조제로 활용될 가능성을 제시해 주고 있다.
Acknowledgments
이 논문은 2019학년도 원광대학교의 교비지원에 의해 수행됨.
References
-
Kelland L. The Resurgence of Platinum-Based Cancer Chemotherapy. Nat Rev Cancer. 2007;7(8):573-84.
[https://doi.org/10.1038/nrc2167]

-
Barabas K, Milner R, Lurie D, Adin C. Cisplatin: A Review of Toxicities and Therapeutic Applications. Vet Comp Oncol. 2008;6(1):1-18.
[https://doi.org/10.1111/j.1476-5829.2007.00142.x]

-
Rybak LP. Mechanisms of Cisplatin Ototoxicity and Progress in Otoprotection. Curr Opin Otolaryngol Head Neck Surg. 2007;15(5):364-9.
[https://doi.org/10.1097/MOO.0b013e3282eee452]

- Cubeddu LX. Mechanisms by Which Cancer Chemotherapeutic Drugs Induce Emesis. Semin Oncol. 1992;19(6 Suppl 15):2-13.
- Hanigan MH, Devarajan P. Cisplatin Nephrotoxicity: Molecular Mechanisms. Cancer Ther. 2003;1:47-61.
-
McWhinney SR, Goldberg RM, McLeod HL. Platinum Neurotoxicity Pharmacogenetics. Mol Cancer Ther. 2009;8: 10-16.
[https://doi.org/10.1158/1535-7163.MCT-08-0840]

-
Kintzel PE. Anticancer Drug-Induced Kidney Disorders. Drug Saf. 2001;24(1):19-38.
[https://doi.org/10.2165/00002018-200124010-00003]

-
Ahn BS, Kim SK, Kim HN, Lee JH, Lee JH, Hwang DS, Bae H, Min BI, Kim SK. Gyejigachulbu-Tang Relieves Oxaliplatin-Induced Neuropathic Cold and Mechanical Hypersensitivity in Rats via the Suppression of Spinal Glial Activation. Evid Based Complement Alternat Med. 2014;2014:436842.
[https://doi.org/10.1155/2014/436482]

-
Kim SK, Kwon DA, Lee HS, Kim HK, Kim WK. Preventive Effect of the Herbal Preparation, HemoHIM, on Cisplatin-Induced Immune Suppression. Evid Based Complement Alternat Med. 2019;2019:3494806.
[https://doi.org/10.1155/2019/3494806]

-
Kim HJ, Lee JY, You BR, Soo DE, Kim MR. Antioxidant Activities of Rehmannia glutinosa by Traditional Methods. Korean J Medicinal Crop Sci. 2011;19(5):341-6.
[https://doi.org/10.7783/KJMCS.2011.19.5.341]

- Han JH, Kim GY. Hanbangyakrihak, Seoul: Eui Seong Dang Publishing Co. p. 2008. p. 169.
- Seo SJ, Kim YH, Park RG, So HS, Jeon BH, Shin MK, Jung SY, Kim KY, You YO. Protective Effect of Rehmannia Radix Preparata Extract on the Cisplatin-induced Cytotoxicity of HEI-OC1 Cells via Scavenging of Free Radicals. J Physiol & Pathol Korean Med. 2005;19(5):1349-55.
- Ju SM, Park JM, Jeon BJ, Yang HM, Hong JE, Kim IG, Kim WS, Jeon BH. Preventive Effect of Puerariae Radix and Rehmanniae Radix Preparata on Cisplatin-induced Rat Mesangial Cell Apoptosis. J Physiol & Pathol Korean Med. 2008;22(5):1140-6.
-
Jun SA, Lee H. The Effects of Dokhwaljihwang-tang Intravenous Pharmacopuncture on Cisplatin-Induced Emesis and Gastrointestinal Mobility Disorder in Rats. J Acupunct Res. 2017;34(3):39-48.
[https://doi.org/10.13045/acupunct.2017091]

- Park YC, KIM JB, Kook YB, Lee SD. Pharmacological and Toxicological review of Yukmijihwang-tang (Hwan). Herb Formula Sci. 2012;20(1):13-24.
- Zhang ZJ. Gumgueyolak. Beijing: Inminwisaeng publisher; 1989. p. 157.
- Lee MH, Son IC. Effect of Aqua-Acupuncture of Yukmijihwangtang and Palmijihwangtang Water Extracts on the Renal Function. J Acupunct Res. 1998;15(2):255-77.
-
Sakamoto S, Kudo H, Kawasaki T, Kasahara N, Okamoto R. Effect of Ba-Wei-Di-Huang-Wan (Hachimi-Jio-Gan) on Thymidine Kinase and Its Isozyme Activities in the Prostate Glands in Rats. 1988;16(1-2):29-36.
[https://doi.org/10.1142/S0192415X88000066]

-
Usuki S. Hachimijiogan Produces Testosterone in Adult Rat Testes. Am J Chin Med. 1988;16(3-4):93-105.
[https://doi.org/10.1142/S0192415X88000169]

-
Kim HY, Yokozawa T, Cho EJ, Yamabe N. Protective Effects of the Chinese Prescription Hachimi-jio-gan Against Diabetic Oxidative Stress. J Pharm Pharmacol. 2004;56(10):1299-305.
[https://doi.org/10.1211/0022357044490]

-
Furuya Y, Kawakita T, Nomoto K. Immunomodulating Effect of a Traditional Japanese Medicine, Hachimi-Jio-Gan (Ba-Wei-Di-Huang-Wan), on Th1 Predominance in Autoimmune MRL/MP-lpr/lpr Mice. Int Immunopharmacol. 2001;1(3):551-9.
[https://doi.org/10.1016/S1567-5769(00)00024-2]

-
Oka H, Goto H, Koizumi K, Nakamura S, Tsuneyama K, Zhou Y, Jo M, Fujimoto T, Sakurai H, Shibahara N, Saiki I, Shimada Y. Effect of Hachimijiogan Against Renal Dysfunction and Involvement of Hypoxia-Inducible Factor-1α in the Remnant Kidney Model. Evid Based Complement Alternat Med 2011;2011:348686.
[https://doi.org/10.1155/2011/348686]

-
Jiang M, Wei Q, Pabla N, Dong G, Wang CY, Yang T, Smith SB, Dong Z. Effects of Hydroxyl Radical Scavenging on Cisplatin-Induced p53 Activation, Tubular Cell Apoptosis and Nephrotoxicity. Biochem Pharmacol. 2007;73(9):1499-510.
[https://doi.org/10.1016/j.bcp.2007.01.010]

- Ju SM, Pae HO, Kim WS, Kang DG, Lee HS, Jeon BH. Role of Reactive Oxygen Species in p53 Activation During Cisplatin-Induced Apoptosis of Rat Mesangial Cells. Eur Rev Med Pharmacol Sci. 2014;18(8):1135-41.
-
Wang D, Lippard SJ. Cellular Processing of Platinum Anticancer Drugs. Nat Rev Drug Discov. 2005;4(4):307-20.
[https://doi.org/10.1038/nrd1691]

-
Cohen SM, Lippard SJ. Cisplatin: From DNA Damage to Cancer Chemotherapy. Prog Nucleic Acid Res Mol Biol. 2001;67:93-130.
[https://doi.org/10.1016/S0079-6603(01)67026-0]

-
Pabla N, Dong Z. Cisplatin Nephrotoxicity: Mechanisms and Renoprotective Strategies. Kidney Int. 2008;73(9):994-1007.
[https://doi.org/10.1038/sj.ki.5002786]

-
Kim TW, Kim YJ, Park SR, Seo CS, Ha H, Shin HK, Jung YJ. Chrysanthemum Indicum Attenuates Cisplatin-Induced Nephrotoxicity Both in Vivo and in Vitro. Nat Prod Commun. 2015;10(3):397-402.
[https://doi.org/10.1177/1934578X1501000306]

- Oh RS, Kim YH, Ahn BG. Study on The Effects of Parnijiwhanghan and Yukmijiwhanghan. Korean J Orient Med Pathol. 1996;10(2):12-7.
-
Nakagawa T, Yokozawa T, Yamabe N, Rhyn DY, Goto H, Shimada Y, Shibahara N. Long-term Treatment With Hachimi-jio-gan Attenuates Kidney Damage in Spontaneously Diabetic WBN/Kob Rats. J Pharm Pharmacol. 2005;57(9):1205-12.
[https://doi.org/10.1211/jpp.57.9.0016]

-
Yamabe N, Yokozawa T, Kim HY, Cho EJ. Protective Effect of Hachimi-jio-gan Against Renal Failure in a Subtotal Nephrectomy Rat Model. J Pharm Pharmacol. 2005;57(12):1637-44.
[https://doi.org/10.1211/jpp.57.12.0014]

-
Casares C, Ramírez-Camacho R, Trinidad A, Roldán A, Jorge E, García-Berrocal JR. Reactive Oxygen Species in Apoptosis Induced by Cisplatin: Review of Physiopathological Mechanisms in Animal Models. Eur Arch Otorhinolaryngol. 2012;269(12):2455-9.
[https://doi.org/10.1007/s00405-012-2029-0]

-
Conklin KA. Dietary Antioxidants During Cancer Chemotherapy: Impact on Chemotherapeutic Effectiveness and Development of Side Effects. Nutr Cancer. 2000;37(1);1-18.
[https://doi.org/10.1207/S15327914NC3701_1]

-
Bhatt K, Zhou L, Mi QS, Huang S, She JX, Dong Z. MicroRNA-34a Is Induced via p53 During Cisplatin Nephrotoxicity and Contributes to Cell Survival. Mol Med. 2010;16(9-10):409-16.
[https://doi.org/10.2119/molmed.2010.00002]