청아원가감 추출물이 난소적출로 유발된 흰쥐의 골다공증 모델이 미치는 영향
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
This study was conducted to evaluate the efficacy of Cheongawongagam on osteoporosis rat. A total of 35 rats were divided into seven groups; Normal control(SD-Nr), experimental control group(OVX-CTL), positive control group(OVX-17β-E2) and herb extracts group[Eucommia ulmoides(OVX-EU-E), Juglandis semen(OVX-JR-SE), Acanthopanax senticosus(OVX-AS-E) extract and Cheongawongagam extracts(OVX-JAEG-E)]. All control group, and herb extracts group were ovariectomized. After the 3 weeks recovery period, herb extract group were orally administered 200 mg / kg of the EU-E, JR-SE, AS-E and JAEG-E for 12 weeks. In the OVX-CTL, 17β-estradiol(E2) was administered subcutaneously on the back of the rats at a dose of 0.03 ug/sc. Their body weight, serum total cholesterol, triglyceride, aspartate aminotransferase (AST), alanine aminotransferase (ALT), alkaline phosphatase (ALP), Leukotriene B4 (LTB4), calcium (Ca), estradiol, osteocalcin, and deoxypyridinoline (DPD) concentration were measured. Also, we investigated mRNA expression of inflammatory cytokine, MMP-2, MMP-9, and bone tissue. As a result, total cholesterol was significantly decreased in the OVX-AS-E and OVX-JAEG-E. ALP was significantly increased and osteocalcin, DPD was significantly decreased in OVX-JAEG-E. The expression of inflammatory mediators (TNF-α, IL-1β, LTB4, COX-2, NOS-2), inflammatory cytokines IL-1β and MMP-9 mRNA were significantly decreased in OVX-JAEG-E. Histologic examination of the femur showed that bone mineral density, and bone mass were increased and bone marrow were decreased in the OVX-JAEG-E group. The above experiment shows that cheongawongagam extract were effective in the prevention and treatment of osteoporosis.
Keywords:
Osteoporosis, Eucommia ulmoides, Juglandis semen, Acanthopanax senticosus, Cheongawongagam extract서 론
골다공증은 골강도의 약화로 골절의 위험이 증가되는 전신적인 골격계 질환으로 골밀도와 골의 질 감소, 골조직 미세구조의 약화를 특징으로 한다. 골다공증은 가장 대표적인 노인성 질환 중 하나로, 인구가 점차 고령화됨에 따라 골다공증에 대한 사회적 관심이 대두되고 있다1).
골다공증 환자는 막연한 요통 이외에는 뚜렷한 자각증상이 없으나 작은 충격이나 외상에 의해 척추, 고관절, 손목, 상완골 등 다양한 부위의 골절이 나타날 수 있다. 그 중에서 가장 심각한 골절은 고관절 골절로, 20 ~ 30%가 1년 이내에 관련 합병증으로 사망한다고 알려져 있다2,3).
이로 인해 골절이 나타나면 치료비용은 물론, 장기간의 후유증 및 삶의 질에 큰 영향을 주게 되어 본인뿐만 아니라 주변 가족까지 고통을 받게 되기 때문에 사회적, 경제적 손실이 발생하게 된다. 이에 골다공증의 예방과 치료를 위한 다양한 연구와 대책이 경제, 복지, 보건 의료적 측면에서 중요해지고 있다4).
한의학에서는 골다공증을 骨痿, 骨痺, 骨枯 등과 연관시키는데, 임상 논문에서는 骨痿의 개념이 가장 유사하다고 보고 있다5). 骨痿는 광의적으로 우리 몸의 근간인 뼈에 전반적 영양부족 상태가 오는 것을 말하고, 협의적으로는 골형성의 감소, 골흡수의 증가와 골기질의 무기질 침착이 충분하지 못하여 전체 골량이 감소되고 골조직이 약화되며 변형되는 질환을 총칭한다6).
골다공증 치료와 관련하여 한의학적 연구 동향을 보면 두충, 녹용, 홍화자 등 한약 단독 추출물 혹은 육미지황탕, 청아지황탕 등 복합 추출물을 투여한 연구들이 진행되었고 특히 단독 약물을 투여한 경우가 복합 약물을 투여를 한 경우보다 많았다7). 기본적인 치료법으로는 補益藥을 바탕으로 하여 補肝腎 强筋骨의 기능을 가진 약재들을 다루었으며 골다공증의 원인을 腎虛로 접근하여 치료한 연구가 보고되었다8).
청아원은 두충, 보골지, 호두, 생강으로 구성된 처방으로, 《東醫寶鑑》에서 腎氣가 허약하여 발생한 요통에 다용되었다9). 이전 연구에서 노화질환에 관여하는 활성질소 제거를 활성화시킨다는 보고가 있으며, 이를 활용한 임상 연구에서 골다공증 개선에 유효성 및 안전성을 나타내었다10,11). 다만 청아원의 구성성분 중 보골지는 다량 복용시 간독성 혹은 과민반응으로 복용시 신중해야 한다는 보고가 있어 보골지 대신 補肝腎 强筋骨하며 임상에서 안전하게 다용되는 오가피로 대체하였다12,13).
이에 본 저자는 두충, 호두, 오가피 단독 추출물 및 청아원가감 추출물을 이용하여 골다공증 예방 및 치료에 미치는 효과를 살펴보고자 하였다. 난소를 적출하여 에스트로겐 결핍성 골다공증을 유발한 흰쥐에 3 주간의 회복기 후 두충, 호두, 오가피 단독 추출물 및 청아원가감 추출물을 12 주간 경구 투여하여 비교 분석한 결과 유의한 결과를 얻었기에 보고하는 바이다.
재료 및 방법
1. 재료
실험동물은 7 주령의 암컷 Sprague-Dawley(SD) rat(SLC, Japan)를 구입하여 온도(20-25℃)와 습도(40-45%)를 유지한 사육실의 polycarbonate cage에 5 마리씩 사육했다. 명암주기는 낮과 밤 12 시간: 12 시간으로 하였으며, 수술 후 사료와 물은 자유롭게 공급하였다. 실험물질은 난소적출 3 주일의 회복기 후 투여를 시작하였고, 사용된 실험동물 관리 및 모든 실험 과정은 대전대학교 동물실험윤리위원회의 승인 하에 동물실험의 윤리적, 과학적 타당성과 효율적 관리를 검토 받았다. (승인번호: DJUARB2017-037)
본 실험에 사용한 국내 한약공급업체인 옴니허브㈜에서 구입, 정선하여 사용하였다. 두충, 호두, 오가피 각각 1000 g과 청아원가감 추출물 (두충1:호두1:오가피1:생강1)을 한일분쇄기(FM-700SS, 한국)로 분쇄하여 환류 추출기에 넣고 45℃에서 30% 에탄올을 3 ℓ 가하여 60 분 추출한 후 다시 30% 에탄올 3 ℓ를 가하여 같은 조건으로 60 분 동안 재탕하였다. 그 후 농축과정을 거치고 건조하여 두충추출물 (38.28 g, 수율 3.828%), 호두추출물 (13.08 g, 수율 1.308%), 오가피추출물 (17.16 g, 수율 1.716%), 4종 혼합추출물 (14.19 g, 수율 1.419%)을 얻었다.
2. 방법
실험군은 아래와 같이 일곱 군으로 분류하였고 각 군마다 5마리씩 실험동물을 배정하였다.
(1) SD-Nr군: SD rat-normal 정상군으로 양측의 난소를 노출 시킨 뒤 제거하지 않고 복강을 폐쇄한 난소 비적출군
(2) OVX-CTL군: 난소를 절제한 후 0.5% carboxymethylcellulose (0.5% CMC, vehicle)를 경구 투여한 실험 대조군
(3) OVX-17β-E2군: 난소를 절제한 후 17β-estradiol(E2)을 0.03 ug/sc의 용량으로 등 부위에 피하 주사한 양성 대조군
(4) OVX-JR-SE군: 난소를 절제한 후 호두추출물을 200 mg/kg 경구 투여한 군
(5) OVX-AS-E군: 난소를 절제한 후 오가피추출물을 200 mg/kg 경구 투여한 군
(6) OVX-EU-E군: 난소를 절제한 후 두충추출물을 200 mg/kg 경구 투여한 군
(7) OVX-JAEG-E군: 난소를 절제한 후 호두, 오가피, 두충, 생강 혼합추출물 (청아원가감 추출물)을 200 mg/kg 경구 투여한 군
난소 적출군을 ketamine hydrochloride(ICN Biochemicals Inc., USA)와 Xylazine hydrochloride (Wako Pure Chemical Industries Ltd., Japan)로 마취하여 개복한 뒤, 하복부의 피부, 지방, 근육 층을 절개하여 난소를 노출시켰다. 5-0 (쥐) 견사로 결찰하여 난소를 절제했고, 난소 비적출군에선 양측의 난소를 노출 시킨 뒤 난소를 제거하지 않고 복강을 폐쇄했다.
시료 추출물을 증류수에 녹여 체중 kg 당 0.2 ml의 용량으로, 난소 적출 3 주 후부터 15 주간 경구용 zonde가 부착된 3 ml syringe를 이용하여 투여하였으며, 대조약물인 17β-estradiol(E2)는 0.03 ug/sc의 용량으로 등 부위에 피하 주사하였다.
수술 당일, 난소 적출 1 주일 후, 투여 시작 시 및 최종 희생 시를 포함해 투여 기간 동안 매주 실험동물용 체중계 (Ohaus, USA, Adventure-pro AVG 812)를 사용하여 측정하였다.
동물실험 종료 후 전날 절식하여 공복상태에서 마취하고, 심장에서 혈액을 채혈하였다. 흰쥐를 희생하여 대정맥에서 1 ml의 정맥혈을 채취하고, 실온에서 15 분간 3,000 rpm으로 원심 분리 하였다. 혈청 중 Leukotriene B4 (LTB4), Deoxypyridinoline (DPD), Osteocalcin (OC), Calcium (Ca), ALP, Triglyceride, total cholesterol, AST, ALT를 측정하였다.
17β-estradiol (E2)은 항원 효소 복합 용액을 만들어 항원항체 반응을 시킨 후 17β-estradiol color solution으로 발색하였으며 17β-estradiol stop solution을 첨가하여 450 nm에서 측정하였다.
추출한 RNA를 diethyl pyrocarbonate (DEPC)를 처리한 증류수에 녹인 후, 불활성화시켜 first strand cDNA 합성에 이용하였다. 역전사 반응은 total RNA 3 ㎍을 DNase I (10 U/㎕) 2 U/tube로 37℃ heating block에서 30 분간 반응시킨 후 75℃에서 10 분간 변성시키고, 이것을 2.5 ㎕ 10 mM dNTPs mix, 1 ㎕ random sequence hexanucleotides (25 pmole/ 25 ㎕), RNA inhibitor로서 1 ㎕ RNase inhibitor (20 U/㎕), 1 ㎕ 100 mM DTT, 4.5 ㎕ 5×RT buffer (250 mM Tris-HCl, pH 8.3, 375 mM KCl, 15 mM MgCl2)를 넣은 후, 1 ㎕의 M-MLV RT (200 U/㎕)를 다시 작용시키고 DEPC 처리된 증류수를 섞어서 최종 부피를 20 ㎕로 만들었다. 이 20 ㎕의 반응 혼합액을 섞어 2,000 rpm에서 5 초간 원심 분리하여 60 분 동안 37℃ heating block에서 반응시킨 후 first-strand cDNA를 합성하였다. 그 뒤 5 분간 95℃에서 방치하였고 M-MLV RT를 불활성화시켜 합성이 완료된 cDNA를 polymerase chain reaction (PCR)에 사용하였다. Real time quantitative PCR은 Applied Biosystems 7500 Real-Time PCR system (Applied Biosystems, USA)를 이용하였다. 염증사이토카인 유전자 발현은 TaqMan probe (FAM dye-labeled, ABi, USA)를, internal standard는 Mouse GAPDH probe set; Endogenous Control (VIC®/MGB Probe, Probe limited) from Applied Biosystems (4352339E)를 사용했고, primer의 최종 농도가 200 nM이 되도록 반응시켰다. 실험군 및 대조군은 internal standard로 G3PDH를 사용하였다. Target group의 Quantitative PCR는
y = x(1+e)n (x = starting quantity, y = yield, n = number of cycles = efficiency)로 계산하여 RQ (relative quantitative)을 측정하였다.
흰 쥐의 우측 대퇴골을 분리하여 10% neural buffered formalin (NBF)에 고정하여 칼슘제거 용액 (24.4% formic acid and 0.5 N sodium hydroxide)을 5일간 이용하여 탈회시켰다. 이 후 파라핀에 봉입한 다음, 3~4 μm의 연속절편을 제작하였고, 조직병리검사는 표준방법에 의하여 Hematoxylin and Eosin (H&E)으로 염색하였으며, 염색한 조직은 광학현미경 (Optical & light microscopy, Olympus BX51, Olympus Optical Co., Tokyo, Japan)을 이용하여 100 배 시야에서 관찰하였다.
각 군의 결과값을 mean ± standard deviation (SD)으로 표기하였으며, SPSS 22.0 software (IBM-SPSS Inc., Chicago, IL)를 이용하여 One-way ANOVA 한 뒤에 Duncan’s multiple comparison tests로 유의성을 검증하였다. p 값이 0.05, 0.01 혹은 0.001 보다 작은 경우를 구분하여 분석하였으며 (#p<0.05, ##p<0.01, ###p<0.001 vs. SD-Nr; *p<0.05, **p<0.01 and ***p<0.001 vs. OVX-CTL), 각 경우에 해당 시 통계적으로 유의한 차이가 있는 것으로 판정하였다.
결 과
1. 체중 변화
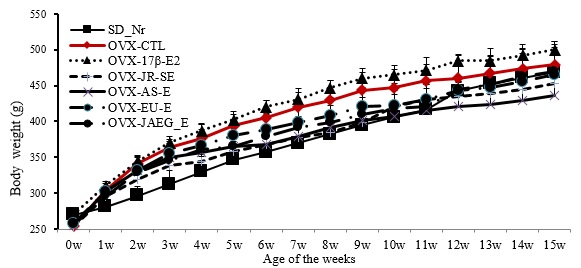
난소절제술을 시행한 후 3 주간의 회복기를 거쳐 실험기간인 15 주 동안 일주일에 1 회 체중을 측정한 결과, 정상 SD-Nr군에 비하여 난소절제 대조군 (OVX-CTL)과 양성대조군 (OVX-17β-E2)이 약간 증가하였으나, 약물실험군과 정상군 간의 체중변화는 유의한 차이가 관찰되지 않았다(Fig. 1).
2. 혈액 생화학적 검사
대사성질환의 지표인 중성지방과 총콜레스테롤을 분석한 결과, 중성지방은 OVX-AS-E 군만이 대조군 (OVX-CTL)에 비하여 유의성 있게 감소하였다(p <0.01). 혈청 내 총콜레스테롤 함량은 정상군(SD-rat normal)에 비하여 대조군 (OVX-CTL)이 유의성 있게 증가하였고 (p<0.05), 양성대조군과 AS-E, JAEG-E 투여군도 대조군 (OVX-CTL)에 비하여 유의성 있게 감소하였으며 OVX-AS-E 군에서의 총콜레스테롤 함량이 가장 낮았다 (p<0.05)(Fig. 2).
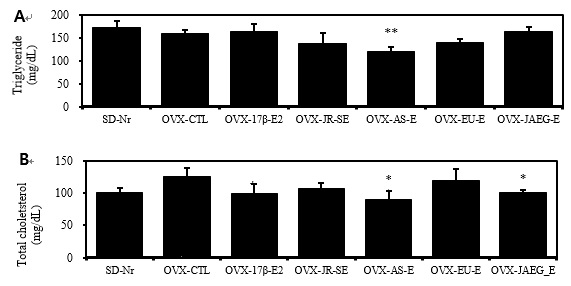
Clinical Chemistry changes of triglyceride (A) and total cholesterol (B) of OVX rats after 15 weeks treatment. # p<0.05, ## p<0.01 and ### p<0.001 compared with SD-Nr, *p<0.05, **p<0.01 and ***p<0.001 compared with OVX-CTL, Values are means ± SEM (n = 5), The statistical significance was revealed by ANOVA.
3. 혈청 변화
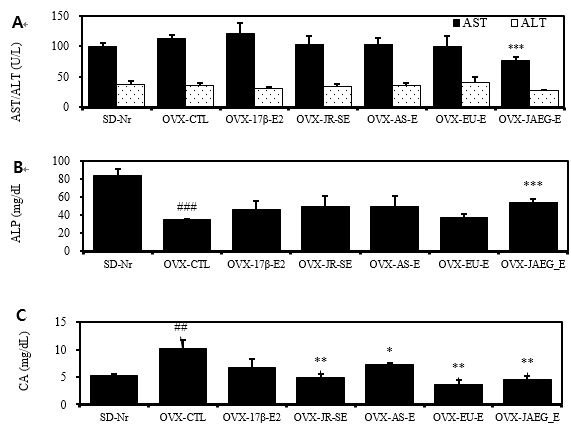
혈청 AST, ALT, ALP 수준을 측정한 결과, AST, ALT 수준은 모든 약물실험군에서 간수치가 유의미하게 증가하지 않았고, OVX-JAEG-E 군은 AST가 대조군에 비하여 유의성 있게 감소하였다 (p<0.001). ALP 수준은 정상군에 비하여 대조군이 2 배 이상 감소하였고 (p<0.01), OVX-JAEG-E 군은 대조군에 비하여 유의성 있게 증가하였다(p<0.001).
15 주 후 혈청내 칼슘농도는 정상군에 비하여 대조군이 2 배 이상 증가하였다(p<0.01). 양성대조군을 포함한 약물실험군에서 혈청내 칼슘농도가 대조군에 비하여 감소하였다. 양성대조군을 제외한 모든 약물실험군은 대조군에 비하여 유의성 있게 감소하였고 OVX-EU-E 군에서의 칼슘농도가 가장 낮았다(p<0.05, p<0.01) (Fig. 3).
4. 혈청내 염증매개인자
염증매개인자인 IL-1β, TNF-α, LTB4를 ELISA를 통해 측정한 결과, 혈청내 염증 사이토카인 TNF-α 수준에서는 정상군에 비하여 대조군이 2 배 이상 증가하였고 (p<0.001), 양성대조군을 포함한 모든 약물실험군은 대조군에 비하여 유의성 있게 감소하였다 (p<0.05, p<0.01).
혈청내 염증 사이토카인 IL-1β 수준에서는 정상군에 비하여 대조군이 현저히 증가하였고 (p<0.01), EU-E와 JAEG-E 투여군은 대조군에 비하여 유의성 있게 감소하였으며(p<0.05), 양성대조군과 JR-SE, AS-E 투여군은 대조군에 비하여 감소하였으나 유의성은 없었다.
또한 혈청내 염증매개인자인 LTB4 수준에서는 정상군에 비하여 대조군이 2 배 이상 증가하였고(p<0.01), AS-E와 JAEG-E 투여군은 대조군에 비하여 유의성 있게 감소하였으나 (p<0.05, p<0.01), 양성대조군과 JR-SE, EU-E 투여군에서는 유의성이 없었다(Fig. 4).
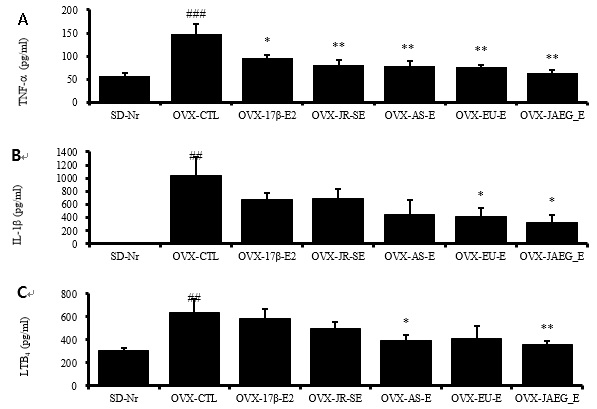
Clinical changes of TNF-α (A), IL-1β (B) and LTB4 (C) level in serum (ELISA) of OVX rats after 15 weeks treatment. # p<0.05, ## p<0.01 and ### p<0.001 compared with SD-Nr, *p<0.05, **p<0.01 and ***p<0.001 compared with OVX-CTL, Values are means ± SEM (n = 5), The statistical significance was revealed by ANOVA.
5. 혈청내 Osteocalcin과 DPD
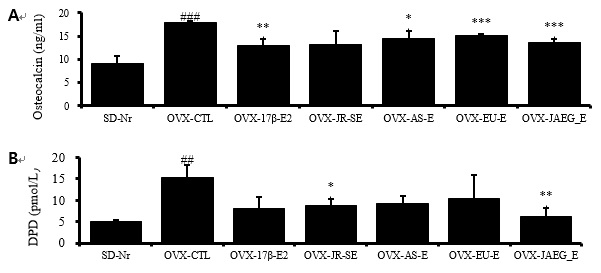
실험 종료 후 골대사지표인 Osteocalcin과 DPD 단백질 수준을 ELISA를 통해 측정한 결과, 혈청내 골대사지표인 Osteocalcin 단백질 수준에서는 정상군에 비하여 대조군이 2 배 이상 증가하였고 (p<0.001), 양성대조군을 포함한 모든 약물실험군은 대조군에 비하여 감소하였으며, 유의성은 JR-SE 투여군을 제외한 양성대조군과 AS-E, EU-E, JAEG-E 투여군에서 나타났다 (p<0.05, p<0.01, p<0.001).
그리고 DPD 단백질 수준에서는 정상군에 비하여 대조군이 2 배 이상 증가하였고 (p<0.01), JR-SE와 JAEG-E 투여군은 대조군에 비하여 유의성 있게 감소하였으나 (p<0.05, p<0.01), 양성대조군과 AS-E, EU-E 투여군은 대조군에 비하여 감소하였으나 유의성은 없었다(Fig. 5).
6. 혈청내 17β-estradiol (E2)
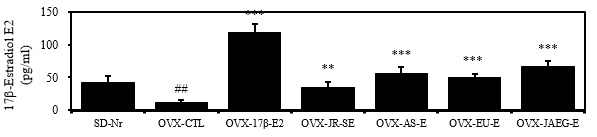
혈청내 17β-estradiol (E2) ELISA를 통해 측정한 결과, 혈청내 17β-estradiol (E2) 수준에서는 정상군에 비하여 대조군이 2 배 이상 감소하였고 (p<0.01), 양성대조군은 10 배 이상 현저히 증가하였다 (p<0.001). 그 외 모든 약물실험군은 대조군에 비하여 유의성 있게 증가하였다 (p<0.01, p<0.001)(Fig. 6).
7. Femur joint내 염증성 사이토카인 발현
동물실험 종료 후 염증 사이토카인인 IL-1β, IL-6, TNF-α mRNA 유전자 발현을 분석하였다. 그 결과 IL-1β mRNA 유전자 발현은 정상군에 비하여 대조군이 현저히 증가하였고 (p<0.01), JR-SE, EU-E와 JAEG-E 투여군은 대조군에 비하여 유의성 있게 감소하였다 (p<0.05). 양성대조군과 AS-E 투여군은 대조군에 비하여 감소하였으나 유의성은 나타나지 않았다.
IL-6와 TNF-α mRNA 유전자 발현은 정상군에 비하여 대조군이 현저히 증가하였고 (p<0.01), 약물실험군과 양성대조군은 대조군에 비하여 감소하였으나 유의성은 나타나지 않았다(Fig. 7).
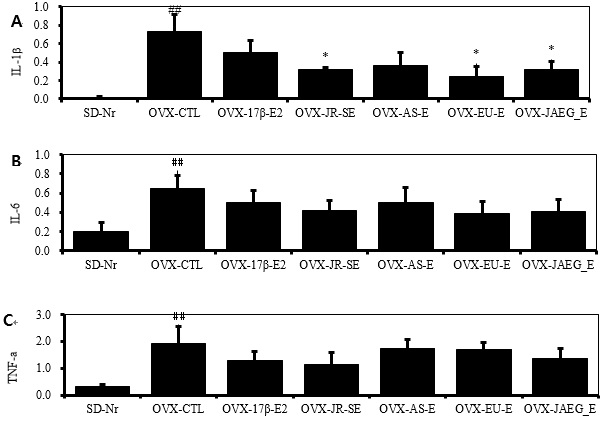
Clinical changes of IL-1β (A), IL-6 (B) and TNF-α (C) mRNA expression in Joint/Bone(real-time PCR) of OVX rats after 15 weeks treatment. # p<0.05, ## p<0.01 and ### p<0.001 compared with SD-Nr, *p<0.05, **p<0.01 and ***p<0.001 compared with OVX-CTL, Values are means ± SEM (n = 5), The statistical significance was revealed by ANOVA.
8. Femur joint내 염증성매개 유전자 발현
동물실험 종료 후 COX-2와 NOS-2 mRNA 유전자 발현을 분석하였다. 그 결과 COX-2 mRNA 유전자 발현은 정상군에 비하여 대조군이 현저히 증가하였고 (p<0.001), JR-SE, EU-E, 그리고 JAEG-E 투여군은 대조군에 비하여 유의성 있게 감소하였으며 (p<0.05, p<0.01), 양성대조군과 AS-E 투여군은 대조군에 비하여 감소하였으나 유의성은 나타나지 않았다.
염증매개인자인 NOS-2 mRNA 유전자 발현은 정상군에 비하여 대조군이 현저히 증가하였고 (p<0.001), JR-SE, EU-E, JAEG-E 투여군과 양성대조군은 대조군에 비하여 유의성 있게 감소하였으며 (p<0.05, p<0.01), AS-E 투여군은 대조군에 비하여 감소하였으나 유의성은 나타나지 않았다.
동물실험 종료 후 전이효소인 MMP-2 mRNA 유전자 발현을 관절조직에서 분석하였다. 그 결과 MMP-2 mRNA 유전자 발현은 정상군에 비하여 대조군이 현저히 증가하였고 (p<0.05), 양성대조군과 모든 약물실험군은 대조군에 비하여 감소하였으나 유의성은 나타나지 않았다.
또한 MMP-9 mRNA 유전자 발현은 정상군에 비하여 대조군이 현저히 증가하였고 (p<0.01), AS-E, JAEG-E 투여군 그리고 양성대조군은 대조군에 비하여 유의성 있게 감소하였으며 (p<0.05), JR-SE, EU-E 투여군은 대조군에 비하여 감소했으나 유의성은 나타나지 않았다(Fig. 8).
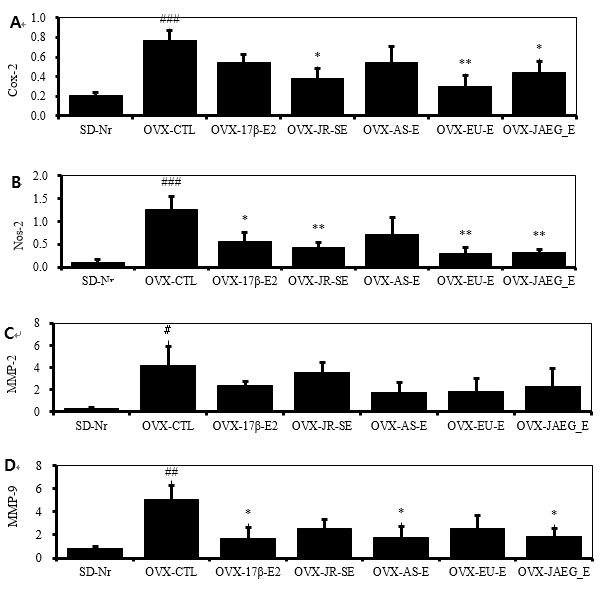
Clinical changes of COX-2 (A), NOS-2 (B), MMP-2 (C) and MMP-9 (D) mRNA expression in Joint/Bone(real-time PCR) of OVX rats after 15 weeks treatment. # p<0.05, ## p<0.01 and ### p<0.001 compared with SD-Nr, *p<0.05, **p<0.01 and ***p<0.001 compared with OVX-CTL, Values are means ± SEM (n = 5), The statistical significance was revealed by ANOVA.
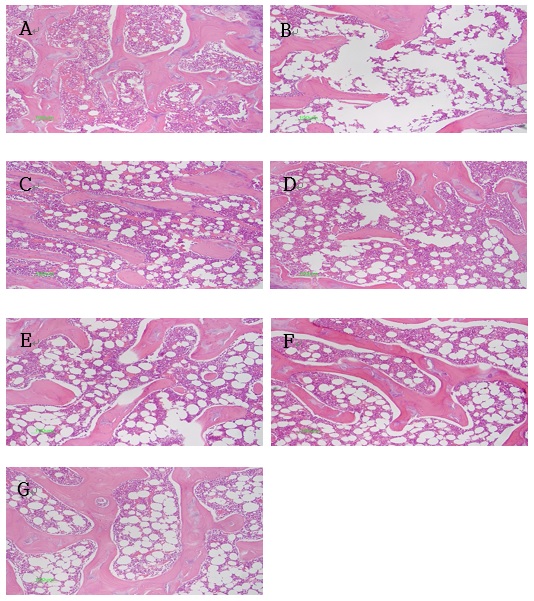
9. 조직학적 변화
골소주 면적은 정상군에 비하여 대조군 (OVX-CTL)이 현저하게 증가하였고, 골 내부에 pore가 많이 나타났으며 지주골이 감소하는 경향을 보였다. 모든 약물실험군과 양성대조군은 대조군에 비하여 골 내부에 pore가 감소한 것을 확인할 수 있었다(Fig. 9).
고 찰
골다공증은 골 항상성을 유지하려는 골재형성이 무너졌을 때 나타나는데, 골재형성은 골을 형성하는 조골세포와 골을 흡수하는 파골세포의 상호보완 작용으로 유지된다14).
최근 우리나라는 노령 인구비가 2008년에 10%, 2012년 11.7%, 2016년 13.5%로 증가하여, 2000년 이후 불과 17년만에 14.2%로 고령화 사회에서 고령 사회로 급격하게 진입하였다. 이러한 인구의 급격한 노령화는 골다공증 유병률을 증가시키고 골다공증에 대한 예방과 치료가 중요해졌다15,16).
골다공증 치료로 식이요법(칼슘, 비타민D 섭취), 근력 강화 운동, 금연, 금주가 보편적으로 권장되고 있으며 약리학적 치료제로는 비스포스포네이트, 칼시토닌, 이프리플라본, 랄록시펜 등의 비호르몬요법과 에스트로겐 제제 등의 호르몬요법이 표준 치료법으로 사용되고 있다14,17). 임상적으로 비스포스포네이트는 치주 질환 환자에서 턱뼈의 괴사와 같은 부작용이 발생할 수 있고 랄록시펜, 에스트로겐 치료제의 경우 혈전 색전증의 위험을 증가시킬 수 있으며 이외 식도, 위장관의 궤양 및 천공 등의 부작용이 보고되었다18,19). 이에 장기간 사용에도 부작용이 적은 한약재와 천연물에 대한 관심이 증가하고 있다.
한의학에서는 골질환은 腎과 밀접한 관계로 보고 腎이 뼈의 생장과 발육을 주관하는 장기로 인식되고 있다20). 동의보감에 근거하여 신허 요통을 치료하는 대표적인 처방으로 청아원을 사용하는데 이는 두충, 호두, 보골지, 생강으로 구성되어 있다9). 임상적으로 청아원가미방21) 혹은 청아원11,22)을 투여하여 골다공증에 대한 연구가 진행되어왔다. 이 중 보골지는 다량 복용시 간, 신장에 부담을 줄 수 있다는 보고에 따라 이를 감하고 한의학 전통문헌과 임상적으로 다용하는 오가피를 가미하여 두충, 호두, 오가피, 생강 복합추출물인 청아원가감 추출물을 사용하였다12).
두충은 性이 溫하고, 味는 甘微辛 하는데 肝腎을 보하고 筋骨을 강하게 하는 효능을 갖고 있다13). 실험연구상 두충 추출물이 골밀도 감소 혹은 미세 구조의 개선과 관련하여 골다공증을 예방한다고 하였고 파골세포의 분화 및 활성을 억제시킨다고 보고하였다23,24).
호도는 性이 溫하고, 味는 甘하며 腎을 보하고 精을 수렵하는 효능으로 임상적인 연구는 많이 없으나 호두 추출물이 조골세포를 활성화시켜 뼈 손실을 방지한다고 하였다13,25).
오가피는 性은 溫, 味는 辛苦하고 두충과 마찬가지로 補肝腎, 强筋骨 하는 효능을 가지며 임상연구상 오가피 추출물이 폐경기 후 여성에 있어서 혈청 osteocalcin 농도를 증가시키고 골다공증에 유효성 및 안전성을 입증하였으며, 난소적출로 인한 骨多孔症에서의 골손상을 억제하는 효과를 나타내었다고 하였다13,26).
생강은 性이 溫하고, 味는 辛하며 解表散寒, 溫中止嘔, 化痰止咳의 효능을 갖고 있는데 최근 연구에 따르면 생강은 골절염과 골다공증에서 골흡수를 억제하여 골밀도 감소를 예방한다고 보고하였고 생강의 생리 활성 성분인 6-gingerol이 ALP 활성과 골아세포 분화를 자극하여 골 형성 효과를 입증하였다13,27,28).
이에 본 연구에서는 두충, 호두, 오가피 단독추출물과 청아원가감 추출물(두충, 호두, 오가피, 생강 복합추출물)이 골다공증에 미치는 영향을 알아보고자 하였다. 난소 적출을 유발시킨 흰쥐에서의 골소실은 폐경기의 여성과 비슷한 양상을 나타난다고 하였기에 흰쥐의 난소적출로 골다공증을 인위적으로 유도하였고 세포실험 연구에서 파골세포 분화를 억제시키면서 세포독성이 없는 용량을 선정하여 그 결과 200 ㎍/㎖으로 동물실험을 진행하였다29).
난소적출 후 3 주간의 회복기 후에 약물을 12 주 간 경구 투여하여 각 군별 체중 검사, 혈청 검사, 혈청 내 골 대사지표 검사, 대퇴관절 내 유전자 발현 검사, 조직학적 검사를 통해 두충, 호두, 오가피 단독 추출물과 청아원가감 추출물이 흰쥐에 미친 영향을 비교 관찰하였다.
체중 증가량을 보면 약물실험군인 실험군과 정상군 간의 체중변화는 유의한 차이가 관찰되지 않았고 약물 투여가 OVX 흰쥐의 체중을 변화시키는데 영향을 미치지 않는 것으로 확인되었다.
폐경기 여성의 경우 노화나 체질량 지수 변화와 무관하게 혈중 중성지방과 총콜레스테롤의 농도가 증가하는 것으로 알려져 있다30). 본 연구에서 총콜레스테롤의 경우 정상군에 비해 유의미하게 증가하였으나, 중성지방은 감소하는 경향으로 위의 결과와는 상반되게 나타났다. 중성지방의 경우 OVX-AS-E 군에서 대조군(OVX-CTL)에 비하여 유의성 있게 감소하였고, 총콜레스테롤 함량은 양성대조군과 AS-E, JAEG-E 투여군이 대조군 (OVX-CTL)에 비하여 유의성 있게 감소하였다. 총콜레스테롤, 중성지방은 오가피 추출물 투여군에서 모두 유효한 결과를 보였기에 혈중 지질 대사와 관련하여 오가피의 비율 혹은 용량에 따른 청아원가감 추출물간의 비교연구는 추후 필요할 것으로 보인다.
간 독성에 미치는 영향을 알아보기 위해 혈중 AST, ALT 변화를 관찰하였다. AST, ALT 관련하여 모든 실험 투여군에서 간독성은 나타나지 않았고, 특히 JAEG-E 투여군에서 AST가 유의미하게 감소되어 추후 연구가 필요할 것으로 생각된다.
ALP는 간담도의 폐색 및 담즙 배설 장애 시 증가하는 효소로, 간 이외 뼈에도 많이 존재하여 골다공증뿐 아니라 골 대사 이상 질환을 진단하며 골 형성을 판단하는 지표로 알려져 있다31,32). ALP 측정결과 정상군에 비하여 대조군이 2 배 이상 감소하였고, 대조군에 비하여 양성대조군과 JR-SE, AS-E, EU-E 투여군은 증가하는 경향을 보였으며, JAEG-E 투여군은 대조군에 비하여 유의성 있게 중가하였다. 이는 청아원가감 추출물이 조골세포 활성에 영향을 미쳐 골 성장이 활발히 일어나고 있는 것으로 사료된다.
혈청내 칼슘농도 변화는 골흡수와 관련이 있는데, 폐경 후의 여성은 난소 기능 저하로 인한 에스트로겐의 감소로 칼슘을 뼈에 저장하지 못하여 혈중 칼슘농도가 상승하게 된다33). 본 연구에서도 칼슘농도가 정상군에 비하여 대조군이 2 배 이상 증가하여 혈액을 통한 칼슘의 배출을 예상할 수 있었고, 양성대조군을 제외한 모든 약물실험군에서 대조군에 비하여 유의성 있게 감소하였다. 이는 청아원가감 추출물이 칼슘을 뼈에 저장시켜 골조직 약화를 억제하는 효능이 있는 것으로 보인다.
폐경기 이후 가속화된 뼈 손실의 일차 매개체로서 염증성 사이토카인을 연관시키는데, 염증성 사이토카인은 골다공증이 있는 여성의 골수세포에서 상대적으로 증가하며 파골세포의 골 흡수와 관련되어 있다34,35). 혈청내 염증매개인자 수준을 관찰한 결과, TNF-α, IL-1β, LTB4 모두 정상군에 비하여 대조군이 유의미한 증가하였다. TNF-α의 경우 양성대조군을 포함한 모든 약물실험군은 대조군에 비하여 유의성 있게 감소하였다. 혈청내 염증사이토카인 IL-1β 수준에서 EU-E와 JAEG-E 투여군은 대조군에 비하여 유의미하게 감소하였고, 양성대조군과 JR-SE, AS-E 투여군은 대조군에 비하여 감소하였으나 유의성은 나타나지 않았다.
혈청내 염증매개인자인 LTB4는 Arachidonic acid 대사작용에 생산되는데, AS-E와 JAEG-E 투여군은 대조군에 비하여 유의성 있게 감소를 나타내었으나, 양성대조군과 JR-SE, EU-E 투여군은 대조군에 비하여 감소하였으나 유의성은 나타나지 않았다.
Osteocalcin은 골 특이 단백질로 조골세포의 활성으로 인해 분비되며 골아세포의 활성이 증가할수록 혈청 osteocalcin의 농도가 높아진다36,37). 혈청내 Osteocalcin 단백질수준을 보면 정상군에 비하여 대조군이 2 배 이상 증가하였고, JR-SE 투여군을 제외한 양성대조군 과 AS-E, EU-E, JAEG-E 투여군에서 유의미하게 감소하였다. DPD는 혈청내 골대사 염증매개인자인 Arachidonic acid 대사작용에서 생산되며 골 흡수 표지자로 사용된다38). 본 실험결과 정상군에 비하여 대조군이 2 배 이상 증가하였고, JR-SE와 JAEG-E 투여군은 대조군에 비하여 유의성 있게 감소하였다. 이러한 Osteocalcin과 DPD의 감소는 선행연구 결과를 참고했을 때 청아원가감 추출물이 골흡수와 골형성에 영향을 주는 것으로 보인다39).
본 실험에서는 난소를 적출시킨 흰쥐를 사용하여 에스트로겐 결핍성 골다공증을 유발시켰는데 이에 17β-estradiol (E2)을 투여하여 양성대조군으로 설정하고 약물실험군과 비교하였다. 혈청내 17β-estradiol (E2)을 측정한 결과, 정상군에 비하여 대조군이 2 배 이상 감소하였고, 양성대조군 은 10 배 이상 현저히 증가하였다. 그 외 모든 약물실험군은 대조군에 비하여 유의성 있게 증가하였는데 이는 청아원가감 추출물이 난소절제로 유도되는 에스트로겐 감소를 억제시킨다는 것으로 보인다.
동물실험이 끝난후 염증성 사이토카인인 IL-1β, IL-6, TNF-α mRNA 유전자 발현을 분석한 결과 IL-1β, IL-6와 TNF-α mRNA 유전자 발현은 정상군에 비하여 대조군이 현저히 증가하였다. IL-1β mRNA 유전자 발현은 JR-SE, EU-E와 JAEG-E 투여군에서 대조군에 비해 유의미하게 감소하였고, 양성대조군과 AS-E 투여군은 대조군에 비하여 감소하였으나 유의성은 나타나지 않았다. IL-6와 TNF-α mRNA 유전자 발현은 양성대조군을 포함한 모든 약물실험군에서 대조군에 비하여 감소하였으나 유의성은 나타나지 않았다.
COX-2, NOS-2 mRNA은 Arachidonic acid 대사작용에서 생산되는데, COX-2, NOS-2 mRNA 유전자 발현은 정상군에 비하여 대조군이 현저하게 증가하였다. COX-2 mRNA 유전자 발현에서 JR-SE, EU-E, JAEG-E 투여군은 대조군에 비하여 유의성 있게 감소하였고, 양성대조군과 AS-E 투여군도 대조군에 비하여 감소하였으나 유의성은 나타나지 않았다. 염증매개인자인 NOS-2 mRNA 유전자 발현은 AS-E 투여군을 제외한 모든 약물실험군과 양성대조군에서 대조군에 비하여 유의하게 감소하였다.
전이효소인 MMP-2, MMP-9은 주로 골아세포와 파골세포에서 발현되는데 뼈의 구조 및 생체 역학적 특성에 차별적으로 영향을 미친다40). MMP-2, MMP-9 mRNA 유전자 발현을 관절조직에서 분석한 결과, 정상군에 비하여 대조군이 현저히 증가하였다. MMP-2 mRNA 유전자 발현은 약물실험군인 양성대조군, 모든 약물실험군은 대조군에 비하여 감소하였으나 유의성은 없었다. 또한 MMP-9 mRNA 유전자 발현은 AS-E, JAEG-E 투여군과 양성대조군에서 대조군에 비하여 유의미하게 감소하였고, JR-SE, EU-E 투여군에서는 유의성이 없었다.
대퇴골에서 H&E염색을 통한 조직학적 검사상, 대조군에 비해 모든 약물실험군에서 골소주 면적 및 골 내부 pore이 감소하는 것을 관찰 할 수 있었는데 이는 청아원가감 추출물이 골 손실 발생을 억제시키는 효과가 있음을 의미한다. 하지만 골밀도, 골량, 골소주 면적과 관련하여 정확한 수치화를 통해 비교하지 못하였기에 추후 지속적인 연구가 필요할 것으로 사료된다.
이상의 결과를 종합해보면, 난소 절제술을 시행한 흰쥐에서 3 주의 회복기 후 12 주간 두충, 호두, 오가피 추출물 및 청아원가감 추출물을 경구 투여한 결과 간독성을 보이지 않았으며 골다공증 관련 염증인자를 억제하는데 유효성이 있는 것으로 나타났다.
이전 청아원 관련 임상연구에서 골밀도 수치에서는 유의한 결과를 보였으나 골대사 지표와 관련하여서는 유의성을 보이지 않았다. 이에 반해 청아원가감 추출물은 두충, 호두, 오가피 추출물과 비교하여 골형성 지표, 골흡수 지표, 염증매개인자와 관련해 유효한 결과를 나타내어 좀 더 적극적으로 골다공증 치료 및 예방에 활용될 수 있을 것으로 사료된다. 향후 지속적인 실험 연구와 임상 시험을 통한 안전성과 유효성 입증을 위한 연구를 추가적으로 진행되어야 할 것으로 보이며, 청아원가감 추출물의 구성성분인 두충, 호두, 오가피 비율 조합에 따른 골밀도에 관한 효능 비교, 기존 골다공증 치료제와의 비교 연구가 필요할 것으로 사료된다.
결 론
난소적출을 통한 흰쥐의 골다공증 모델에 두충, 호두, 오가피 추출물 및 청아원가감 추출물이 골다공증에 미치는 영향을 알아보기 위해 체중 검사, 혈청 검사, 혈청내 골 대사지표 검사, 대퇴관절 내 유전자 발현 검사를 관찰한 결과 다음과 같은 결론을 얻었다.
청아원가감 추출물에서 간독성은 나타나지 않았다.
청아원가감 추출물에서 골형성 관련지표인 ALP는 유의성 있게 증가하였고, Osteocalcin과 DPD는 유의성 있게 감소하였다.
청아원가감 추출물에서 혈청내 칼슘농도는 유의성 있게 감소하였다.
청아원가감 추출물에서 혈청내 염증매개인자 수준 TNF-α, IL-1β, LTB4는 유의성 있게 감소하였다.
청아원가감 추출물에서 혈청내 17β-estradiol (E2)은 유의성 있게 증가하였다.
청아원가감 추출물에서 염증 사이토카인 IL-1β mRNA 유전자 발현은 유의성 있게 감소하였고, IL-6, TNF-α mRNA 유전자 발현은 감소하는 경향을 보였다.
청아원가감 추출물에서 염증성매개 COX-2, NOS-2 mRNA 유전자 발현은 유의성 있게 감소하였다.
청아원가감 추출물에서 MMP-9 mRNA 유전자 발현은 유의성 있게 감소하였다.
청아원가감 추출물에서 조직학적으로 골소주 면적 및 골 내부 pore 의 감소를 보였다.
Acknowledgments
2019학년도 대전대학교 교내학술연구비 지원에 의해 연구되었음.
References
- Korean society for bone and mineral research. Osteoporosis 3 edition. Seoul : Hanmi publishing; 2006. 11-7, 205-15.
-
Yoo JH, Moon SH, Ha YC, Lee DY, Gong HS, Park SY, et al. Osteoporotic fracture: 2015 position statement of the Korean society for bone and mineral research. J bone Metab. 2015;22(4):175-81.
[https://doi.org/10.11005/jbm.2015.22.4.175]

-
Lee SR, Kim SR, Chung KH, Ko DO, Cho SH, Ha YC, et al. Mortality and activity after hip fracture: a prospective study. J Korean Orthop Assoc. 2005;40(4):423-7.
[https://doi.org/10.4055/jkoa.2005.40.4.423]

-
Kim YS. Strategies for prevention of elderly hip fracture. J Korean Med Assoc. 2016;59(8):631-6.
[https://doi.org/10.5124/jkma.2016.59.8.631]

- Kim JH. Reviews of recent research on the osteoporosis - is mainly dependent on the oriental medicine clinical and experimental study. J Korean Acupunct Moxibustion Soc. 1998;15(2):437-54.
- The Korean orthopaedic association. Orthopaedic. Seoul : Choesin publishing ; 1999.
- Seo MS, Kim HC, Choo WJ, Jeong SY, Kim SJ, Choi JU, et al. The Review on the Study of Osteoporosis in Korean Medicine Journals. J Korea CHUNA Man Med Spine Nerves. 2013;8(2):67-78.
- Kim MB, Kim SS, Chung SH. A Literature Review of Herbal Medicines on Osteoporosis Studies-Reviewing Articles Published after Year 2000. J Korean Med Rehabil. 2010;20(1):91-107.
- J Huh. Dogneui Bogam. Seoul : Dongeuibogam publishing; 2005.
- Kim SH, Jeong JC. Peroxynitrite Scavenging Activity and its Mechanism of Cheonga-hwan. J Korean Med. 2002;23(4).
-
Yun GW, Kang JH, Lee H. Effects of Korean herbal medicine (Cheong-A-Won) for treatment of bone mineral density in women with osteoporosis: A randomized, double blind, placebo controlled trial. Eur J Integr Med. 2018;20:84-9.
[https://doi.org/10.1016/j.eujim.2018.04.009]

-
Xu Y, Zhao Y, Xie J, Sheng X, Li Y, Zhang Y. The Evaluation of Toxicity Induced by Psoraleae Fructus in Rats Using Untargeted Metabonomic Method Based on UPLC-Q-TOF/MS. Evidence-Based Complement Altern Med. 2017;2017.
[https://doi.org/10.1155/2017/6207183]

- HB Pyeonchanwiwonhoe. Bonchohak. Seoul : Yeongrimsa. 2004;325-6, 603-4, 616-7.
-
Chung HY. Osteoporosis diagnosis and treatment 2007. Endocrinol Metab. 2008;23(2):76-108.
[https://doi.org/10.3803/jkes.2008.23.2.76]

-
Yang KH. Ageing society and osteoporosis. J Korean Med Assoc. 2016;59(11):833-5.
[https://doi.org/10.5124/jkma.2016.59.11.833]

- Park SH, Lee K. Prediction for the spatial distribution of medical facilities complying with the changes in the population structure in Korea. J Geol Soc Korea. 2018;53(53):371-85.
-
Cosman F, de Beur SJ, LeBoff MS, Lewiecki EM, Tanner B, Randall S, et al. Clinician’s guide to prevention and treatment of osteoporosis. Osteoporos Int. 2014;25(10):2359-81.
[https://doi.org/10.1007/s00198-014-2794-2]

-
Abrahamsen B. Bisphosphonate adverse effects, lessons from large databases. Curr Opin Rheumatol. 2010;22(4):404-9.
[https://doi.org/10.1097/BOR.0b013e32833ad677]

-
MacLean C, Newberry S, Maglione M, McMahon M, Ranganath V, Suttorp M, et al. Systematic review: comparative effectiveness of treatments to prevent fractures in men and women with low bone density or osteoporosis. Ann Intern Med. 2008;148(3):197-213.
[https://doi.org/10.7326/0003-4819-148-3-200802050-00198]

- Do HK. Donguisingyehak, Seoul. 1991;1144-51.
- Kim MS, Seo BI, Kwak MA, Ji SY. Effect of Chungajihwangtang on osteoporosis in ovariectomized rats. Korea J Herbol. 2003;18(2):49.
- Kang JH, Choi JY, Yoon KS, Lee H. The analysis of 278 cases who were medicated with Cheonga-won. J Korean Acupunct Mox Med Sci. 2011;28(1):93-100.
-
Zhang R, Liu ZG, Li C, Hu SJ, Liu L, Wang JP, et al. Du-Zhong (Eucommia ulmoides Oliv.) cortex extract prevent OVX-induced osteoporosis in rats. Bone. 2009;45(3):553-9.
[https://doi.org/10.1016/j.bone.2008.08.127]

- Jung YT, Choi YH, Song JH, Lee CH, Lee MS, Jang SJ, et al. Effect of water extract of Eucommiae cortex in RANKL-induced osteoclast differentiation. J Physiol Pathol Korean Med. 2009;23(3):613-8.
-
Papoutsi Z, Kassi E, Chinou I, Halabalaki M, Skaltsounis LA, Moutsatsou P. Walnut extract (Juglans regia L.) and its component ellagic acid exhibit anti-inflammatory activity in human aorta endothelial cells and osteoblastic activity in the cell line KS483. Br J Nutr. 2008;99(4):715-22.
[https://doi.org/10.1017/S0007114507837421]

-
Hwang YC, Jeong IK, Ahn KJ, Chung HY. The effects of Acanthopanax senticosus extract on bone turnover and bone mineral density in Korean postmenopausal women. J Bone Miner Metab. 2009;27(5):584-90.
[https://doi.org/10.1007/s00774-009-0093-3]

- Funk JL, Frye JB, Wright LE, Timmermann BN. Effects of Ginger (Zingiber officialis L) on Inflammation-Induced Bone Loss. Federation of American Societies for Experimental Biology; 2012.
-
Fan JZ, Yang X, Bi ZG. The effects of 6-gingerol on proliferation, differentiation, and maturation of osteoblast-like MG-63 cells. Brazilian J Med Biol Res. 2015;48(7):637-43.
[https://doi.org/10.1590/1414-431x20154494]

-
Kalu DN, Arjmandi BH, Liu CC, Salih MA, Birnbaum RS. Effects of ovariectomy and estrogen on the serum levels of insulin-like growth factor-I and insulin-like growth factor binding protein-3. Bone Miner. 1994;25(2):135-48.
[https://doi.org/10.1016/S0169-6009(08)80255-3]

-
Stevenson JC, Crook D, Godsland IF. Influence of age and menopause on serum lipids and lipoproteins in healthy women. Atherosclerosis. 1993;98(1):83-90.
[https://doi.org/10.1016/0021-9150(93)90225-J]

-
Datta HK, Ng WF, Walker JA, Tuck SP, Varanasi SS. The cell biology of bone metabolism. J Clin Pathol. 2008;61(5):577-87.
[https://doi.org/10.1136/jcp.2007.048868]

-
Naylor K, Eastell R. Bone turnover markers: use in osteoporosis. Nat Rev Rheumatol. 2012;8(7):379.
[https://doi.org/10.1038/nrrheum.2012.86]

-
Yeh JK, Aloia JF, Barilla M-L. Effects of 17β-estradiol replacement and treadmill exercise on vertebral and femoral bones of the ovariectomized rat. Bone Miner. 1994;24(3):223-34.
[https://doi.org/10.1016/S0169-6009(08)80139-0]

-
Mundy GR. Osteoporosis and inflammation. Nutr Rev. 2007;65(suppl_3):S147-51.
[https://doi.org/10.1111/j.1753-4887.2007.tb00353.x]

-
Pino AM, Ríos S, Astudillo P, Fernández M, Figueroa P, Seitz G, et al. Concentration of adipogenic and proinflammatory cytokines in the bone marrow supernatant fluid of osteoporotic women. J Bone Miner Res. 2010;25(3):492-8.
[https://doi.org/10.1359/jbmr.090802]

-
Hammett-Stabler CA. The use of biochemical markers in osteoporosis. Clin Lab Med. 2004;24(1):175-97.
[https://doi.org/10.1016/j.cll.2004.01.013]

-
Notelovitz M. Osteoporosis: screening, prevention, and management. Fertil Steril. 1993;59(4):707-25.
[https://doi.org/10.1016/S0015-0282(16)55848-8]

- Kim W. Recent research of biochemical bone markers measurement in osteoporosis and clinical utility. Graduate School of Seoul National University; 2015.
- Choi SH, Lee SY, Kim YJ. The pattern of urinary deoxypyridinoline and serum osteocalcin across menopausal transition in women. J Korean Acad Fam Med. 2000;21(12):1552-9.
-
Nyman JS, Lynch CC, Perrien DS, Thiolloy S, O’Quinn EC, Patil CA, et al. Differential effects between the loss of MMP‐2 and MMP‐9 on structural and tissue‐level properties of bone. J Bone Miner Res. 2011;26(6):1252-60.
[https://doi.org/10.1002/jbmr.326]