한의학과 현대의학에서의 폐신관계
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
In Korean medicine, the lungs and kidneys are viewed as interconnected organs essential for fluid metabolism and respiratory function. The lungs are described as the "upper source of water," dispersing body fluids and qi (vital energy) throughout the body, while the kidneys anchor and store qi. Both traditional and modern medicine recognize that dysfunction in one organ can lead to impairment in the other, with numerous cases illustrating concurrent decline in kidney function in pulmonary diseases and vice versa.This review examines and contrasts lung-kidney interactions as conceptualized in Korean and modern medicine, focusing on their roles in respiration, fluid balance, and immune response. We analyze the physiological basis of lung and kidney interdependence, utilizing traditional theories from Korean medicine alongside findings from modern clinical research. In Korean medicine, the lung-kidney relationship is characterized by a mutual dependence that supports homeostasis in both respiration and fluid regulation. Pathological observations, such as those in chronic obstructive pulmonary disease (COPD) and chronic kidney disease (CKD), confirm the modern understanding that these organs share roles in acid-base balance, blood pressure control, and fluid metabolism. Autoimmune diseases, such as systemic lupus erythematosus (SLE) and ANCA-associated vasculitis, also commonly impact both organs, demonstrating immune system-mediated injury in both the lungs and kidneys. Our findings underscore the importance of a combined therapeutic approach that considers both lung and kidney function in treating diseases affecting either organ. Korean medicine’s integrated perspective on lung and kidney interaction aligns with modern medical research, which supports the need for cross-disciplinary treatment strategies. Future research should explore the mechanisms of lung-kidney interaction further to enhance understanding of disease progression and treatment efficacy. This study highlights the physiological and pathological interactions between the lungs and kidneys, presenting an integrated framework that bridges traditional Korean medicine and contemporary clinical insights. Understanding these interdependencies will help develop comprehensive treatment strategies for patients experiencing simultaneous lung and kidney dysfunction.
Keywords:
Korean Medicine, Lung-Kidney, Upper source of water, Receiving qi서 론
폐와 신장은 인체의 생리 기능을 유지하는데 없어서는 안될 핵심 장기이다. 신장은 체액과 노폐물 배출을 담당하고, 폐는 호흡을 통해 산소를 전신에 공급하며, 세포내 호흡의 결과 생성되는 이산화탄소를 체외로 배출하는 역할을 한다. 두 장기는 고유한 기능을 수행하지만, 한의학과 현대의학 모두에서 이들의 긴밀한 상호작용이 강조되고 있다.
만성폐질환과 신부전과 같은 호흡기계와 신장병변은 종종 동반하여 나타난다. 만성폐쇄성폐질환(COPD)환자에게서 신부전의 발병률이 높고, 신부전 환자에게서 폐기능 저하가 빈번하게 관찰된다1-3). 따라서 두 기관의 상호작용을 종합적으로 이해하고 이를 기반으로 한 통합적인 치료전략의 개발이 요구되는 상황이다.
본 연구에서는 폐와 신장의 기능적 작용이 단순히 산-염기 균형을 조절하는 데 그치지 않고, 체내 다양한 대사 경로에 밀접하게 연관되어 있음을 고찰하였다. 본 연구는 한의학에서 바라보는 肺와 腎의 이론과 현대의학에서 밝혀진 폐와 신장의 기능적 관계를 연계하여, 두 이론 간의 융합적 관점에서 체내 대사기전을 설명할 수 있는 이론적 틀을 탐색함으로써, 폐와 신장 기능장애를 동시에 겪는 환자들에 대한 치료 접근법을 제시하고 두 기관의 상호작용에 대한 기초 연구의 확장을 위한 중요한 토대를 마련하고자 한다.
본 론
1. 한의학에서 腎과 肺의 상호관계
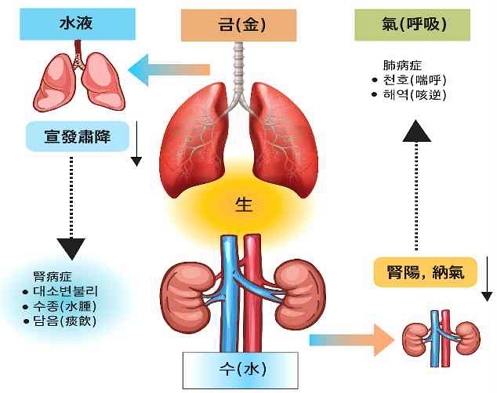
肺와 腎은 五行의 生克순환의 측면에서 母子(金生水)의 관계이므로 상호간 질환이 파급될 가능성이 높다. 또한 위치와 기능의 측면에서, 肺는 장부에서 가장 높이 위치하여 五臟六腑를 덮고 있는 華蓋之臟으로 宣發肅降, 通調水道의 기능을 하고, 腎은 오장 중에서 가장 낮은 위치한 뿌리(根)에 해당하여 納氣, 主水, 藏精의 기능을 한다4). 그러므로, 肺와 腎은 인체 氣機의 승강출입 측면에서, 그리고 呼吸 및 水液대사에서 상호 밀접한 관계를 가진다.
肺는 水의 上源이므로 水源이 충분해야만 腎陰이 끊임없이 滋養을 받고, 腎陰이 충족해야만 위로 肺를 도와서 肺陰 역시 충분해진다. 外感, 內傷 혹은 오래된 咳嗽로 인해 肺陰虛가 발생하여 腎으로 파급되거나, 陰虛의 기본인 腎陰虛가 선행하여 肺를 滋養하지 못할 경우 肺腎陰虛의 相兼證이 발생한다. 肺가 宣發肅降을 잘 하지 못하여 咳嗽氣促이 오래된 상태에서 形體消瘦, 骨蒸潮熱, 顴紅盜汗 등의 虛熱상과 腎虛의 증상(腰膝酸軟 등)이 동반되는 경우가 많다5).
인체의 호흡은 기본적으로 肺의 宣發肅降에 의해 이루어지지만, 肺에서 흡입된 淸氣는 腎의 納氣작용을 통해 인체 심부로 전해진다6). 勞倦으로 腎氣를 손상하거나 肺氣가 장기간 虛衰하여 腎氣가 부족해지면 氣가 歸元하지 못하므로 氣短喘息, 呼多吸少, 動則喘甚의 증상이 나타나며 腎虛의 증상(腰膝酸軟)과 氣虛 혹은 심하면 陽虛의 증상이 동반되어 肺腎氣虛의 相兼證을 형성한다7).
肺와 腎의 상호 관계 혹은 협조를 처방명에서 명시한 상용 처방으로는 『方藥合編』의 金水六君煎(上統51)과 淸上補下丸(上統52)을 들 수 있다. 金水六君煎에서 金水는 肺腎을 가리키며, 이 처방은 二陳湯에 熟地黃, 當歸를 君臣藥으로 가미하여 痰濕으로 運化障礙하여 生血不充으로 인해 야기되는 肝腎陰虛하며 痰盛한 만성적인 가래형 기침이나 가래를 호소하는 환자를 치료한다. 淸上補下丸에서 淸上은 淸肅肺氣를, 補下는 補腎納氣를 가리키며, 이 처방은 六味地黃丸 半劑에 潤肺止咳하는 麥門冬, 天門冬, 五味子와 祛痰止咳하는 半夏, 貝母, 瓜蔞仁 등을 가미하여 淸金과 동시에 陰精을 肺로 上昇시켜 만성적인 기침을 호소하는 환자를 치료한다8,9). 肺와 腎의 상생 관계와 상하 협조 관계를 그 치법 및 처방명에서 나타낸 사례라고 할 수 있다.
형상의학에서 肺와 腎은 上下 雙으로 이루어져 있어 腎은 肺의 뿌리가 되고, 肺는 腎의 잎사귀가 되며, 脊椎는 肺와 腎을 연결시켜주는 줄기에 해당하여 精氣의 升降이 이루어지는 장소가 되므로, 肺와 腎 및 척추질환은 서로 밀접한 상관관계를 맺고 있다10)는 설명도 동일한 맥락으로 이해할 수 있다.
肺의 宣發肅降과 通調水道는 腎陽의 추동력에 의지하고, 腎의 主水液은 肺의 기능에 의지하여 인체의 水液대사를 조절하고 관리하는 기능을 맡아서 津液의 생성, 수포, 배설 및 배뇨 관계의 전반에 관여한다. 肺가 제 기능을 하지 못하면 腎에 영향을 미쳐서 小便短少, 水腫 등이 나타나고, 腎陽이 부족하여 津液을 蒸騰하여 氣化시키는 기능이 저하되면 咳嗽, 喘息 등의 증상이 나타난다. 『素問』「水熱穴論」에서 腎이 主水하는 것은 그 本은 腎에 있고, 그 末은 肺에 있다고 한 것 (“腎何以主水?⋯其本在腎, 其末在肺⋯”) 과 같다11).
2. 현대의학에서 폐와 신장의 생리적 상호 관계
현대의학에서 폐와 신장 두 장기는 기능이 분명히 다르지만, 생리병리적으로 밀접한 연관이 있다. 생리적으로 두 장기는 산-염기 조절, 혈압과 체액의 항상성 유지 등에서 서로 밀접한 관계에 있다12).
호흡에서 폐는 산소와 이산화탄소의 교환을 담당하는 핵심 기관이며, 신장은 산-염기 균형을 유지하고, 대사 부산물의 배출을 통해 호흡대사를 지원한다. 폐는 호흡계의 핵심기관으로, 산소(O2)를 공급하고 이산화탄소(CO2) 배출하는 기능을 수행한다. 공기에서 들이마신 산소는 폐포를 거쳐 모세혈관으로 확산되며, 적혈구 내 헤모글로빈에 결합하여 전신으로 운반되는 반면, 체내 세포 대사과정의 부산물로 생성된 이산화탄소는 폐포를 통해 외부로 배출된다13). 폐는 이산화탄소의 배출을 통해 산-염기 균형을 유지하는 데 중요한 역할을 한다. 이산화탄소는 체내에서 물과 반응하여 탄산(H2CO3)을 형성하고, 이는 다시 수소이온(H+)과 중탄산이온(HCO3-)으로 해리된다. 폐에서 이산화탄소가 적절히 제거되지 않으면, 혈액 내 pH가 낮아져 호흡성 산증이 발생할 수 있다14). 반대로 과도한 이산화탄소 배출로 인한 호흡성 알칼리증도 발생할 수 있다. 폐는 호흡을 통해 혈액의 pH를 신속하게 조절하고 있다. 신장은 호흡에 있어서 폐가 빠르게 조절하지 못하는 부분을 보완하는 역할을 한다. 신장은 혈액 내 과도한 수소이온(H+)을 소변으로 배출하여 혈액의 산성화를 방지할 뿐만 아니라, 근위세뇨관에서 중탄산이온(HCO3-)을 재흡수함으로써 혈액의 pH균형을 유지한다15,16). 이러한 신장의 역할을 폐에서 즉각적으로 이루어지는 이산화탄소의 배출과는 달리 더 장기적인 pH조절에 기여한다.
동시에 혈액 내 산소 포화도가 낮아지면 폐에서 산소교환을 증가시키기 위해 호흡이 촉진된다. 또한 조직 내 산소가 부족한 상환에서는 신장의 사이질 섬유아세포에서는 빠르게 에리트로포이에틴(EOP)을 분비하여 골수에서의 적혈구 생성을 촉진함으로써, 혈액 내 산소 수송능력을 향상시킨다17). 이처럼 폐와 신장은 효율적인 조직 내 산소 공급을 위한 기능을 함께 수행하고 있다.
호흡을 통해 폐는 소량의 수분을 증발시킨다. 폐호흡을 통해 증발되는 수분의 양은 습기가 많은 환경에서는 200 ml에서 심한 운동을 했을 경우 1500ml 까지 이를 수 있다18). 폐를 통한 수분 소실은 체액 대사에 있어 상대적으로 작은 부분을 차지하지만, 과도한 호흡으로 인한 수분 손실은 탈수와 전해질 불균형을 초래할 수 있으며, 이는 전신적인 수액대사에 영향을 미친다19). 신장은 수액대사의 중심 역할을 하며, 체내 수분과 전해질의 균형을 유지한다. 신장은 네프론을 통해 혈액을 여과하고, 필요한 수분 및 전해질을 재흡수하며, 불필요한 노폐물과 과잉 수분을 소변으로 배출한다. 이러한 과정을 통해 신장은 체액의 전해질 농도와 체액량을 조절한다20). 특히, 나트륨(Na⁺), 칼륨(K⁺), 칼슘(Ca²⁺) 등의 전해질 균형을 유지하는 것은 체액 대사에서 중요한 요소이다. 신장 기능이 손상된 환자는 수분 및 전해질 배출 능력이 감소하므로, 과도한 수분 섭취나 불균형한 전해질 투여는 체액 대사에 심각한 문제를 초래할 수 있다.
폐와 신장 두 장기는 혈압 및 체액의 균형 조절에 상호 작용을 한다. 체액량과 혈압이 감소하면 renin-angiotensin-aldosterone system (RAAS)이 활성화된다. 체액 및 혈압의 감소로 인해 사구체 여과율(GFR)이 떨어질 경우 신장은 renin을 합성하고 분비한다. 이 renin은 angiotensinogen을 angiotensin I으로 전환시킨다. 폐의 모세혈관에서는 angiotensin converting enzyme (ACE)를 분비하며, 이 곳에서 분비된 ACE는 renin에 의해 생성된 angioteinsin I을 angiotensin II로 전환시킨다. 이렇게 형성된 angiotensin II는 강력한 혈관 수추인자인과 동시에 부신 피질에서 aldosterone의 분비를 촉진시킴으로써 신장에서 나트륨과 수분의 재흡수를 촉진하여 혈압과 체액량을 높인다21,22). 이와 같이 폐와 신장은 RAAS 시스템을 통해 혈압과 수액대사 조절에서 중요한 역할을 하며, 체내의 항상성을 유지한다.
폐질환이 있을 경우 신장 기능이 저하되는 현상은 많은 임상 현장에서 관찰된다. 특히 중증호흡기 질환에서 신장기능 저하가 두드러지게 나타나며, 이는 생리 병리적 연관성에 의해 설명될 수 있다.
COVID-19 팬데믹 동안, 급성 호흡부전으로 인한 신장 기능의 손상이 많은 환자들에게서 관찰되었다. 급성 신장 손상(Acute kidney injury, AKI)은 심각한 급성 호흡기 질환, 특히 중증 급성 호흡기 질환(severe acute respiratory illness ‘SARI) 환자에게서 발생률이 높다. AKI는 남성, 고령, 비만, 흡연, 허혈성 심질환, 당뇨병, 고혈압과 같은 위험 인자와 밀접하게 관련되어 있으며23-25), 이러한 위험인자가 있는 환자들은 호흡기 질환이 발생했을 때 신장 기능이 더 쉽게 악화될 수 있다.
만성폐쇄성 폐질환(COPD) 환자에게서도 신장 기능 저하의 빈도가 증가한다는 여러 임상 연구가 보고되었다26-28). COPD 환자는 신장으로 공급되는 혈액이 감소하여 RAAS가 활성화됨과 아울러 항이뇨호르몬(antidiuretic hormone), 심방나트륨이뇨펩티드(atrial natriuretic peptide), 엔도셀린-1(endothelin-1)의 수치가 높아져 염과 물이 저류됨으로 인하여, 폐 고혈압이 발생할 수 있다15). COPD 환자에서 발생하는 폐고혈압과 신장 혈류 감소는 RAAS를 자극함으로써 폐와 신장에서 산소 공급과 혈류 역동성에 부정적인 영향을 미치며, 결과적으로 전신적 혈관 저항 증가와 함께 신장 기능 저하를 초래할 수 있다29).
COPD는 전신염증, 저산소증, 그리고 혈관 내피세포의 기능부전과 관련되어 있으며, 이러한 병리적 요인들이 신장기능의 감소를 유발하는 것으로 보고되었다30). 특히 폐기종을 동반한 COPD환자의 경우, 당뇨, 고혈압과 같은 위험요소가 없음에도 신장 기능 저하를 경험할 확률이 높다고 보고되었다31). 또한, 국내 50세 이상 412명의 남성을 대상으로 실시된 임상연구에서는, 예측 강제폐활량(FEV1)이 낮을수록 만성신장질환(Chronic kidney disease, CKD)의 유병률이 증가하는 경향이 있음을 확인하였다32). 이는 폐 기능 보호가 CKD의 예방에 중요한 역할을 할 수 있음을 시사한다.
더 나아가, 중환자실에 입원한 중증 폐질환 환자들에게서도 신장 기능이상이 빈번하게 나타난다는 보고가 있다. 심각한 저산소증 상태 (PaO2<40mmHg)에서는 신장으로 들어가는 혈류가 감소하여 신기능 부전이 발생할 수 있으며33), 저산소증에 가장 민감한 신장 세뇨관이 손상됨에 따라 급성신손상(Acute Kidney Injury, AKI)이 초래될 수 있다34,35). 이 또한 폐 기능 손상이 신장에 미치는 직접적 영향을 보여주는 임상적 사례로 볼 수 있다.
이처럼 폐질환은 다양한 경로를 통해 신장 기능에 부정적인 영향을 미칠 수 있다. 급성 및 만성 폐질환 모두 신장 기능 저하를 유발할 수 있으며, 중증 호흡기 질환이나 만성 질환의 경우 이러한 연관성이 더욱 두드러진다. 따라서, 신장 기능 악화를 예방하기 위해 폐 질환의 적절한 관리와 예방이 중요하다. 폐와 신장 간의 상호작용에 대한 심도 있는 이해는 환자 관리의 질을 높이고, 효과적인 치료 전략 수립에 기여할 수 있을 것이다.
신장질환이 있을 경우 신장의 기능저하는 폐 기능에 부정적인 영향을 미칠 수 있다. 특히 급성신장손상(AKI)과 만성신장질환(CKD)는 각각의 병리기전을 통해 폐손상을 유발할 수 있다.
AKI는 폐손상을 유발할 수 있으며, 이로 인해 발생하는 급성호흡곤란증후군(ARDS)을 “요독성 폐(uremic lung)”라고 불리기도 한다36). AKI가 발생하면, 상피의 Na-K 채널과 acuaporin5의 발현을 낮춤으로써 폐포에서 체액의 이동을 어렵게 하고, 폐의 혈관투과성을 증가시킴으로써 염증반응과 산화적 스트레스를 가속화시킨다37). 한 연구에서는 허혈성 AKI가 발생한 지 2시간 이내에 폐의 혈관내피세포를 따라 호중구가 침윤된다고 보고하였다38). 이는 신장손상이 빠르게 폐 염증으로 이어질 수 있음을 시사한다. 또한, AKI로 인해 발생하는 염증반응은 다양한 매개체에 의해 조절되며, TNF39), TNFR140), adhesion molecule(ICAM-1)41), chemokine(IL-8, MIP-2)42,43) 등의 사이토카인과 케모카인은 폐 손상의 중요 원인으로 작용한다. Klein 등의 연구에 따르면, IL-6는 AKI로 인한 폐손상의 직접 매개인자로 작용할 수 있다44). 이 외에도 AKI는 체액 과부하와 전해질 불균형을 초래하여 폐부종과 호흡곤란을 유발할 수 있다45,46). 이러한 호흡기 합병증은 AKI환자의 높은 사망률과 밀접하게 관련되어 있으며, 따라서 호흡기계 합병증을 예방하는 것이 AKI 환자의 생존율을 높이는 데 중요한 전략이 될 수 있다.
CKD 또한 폐 기능에 다양한 방식으로 영향을 미칠 수 있다. CKD로 인해 체액의 항상성, 산-염기 균형, 혈관 긴장도가 변화하게 되면, 이러한 변화는 폐 기능 저하로 이어질 수 있다29). CKD로 인한 체액 저류는 폐 울혈과, 폐부종을 유발하여 호흡곤란을 초래할 수 있다. 또한 CKD와 관련된 대사성 산증은 보상기전으로 과호흡을 유도하며, 이로 인해 호흡기 근육의 피로와 환기 효율의 저하가 발생할 수 있다. CKD에서는 RAAS와 교감신경계의 활성화로 인해 혈관수축, 나트륨 저류, 체액의 과부하가 일어나며, 이는 폐 기능에 부정적인 영향을 미친다47). 또한 CKD환자는 면역반응이 저하되어 있어 폐렴과 같은 감염에 더 취약해진다. 이로 인해 환자는 폐질환의 발생 위험이 증가하며, 신장질환 환자의 전반적인 예후를 악화시킬 수 있다48).
이와 같이 신장질환은 폐 기능 이상을 유발할 수 있으며, 이러한 상호작용은 환자의 전반적인 건강 상태를 복합적으로 악화시킬 수 있다. 따라서 신장질환 환자에게서 폐 기능을 보호하고 유지하는 것은 매우 중요한 임상적 과제이다.
자가면역질환은 인체 면역체계가 외부 병원체 대신 정상적인 자기 조직을 공격하는 질환이다. 이 결과 다양한 장기나 조직에 염증반응과 기능부전을 유발한다. 폐와 신장 두 기관이 밀접하게 상호작용하고 있음은 폐와 신장을 동시에 침범하는 자가면역질환들이 상당 수 존재한다는 사실에서 확인할 수 있다.
신장과 폐를 동시에 침범하는 대표적인 질환으로는 미세다발혈관염(Microscopic Polyangiitis, MPA), 다발혈관염동반 육아종(Granulomatosis with Polyangiitis, GPA), 호산구성 육아종증 다발혈관염(Eosinophilic Granulomatosis with Polyangiitis, EGPA), 전신성 홍반성 루푸스(Systemic Lupus Erythematosus, SLE), 그리고 굿파스처 증후군(Goodpasture Syndrome, GPS)이 있다. 이러한 자가면역질환들은 특정 자가항체나 면역복합체가 혈관을 매개로 폐와 신장에 동시에 염증을 유발한다는 공통적인 병리 기전을 공유하고 있다.
GPA(과거 베게너육아종증으로 알려짐)는 작거나 중간 크기의 혈관을 침범하는 치명적인 혈관염으로, 상기도와 하기도에 육아종성 염증을 유발하고 신장에서는 사구체 염을 일으킨다49). 이는 폐와 신장 모두에서 염증반응을 통해 면역 시스템의 과도한 반응을 유발하여 각 기관이 상호 연관되어 병변이 발생할 수 있음을 시사한다. 또한, EPGA (과거 척스트라우스증후군으로도 알려짐)은 천식과 호산구 증가증을 동반한 소혈관 염증질환으로, 호흡기 감염과 신기능 저하를 초래하며, MPO-ANCA (anti-myeloperoxidase) 양성 반응을 보이는 경우가 많다50). 이는 혈관성 염증 반응이 폐와 신장에 동시에 영향을 미치는 대표적 사례로, 두 기관의 면역 매개 염증 반응이 상호 강화되는 기전을 보여준다. GPS는 자가항체가 신장의 사구체와 폐의 모세혈관 기저막을 공격하여 염증을 유발하는 질환으로, 혈뇨와 객혈이 동반된다51). GPS에서는 항-GBM 항체가 신장과 폐의 기저막에 동시에 침착되어 염증 반응을 일으키므로, 두 기관이 동시에 손상되는 메커니즘이 분명하게 나타난다. 이는 자가면역반응이 신장과 폐의 혈관 및 조직 구조에 상호 영향을 미치는 대표적인 사례이다.
SLE는 전신성 자가면역질환으로 폐와 신장을 포함한 다수의 장기에 동시에 영향을 미치는 특성을 보인다52). SLE에서는 혈액 내 순환하는 면역 복합체가 폐와 신장에 잘 침착되어, 두 기관의 염증 반응이 촉발되며, 흉막염, 사구체 신염이 유발될 수 있다.
고 찰
본 연구에서는 한의학과 현대의학에서 肺와 腎臟의 상호 관계를 비교 고찰하였다. 두 의학 체계는 각기 다른 이론적 배경을 바탕으로 肺와 腎臟의 역할과 그 상호작용을 설명하고 있지만, 두 관점 모두 肺와 腎臟이 밀접하게 연결되어 있으며, 이러한 상호작용이 생리 및 병리 현상에 중요한 영향을 미친다는 점에서 일치한다.
한의학에서는 肺와 腎은 呼吸과 水液대사조절에 있어서 상호 연관되어 있다고 인식한다. 肺는 “主氣” 와 “通調水道” 작용을 통해 眞氣를 생성하고, 水液대사를 관리한다. 肺는 淸氣를 흡입하고 濁氣를 배출하는 기관으로, 先發과 肅降을 통해 氣道가 通暢되며, 呼吸을 순조롭게 한다58). 腎은 納氣작용을 통해 肺의 呼吸을 완성시킨다. 肺에서 흡입한 淸氣는 腎臟의 精氣와 서로 결합해야 인체의 眞氣를 만들기 때문에 [景岳全書]에서는 “肺는 氣를 주관하고, 腎은 氣의 근본이 된다(肺爲氣之主, 腎爲氣之本)”고 설명하였다59). 이처럼 肺의 呼吸 기능은 腎氣가 충분해야만 收斂될 수 있으며, 肺의 先發과 肅降기능에 문제가 생겼을 때 咳喘, 喘促 등의 병리증상이 나타난다. 腎의 精氣가 부족하여 納氣작용이 약해지면, 吸氣不足, 氣短, 氣急 과 같은 증상이 나타나며, 이 경우 반드시 補腎納氣의 방법으로 치료해야 한다.
水液대사의 조절에 있어서도 肺와 腎의 역할은 중추적이다. 肺는 先發과 肅降기능을 통해 전신의 水道를 조절한다. 肺는 先發을 통해 水液을 전신에 布散시키고, 땀을 통해 체외로 배출하며, 肅降을 통해 水液을 방광으로 내려 보내 배출하게 한다. 이러한 기능으로 인해 肺는 “水之上源”이라고 불린다59). 腎은 津液의 輸布와 排泄을 조절하여 체내 水液 대사를 조절하는 중추적인 역할을 하는 臟이다60). 水液은 肺의 先發肅降 기능을 통해 전신으로 운반되며, 膀胱으로 내려가 체외로 배출되는데, 이 과정은 腎의 氣化작용이 원활히 이루어져야 완성될 수 있다. 따라서 肺의 宣發肅降 기능에 문제가 있거나, 腎의 陽氣가 부족하여 氣化기능에 장애가 발생하면, 水液대사 조절에 문제가 생겨 水腫, 小便不利, 尿少, 尿閉 등의 病症이 나타날 수 있다.
이러한 한의학의 肺와 腎에 대한 인식은 실제 임상에서 두 臟의 상생 및 상하 협조 관계를 고려하여 처방을 활용하는 실용적 응용을 통해 실천되고 있다.
현대의학에서는 폐와 신장이 산-염기 균형 및 혈압, 체액 조절에서 밀접한 상호작용을 한다고 설명한다. 폐와 신장은 산-염기 균형을 유지하는데 있어 상호 의존적이다. 폐는 호흡을 통해 이산화탄소를 빠르게 배출하여 pH를 즉각적으로 조절할 수 있으며, 신장은 이를 보완하여 수소 이온의 배출과 중탄산 이온의 재흡수를 통해 장기적인 균형을 유지한다. 가령, 호흡성 산증이 발생할 경우 신장은 더 많은 수소이온을 배출하고 중탄산이온을 재흡수하여 혈액의 산도를 낮춘다. 이와 반대로 대사성 산증에서는 폐가 보상적 과호흡을 통해 이산화탄소를 더 많이 배출하여 pH를 정화하는 역할을 한다. 이들의 상호작용은 임상 상황에서 중요한 의의를 지닌다. 폐기능이 손상되면 신장이 이를 보상하려고 하지만, 그 기능이 한계에 도달하면 전신적인 산-염기 불균형이 발생할 수 있다. 만성 폐쇄성 폐질환(COPD)환자는 폐에서 충분한 이산화탄소 배출이 어려워져 호흡성 산증이 발생할 수 있으며, 이 경우 신장이 보상적 역할을 수행하지만 장기적으로 신장의 기능이 저하될 수 있다. 이와 유사하게, 신부전 환자는 대사성 산증이 발생하기 쉽고, 이 때 폐를 이를 보상하기 위해 호흡을 증가시키는 현상이 나타난다.
또한 두 기관은 체내 수분의 균형을 유지하는데 상호 보완적인 역할을 수행한다. 폐는 호흡을 통한 수분 증발로 수분을 조절한다. 매 호흡시 공기가 폐로 들어오고 나가면서 일정량의 수분이 증발하면서 소량의 수분 손실이 발행하며, 이러한 수분 손실은 건조하거나 차가운 환경에서 더 증가할 수 있다. 이는 체액량에 일정한 영향을 미친다. 신장은 체내 수분 조절의 중추적 역할을 수행하는 장기이다. 네프론에서 여과된 수분은 세뇨관에서 재흡수하거나 배출하여 체액량이 조절되며, 이는 항이뇨호르몬(ADH)과 renin-angiotensin-aldosterone system(RAAS)의 작용을 통해 이루어진다. ADH는 체내 수분이 부족할 때 신장 세뇨관에서 수분의 재흡수를 촉진하여 체액을 보존하며, RAAS는 체내 나트륨 및 수분을 재 흡수하고, 혈관을 수축시킴으로써 혈압을 높인다. 이처럼 폐와 신장은 체내 수분의 조절을 위해 협력하고 있다. 탈수가 발생할 경우 신장은 수분의 재흡수를 촉진하여 소변의 배출을 줄이며, 폐는 호흡을 통해 최소한의 수분 손실만 일어나도록 조절한다. 이런 방식으로 폐와 신장은 서로 보완적인 관계로 체액의 항상성을 유지하는데 기여한다.
폐와 신장의 연관성은 자가면역질환의 관점에서도 특징적으로 나타난다. 이 두 기관은 면역복합체와 자가 항체가 쉽게 침착되는 구조를 가지고 있다. 특히 SLE나 미세다발혈관염, 다발혈관염동반육아종, 호산구성육아종증다발혈관염과 같은 ANCA 연관 혈관염에서는 병변이 폐와 신장에 두드러지게 나타난다. ANCA 연관 혈관염의 경우 proteinase 3(PR3)나 myeloperoxidase(MPO)에 대한 자가항체로 인하여 혈관에 염증을 일으켜 폐와 신장 모두를 손상시킨다. 혈관염을 포함한 전신성 자가면역질환은 병변이 폐나 신장이외의 기관에서도 나타날 수 있다는 점에서 한의학의 폐 신 관계를 자가면역질환의 틀로만 이해하려는 것은 한계가 있다. 그러나 상당수 자가면역질환의 주요한 병변이 두 기관에 특징적으로 나타나는 점은 주목할 만하다. 다발혈관염동반육아종은 염증반응이 상기도 및 폐의 육아종성염증과 신장의 사구체염이 가장 특징적이다. 이는 두 기관이 혈관염에 대한 면역반응에서 비슷한 병리적 기전을 공유하고 있음을 시사하며, 폐와 신장의 연관성을 이해하는 데 자가면역질환의 병리적 기전이 일정한 해석의 틀을 제공할 수 있음을 보여준다. 따라서 자가면역질환에서 나타나는 폐와 신장의 상호작용은 단순한 병변의 나열을 넘어, 두 기관이 면역 반응을 통해 상호 연관되어 있음을 보여준다. 이러한 기전을 이해하는 것은 자가면역질환 환자에서 폐와 신장을 함께 고려하는 통합적 치료 접근의 중요성을 제시한다.
결 론
본 논문에서는 한의학과 현대의학의 관점에서 폐와 신장의 상호 관계를 고찰하고, 자가면역질환에서 두 기관이 어떻게 상호작용하며 병리적 변화를 일으키는지를 분석하였다. 한의학의 肺腎간의 상호관계에 대한 개념은 폐와 신장이 호흡과 체액 대사 조절에 있어 상호 보완적 역할을 수행한다는 점에서 두 기관의 연계성을 강조하며, 이는 실제 임상에서 신장과 폐 질환의 병태가 상호 영향을 미치는 기전과도 일치함을 확인하였다.
현대의학적 관점에서 자가면역질환, 특히 SLE나 ANCA 연관 혈관염은 면역 반응이 폐와 신장에 동시에 작용하여 염증과 손상을 유발할 수 있음을 보여주었다. 이러한 기전은 두 기관이 자가면역 반응의 표적이 되어 병리적 상호작용이 발생할 수 있는 과정을 잘 설명하며, 이는 한의학의 상호 보완적 접근을 기반으로 한 치료의 필요성을 뒷받침한다.
본 연구는 폐와 신장의 관계에 대한 심층적 이해를 통해, 자가면역질환과 같은 복합적 질환에서 두 기관의 병태를 함께 고려한 통합적 치료 전략의 필요성을 강조하였다. 앞으로의 연구는 다양한 자가면역질환에서 폐와 신장의 상호작용을 임상적, 분자적 수준에서 더 명확히 규명하여, 질환에 대한 이해를 넓히고 치료 접근을 최적화하는 데 기여할 수 있을 것이다.
Acknowledgments
본 연구는 부산대학교 기본연구지원사업(2년)의 지원을 받아 수행되었음.
References
-
Madouros N, Jarvis S, Saleem A, Koumadoraki E, Sharif S, Khan S. Is There an Association Between Chronic Obstructive Pulmonary Disease and Chronic Renal Failure?, Cureus. 2022;(14):e26149.
[https://doi.org/10.7759/cureus.26149]

-
Park S, Lee S, Kim Y, Cho S, Kim K, Kim YC, Han SS, Lee H, Lee JP, Joo KW, Lim CS, Kim YS, Kim DK. Kidney function and obstructive lung disease: a bidirectional Mendelian randomisation study, Eur Respir J. 2021;58.
[https://doi.org/10.1183/13993003.00848-2021]

- Hassan IS, Ghalib MB. Lung disease in relation to kidney diseases, Saudi journal of kidney diseases and transplantation : an official publication of the Saudi Center for Organ Transplantation, Saudi Arabia. 2005;(16):282-7.
- Professors of Physiology in Korean Medicine. Jipmundang, 2008;269, 290.
- Textbook Editing Committee. Pathology in Korean Medicine. Korean Medicine Culture Publisher. 2019; 448, 502.
- Deng X, Huang G. Exploration of the concept of kidney governing Qi absoption based on the Lung-Kidney relationship. Journal of Guizhou University of Traditional chinese medicine. 2024;46(2):1-4.
- Textbook Editing Committee. Pathology in Korean Medicine. Korean Medicine Culture Publisher. 2019; 448, 502.
- Shin JY. Commentary of Bangyakhappyeon. Seongbo-sa. 1988;51.
- Lee JD. A New View of the Bangyakhappyeon. Cheonghong. 2012;440.
- Lee JE, Kim PJ, Lee YT. Application of Shinkihuan in Hyungsang Medicine, Korean J. Oriental Physiology & Pathology. 2002;16(5):840-4.
- Choi SH. Korean Medicine. Bigbook. 2006;371-2.
-
Visconti L, Santoro D, CernaroV, Buemi M. A. Lacquaniti, Kidney-lung connections in acute and chronic diseases: current perspectives, Journal of nephrology. 2016;(29):341-8.
[https://doi.org/10.1007/s40620-016-0276-7]

-
Haase VH. Hypoxic regulation of erythropoiesis and iron metabolism, American journal of physiology. Renal physiology. 2010;(299):F1-13.
[https://doi.org/10.1152/ajprenal.00174.2010]

- Song JS. The interpretation of Respiratory Acidosis and Respiratory Alkalosis, Acute and Critical Care. 2002;17(2):70-4.
-
Joseph A, Kristin D, Joseph A, Sameer T, Manpreet V, Ayse AA. Two to Tango: Kidney-Lung Interaction in Acute Kidney Injury and Acute Respiratory Distress Syndrome, Front Pediatr. 2021;(9):744110.
[https://doi.org/10.3389/fped.2021.744110]

-
Rajkumar P, Pluznick JL. Acid-base regulation in the renal proximal tubules: using novel pH sensors to maintain homeostasis, American journal of physiology. Renal physiology. 2018;(315):F1187-F1190.
[https://doi.org/10.1152/ajprenal.00185.2018]

-
Eckardt KU. Erythropoietin production in liver and kidneys, Current opinion in nephrology and hypertension. 1996;(5):28-34.
[https://doi.org/10.1097/00041552-199601000-00007]

- Gisolfi CV. Water Requirements during Exercise in the Heat, Nutritional Needs in Hot Environments. 1993;87-96.
- Institute of Medicine. Dietary reference intakes for water, potassium, sodium, chloride, and sulfate. Washington, D.C.: The National Academies Press. 2005.
-
Hall JE, The kidney, hypertension, and obesity, Hypertension. 2003;(41):625-33.
[https://doi.org/10.1161/01.HYP.0000052314.95497.78]

-
Ruster C, Wolf G. Renin-angiotensin-aldosterone system and progression of renal disease, Journal of the American Society of Nephrology : JASN. 2006;(17):2985-91.
[https://doi.org/10.1681/ASN.2006040356]

-
Hu C, Kang BY, Megyesi J, Kaushal GP, Safirstein RL, Mehta JL. Deletion of LOX-1 attenuates renal injury following angiotensin II infusion, Kidney Int. 2009;(76):521-7.
[https://doi.org/10.1038/ki.2009.234]

-
Hirsch JS, Ng JH, Ross DW, Sharma P, Shah HH, Barnett RL, Hazzan AD, Fishbane S, Jhaveri KD, Northwell C-RC Northwell Nephrology, Acute kidney injury in patients hospitalized with COVID-19, Kidney Int. 2020;(98):209-18.
[https://doi.org/10.1016/j.kint.2020.05.006]

-
Xie Y, Bowe B, Maddukuri G, Al-Aly Z. Comparative evaluation of clinical manifestations and risk of death in patients admitted to hospital with covid-19 and seasonal influenza: cohort study, BMJ. 2020;(371):m4677.
[https://doi.org/10.1136/bmj.m4677]

- Richardson S, Hirsch JS, Narasimhan M. Presenting Characteristics, Comorbidities, and Outcomes Among 5700 Patients Hospitalized With COVID-19 in the New York City Area (vol 323, pg 2050, 2020), Jama-J Am Med Assoc. 2020;(323):2098
-
Yvette RBM van Gestel, Michel Chonchol, Sanne E Hoeks, Gijs MJM Welten, Henk Stam, Frans W Mertens, Ron T van Domburg, Don Poldermans. Association between chronic obstructive pulmonary disease and chronic kidney disease in vascular surgery patients, Nephrol Dial Transpl. 2009;(24):2763-7.
[https://doi.org/10.1093/ndt/gfp171]

-
Gjerde B, Bakke PS, Ueland T, Hardie JA, Eagan TM. The prevalence of undiagnosed renal failure in a cohort of COPD patients in western Norway, Respir Med. 2012;(106):361-6.
[https://doi.org/10.1016/j.rmed.2011.10.004]

-
Incalzi RA, Corsonello A, Pedone C, Battaglia S, Paglino G, Bellia V. Extrapulmonary Consequences of, Chronic renal failure: a neglected comorbidity of COPD, Chest. 2010;(137):831-7.
[https://doi.org/10.1378/chest.09-1710]

-
Gembillo G, Calimeri S, Tranchida V, Silipigni S, Vella D, Ferrara D, Spinella C, Santoro D, Visconti L. Lung Dysfunction and Chronic Kidney Disease: A Complex Network of Multiple Interactions, J Pers Med. 2023;(13).
[https://doi.org/10.3390/jpm13020286]

-
Gan WQ, Man SFP, Senthilselvan A, Sin DD. Association between chronic obstructive pulmonary disease and systemic inflammation: a systematic review and a meta-analysis, Thorax. 2004;(59):574-80.
[https://doi.org/10.1136/thx.2003.019588]

-
Gaddam S, Gunukula SK, Lohr JW, Arora P, Prevalence of chronic kidney disease in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis, BMC Pulm Med. 2016;(16):158.
[https://doi.org/10.1186/s12890-016-0315-0]

-
Han SL, Park BG. Relationship of Forced Vital Capacity with Chronic Kidney Disease among Middle-Aged and Elder Korean Men, Korean Journal of Family Practice. 2019;9(1):96-101.
[https://doi.org/10.21215/kjfp.2019.9.1.96]

-
Darmon M, Schortgen F, Leon R, Moutereau S, Mayaux J, Di Marco F, Devaquet J, Brun-Buisson C, Brochard L. Impact of mild hypoxemia on renal function and renal resistive index during mechanical ventilation, Intensive Care Med. 2009;(35):1031-8.
[https://doi.org/10.1007/s00134-008-1372-5]

-
Devarajan P. Update on mechanisms of ischemic acute kidney injury, Journal of the American Society of Nephrology : JASN. 2006;(17):1503-20.
[https://doi.org/10.1681/ASN.2006010017]

-
Scholz H, Boivin FJ, Schmidt-Ott KM, Bachmann S, Eckardt KU, Scholl UI, Persson PB. Kidney physiology and susceptibility to acute kidney injury: implications for renoprotection, Nature reviews. Nephrology. 2021;(17):335-49.
[https://doi.org/10.1038/s41581-021-00394-7]

-
Scheel PJ, Liu M, Rabb H, Uremic lung: new insights into a forgotten condition, Kidney International. 2008;(74):849-51.
[https://doi.org/10.1038/ki.2008.390]

-
Paladino JD, Hotchkiss JR, Rabb H. Acute kidney injury and lung dysfunction: a paradigm for remote organ effects of kidney disease?, Microvascular research. 2009;(77):8-12.
[https://doi.org/10.1016/j.mvr.2008.09.001]

-
Awad AS, Rouse M, Huang L, Vergis AL, Reutershan J, Cathro HP, Linden J, Okusa MD. Compartmentalization of neutrophils in the kidney and lung following acute ischemic kidney injury, Kidney Int. 2009;(75):689-8.
[https://doi.org/10.1038/ki.2008.648]

-
Gu J, Chen J, Xia P, Tao G, Zhao H, Ma D. Dexmedetomidine attenuates remote lung injury induced by renal ischemia-reperfusion in mice, Acta Anaesthesiol Scand. 2011;(55):1272-8.
[https://doi.org/10.1111/j.1399-6576.2011.02526.x]

-
White LE, Santora RJ, Cui Y, Moore FA, Hassoun HT. TNFR1-dependent pulmonary apoptosis during ischemic acute kidney injury, Am J Physiol-Lung C. 2012;(303):L449-L459.
[https://doi.org/10.1152/ajplung.00301.2011]

-
Feltes CM, Hassoun HT, Lie ML, Cheadle C, Rabb H. Pulmonary endothelial cell activation during experimental acute kidney injury, Shock. 2011;(36):170-6.
[https://doi.org/10.1097/SHK.0b013e3182169c76]

-
Anand IS, Chandrashekhar Y, Ferrari R, Sarma R, Guleria R, Jindal SK, Wahi PL, Poole-Wilson PA, Harris P. Pathogenesis of congestive state in chronic obstructive pulmonary disease. Studies of body water and sodium, renal function, hemodynamics, and plasma hormones during edema and after recovery, Circulation. 1992;(86):12-21.
[https://doi.org/10.1161/01.CIR.86.1.12]

-
Faubel S, Edelstein CL, Mechanisms and mediators of lung injury after acute kidney injury, Nature reviews. Nephrology. 2016;(12):48-60.
[https://doi.org/10.1038/nrneph.2015.158]

-
Klein CL, Hoke TS, Fang WF, Altmann CJ, Douglas IS, Faubel S. Interleukin-6 mediates lung injury following ischemic acute kidney injury or bilateral nephrectomy, Kidney Int. 2008;(74):901-9.
[https://doi.org/10.1038/ki.2008.314]

-
Herrlich A. Interorgan crosstalk mechanisms in disease: the case of acute kidney injury-induced remote lung injury, FEBS letters. 2022;(596):620-37.
[https://doi.org/10.1002/1873-3468.14262]

-
Bollenbecker S, Czaya B, Gutiérrez OM, Krick S. Lung-kidney interactions and their role in chronic kidney disease-associated pulmonary diseases, Am J Physiol-Lung C. 2022;(322):L625-L640.
[https://doi.org/10.1152/ajplung.00152.2021]

-
Mukai H, Ming P, Lindholm B, Heimburger O, Barany P, Stenvinkel P, Qureshi AR. Lung Dysfunction and Mortality in Patients with Chronic Kidney Disease, Kidney & blood pressure research. 2018;(43):522-35.
[https://doi.org/10.1159/000488699]

-
Nickel NP, O'Leary JM, Brittain EL, Fessel JP, Zamanian RT, West JD, Austin ED. Kidney dysfunction in patients with pulmonary arterial hypertension, Pulm Circ. 2017;(7):38-54.
[https://doi.org/10.1086/690018]

-
Bachmeyer C, Halioua B. "Granulomatosis with polyangiitis (Wegener's)" for "Wegener granulomatosis": dermatology journals should also adopt the alternative name, JAMA Dermatol. 2013;(149):526-7.
[https://doi.org/10.1001/jamadermatol.2013.2060]

-
Matthieu G, Christian P, Chiara B, Elisabeth B, Paolo B, Vincent C, Klaus D, Bertrand D, Wolfgang G, Julia H, Marc H, David J, J Charles J, Romain L, Alfred M, Peter AM, Luc M, Renato AS, Ulrich S, Augusto V, Michael EW, Jean-François C, Loïc G. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss) (EGPA) Consensus Task Force recommendations for evaluation and management, Eur J Intern Med. 2015;(26):545-53.
[https://doi.org/10.1016/j.ejim.2015.04.022]

-
Bolton WK. Goodpasture's syndrome, Kidney Int. 1996;(50): 1753-66.
[https://doi.org/10.1038/ki.1996.495]

-
Tsokos GC. MECHANISMS OF DISEASE Systemic Lupus Erythematosus, New Engl J Med. 2011;(365):2110-21.
[https://doi.org/10.1056/NEJMra1100359]

-
Talarico R, Barsotti S, Elefante E, Baldini C, Tani C, Mosca M. Systemic vasculitis and the lung, Curr Opin Rheumatol. 2017;(29):45-50.
[https://doi.org/10.1097/BOR.0000000000000342]

- Zakharova EV, Iakovlev VN, Vinogradova OV, Sheikh ZV, Zhidkova NV, Alekseev VG. [ANCA-associated vasculitis affecting lungs and kidneys: clinical and morphological characteristic, treatment, outcomes], Klin Med (Mosk). 2013;(91):38-43.
-
Buda N, Masiak A, Zdrojewski Z. Utility of lung ultrasound in ANCA-associated vasculitis with lung involvement, PLoS One 14 (2019) e0222189.
[https://doi.org/10.1371/journal.pone.0222189]

-
Shin JI, Lee KH, Park S, Yang JW, Kim HJ, Song K, Lee S, Na H, Jang YJ, Nam JY, Kim S, Lee C, Hong C, Kim C, Kim M, Choi U, Seo J, Jin H, Yi B, Jeong SJ, Sheok YO, Kim H, Lee S, Lee S, Jeong YS, Park SJ, Kim JH, Kronbichler A. Systemic Lupus Erythematosus and Lung Involvement: A Comprehensive Review, Journal of Clinical Medicine. 2022 Nov 13;11(22):6714.
[https://doi.org/10.3390/jcm11226714]

- Antonio G, Maria IR, Armando DV, Andrea G, Massimo F, Giulio P, Salvatore M, Rosaria T, Lucia L, Marco DV. Goodpasture's syndrome: a clinical update, Autoimmun Rev. 2015;(14):246-53.
- Kim W. Principles of Korean Medicine (Hanuihak Wonron), Seongbosa publishin. 1993; 165.
- Kim W. Principles of Korean Medicine (Hanuihak Wonron), Seongbosa publishin. 1993; 165-8.
- Kim W. Principles of Korean Medicine (Hanuihak Wonron), Seongbosa publishin. 1993; 81.