
신장(腎), 뼈(骨), 치아(齒)의 관계에 대한 동서의학적 고찰
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Bones and teeth impact quality of life and serve as important indicators of overall health, and diseases such as osteoporosis and periodontitis are emerging as increasingly significant health issues in aging societies. In traditional Korean medicine(TKM), bones and teeth are classified under the kidneys, explaining their interrelationship, and biomedical studies have been published on this connection. This study aims to compare the perspectives of TKM and biomedicine on the relationship between the kidneys, bones, and teeth, focusing on similarities between the two disciplines. The fact that the kidneys produce active vitamin D, which contributes to skeletal formation, and that sex hormones, which influence the lifespan of osteoclasts and osteoblasts, resemble the role of the kidneys(腎) in TKM, which are associated with growth and reproduction, aligns with the TKM concept that "the kidneys govern the bones"(腎主骨). Furthermore, the histological similarity between bones and teeth, as well as the metabolic parallels involving osteoclast metabolism, retinoic acid metabolism, and vitamin D, support the idea that "teeth are the surplus of bones"(齒者骨之餘). In addition to the kidneys acting on the shared pathways of bones and teeth, the pathological link between kidney deficiency(腎虛) and dental diseases—caused by aging, overwork, or congenital deficiencies—explains the concept that "the kidneys govern the teeth"(腎主齒). This study contributes to an integrated understanding of both disciplines by comparing the TKM concept with biomedical explanations concerning the kidneys, bones, and teeth. Through this approach, it can be demonstrated that TKM concepts remain valid in modern contexts, while also suggesting the potential to explain less clearly understood TKM theories in this manner.
Keywords:
Relationship Between Kidneys, Bones, and Teeth, Eastern-Western Medicine, Comparison서 론
뼈와 치아는 인체의 주요 지지 구조물로, 삶의 질에 직접적인 영향을 미친다. 2008년에서 2011년의 한국 국민건강영양조사 결과에 따르면 골다공증과 같은 뼈 질환이 50대 이상에서 남성 7.0%, 여성 40.1%로 흔히 발생하고 있으며1), 19세 이상 성인의 26.8%가 치주염 같은 치아 질환을 앓고 있는 것으로 나타났다2). 또한 2013년에서 2022년의 한국 국민건강영양조사 결과에서도 19세 이상에서 치아, 잇몸 등의 문제로 저작 불편이나 발음 불편을 느낀 비율은 약 20.4%3)로 구강 건강 관련 문제는 지속되고 있음을 알 수 있다.
한의학에서는 간(肝), 심(心), 비(脾), 폐(肺), 신(腎)의 다섯 가지 장부가 모든 기관과 기능을 포괄하는 기능계를 형성하며, 목(木), 화(火), 토(土), 금(金), 수(水)의 오행(五行)의 특징에 따라 각 장부와 기관, 기능이 배속되어 서로 유기적인 관계를 맺고 있다고 보고 있다4). 특히 한의학에서 신(腎)은 단순히 해부학적 장기인 신장(Kidney)에 국한되지 않고 뼈, 골수, 치아, 방광, 갑상선 등 다양한 기관과 정(精)과 같은 기능적 요소를 포함하는 복합적인 개념이라고 보고 있다5,6). 이러한 관점은 오랜 임상 경험을 통해 발전해왔으나, 장부와 기관 사이의 비가시적 연계와 한의학적 용어의 불명확성으로 쉽게 이해하기에는 어려움이 많았다. 신(腎)과 뼈7,8), 신(腎)과 갑상선5)의 관계를 살펴본 선행연구가 있지만, 신(腎)이 치아와 더불어 뼈와 어떠한 생리적, 병리적 연관성을 가지고 있는지 종합적으로 탐구한 연구는 거의 없는 실정이다.
뼈와 치아 질환은 한의학에서 신허(腎虛)를 원인으로 보았으며, 접골탕9) 육미지황환10) 등 신(腎)을 보(補)하는 처방을 활용하여 치료해왔다. 특히 『東醫寶鑑 外形篇 牙齒』에서 "腎衰則齒豁, 精盛則齒堅, 虛熱則齒動."라 하여 신(腎)이 쇠약하면 치아 사이가 벌어지고, 신(腎)에 정(精)이 충만하면 치아가 견실해지며, 허열(虛熱)이 발생하면 치아가 흔들린다고 기록하여 신(腎)기능이 치아 건강에 미치는 영향을 언급하고 있다. 이러한 한의학적 개념은 신장 기능의 저하가 골다공증과 더불어 잔존 치아 수 감소와 치주 질환 발생에 영향을 미친다는 여러 연구와 일치한다고 볼 수 있다11-17). 이는 뼈와 치아가 전신 건강에 중요한 지표가 될 수 있음을 시사함과 동시에 신(腎)과 뼈(骨), 치아(齒)의 상관성이 생의학으로도 설명될 수 있는 가능성을 제시하고 있다.
따라서 본 연구에서는 신장과 뼈와 치아의 연관성을 명확히 하고, 예시를 통해 한의학과 생의학의 설명을 비교하여 두 학문이 상호 호환될 가능성을 확인하고자 한다. 이 연구는 두 의학 체계의 다른 관점을 통합하여 이해하는 데 도움이 될 수 있을 것이며, 뼈와 치아 질환의 예방과 치료에 기여할 새로운 접근법의 개발에 기초 자료로 활용할 수 있을 것이다. 궁극적으로 고령 인구의 전반적인 건강 증진과 삶의 질 향상에도 이바지할 것으로 기대된다.
본 론
1. 신장과 뼈의 관계
한의학에서 신(腎)은 정(精)이라는 정미로운 생명의 원천 물질을 간직하고 있으며4), 신(腎)에 정(精)이 충만해야 인간의 생식 및 발육이 원활하게 이루어진다4)고 보았다. 황제내경(黃帝內經)에서는 “腎藏精”, “腎主骨”, “腎生骨髓”라 하여 신(腎)이 정(精)을 저장하고, 뼈를 주관하며, 골수(骨髓)를 생(生)한다고 언급하였으며18), 이는 뼈와 골수(骨髓)가 신(腎)과 밀접한 관계가 있음을 뜻한다. 이러한 관계를 바탕으로 한의학에서는 뼈 질환의 치료에 신(腎)과 관련된 처방을 활용해 왔다. 예를 들어, 골밀도의 저하로 인해 뼈가 얇아지고 골강도가 약해져 골절이 잘 발생하는 골다공증19)은 한의학에서 뼈가 쇠약해지는 골위(骨萎), 뼈가 저린 골비(骨痺), 뼈가 마르는 골고(骨枯), 뼈가 생명을 다한 골극(骨極)과 유사하다고 할 수 있는데20), 이러한 질환의 원인을 신허(腎虛)로 보아21)신(腎)을 보(補)하는 약재인 골쇄보, 음양곽, 토사자, 속단, 보골지 등을 활용하고 있다22).
일반적으로 뼈의 대사에는 비타민 D와 성호르몬의 작용과 관련이 있다. 뼈의 항상성 유지는 파골세포에 의한 뼈 흡수와 조골세포에 의한 뼈 형성의 균형을 통해 이루어지는데23,24), 비타민 D는 혈중 칼슘의 흡수에, 성호르몬은 파골세포와 조골세포의 수명에 영향을 줌으로써 뼈의 대사에 관여하게 된다23,25,26).
비타민 D는 자외선 조사를 통해 피부에서 합성되거나 식이로 섭취되는데, 이는 인체에서 활용될 수 없는 상태이기 때문에 간(Liver)과 신장(Kidney)에서 두 번의 대사 과정을 거친 후 활성화된다27). 이러한 활성 상태의 비타민 D는 세포의 비타민 D 수용체(Vitamin D Receptor, VDR)의 합성을 도와 장내 칼슘을 흡수하고, 신장(Kidney)에서 칼슘을 재흡수하여 뼈의 주요 성분이 되는 인체 내 칼슘의 양을 조절하는 기능을 한다23). 신장(Kidney)은 근위 세뇨관에서 1α-하이드록실화(1α-hydroxylase) 효소를 이용해 비타민 D를 최종 활성 상태로 바꾸는 역할을 하는데28), 만약 신장(Kidney)에 문제가 생기면 비타민 D의 불활성화에 따른 뼈 대사의 이상을 초래한다. 예를 들면, 만성신장질환(CKD)의 흔한 합병증은 비타민 D 대사 이상으로 인한 미네랄 대사 장애와 뼈 질환이며, 이를 신성 골이영양증(renal osteodystrophy), 또는 만성 콩팥병-미네랄뼈질환(Chronic Kidney Disease-Mineral Bone Disorder, CKD-MBD)이라고 정의하고 있다16,17). 또한 만성신장질환(CKD)은 신장(Kidney)에서 비타민 D 활성화가 저하되어 인체에서의 칼슘 흡수를 방해하는데, 이때 혈청 칼슘의 양을 증가시키기 위해 보상적으로 부갑상선에서 파라토르몬(Parathyroid Hormone, PTH)의 방출을 늘린다23,28). 이 상황이 지속될 경우 이차성 부갑상선 기능 항진증(Secondary Hyperparathyroidism, Secondary HPT)이 발생하여 뼈에서의 칼슘 유출이 많아져 골밀도가 낮아지기 쉽고, 이에 따라 만성신장질환(CKD)에서 골다공증이 발생할 가능성이 높아진다29). 또한 신장(Kidney) 기능을 반영하는 지표인 추정 사구체 여과율(estimated Glomerular Filtration Rate, eGFR)이 감소함에 따라 골절 위험은 증가한다30,31). 만성신장질환(CKD)에 의해 발생한 골다공증은 일반적인 골다공증과는 달리 이차성 부갑상선 기능 항진증(Secondary HPT)으로 인한 피질골 골밀도의 감소가 크며, 이로 인해 대퇴골 및 고관절 골절이 다발한다17,32,33).
이를 종합하면, 비타민D의 활성화와 칼슘 대사에 신장(Kidney)이 매우 중요한 역할을 한다고 볼 수 있다. 한의학에서도 골다공증이나 골절 치료에 구기자, 속단, 토사자, 보골지 등 신(腎)을 보(補)하는 약재를 치료에 사용해 왔으며9,22,34), 신(腎)이 허(虛)할수록 골밀도가 낮아진다는 연구결과가 제시된 바 있다35). 이를 통해 한의학과 생의학이 공통적으로 신장과 뼈 사이에 밀접한 연관성이 있다고 파악했음을 알 수 있다.
성호르몬 역시 신장(Kidney)이 뼈 대사와 밀접한 관련이 있다는 관점에서 해석해볼 수 있다36). 시상하부-뇌하수체-성선축(Hypothalamic-Pituitary-Gonadal Axis, HPG축)을 인간 생식의 중심이라 할 수 있는데, 남녀의 생식샘에서 분비되는 성호르몬은 뼈의 성장과 밀접한 연관이 있는 것으로 알려져 있다8,37). 성호르몬이 결핍되면 파골세포의 수명이 연장되고 조골세포의 수명은 짧아지게 되어 골밀도가 감소하며25), 성호르몬은 산화 스트레스의 생성을 억제하여 골 세포의 항상성을 유지하게 된다26). 예를 들어, 에스트로겐은 남녀 모두의 골 대사를 조절하여 뼈 항상성을 유지하도록 하며38), 남성에게 있어 테스토스테론은 파골세포에 직접적으로 작용하여 파골세포의 활성을 억제한다고 한다39,40). 병리학적으로도 성호르몬과 뼈의 연관성을 살펴볼 수 있는데, 만성 통증에 사용하는 강력한 진통제인 오피오이드(Opioid)는 HPG축의 기능을 억제하여 오피오이드의 장기간 사용은 오피오이드 유발 성선기능저하증(Opioid-Induced Hypogonadism, OHG)을 초래하며41,42), 이는 결국 골밀도의 저하를 유발하게 된다43).
생의학에서는 HPG축이 발달됨에 따라 2차 성징이 나타나고, 노화가 진행되면서 HPG축의 활성도도 감소한다고 밝혀졌다8,44). 황제내경(黃帝內經)에서도 여성과 남성의 성장과 노화에 대한 기록이 남아있는데, 여성은 14세경에 신기(腎氣)가 왕성해져 월경을 하고, 49세경에 신기(腎氣)가 고갈되어 월경이 끊어진다고 나와있다18). 남성의 경우 16세경에 자식을 가질 수 있게 되고, 64세경에 생식 능력이 저하된다고 언급하고 있다18). 이를 통해 HPG축이 활성화되고 퇴화하는 시기가 한의학에서 신기(腎氣)가 왕성해지고 고갈되는 시기와 맞물린다는 것을 확인할 수 있다. 이는 이차 성징과 생식에 관여하는 HPG축의 역할을 한의학에서는 천계(天癸)라 하여, 신기(腎氣)의 충실과 쇠퇴에 의해 생식기능도 조정된다고 보고 있다4,45). 결국 한의학과 생의학 모두 공통적으로 신장과 성호르몬 사이에 밀 접한 연관성이 있다고 파악했음을 알 수 있다46).
상기한 내용을 토대로 판단했을 때, 비타민 D와 HPG축을 매개로 신장(Kidney)과 뼈의 관계를 살펴볼 수 있으며, 뼈 대사와 생식선의 성숙도가 한의학에서 바라보는 신(腎)의 역할과 긴밀한 관계가 있음을 확인할 수 있다. 따라서 한의학적으로 "신장이 뼈를 주관한다"는 신주골(腎主骨)의 의미가 생의학적으로 해석될 수 있음을 시사한다(Fig. 1).
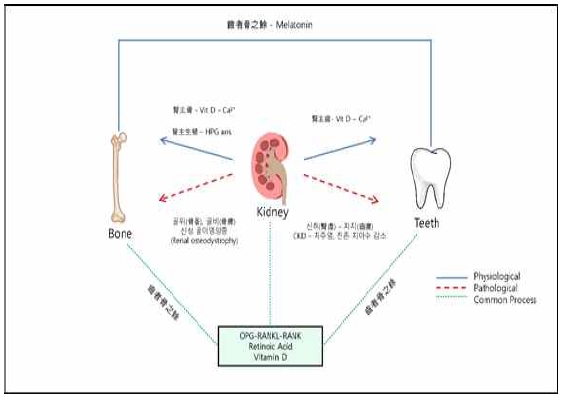
Physiological and Pathological Relationships Between the Kidneys, Bones, and Teeth. The kidneys play an essential role in the physiological processes of bones and teeth, and when kidney function declines and these processes are disrupted, pathological conditions arise. The relationship between the kidneys and bones can be understood physiologically through the activation of vitamin D and sex hormones in the kidneys, a concept referred to as "the kidneys govern the bones" (腎主骨). Pathologically, this relationship is associated with conditions such as osteomalacia, osteoporosis, and renal osteodystrophy. Additionally, the kidneys influence teeth through the activation of vitamin D and subsequent calcium absorption, a concept known as "the kidneys govern the teeth" (腎主齒). Consequently, kidney dysfunction can lead to dental diseases. It is evident that the kidneys, bones, and teeth are closely interconnected through common processes such as the OPG-RANKL-RANK pathway, retinoic acid metabolism, and vitamin D. Furthermore, bones and teeth share additional biomedical similarities through processes mediated by melatonin, which is captured by the concept "teeth are the surplus of bones" (齒者骨之餘).
2. 신장과 치아의 관계
신장과 뼈의 관계와 마찬가지로, 한의학에서는 뼈와 치아의 관계도 직접적으로 언급하고 있다. 『東醫寶鑑 外形篇 牙齒』에서 "齒者骨之餘"라 하여 치아는 뼈의 여분18)이라고 하였다. 또 『東醫寶鑑 雜病篇』에서 "齒不生者, 由齒者骨之所終, 髓之所養, 稟氣不足, 則髓不能充於骨, 故齒久不生."라 하여 치아는 뼈의 끝부분이고 치아와 뼈 모두 골수가 길러주며, 선천적인 기운이 부족하면 골수가 뼈를 영양하지 못하여 치아가 오랫동안 생기지 않는다18)고 언급하여 뼈와 치아는 유사한 부분이 많다고 인식하였다. 따라서 뼈에 충분한 영양이 공급되지 않아 발생하는 치아 병증에 육미지황환, 좌귀음과 같은 처방을 활용하여47-50) 치료할 수 있다. 이를 통해 치아와 뼈 사이의 밀접한 연관성이 있음을 살펴볼 수 있다21).
생의학에서도 치아와 뼈의 관계를 성분과 대사 측면에서 살펴볼 수 있다. 치아는 저작 운동을 통해 소화를 돕고, 발음을 명확하게 하여 의사소통을 원활하게 하며, 얼굴 구조를 지지함으로써 얼굴 형태를 유지하는 다양한 기능을 한다51). 치아의 구조는 크게 상아질, 법랑질, 치수로 구성되어 있는데52), 그 중 상아질은 치아에서 가장 큰 부피를 차지하는 핵심적인 구조이다53,54). 상아질은 콜라겐(18%), 비콜라겐성 단백질(2%), 하이드록시아파타이트(Hydroxyapatite, 70%), 체액(10%)으로 구성되어 뼈와 화학 성분 및 구성 비율이 매우 유사하다55). 이 때문에 치아를 골이식재로 만들어 이식하는 이식재로 사용하기도 한다56).
뼈와 치아의 대사적인 유사성도 존재하는데, 대표적으로 파골세포의 대사와 레티노산(Retinoic Acid)의 대사가 있다. 일반적으로 뼈 대사에서 파골세포는 뼈를 파괴하여 혈청 칼슘 농도를 증가시키는 역할을 하지만, 치아에서는 파골세포가 치아 주변에서 활성화되어 치아 뿌리를 성장시키며, 이를 통해 치아의 발달과 맹출을 돕는 역할을 한다57). OPG-RANKL-RANK(Osteoprotegerin-Receptor Activator of Nuclear Factor κB Ligand-Receptor Activator of Nuclear Factor κB) 경로는 골 보호인자와 골 흡수인자의 길항 작용을 통해 뼈와 치아의 생성과 해체에 관여하는데, 파골세포는 이 경로에 의해 활성 조절이 이루어진다58-60). 파골세포에 의한 골 파괴를 억제하여 골다공증 치료에 많이 활용되는 비스포스포네이트(Bisphosphonate)는 OPG-RANKL-RANK 경로에서 골 흡수인자의 작용을 방해함으로써 파골세포의 활성화를 막아 치아의 발달 및 맹출을 억제하는 역할을 한다61-63). 또한, 레티노산은 장기 발달에 필수적인 신호 인자인데, OPG-RANKL-RANK 경로에 영향을 주어 파골세포를 활성화해서 뼈의 재형성과 치아의 발달을 돕는 역할을 한다64,65). Aldh1a2 효소는 치아 발생 동안 치아 주머니에 강하게 발현되어 레티노산을 형성함으로써 치아를 발달시키며66), 이 효소에 변이가 생길 경우 레티노산의 형성이 저하되어 골관절염을 유발한다는 연구 결과도 있다64-66). 이처럼 뼈와 치아는 레티노산(retinoic Acid)의 대사 과정 동안 Aldh1a2 효소와 OPG-RANKL-RANK 경로를 공유하고 있다.64-66)
또한, 수면과 각성 주기를 조절하여 일주기 리듬에 관여한다고 알려져 있는 멜라토닌(Melatonin)에서도 뼈와 치아의 공통점을 찾을 수 있다67). 멜라토닌은 골모세포의 증식을 촉진하고68) 파골세포의 생성을 억제하며69), 뼈 흡수를 억제하는 에스트로겐의 효과를 증가시킴70)으로써 뼈 형성 및 골밀도 향상에 기여한다. 치아에서도 멜라토닌은 법랑질 및 상아질 형성 세포에 작용하여 치아의 성장과 발달을 돕는다71)고 알려져 있으며, 치아의 성장은 일주기적 증가 양상을 보인다는 점에서 멜라토닌의 영향을 찾아볼 수 있다72).
신장(Kidney) 역시 OPG-RANKL-RANK 경로와 레티노산 대사와 관련이 있다. 신장(Kidney)에 의해 활성화된 비타민 D는 OPG-RANKL-RANK 경로에서 파골세포를 활성화하는 방향으로 작용하여 뼈에서 혈액 내로 칼슘의 유리를 촉진하지만73), 동시에 활성 상태의 비타민 D는 장과 신장(Kidney)에서의 칼슘 흡수를 통해 정상적인 뼈와 치아의 골격 발달에 기여한다74). 특히 구강에서는 향균 펩타이드(Anti-Microbial Peptides, AMPs)를 생성하고 면역 세포의 활동을 증가시킴으로써 향균, 항염증 효과를 향상시켜 치주질환과 충치를 예방한다75-77). 또한, 신장(Kidney)은 비타민 A의 대사 산물 중 가장 활성화 형태인 레티노산 대사의 주요 기관78)으로, 레티노산을 제거(Clearance)함으로써 인체 내 레티노산 항상성을 유지하는 데 필수적이다79). 만일 신장(Kidney)에서 제거되지 않아 혈장에 레티노산 농도가 높을 경우 만성신장질환(CKD) 환자에서 흔히 발생하는 골절 및 골다공증80,81)이 초래될 수 있다.
상기한 뼈와 치아의 공통점은 한의학의 치자골지여(齒者骨之餘) 개념과 부합한다고 할 수 있다. 또한, 신장(Kidney)이 뼈와 치아의 공통 대사 과정에 관여하고, 뼈와 치아의 건강에 필수적인 비타민 D의 활성화에 중요한 역할을 한다는 점에서 신(腎)이 뼈를 주관한다는 신주골(腎主骨)과 신(腎)이 치아를 주관한다는 신주치(腎主齒)의 의미와 연결해볼 수 있다(Fig. 1).
『黃帝內經 上古天眞論』에서 "女子 七歲 腎氣盛 齒更髮長, 丈夫 八歲 腎氣實 髮長齒更, ⋯ 三七 腎氣平均 故 眞牙生而長極,, ⋯ 五八 腎氣衰 髮墮齒槁, ⋯ 八八 則齒髮去"라 하여 성장과 노화에 의해 신기(腎氣)가 성하면 치아가 성장하고 단단해지며, 신기(腎氣)가 고갈되면 치아 또한 약해지고 빠진다18)고 하였다. 또 『東醫寶鑑 外形篇 牙齒』에서는 "腎衰則齒豁, 精盛則齒堅, 虛熱則齒動."라 하여 신(腎)이 쇠약하면 치아 사이가 벌어지고, 신(腎)에 정(精)이 충만하면 치아가 견실해지며, 반면 신(腎)의 정(精)이 부족하면 허열(虛熱)이 발생하여 치아가 흔들린다고 보았다18,82). 이처럼 한의학에서 신(腎)은 치아의 성장과 퇴화에 주된 영향을 미치는 장부로 인식하고 있음을 알 수 있다.
신장(Kidney) 기능이 나쁠수록 잔존 치아수가 감소하고 치주 질환에 이환될 가능성이 높으며11-15), 잔존 치아수가 20개 미만인 경우 만성신장질환(CKD) 유병률이 약 2배 높았다는 연구결과11)는 한의학에서 바라본 신(腎)과 치아의 관계를 보여주는 예가 될 수 있다. 치주염과 만성신장질환(CKD)이 서로 영향을 주고받을 가능성이 있다12,83-85)는 점에서 생의학 역시 신장(Kidney)과 치아의 관계에 주목하고 있다는 것을 알 수 있다.
한의학에서는 노화, 잦은 성관계, 만성 질환, 정신적 스트레스, 과로, 선천적으로 허약하게 태어났을 때 신(腎)이 허약해 진다고 보았다82). 이 경우 치아의 흔들림, 탈락, 치아가 늦게 자라는 등의 증상이 발생할 수 있다48,49). 선행 연구에서 신(腎)을 보(補)하는 처방인 팔미지황환이 치주조직의 재생에 중요한 골모유사세포(Osteoblast-Like Cell Line)의 활성도를 유의하게 증가시켰다고 보고했는데86), 이는 치아 병증과 신허(腎虛)의 연관성을 보여준 결과라 할 수 있다.
특히 노화는 치아 재생능력의 감퇴, 염증 반응의 증가, 면역력 저하로 인한 구강 감염 증가 등을 유발하여 치아 손상을 일으키며, 충치, 치주염, 치아 골절 등은 치아의 노화로 인해 생기는 대표적인 치과 질환이다51).
마찬가지로, 과로로 인한 수면 시간의 부족은 전신 염증과 산화 스트레스를 유발하여 면역 체계를 변화시키고 구강 환경을 세균 감염에 취약한 환경으로 만들 수 있다87,88). 선행 연구에서는 수면 시간 감소 시 치주염 유병률이 높아진다는 결과가 있었다88-90).
육체적 과로 뿐만 아니라 정신적 스트레스 역시 산화 스트레스를 증가시켜 치주염의 발생률을 높인다91). 또한 정신적 스트레스는 장내 미생물 군집을 변화시켜 전신적인 면역 기능을 저하시키고92), 스트레스 관련 호르몬인 코티솔(Cortisol)의 방출을 높여 면역 반응을 억제함으로써 구강 감염을 증가시킨다93).
또한, 한의학에서는 신(腎)이 치아를 포함한 소아의 성장에 매우 큰 영향을 미친다고 파악하였다. 성장에는 성장호르몬 뿐만 아니라 갑상선호르몬, 부신피질호르몬, 성호르몬이 중요한데, 이 호르몬들은 뇌하수체에서 직접 생성되거나, 뇌하수체에서 분비된 자극 호르몬에 의해 만들어진다94). 황제내경(黃帝內經)에서 “腎生骨髓”, “諸髓者 皆屬於腦”라 하여 신(腎)은 골수를 만들고, 골수는 뇌에 속한다고 언급하여18) 신(腎)과 뇌 사이의 연관성이 있음을 설명하고 있으므로4), 성장에 영향을 미치는 뇌하수체는 신(腎)기능에 포함된다고 볼 수 있다94). 성장 호르몬이 결핍된 저신장 소아가 성장 호르몬 결핍 없이 키가 작은 소아에 비해 치아 발육이 더욱 지연되었다는 연구 결과95)가 있으며, 만성신장질환(CKD)이 있는 소아에게서 성장호르몬(Growth Hormone, GH) 분비 속도가 감소하여 성장 지연이 나타났다고 보고된 바 있어96), 치아의 발달에 신기능의 절대적인 영향을 뒷받침한다(Fig. 2).
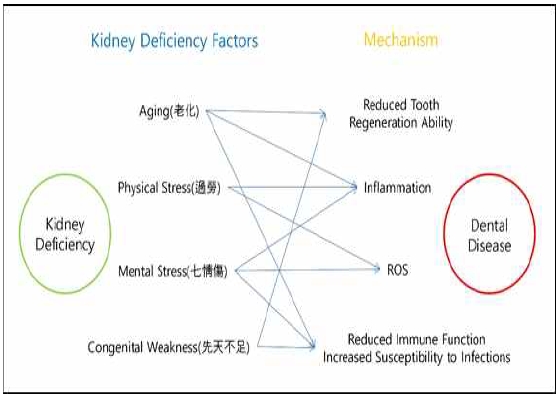
The Connection Between Kidney Deficiency and Dental Disease. In traditional Korean medicine, factors that weaken the kidneys—such as aging, physical overexertion, mental stress, and congenital weakness—can lead to dental diseases by decreasing tooth regeneration, increasing inflammation, elevating oxidative stress, and impairing immune function.
고 찰
본 연구에서는 뼈와 치아의 생리, 병리 현상에 있어 신장의 역할에 대해서 한의학과 생의학의 설명을 비교하여 신장과의 관계를 알아보고자 하였다. 한의학에서는 신(腎)이 뼈와 치아의 발달에 중요한 역할을 한다고 보았으며, 뼈의 건강을 주관한다는 신주골(腎主骨), 치아의 건강을 주관한다는 신주치(腎主齒)라는 개념으로 설명하고 있다. 뼈 대사에서 비타민 D와 성호르몬의 역할이 중요한데, 비타민 D는 신장(Kidney)에서 활성화되어27) 혈중 칼슘 흡수를 돕고23), 성호르몬은 뼈의 흡수와 형성을 조절한다25). 성호르몬의 분비를 조절하는 HPG축8,37)은 한의학에서 신(腎)의 역할과 밀접하게 연관되어 있어, 신장이 뼈 대사에 긴밀히 관여한다는 것을 보여주며, 이는 한의학에서 말하는 신주골(腎主骨)의 개념으로 해석할 수 있다. 따라서 골절이나 골다공증과 같은 뼈 질환에 신(腎)을 보(補)하는 방법으로 한의학에서는 치료해왔다21,22). .
또한, 한의학에서 치아는 치자골지여(齒者骨之餘)라 하여 치아가 뼈의 일부분이라는 개념으로 설명하고 있다. 생의학에서도 치아와 뼈의 조직학적 성분55)과 파골세포와 레티노산의 대사64,65), 그리고 비타민 D의 활성화와 그 작용 등을 통해 치아와 뼈가 유사하다고 볼 수 있다. 뼈를 주관하는 신장(腎)이 그의 일부인 치아까지 주관한다는 신주치(腎主齒)의 개념은 신장(Kidney) 기능이 저하되어 치아 수가 감소하고 치주 질환이 증가하며11-15), 노화51), 과로87-90) 등의 원인으로 치아 질환의 발생률이 달라질 수 있다는 것으로 설명할 수 있다.
이처럼, 한의학과 생의학 모두 신장이 뼈와 치아의 건강을 유지하는 데 중요한 역할을 하고 있다고 파악하고 있음을 알 수 있다. 다만 한의학에서는 신(腎)이 정(精)을 매개로 뼈와 치아의 생장과 발육을 돕는다 하여 신기능계 내에서 뼈와 치아와의 관계성을 설명하고 있는데 비해, 생의학에서는 비타민 D와 파골세포의 대사 등에서 신장(Kidney)의 역할을 규명하며 뼈와 치아에 미치는 영향을 통해 그 관련성을 주목하게 되었다는 차이가 있다. 앞으로 많은 연구가 필요하겠으나 현재까지 발표된 신장과 뼈, 치아와의 관계에 대한 생의학적 연구 결과가 한의학에서 바라보는 신기능계 생리관과 일맥 상통한다는 점에서 의미가 크다고 할 수 있다.
선행 연구에서 신장과 뼈의 관계(腎主骨)에 대한 논의가 주를 이루었던 것과 달리, 본 연구에서는 신장과 뼈, 뼈와 치아, 신장과 치아의 연관성에 대해 한의학과 생의학의 개념과 설명을 비교하여 살펴보았다는 점에서 의의가 있다.
이전에도 신장(腎)과 치아의 연관성에 대한 연구는 존재했으나, 주로 경락을 활용해 설명47,48,50)하여 경락을 신장(Kidney)이나 치아와 같이 실재하는 요소에 대응시키는 방식이 다소 난해한 측면이 있었다. 그에 비해 본 연구는 경락을 배제하고 생리, 병리적 측면을 바탕으로 신장과 치아의 관계를 고찰하였다. 또한 본 연구를 통해 보신(補腎) 처방이 골모유사세포를 활성화시키고86) 골밀도를 높였다22,34)는 선행 연구 결과를 해석할 수 있다. 그러나, 신장과 치아의 관계를 충분히 설명하기에는 관련 연구가 부족하였으며, 현재에도 이와 관련된 연구가 진행되고 있어 명확한 관계를 설명할 수 없다는 한계가 존재한다. 특히, 한의학에서 뼈와 치아를 모두 신(腎)에 배속하여 밀접한 관계로 파악하고 있으므로, 실제 치아와 신(腎) 간의 관련성을 명확히 설명할 수 있는 연구가 진행될 필요가 있다.
그럼에도 불구하고 본 연구는 신장과 치아의 관계를 동서의학적으로 고찰한 첫번째 시도라는 점에서 그 의의가 있다고 할 수 있다. 이 연구에서는 한의학에서 신(腎)에 속하는 요소들이 생의학적으로도 신장(Kidney)과 직간접적인 관련이 있음을 보여주었으며, 이는 한의학의 오장(五臟) 기능계에 속하는 다른 기관들도 각 장부와 밀접한 연관성을 가지고 있다는 것을 생의학적으로 설명할 수 있는 가능성을 제시한다. 또한, 한의학적 개념이나 이론과 유사한 생의학적 설명을 비교함으로써, 동서의학의 통합적 이해를 시도하였으며, 이러한 접근은 궁극적으로 두 학문의 생리, 병리 이론을 호환 가능하게 할 수 있을 것이다. 따라서 본 연구는 동서의학의 융합 연구와 임상 활용에 있어서 중요한 기초 자료가 될 것으로 기대한다.
결 론
본 연구는 한의학과 생의학의 생리, 병리적 설명을 비교함으로써 신장과 뼈, 치아의 관계성을 명확히 하였다. 아울러 다소 모호하게 이해될 수 있는 한의학의 이론 체계가 생의학으로도 설명될 수 있음을 보이며, 더욱 활발한 연구를 통한 한의학의 현대적 해석 및 적용을 제언하였다.
이와 같은 연구 결과를 통하여 두 의학 체계를 기반으로 한 신장, 뼈, 치아 질환의 새로운 접근을 시도할 수 있을 것이고 나아가 동서의학의 통합적 이해와 융합 연구에 기여할 것으로 기대한다.
Acknowledgments
본 연구의 진행에 있어 도움을 준 대전대학교 한의과대학 김찬 학생에게 고마움을 전한다.
References
-
Kim Y, Kim J, Cho D. Gender Difference in Osteoporosis Prevalence, Awareness and Treatment: Based on the Korea National Health and Nutrition Examination Survey 2008~2011. JKAN. 2015;45(2):293-305.
[https://doi.org/10.4040/jkan.2015.45.2.293]

-
Han DH, Lee HJ, Lim S. Smoking induced heavy metals and periodontitis: findings from the Korea National Health and Nutrition Examination Surveys 2008–2010. Journal of Clinical Periodontology. 2013;40(9):850-8.
[https://doi.org/10.1111/jcpe.12133]

- KDCA. 2022 Korea National Health and Nutrition Examination Survey(KNHANES) Division of Health and Nutrition Survey Analysis, Bureau of Chronic Disease Prevention, Korea Disease Control and Prevention Agency (KDCA); 2023.
- Schools NPPoKM. Physiology of Korean Medicine. Jipmoondang: DG Lim; 2016.
- Park J, Han Y. A Study on the relationship between Shin(腎) with Thyroid. JIKM. 1997;18(2):305-31.
-
Park MS, Cho J, Hur W, Yoo H. A Review on “Kidney” Functional System in Korean Medicine : From the Perspective of Molecular Physiology. Journal of Physiology & Pathology in Korean Medicine. 2022;36(5):169-74.
[https://doi.org/10.15188/kjopp.2022.10.36.5.169]

-
Ju D, Liu M, Zhao H, Wang J. Mechanisms of “kidney governing bones” theory in traditional Chinese medicine. Frontiers of Medicine. 2014;8(3):389-93.
[https://doi.org/10.1007/s11684-014-0362-y]

-
Zhu H, Liu Q, Li W, Huang S, Zhang B, Wang Y. Biological Deciphering of the "Kidney Governing Bones" Theory in Traditional Chinese Medicine. Evid Based Complement Alternat Med. 2022;2022:1685052.
[https://doi.org/10.1155/2022/1685052]

-
Lee H, Oh M. Effects of Jeopgolsan (JGS) Extract on Fracture Healing. JKM. 2018;28(1).
[https://doi.org/10.18325/jkmr.2018.28.1.1]

- Kwak I, Yoon C, Jung J. A Literature Study of the Teeth. JIKM. 1995;16(2):146-77.
-
Kim N-Y, Kim J-E, Choi C-H, Chung K-H. Association between chronic kidney disease and tooth loss in elderly Koreans: The Korea National Health and Nutrition Examination Survey 2016-2018. Journal of Korean Academy of Oral Health. 2023;47(4):202-6.
[https://doi.org/10.11149/jkaoh.2023.47.4.202]

-
Lee E-S, Do K-Y. Relationship between Periodontal Disease and Chronic Kidney Disease: A Systematic Review of Cohort Studies. Journal of Dental Hygiene Science. 2017;17(2):160-7.
[https://doi.org/10.17135/jdhs.2017.17.2.160]

-
Shin HS. Number of existing permanent teeth is associated with chronic kidney disease in the elderly Korean population. Korean J Intern Med. 2018;33(6):1150-9.
[https://doi.org/10.3904/kjim.2016.386]

-
Choi HM, Han K, Park YG, Park JB. Associations between the number of natural teeth and renal dysfunction. Medicine (Baltimore). 2016;95(34):e4681.
[https://doi.org/10.1097/MD.0000000000004681]

-
Fisher MA, Taylor GW. A prediction model for chronic kidney disease includes periodontal disease. J Periodontol. 2009;80(1):16-23.
[https://doi.org/10.1902/jop.2009.080226]

-
Moe S, Drüeke T, Cunningham J, Goodman W, Martin K, Olgaard K, et al. Definition, evaluation, and classification of renal osteodystrophy: A position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney International. 2006;69(11):1945-53.
[https://doi.org/10.1038/sj.ki.5000414]

-
Kwon YJ. Osteoporosis in Patients with Chronic Kidney Disease. The Korean Journal of Medicine. 2020;95(2):89-94.
[https://doi.org/10.3904/kjm.2020.95.2.89]

- MEDICLASSICS [internet]. Korea Institute of Oriental Medicine. [2014] [cited 2024 October 30]. Available from: https://www.mediclassics.kr/, .
-
Kim JYM. Diagnosis of Osteoporosis. KHS. 2011;23(2):108-15.
[https://doi.org/10.5371/jkhs.2011.23.2.108]

- Choi BH, Kim SM. Report on the Crosstabulation Analysis about Bone Mineral Density Test of Workers. JPPKM. 2009;23(6):1508-12.
- Kang S, Park Y, Ahn H. The bibliographical studies on the acupuncture treatment of the osteoporosis. The Journal of Korean Acupuncture & Moxibustion Society. 1995;15(2):171-89.
-
Won J, Han D, Nam S, Kil B, Kim D. Effect of Herbal Medicine on Osteoporosis: A Review of Animal Experiment, Clinical Studies Published in Korea and Overseas. JKM. 2021;31(3).
[https://doi.org/10.18325/jkmr.2021.31.3.31]

-
Christakos S, Dhawan P, Verstuyf A, Verlinden L, Carmeliet G. Vitamin D: Metabolism, Molecular Mechanism of Action, and Pleiotropic Effects. Physiol Rev. 2016;96(1):365-408.
[https://doi.org/10.1152/physrev.00014.2015]

-
Ralston SH. Bone structure and metabolism. Medicine. 2009;37(9):469-74.
[https://doi.org/10.1016/j.mpmed.2009.06.014]

-
Kousteni S, Bellido T, Plotkin LI, O'Brien CA, Bodenner DL, Han L, et al. Nongenotropic, Sex-Nonspecific Signaling through the Estrogen or Androgen Receptors: Dissociation from Transcriptional Activity. Cell. 2001;104(5):719-30.
[https://doi.org/10.1016/S0092-8674(01)00268-9]

-
Sibilia V, Bottai D, Maggi R, Pagani F, Chiaramonte R, Giannandrea D, et al. Sex Steroid Regulation of Oxidative Stress in Bone Cells: An In Vitro Study. International Journal of Environmental Research and Public Health. 2021;18(22):12168.
[https://doi.org/10.3390/ijerph182212168]

-
DeLuca HF. Overview of general physiologic features and functions of vitamin D. Am J Clin Nutr. 2004;80(6 Suppl):1689S-96S.
[https://doi.org/10.1093/ajcn/80.6.1689S]

-
Bland R, Walker EA, Hughes SV, Stewart PM, Hewison M. Constitutive expression of 25-hydroxyvitamin D3-1alpha-hydroxylase in a transformed human proximal tubule cell line: evidence for direct regulation of vitamin D metabolism by calcium. Endocrinology. 1999;140(5):2027-34.
[https://doi.org/10.1210/endo.140.5.6683]

-
Moe SM, Drueke TB. Management of secondary hyperparathyroidism: the importance and the challenge of controlling parathyroid hormone levels without elevating calcium, phosphorus, and calcium-phosphorus product. Am J Nephrol. 2003;23(6):369-79.
[https://doi.org/10.1159/000073945]

-
Naylor KL, McArthur E, Leslie WD, Fraser L-A, Jamal SA, Cadarette SM, et al. The three-year incidence of fracture in chronic kidney disease. Kidney International. 2014;86(4):810-8.
[https://doi.org/10.1038/ki.2013.547]

-
Nickolas TL, McMahon DJ, Shane E. Relationship between moderate to severe kidney disease and hip fracture in the United States. J Am Soc Nephrol. 2006;17(11):3223-32.
[https://doi.org/10.1681/ASN.2005111194]

-
Cummings SR, Browner WS, Bauer D, Stone K, Ensrud K, Jamal S, et al. Endogenous Hormones and the Risk of Hip and Vertebral Fractures among Older Women. New England Journal of Medicine. 1998;339(11):733-8.
[https://doi.org/10.1056/NEJM199809103391104]

-
Lips P, Netelenbos JC, Jongen MJM, van Ginkel FC, Althuis AL, van Schaik CL, et al. Histomorphometric profile and vitamin d status in patients with femoral neck fracture. Metabolic Bone Disease and Related Research. 1982;4(2):85-93.
[https://doi.org/10.1016/0221-8747(82)90021-2]

-
Won J, Choi Y, Lee B, Lee H. Improvement of Low Bone Mineral Density Treated with Jeopgol-tang in a Middle-Aged Man: A Case Report. JKM. 2021;42(2):90-7.
[https://doi.org/10.13048/jkm.21018]

-
Kim Y, Kang J, Kwak K, Lee H. Observation of Correlation between Deficiency Syndrome of Kidney and Bone Mineral Density in Osteoporosis Patients. Korean Journal of Acupuncture. 2014;31(3):99-107.
[https://doi.org/10.14406/acu.2014.019]

- Choi H, Choi J. Diagrammatic Representation of Pathophysiology in Korean Medicine. Jipmoondang: DG Lim; 2014.
-
Peper JS, Brouwer RM, van Leeuwen M, Schnack HG, Boomsma DI, Kahn RS, et al. HPG-axis hormones during puberty: a study on the association with hypothalamic and pituitary volumes. Psychoneuroendocrinology. 2010;35(1):133-40.
[https://doi.org/10.1016/j.psyneuen.2009.05.025]

-
Cauley JA. Estrogen and bone health in men and women. Steroids. 2015;99(Pt A):11-5.
[https://doi.org/10.1016/j.steroids.2014.12.010]

-
Leder BZ, LeBlanc KM, Schoenfeld DA, Eastell R, Finkelstein JS. Differential Effects of Androgens and Estrogens on Bone Turnover in Normal Men. The Journal of Clinical Endocrinology & Metabolism. 2003;88(1):204-10.
[https://doi.org/10.1210/jc.2002-021036]

-
Pederson L, Kremer M, Judd J, Pascoe D, Spelsberg TC, Riggs BL, et al. Androgens regulate bone resorption activity of isolated osteoclasts in vitro. Proceedings of the National Academy of Sciences. 1999;96(2):505-10.
[https://doi.org/10.1073/pnas.96.2.505]

-
Wehbeh L, Dobs AS. Opioids and the Hypothalamic-Pituitary-Gonadal (HPG) Axis. J Clin Endocrinol Metab. 2020;105(9).
[https://doi.org/10.1210/clinem/dgaa417]

-
Antony T, Alzaharani SY, El-Ghaiesh SH. Opioid-induced hypogonadism: Pathophysiology, clinical and therapeutics review. Clin Exp Pharmacol Physiol. 2020;47(5):741-50.
[https://doi.org/10.1111/1440-1681.13246]

-
Gotthardt F, Huber C, Thierfelder C, Grize L, Kraenzlin M, Scheidegger C, et al. Bone mineral density and its determinants in men with opioid dependence. J Bone Miner Metab. 2017;35(1):99-107.
[https://doi.org/10.1007/s00774-015-0732-9]

-
Dwyer AA, Quinton R. Anatomy and physiology of the hypothalamic-pituitary-gonadal (HPG) axis. Advanced Practice in Endocrinology Nursing. 2019:839-52.
[https://doi.org/10.1007/978-3-319-99817-6_43]

- Kim E, Seong W, Song K. Syudy on Chungye Relavant to Menstration Starting and Pause Compared by Oriental and Western Medicine. JKOM. 1996;17(2).
- Wang M, Cha N. An approach of Eastern Nursing Science for Regimen on the Oldman. EWNRI. 2002;7(1):7-17.
- Shin S, Kim J. An Integrative Understanding of Two Views on Teeth - Focusing on Relation between Kidney and Yangming. JKMC. 2019;32(1):117-31.
-
Kim S-Y, Oh J, Hong J, Park SK, Park H-J. A Comparison Study of Acupuncture Points Selection between Classics of Traditional Medicine and Clinical Trials in Dental Disorders. Korean Journal of Acupuncture. 2013;30(4):201-11.
[https://doi.org/10.14406/acu.2013.043]

- Kwak I, Un C, Jenog J. A Literature Review on Teeth. JIKM. 1995;16(2):146-77.
- Park B, Lee E. A Study on Clinical treatments of Oriental Medicine for dental diseases. JKMR. 1998;8(2):297-314.
- Xie Y, Chen S, Sheng L, Sun Y, Liu S. A New Landscape of Human Dental Aging: Causes, Consequences, and Intervention Avenues. Aging Dis. 2023;14(4):1123-44.
- Walker WB. The Oral Cavity and Associated Structures. In: Walker HK, Hall WD, Hurst JW, editors. Clinical Methods: The History, Physical, and Laboratory Examinations. Boston: Butterworths Copyright © 1990, Butterworth Publishers, a division of Reed Publishing.; 1990.
-
Goldberg M, Kulkarni AB, Young M, Boskey A. Dentin: Structure, Composition and Mineralization: The role of dentin ECM in dentin formation and mineralization. Frontiers in bioscience (Elite edition).3:711.
[https://doi.org/10.2741/e281]

-
Tjäderhane L, Carrilho MR, Breschi L, Tay FR, Pashley DH. Dentin basic structure and composition—an overview. Endodontic Topics. 2009;20(1):3-29.
[https://doi.org/10.1111/j.1601-1546.2012.00269.x]

-
Murata M. Collagen biology for bone regenerative surgery. jkaoms. 2012;38(6):321-5.
[https://doi.org/10.5125/jkaoms.2012.38.6.321]

- Kim Y, Um I. Autogenous tooth bone graft material. JDIR. 2014;33(1):12-7.
-
Gama A, Navet B, Vargas JW, Castaneda B, Lézot F. Bone resorption: an actor of dental and periodontal development? Frontiers in Physiology. 2015;6:319.
[https://doi.org/10.3389/fphys.2015.00319]

-
Walsh MC, Choi Y. Biology of the RANKL–RANK–OPG system in immunity, bone, and beyond. Frontiers in immunology. 2014;5:511.
[https://doi.org/10.3389/fimmu.2014.00511]

-
Lin J, Callon K, Lin C, Bava U, Zheng M, Reid I, et al. Alteration of bone cell function by RANKL and OPG in different in vitro models. European journal of clinical investigation. 2007;37(5):407-15.
[https://doi.org/10.1111/j.1365-2362.2007.01800.x]

-
Kim M, Kim H, Kim I, Kim S. Expression of RANKL and OPG in the Developing Teeth of the Postnatal Rat. ABA. 2005;18(3):207-15.
[https://doi.org/10.11637/kjpa.2005.18.3.207]

-
Dobnig H, Hofbauer L, Viereck V, Obermayer-Pietsch B, Fahrleitner-Pammer A. Changes in the RANK ligand/osteoprotegerin system are correlated to changes in bone mineral density in bisphosphonate-treated osteoporotic patients. Osteoporosis international. 2006;17:693-703.
[https://doi.org/10.1007/s00198-005-0035-4]

- Choi H. Mode of Action of Bisphosphonates and Clinical Implication. OSTEOPOROSIS. 2008;6(2):63-70.
-
Kim H, Chung J, Kim S. Bisphosphonate and the Eruption of Developing Teeth: Its Effects and Mechanism. ABA. 2006;19(1):73-83.
[https://doi.org/10.11637/kjpa.2006.19.1.73]

-
Hu L, Lind T, Sundqvist A, Jacobson A, Melhus H. Retinoic acid increases proliferation of human osteoclast progenitors and inhibits RANKL-stimulated osteoclast differentiation by suppressing RANK. PloS one. 2010;5(10):e13305.
[https://doi.org/10.1371/journal.pone.0013305]

-
Berkovitz B, Maden M. The distribution of cellular retinoic acid-binding protein I (CRABPI) and cellular retinol-binding protein I (CRBPI) during molar tooth development and eruption in the rat. Connective tissue research. 1995;32(1-4):191-9.
[https://doi.org/10.3109/03008209509013723]

-
Kim J, Cho S. Aldh1a2 is a maker of dental follicle in tooth germs at cap stage. KJOA. 2016;37(1):37-42.
[https://doi.org/10.35607/kjoa.37.1.201612.005]

-
Liu J, Huang F, He HW. Melatonin effects on hard tissues: bone and tooth. Int J Mol Sci. 2013;14(5):10063-74.
[https://doi.org/10.3390/ijms140510063]

-
Roth JA, Kim BG, Lin WL, Cho MI. Melatonin promotes osteoblast differentiation and bone formation. J Biol Chem. 1999;274(31):22041-7.
[https://doi.org/10.1074/jbc.274.31.22041]

-
MacDonald IJ, Tsai HC, Chang AC, Huang CC, Yang SF, Tang CH. Melatonin Inhibits Osteoclastogenesis and Osteolytic Bone Metastasis: Implications for Osteoporosis. Int J Mol Sci. 2021;22(17).
[https://doi.org/10.3390/ijms22179435]

-
Ladizesky MG, Boggio V, Albornoz LE, Castrillón PO, Mautalen C, Cardinali DP. Melatonin increases oestradiol-induced bone formation in ovariectomized rats. J Pineal Res. 2003;34(2):143-51.
[https://doi.org/10.1034/j.1600-079X.2003.00021.x]

-
Kumasaka S, Shimozuma M, Kawamoto T, Mishima K, Tokuyama R, Kamiya Y, et al. Possible involvement of melatonin in tooth development: expression of melatonin 1a receptor in human and mouse tooth germs. Histochemistry and Cell Biology. 2010;133(5):577-84.
[https://doi.org/10.1007/s00418-010-0698-6]

-
Ohtsuka-Isoya M, Hayashi H, Shinoda H. Effect of suprachiasmatic nucleus lesion on circadian dentin increment in rats. Am J Physiol Regul Integr Comp Physiol. 2001;280(5):R1364-70.
[https://doi.org/10.1152/ajpregu.2001.280.5.R1364]

-
Klejna K, Naumnik B, Gasowska K, Myśliwiec M. OPG/RANK/RANKL signaling system and its significance in nephrology. Folia Histochem Cytobiol. 2009;47(2):199-206.
[https://doi.org/10.2478/v10042-009-0035-x]

-
Uwitonze AM, Murererehe J, Ineza MC, Harelimana EI, Nsabimana U, Uwambaye P, et al. Effects of vitamin D status on oral health. The Journal of Steroid Biochemistry and Molecular Biology. 2018;175:190-4.
[https://doi.org/10.1016/j.jsbmb.2017.01.020]

-
Youssef DA, Miller CWT, El-Abbassi AM, Cutchins DC, Cutchins C, Grant WB, et al. Antimicrobial implications of vitamin D. Dermato-Endocrinology. 2011;3(4):220-9.
[https://doi.org/10.4161/derm.3.4.15027]

-
Dietrich T, Nunn M, Dawson-Hughes B, Bischoff-Ferrari HA. Association between serum concentrations of 25-hydroxyvitamin D and gingival inflammation2. The American Journal of Clinical Nutrition. 2005;82(3):575-80.
[https://doi.org/10.1093/ajcn/82.3.575]

-
Hussein AS, Rosli RA, Ramle RS, Khor GH. The impact of vitamin D deficiency on caries, periodontitis, and oral cancer: A systematic review. The Saudi Dental Journal. 2024;36(7):970-9.
[https://doi.org/10.1016/j.sdentj.2024.04.012]

-
Chen A, Liu Y, Lu Y, Lee K, He JC. Disparate roles of retinoid acid signaling molecules in kidney disease. American Journal of Physiology-Renal Physiology. 2021;320(5):F683-F92.
[https://doi.org/10.1152/ajprenal.00045.2021]

-
Henze A, Frey SK, Raila J, Tepel M, Scholze A, Pfeiffer AF, et al. Evidence that kidney function but not type 2 diabetes determines retinol-binding protein 4 serum levels. Diabetes. 2008;57(12):3323-6.
[https://doi.org/10.2337/db08-0866]

-
Penniston KL, Tanumihardjo SA. The acute and chronic toxic effects of vitamin A1234. The American Journal of Clinical Nutrition. 2006;83(2):191-201.
[https://doi.org/10.1093/ajcn/83.2.191]

-
Yadav AS, Isoherranen N, Rubinow KB. Vitamin A homeostasis and cardiometabolic disease in humans: lost in translation? Journal of Molecular Endocrinology. 2022;69(3):R95-R108.
[https://doi.org/10.1530/JME-22-0078]

- Textbooks TCftCoKMP. Korean Medical Pathology. Hanui Munhwasa: JB Kim; 2020.
-
Beck JD, Slade G, Offenbacher S. Oral disease, cardiovascular disease and systemic inflammation. Periodontology 2000. 2000;23(1).
[https://doi.org/10.1034/j.1600-0757.2000.2230111.x]

-
Ebersole JL, Cappelli D. Acute-phase reactants in infections and inflammatory diseases. Periodontology 2000. 2000;23(1).
[https://doi.org/10.1034/j.1600-0757.2000.2230103.x]

-
Sharma P, Fenton A, Dias IH, Heaton B, Brown CL, Sidhu A, et al. Oxidative stress links periodontal inflammation and renal function. Journal of Clinical Periodontology. 2021;48(3):357-67.
[https://doi.org/10.1111/jcpe.13414]

- Kim C, Ahn Y, Ahn S, Doo H. The Effects of Palmijihwang-hwan (Baweidehuang-wan) and Obaeja (Galla Rhois) on Proliferation Activity of Alkaline Phosphatase and the Synthetic Ability of Protein in Osteoblast-like Cell Lines and Periodontal Ligament Fibroblasts. JKM. 2003;24(3):35-44.
-
Carra MC, Schmitt A, Thomas F, Danchin N, Pannier B, Bouchard P. Sleep disorders and oral health: a cross-sectional study. Clinical oral investigations. 2017;21:975-83.
[https://doi.org/10.1007/s00784-016-1851-y]

-
Romandini M, Gioco G, Perfetti G, Deli G, Staderini E, Laforì A. The association between periodontitis and sleep duration. Journal of clinical periodontology. 2017;44(5):490-501.
[https://doi.org/10.1111/jcpe.12713]

-
Han DH, Kim MS, Kim S, Yoo JW, Shen JJ. Sleep time and duration are associated with periodontitis in a representative sample of Koreans. Journal of Periodontology. 2022;93(2):210-9.
[https://doi.org/10.1002/JPER.20-0252]

-
Alqaderi H, Goodson JM, Agaku I. Association between sleep and severe periodontitis in a nationally representative adult US population. Journal of periodontology. 2020;91(6):767-74.
[https://doi.org/10.1002/JPER.19-0105]

-
D’aiuto F, Nibali L, Parkar M, Patel K, Suvan J, Donos N. Oxidative stress, systemic inflammation, and severe periodontitis. Journal of dental research. 2010;89(11):1241-6.
[https://doi.org/10.1177/0022034510375830]

- Chang H, Perkins MH, Novaes LS, Qian F, Zhang T, Neckel PH, et al. Stress-sensitive neural circuits change the gut microbiome via duodenal glands. Cell.
-
Goyal S, Gupta G, Thomas B, Bhat KM, Bhat GS. Stress and periodontal disease: The link and logic!! Ind Psychiatry J. 2013;22(1):4-11.
[https://doi.org/10.4103/0972-6748.123585]

- Jeon C. Study of Growth Disturbance and Endocrine, in the view of Oriental Medicine. JKPM. 2001;15(1):105-15.
- Son H, Kang S, Lee H. An Convergence Analysis of the Effect of Growth Hormone Deficiency on the Development of Teeth in short stature Children. Journal of the Korea Convergence Society. 2021;12(6):39-47.
-
Mahesh S, Kaskel F. Growth hormone axis in chronic kidney disease. Pediatric Nephrology. 2008;23(1):41-8.
[https://doi.org/10.1007/s00467-007-0527-x]
