대식세포 분화 조절을 통한 대시호탕의 암세포 전이 억제 효과
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
The aim of this study was to investigate the role of Daesiho-tang (Da Chai Hu-Tang) water extract (DSTE) in regulating chronic stress-induced cancer progression, focusing on its activity in modulating tumor-associated macrophages (TAMs). Different stimuli can polarize TAMs into immune-stimulating M1 macrophages or immunosuppressive M2 macrophages. During cancer progression, M2 phenotype increases and supports tumor growth, angiogenesis and metastasis. Notably, chronic stress-induced catecholamines promote M2 macrophage polarization. In this study, we investigated whether DSTE regulates norepinephrine (NE)-induced M2 macrophage polarization in RAW 264.7 mouse macrophage cells. Even though NE itself did not increase the expression of M2 markers, the conditioned media of NE-treated 4T1 mouse breast cancer cells (NE CM) significantly up-regulated M2 markers in RAW 264.7 cells, suggesting that NE-regulated cancer cell secretome stimulated M2 polarization. However, such increase was abrogated by DSTE. NE CM also induced phosphorylation of signal transducer and activator of transcription 6 (STAT6) in RAW 264.7 cells, which was clearly reversed by pretreatment with DSTE, demonstrating that DSTE inhibited M2 polarization by inactivating STAT6. Finally, M2-polarized RAW264.7 cells by NE CM markedly increased the migration of 4T1 cells. However, such increase was completely reversed by co-treating RAW264.7 cells with NE CM and DSTE, indicating that DSTE attenuated cancer cell migration by blocking M2 polarization. Taken together, our results suggest a probable use of DSTE for cancer patients under chronic stress by regulating M2 macrophage polarization.
Keywords:
Daesiho-tang, Chronic stress, Norepinephrine, M2 macrophage, Cancer서 론
종양미세환경은 종양침윤면역세포(infiltrating immune cell)를 포함하여 종양연관섬유아세포(cancer associated fiboblast), 혈관내피세포(endothelial cell), 세포외기질(extracellular matrix)과 같은 다양한 비종양세포로 구성되어 있다1). 종양침윤면역세포 중 가장 많은 비율을 차지하고 있는 것은 바로 대식세포로서 이들을 종양연관대식세포(tumor-associated macrophage, TAM)라고 부른다2). TAM은 종양미세환경에서 분비되는 다양한 자극인자에 따라 M1형과 M2형으로 분화할 수 있다2). M1형 대식세포는 박테리아 분비물이나 인터페론 감마(interferon-γ)와 같은 인자에 의해 염증반응을 일으켜 암세포를 사멸시키는 전형적인 역할을 수행하며, 이를 통해 항암작용을 가지는 것으로 알려져 있다2,3). 반면 M2형 대식세포는 인터루킨(interleukin, IL)-4, -13, 형질전환생장인자(transforming growth factor-β, TGF-β)와 같은 인자에 의해 분화되어 항염증 사이토카인을 분비함으로써 면역세포에 의한 암세포 사멸을 억제하는 역할을 한다. 또한 혈관내피성장인자(vascular endothelial growth factor, VEGF) 등을 분비하여 혈관신생을 도움으로써 종양의 성장과 전이를 촉진하는 것으로 알려져 있다2,3). 따라서 암세포를 직접적으로 타겟팅하는 대신 TAM의 M2형 분극을 조절하는 전략이 새로운 항암전략으로 제안되고 있다. 실제로 여러 전임상 연구에서 TAM을 억제하거나 M2형 TAM을 M1형으로 재분극시키는 것이 항암효과를 가짐이 보고되어 있다4,5).
스트레스는 발암 및 암의 진행을 촉진시키는 주요 인자이다6). 인체는 만성적인 스트레스에 노출 시 교감신경계가 항진되어 교감신경섬유 말단이나 부신수질에서 에피네프린(epinephrine), 노르에피네프린(epinephrine)과 같은 카테콜아민을 분비한다7). 이들 카테콜아민은 아드레날린 수용체(adrenergic receptor, AR)를 통해 신호를 전달하는데, 특히 β-AR은 다양한 암종에서 과발현되어 있으며, 암의 불량한 예후와 밀접하게 연관되어 있다8). β-AR 억제제는 임상적으로 암의 전이를 억제하며 예후를 개선시키는 것으로 알려져 있어 β-AR 억제제를 암치료에 활용하려는 전략이 시도되고 있다9-11). β-AR 신호전달경로의 활성화는 암세포 자체를 조절하여 증식신호를 활성화하고, 세포사멸에 저항하도록 하며, 상피간엽이행(epithelial-mesenchymal transition)과 같이 암세포를 전이에 용이한 형태로 변화시키기도 하지만, 종양미세환경을 구성하는 여러 기질세포에도 발현하므로 이들을 보다 폭넓게 조절할 수 있다8). 흥미롭게도 대식세포에 β-AR 신호전달경로가 활성화되면 염증성 유전자들의 발현이 감소하고 항염증성 유전자들의 발현이 증가하는 것으로 알려져 있다12). 이는 스트레스에 의해 대식세포가 M2형으로 분화함을 의미한다13,14). M2형 대식세포는 암을 악화시키는 역할을 하므로 스트레스로 인한 암의 촉진을 억제하기 위해서 대식세포의 M2형 분극을 조절하는 전략이 필요하다.
대시호탕(大柴胡湯)은 『상한론(傷寒論)』에 등장하는 처방으로 시호(柴胡), 황금(黃芩), 작약(芍藥), 반하(半夏), 지실(枳實), 대황(大黃), 대조(大棗), 생강(生薑)의 총 8가지 본초(本草)로 구성되어 있다15). 대시호탕은 소양(少陽)을 화해(和解)하고 앙명열(陽明熱)을 사(瀉)하는 효능이 있어 전통적으로 흉협고만(胸脇苦滿), 한열왕래(寒熱往來), 구토, 심하비경(心下痞硬), 변비 등을 목표로 사용하였다15). 최근 대시호탕의 약리학적 효능으로서 혈압강하 효과16), 간보호 효과17), 항당뇨 효과18), 항비만 효과19,20) 등 만성생활습관병에 대한 개선효과가 보고되어 있다. 흥미롭게도 임21)은 대시호탕이 간암의 발생과 진행을 억제하는 효과가 있음을 보고하여 대시호탕의 항암효과를 제안하였다. 그러나 현재까지 대시호탕이 TAM 조절에 미치는 영향은 전혀 연구된 바가 없다. 본 연구에서는 대시호탕이 스트레스성 카테콜아민인 NE에 의해 유도된 대식세포의 M2형 분극을 억제할 수 있는지, 이를 통해 암세포의 전이를 조절할 수 있는지 조사하여 유의한 결과를 얻었기에 보고하는 바이다.
재료 및 방법
1. 시료 제조
대시호탕을 구성하는 8개 본초는 모두 ㈜본초마루(Seoul, Korea)에서 구입하였다. 대시호탕의 구성은 Table 1과 같다. 먼저 대시호탕 1첩에 증류수 1L를 가한 후 대웅약탕기(DW290; Daewoong Bio Electronics Co., Ltd., Chungcheongbuk-do, Korea)로 3시간 동안 전탕하여 여과 후 감압농축 및 동결건조하였다. 그 결과 얻어진 9.53 g의 분말(수율 14.4%)을 3차 증류수에 100 ㎎/㎖로 녹인 후 사용하였으며, 이를 DSTE(Daesiho-tang water extract)라고 명명하였다.
2. 세포 배양
RAW 264.7 마우스 대식세포는 동의대학교 최영현 교수님으로부터 분양받았고, 4T1 마우스 유방암세포주는 한림대학교 김은지 교수님으로부터 분양받았다. RAW 264.7 세포와 4T1 세포 모두 DMEM (WelGENE, Seoul, Korea) 배지 500 ㎖에 fatal bovine serum (FBS; WelGENE) 50 ㎖과 antibiotics (WelGENE) 5 ㎖을 첨가하여 배양하였으며, 37℃, 5% CO2 조건에서 배양하였다.
3. MTT assay
96 well plate에 RAW 264.7 세포를 5×103개 분주한 후 overnight 안정화시키고 DSTE를 농도별(0, 10, 25, 50, 100 ㎍/㎖)로 처리한 후 24시간 동안 배양하였다. 그 다음 세포배양액에 MTT 시약(Duchefa, Haarlem, The Netherlands)을 0.4 ㎎/㎖ 농도로 첨가한 후 37℃에서 2시간 동안 반응시켰다. 그 다음 plate의 세포배양액을 제거하고 각 well당 dimethylsulfoxide (DMSO; Amresco, Solon, OH, USA)를 100 ㎕씩 넣어 바닥에 형성된 formazin을 용해시켰다. 흡광도는 microplate reader (Molecular Devices, Sunnyvale, CA, USA)를 사용하여 540 nm에서 측정하였으며, OD값을 기준으로 세포생존율을 계산하였다.
4. Reverse transcription-quantitative polymerase chain reaction (RT-qPCR)
RAW 264.7 세포를 6 well plate에 분주하여 overnight 안정화시킨 후 NE (Sigma‐Aldrich, St. Louis, MO, USA)를 다양한 농도(0, 0.1, 1, 10 μM)로 처리하였다. 혹은 4T1 세포에 NE를 다양한 농도(0, 0.1, 1, 10 μM)로 48시간 동안 처리한 후 세포배양액(conditioned medium, CM)을 모아(NE CM) RAW 264.7 세포에 처리하였다. 혹은 NE CM과 DSTE(0, 25, 50 ㎍/㎖)를 동시에 RAW 264.7 세포에 처리하였다. 상기한 방식으로 24시간 동안 배양한 RAW 264.7 세포를 TRIzol reagent (Invitrogen Co., Carlsbad, CA, USA)를 이용하여 RNA를 분리하였다. 1 μg RNA를 CellScript All-in-One 5X First Strand cDNA Synthesis Master Mix (CellSafe, Yongin, Korea)를 사용하여 cDNA로 합성한 후 nuclease-free water에 녹여 사용하였다. 먼저 타겟 유전자의 발현을 정성적으로 분석하기 위해 cDNA를 SimpliAmp Thermal Cycler (Applied Biosystems, Forster City, CA, USA)를 이용하여 증폭하였다. 사용된 primer sequence와 annealing temperature는 Table 2와 같다. PCR 산물은 nucleic acid staining solution (iNtRON Biotechnology, Seongnam, Korea)을 포함한 1.5% agarose gel (Lonza, Walkersville, MD, USA)에 로딩하여 electrophoresis 하였으며, Gel Imaging System (Daihan Scientific, Seoul, Korea)을 통해 발현을 확인하였다. Real-time PCR은 1:50으로 희석된 cDNA와 타겟유전자에 대한 primer (Table 1) 및 CYBR green (Enzynomics, Daejeon, Korea)을 혼합하여 CFX Connect Real-Time PCR Detection System (Bio-Rad Laboratories, Hercules, CA, USA)으로 분석하였다.
5. 웨스턴블롯
먼저 4T1 세포에 NE(0.1 μM)를 48시간 동안 처리한 후 세포배양액을 모았다(NE CM). 그 다음 RAW 264.7 세포를 6 well plate에 분주하여 overnight 안정화시킨 후 NE CM과 DSTE(0, 25, 50 ㎍/㎖)를 동시 처리하였다. 24시간 배양 후 세포를 하베스트하여 lysis buffer로 단백질을 분리하였다. Lysis buffer는 RIPA buffer (Thermo Fisher Scientific, San Jose, CA, USA)에 protease inhibitor cocktail (Thermo Fisher Scientific)과 phosphatase inhibitors (1 mM Na3VO4, 100 mM NaF)를 첨가하여 사용하였다. Bicinchoninic acid (BCA) protein assay kit (Pierce Biotechnology, Rockford, IL, USA)를 사용하여 단백질을 정량한 후 각 조건당 20 ㎍의 단백질을 SDS-PAGE로 분리 및 transfer하였다. 3% bovine serum albumin (BSA, GenDEPOT, TX, USA)으로 blocking 후 1차 항체(1:1000 희석)와 4℃에서 overnight 반응시켰다. 다음 날 Tris-buffered saline with 0.1% Tween 20 (TBST)로 수차례 세척하고 2차 항체(1:10000 희석)와 50분간 실온에서 반응시켰다. 다시 TBST로 수차례 세척하고 D-Plus ECL Femto System (Donginbio, Seoul, Korea)을 사용하여 단백질 발현을 확인하였다. Phosphorylated STAT6 항체는 Cell Signaling Technology (Beverly, MA, USA)에서 구입하였으며, total STAT6 항체와 actin 항체는 Santa Cruz Biotechnology Inc. (Santa Cruz, CA, USA)에서 구입하였다. Anti‑rabbit, anti-mouse 2차 항체는 Enzo Life Sciences (Farmingdale, NY, USA)에서 구입하였다.
6. Transwell migration assay
24 well transwell (8.0 ㎛ pore size; Corning, NY, USA)의 lower chamber에 RAW 264.7 세포를 분주하고 overnight 안정화시킨 후 상기한 방식으로 모은 NE CM과 DSTE (0, 25, 50 ㎍/㎖)를 동시 처리하여 24시간 배양하였다. 그 후 4T1 세포(4×105개)를 serum이 없는 배지 200 ㎕에 현탁하여 0.1% gelatin (Sciencell, Carlsbad, CA, USA)으로 코팅된 insert에 분주하고, lower chamber의 RAW 264.7 세포는 세포배양액을 제거하고 serum이 없는 DMEM 배지 500 ㎕으로 교체해주었다. 위와 같이 24시간 공배양 후 이동한 4T1 세포를 확인하기 위해 insert를 methanol로 고정하고 hematoxylin (Sigma‐Aldrich)으로 30분간 염색하였다. 그 후 현미경(Carl Zeiss, Oberkochen, Germany)으로 염색된 세포를 촬영하고(×100 배율) 계수하여 4T1 세포의 이동능을 평가하였다.
7. 통계 분석
모든 실험 결과는 평균(mean)±표준편차(SD)로 표시하였으며, Student’s t-test를 이용하여 P < 0.05인 것을 통계적으로 유의성 있다고 판단하였다.
결 과
1. 노르에피네프린(NE)이 대식세포의 M2형 분극에 미치는 영향
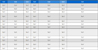
만성적 스트레스에 의해 종양 내 M2형 대식세포 비율이 증가한다는 기존 연구결과14)에 근거하여 RAW 264.7 마우스 대식세포에 스트레스성 카테콜아민인 NE를 농도별로 24시간 처리한 후 M2형 대식세포의 마커유전자인 CD206과 CD163의 발현22)을 RT-PCR로 확인하였다. Fig. 1A에 나타난 바와 같이 RAW 264.7 세포에 NE를 직접 처리하자 CD206과 CD163의 발현이 전혀 증가하지 않았다. 이는 NE가 대식세포의 M2형 분극에 직접적으로 영향을 미치지는 않음을 의미한다. 이러한 경향은 real-time PCR 결과에서도 동일하게 나타났다(Fig. 1B). NE가 대식세포의 분화를 직접적으로 조절하지 않는다면 종양미세환경 속 암세포에 영향을 미쳐서 대식세포의 M2형 분극을 일으키지 않을까 하는 가설을 세워 4T1 마우스 유방암세포에 NE를 농도별로 48시간 처리 후 세포배양액(NE CM)을 모아 RAW 264.7 세포에 처리하였다. 이때 대조군은 NE를 처리하지 않은 4T1 세포로부터 모은 CM (con CM)을 처리하였다(Fig. 1C). 그 결과 Fig. 1D에 나타난 바와 같이 con CM 처리군에 비해 NE CM 처리군에서 CD206과 CD163의 발현이 모두 증가하는 것을 확인하였다. 특히 NE를 0.1 μM로 처리한 CM이 1 μM이나 10 μM로 처리한 CM보다 더욱 현저하게 CD206과 CD163의 발현을 증가시키는 것을 확인할 수 있었다(Fig. 1C). 이러한 경향은 real-time PCR 결과에서도 비슷하게 나타났다(Fig. 1D). 이에 향후 실험은 4T1 세포에 NE를 0.1 μM으로 처리한 CM을 NE CM으로 지칭하여 사용하였다. 상기한 결과들은 NE가 대식세포의 분화를 직접적으로 조절하지는 않지만 암세포에서 분비되는 인자들을 조절함으로써 대식세포를 M2형으로 분화시킴을 의미하는 것이다.
Effects of NE CM on the expression of M2 macrophage markers in RAW 264.7 cells. (A and B) RAW 264.7 mouse macrophages were treated with NE (0.1-10 μM) for 24 h. The mRNA level of CD206 and CD163 was detected by RT-PCR (A) and real-time PCR (B). GAPDH was used as an internal control. (C-E) 4T1 mouse breast cancer cells were treated with NE (0.1-10 μM) for 48 h, and the conditioned medium was collected from 4T1 cells (NE CM). RAW 264.7 cells were treated with NE CM for 24 h. The experimental scheme is shown (C). The mRNA level of CD206 and CD163 was detected by RT-PCR (D) and real-time PCR (E). GAPDH was used as an internal control. The data are expressed as the mean ± SD of three independent experiments. Significance was determined by the Student’s t-test (ns, not significant; * P < 0.05, ** P < 0.01, *** P < 0.001 versus control cells). DSTE, Daesiho-tang water extract; NE, norepinephrine; NE CM, conditioned medium collected from NE-treated 4T1 cells.
2. 대식세포에 독성을 나타내지 않는 DSTE 농도 설정
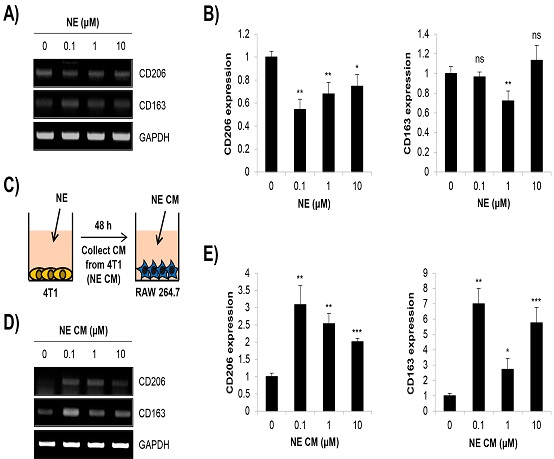
DSTE가 대식세포에 독성을 나타내지 않는 농도 조건을 설정하기 위하여 RAW 264.7 세포에 다양한 농도(0, 10, 25, 50, 100 ㎍/㎖)로 DSTE를 24시간 처리한 후 MTT assay를 시행하였다. 그 결과 DSTE 50 ㎍/㎖까지는 RAW 264.7 세포의 증식에 전혀 영향을 미치지 않는 것으로 나타났으며, DSTE 100 ㎍/㎖에서는 76.45±3.67%의 생존율을 보여 세포증식을 다소 억제하는 것으로 나타났다 (Fig. 2). 따라서 DSTE 50 ㎍/㎖을 최고농도로 설정하여 이후 실험을 진행하였다.
Effects of DSTE on the cell viability of RAW 264.7 cells. RAW 264.7 mouse macrophages were treated with DSTE for 24 h. The cell viability was measured by MTT assay. The data are expressed as the means ± SD of 3 independent experiments. Significance was determined by the Student’s t-test (ns, not significant; *** P < 0.001 versus untreated control). DSTE, Daesiho-tang water extract.
3. DSTE가 NE CM으로 유발한 대식세포의 M2형 분극에 미치는 영향
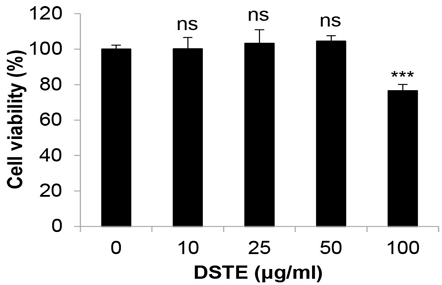
DSTE가 NE CM으로 유발한 대식세포의 M2형 분극을 조절할 수 있는지 확인하기 위하여 RAW 264.7 세포에 NE CM과 DSTE를 함께 처리한 후 M2형 대식세포 마커인 CD206, CD163, arginase-1의 발현을 real-time PCR로 확인하였다. 먼저 CD206의 발현은 con CM 처리군에 비해 NE CM 처리군에서 1.75±0.05배 증가하였으며, DSTE 25 ㎍/㎖을 동시 처리한 군에서 0.81±0.13배, 50 ㎍/㎖을 동시 처리한 군에서 0.86±0.12배로 각각 감소하였다. CD163의 발현은 NE CM 처리에 의해 2.23±0.01배로 증가하였으며, DSTE 25 ㎍/㎖ 동시처리에 의해 1.53±0.21배, 50 ㎍/㎖ 동시처리에 의해 1.34±0.21배로 각각 감소하였다. 마지막으로 arginase-1의 발현은 NE CM 처리 시 1.80±0.12배로 상승하였으며, DSTE 25 ㎍/㎖ 동시처리군에서 1.31±0.34배, 50 ㎍/㎖ 동시처리군에서 0.99±0.14배로 각각 감소하였다. 이러한 결과는 NE CM 처리에 의해 RAW 264.7 대식세포의 M2형 분극이 유발되며, 이를 DSTE가 억제할 수 있음을 보여준다.
Effects of DSTE on the expression of NE CM-induced M2 macrophage markers in RAW 264.7 cells. RAW 264.7 mouse macrophages were stimulated with NE CM for 24 h for M2 polarization and co-treated with DSTE. At 24 h posttreatment, the mRNA level of CD206 (A), CD163 (B) and arginase-1 (C) was measured by real-time PCR. The data are expressed as the mean ± SD of three independent experiments. Significance was determined by the Student’s t-test (### P < 0.001 versus untreated control; ns, not significant; ** P < 0.01, *** P < 0.001 versus the cells treated with NE CM). DSTE, Daesiho-tang water extract; NE, norepinephrine; NE CM, conditioned medium collected from NE-treated 4T1 cells.
4. DSTE가 NE CM으로 유발한 대식세포의 STAT6 활성화에 미치는 영향
다음으로 DSTE가 NE CM으로 유발한 대식세포의 M2형 분극을 억제할 수 있는 분자적 기전을 조사하였다. 일반적으로 대식세포의 M2형 분극을 매개하는 인자로서 signal transducer and activator of transcription 6 (STAT6)가 알려져 있다. STAT6는 M2형 분극을 일으키는 대표적 사이토카인인 IL-4, IL-13에 의해 활성화되어 arginase-1, CD206, Fizz-1과 같은 M2형 대식세포 마커유전자의 발현을 증가시키고, 염증성 유전자들의 발현을 억제하는 것으로 알려져 있다23). 실험 결과 Fig. 4에 나타난 바와 같이 NE CM은 RAW 264.7 대식세포의 STAT6 인산화를 con CM 처리군에 비해 1.84±0.11배로 유의하게 증가시켰다(Fig. 4A and 4B). 그러나 DSTE를 NE CM과 동시처리하자 25 ㎍/㎖ 처리군에서 1.33±0.08배, 50 ㎍/㎖ 처리군에서 0.48±0.06배로 STAT6의 인산화가 각각 감소하는 것을 확인할 수 있었다(Fig. 4A and 4B). 이러한 결과는 DSTE가 NE CM으로 유도한 대식세포의 M2형 분극을 억제하는 효과가 STAT6의 불활성화를 통해 매개됨을 의미한다. 향후STAT6가 조절하는 타겟 유전자로서 arnigase-1, CD206 뿐만 아니라 Fizz-1, Ym1/Ym2, IL-10, TGF-β 등23)의 발현 변화도 면밀히 관찰할 필요가 있다.
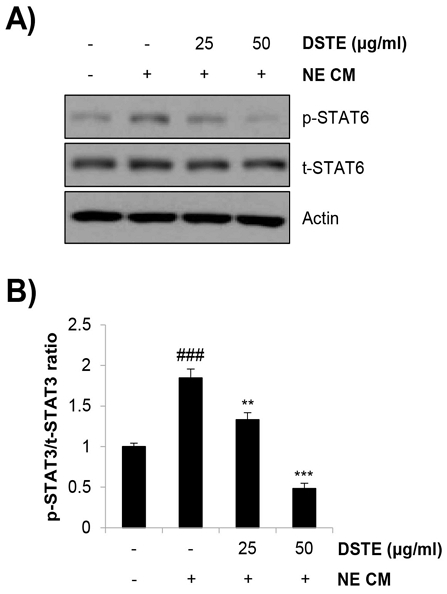
Effects of DSTE on NE CM-induced phosphorylation of STAT6 in RAW 264.7 cells. RAW264.7 mouse macrophages were stimulated with NE CM for M2 polarization and co-treated with DSTE. At 24 h posttreatment, the phosphorylation and total level of STAT6 was detected by western blot analysis. Actin was used as an internal control. (A) The representative blot images of three independent experiments are shown. (B) The ratio between phospho-STAT6 and total STAT6 was calculated using Image J. The data are expressed as the mean ± SD of three independent experiments. Significance was determined by the Student’s t-test (### P < 0.001 versus untreated control; ** P < 0.01, *** P < 0.001 versus the cells treated with NE CM). DSTE, Daesiho-tang water extract; NE, norepinephrine; NE CM, conditioned medium collected from NE-treated 4T1 cells; STAT6, signal transducer and activator of transcription 6.
5. M2형 대식세포에 의해 증가한 암세포의 이동능에 DSTE가 미치는 영향
M2형 대식세포는 금속단백질가수분해효소(metalloproteinase, MMP), 세린 단백질분해효소, 카텝신(cathepsin) 등을 분비하여 혈관내피세포막을 파괴하고 세포외기질을 분해하여 암세포의 이동 및 침윤을 촉진하고 전이를 일으키는 것으로 알려져 있다2,8). 이에 본 연구에서는 NE CM으로 RAW 264.7 세포를 M2형 대식세포로 분화시킨 후 4T1 세포와 공배양하여 4T1 세포의 이동능이 증가하는지 조사하였으며, 이것이 DSTE 처리에 의해 저해될 수 있는지 transwell assay를 통해 확인하였다(Fig. 5A). 실험 결과 NE CM이 처리된 RAW 264.7 세포와 공배양한 4T1 세포는 이동능이 현저히 증가하여 con CM에 비해 222.92±13.7%까지 이동능이 증가하였다. 이는 M2형 대식세포가 암세포의 이동을 직접적으로 촉진할 수 있음을 의미한다. 그러나 NE CM과 DSTE가 동시처리된 RAW 264.7 세포는 4T1 세포의 이동능을 25 ㎍/㎖과 50㎍/㎖에서 각각 130±18.91%, 112.08±13.01%으로 대폭 감소시켰다 (Fig. 5B and 5C). 이러한 결과는 DSTE가 NE CM 처리로 유도한 대식세포의 M2형 분화를 억제함으로써 궁극적으로 암세포의 이동능을 억제할 수 있음을 시사한다.
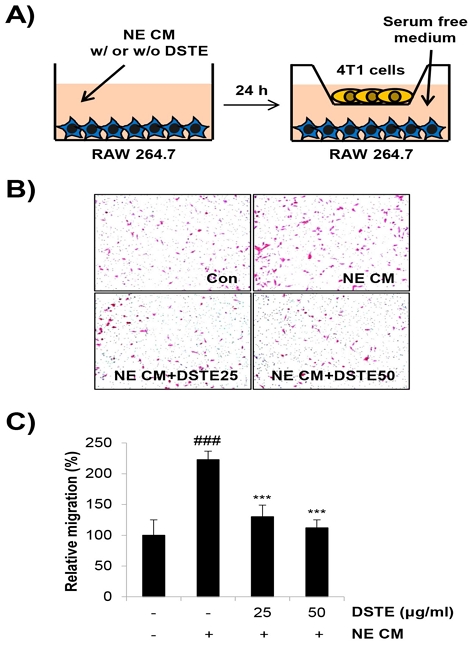
Effects of DSTE on the M2 macrophage-stimulated cancer cell migration. (A) Experimental schemes are shown. RAW 264.7 mouse macrophages were seeded into lower chambers of 24 well transwell plate and cotreated with NE CM and DSTE for 24 h. At 24 h posttreatment, the culture medium was replaced with fresh serum free medium. In upper chambers, 4T1 mouse breast cancer cells suspended in serum free medium were seeded and incubated for migration for 24 h. (B) 4T1 cells that migrated were stained and photographed under a microscope (×100 magnification). (C) The relative migration was evaluated by counting the migrated cells. The data are expressed as the mean ± SD of three independent experiments. Significance was determined by the Student’s t-test (### P < 0.001 versus 4T1 cells co-cultured with untreated RAW 264.7 cells; *** P < 0.001 versus 4T1 cells co-cultured with NE CM-treated RAW 264.7 cells). DSTE, Daesiho-tang water extract; NE, norepinephrine; NE CM, conditioned medium collected from NE-treated 4T1 cells.
고 찰
본 연구는 한의학적으로 소양(少陽)을 화해(和解)하고 앙명열(陽明熱)을 사(瀉)하는 대시호탕의 항암작용을 대식세포 조절의 관점에서 조사한 연구이다. 스트레스는 간(肝)을 중심으로 기(氣)의 울체(鬱滯)를 일으키며, 기울(氣鬱)은 혈액의 운행과 진액의 대사를 막아 어혈(瘀血), 담음(痰飮)과 같은 병리적 산물을 만들고 유형의 덩어리인 암을 형성하게 된다24). 대시호탕은 이러한 간기(肝氣)의 울체를 푸는 동시에 내열(內熱)을 사하며 지실, 대황을 포함하고 있어 유형의 결실(結實)을 깨트리는 작용을 한다15). 따라서 대시호탕은 스트레스로 인한 암의 악화를 제어할 수 있다는 가설을 세울 수 있으며, 실제로 임21)은 대시호탕의 항암효과를 보고한 바 있다. 병리학적으로 만성적 스트레스는 암세포 자체의 성질과 신호전달경로를 조절하여 암을 악화시키기도 하지만, 암세포를 공격하는 면역계를 교란시킨다고 알려져 있다12-14). 특히 스트레스는 종양 내에 M2형 대식세포의 침윤을 증가시켜 암의 전이를 촉진시킨다13,14). 이러한 기존 연구결과들을 근거로 본 연구에서는 대시호탕이 스트레스로 인한 대식세포의 M2형 분극을 조절할 수 있다는 가설을 세웠다.
본 연구의 주된 연구결과 및 시사점은 아래와 같다. 첫째, 스트레스성 카테콜아민인 NE는 직접적으로 RAW 264.7 세포를 M2형으로 분화시키지는 않았으나 4T1 유방암세포에 NE를 처리한 후 모은 세포배양액(NE CM)은 M2형 대식세포 분극을 유도하였다. 이는 NE가 처리된 4T1 세포의 분비체(secretome)가 대식세포를 M2형으로 분화시켰음을 의미한다. 일반적으로 대식세포의 M2형 분극을 유도하는 인자로서 IL-4, IL-13, IL-6, TGF-β 등이 알려져 있다2,3). 이들 중 구체적으로 어떤 인자가 4T1 세포로부터 분비되어 RAW 264.7 세포를 M2형으로 분화시켰는지는 추후 연구가 필요하다. 본 연구에서는 NE CM이 대식세포의 M2형 분화를 유도하고 이를 DSTE가 조절할 수 있는지에 초점을 맞추었으므로 상기한 논의는 향후 별도의 실험을 통해 밝혀져야 할 것이다. 둘째, DSTE는 NE CM으로 유도한 RAW 264.7 세포의 M2형 마커유전자 발현(arginase-1, CD206, CD163)을 현저히 억제하였으며, 이는 전사인자인 STAT6의 불활성화에 의해 매개되었다. 앞서 NE CM이 대식세포의 M2형 분극을 유발하는 기전을 밝혀야 함을 언급했는데, NE CM에 의해 STAT6가 인산화되었으므로 STAT6를 활성화시킨다고 알려져 있는 인자들로 그 범위를 좁힐 수 있다. 예를 들어 IL-6는 M2형 분극을 유발하지만 STAT6 대신 STAT3를 통해 신호를 전달하므로 후보에서 제외할 수 있을 것이다26). 본 연구의 결과에 싣지 않았으나 NE CM은 STAT3를 인산화시키지는 않는 것으로 나타났기 때문이다. 따라서 ⅰ) 대식세포의 M2형 분극을 유도하는 인자, ⅱ) STAT6를 활성화시키는 인자, ⅲ) 대시호탕에 의해 조절된다고 알려져 있는 인자의 세가지 조건을 동시에 만족하는 후보를 탐색해야 할 것이다. 대시호탕이 여러 한약재가 혼합된 처방이라 SCI급 논문에서 다루는 데 한계가 있으며, 구체적인 작용기전을 밝히기보다 현상적인 효과를 다루는 데 급급하여 그동안 밝혀진 타겟이 부족하다는 점이 향후 연구의 한계점일 수 있으나 네트워크 약리학 등의 총체적인 연구방법론으로 접근할 수 있을 것이다. 셋째, NE CM 처리를 통해 M2형으로 분극된 RAW 264.7 세포는 4T1 유방암세포의 이동을 촉진하였으며, 이는 대식세포에 NE CM과 DSTE를 동시처리함으로써 현저히 억제되었다. 이러한 결과는 DSTE가 대식세포의 M2형 분극을 저해하여 궁극적으로 암세포의 전이를 억제할 수 있음을 의미한다. 그 동안 대시호탕의 항암작용에 대한 보고는 매우 한정적이었으며, 간암의 형성을 억제하는 현상에 대한 관찰만 있었을 뿐 그 구체적인 기전은 밝혀진 바 없다21). 또한 대시호탕이 대식세포의 침투와 염증을 억제하여 만성췌장염으로 인한 췌장의 섬유화를 억제한다는 보고가 있으나27), 종양 환경에서 대식세포의 분화를 어떻게 조절하는지에 대해서는 전혀 연구된 바가 없다. 본 연구에서는 DSTE가 스트레스로 인해 촉진된 M2형 대식세포 분극을 억제하여 암의 전이를 억제할 수 있음을 최초로 밝혔다는 데 의의가 있다.
본 연구의 상기한 시사점에도 불구하고 DSTE의 어떤 성분이 이러한 작용을 나타내는지는 밝히지 못했다. DSTE를 구성하는 본초가 8종이며, 개별 본초에 포함된 성분만 해도 수십 종에 달하여 DSTE에는 수백 종의 성분들이 포함되어 있을 것으로 사료된다. 흥미롭게도 최근 연구에 따르면 DSTE를 구성하는 약물인 시호의 주요 활성성분인 saikosaponin d가 STAT6 불활성화 및 PI3K/AKT/mTOR 신호전달경로 억제를 통해 대식세포의 M2형 분극을 저해하고 항암활성을 가지는 것이 밝혀졌다28). 반하 역시 IL-4와 IL-6에 의해 유도된 M2형 대식세포 분극을 STAT6 및 STAT3 억제를 통해 저해할 수 있음이 보고되었다29). 그러나 이러한 개별 연구의 분석만으로는 DSTE의 총체적인 작용기전을 이해하기 어렵다. 8종 본초가 조절하는 신호전달경로와 분자적 타겟을 조사하고, 해당 신호전달경로나 분자 중 암의 전이 및 대식세포 분화와 연관된 것이 있는지 확인하는 작업이 필요하다. 또한 질량분석법(mass spectrometry) 등을 통해 DSTE에 포함된 성분들을 구체적으로 밝히고 이들 성분의 분자적 타겟과 대식세포 조절경로 간의 연관성을 함께 조사해야 할 것이다. 이를 통해 DSTE의 대식세포 조절 및 항암기전을 밝혀나가야 하는 바 여기에는 많은 시간과 노력이 요구된다.
결 론
대시호탕 열수추출물(DSTE)의 대식세포 분화 조절에 대한 연구 결과 다음과 같은 결론을 얻었다. 스트레스 시 분비되는 NE를 4T1 유방암세포에 처리한 후 세포배양액(NE CM)을 모아 RAW 264.7 세포에 처리하자 M2형 대식세포 마커의 발현이 증가하였고, 이는 STAT6의 인산화에 의해 매개되었다. 이러한 현상은 DSTE 처리에 의해 현저히 억제되었다. 또한 NE CM에 의해 M2형으로 분극된 대식세포는 암세포의 이동능을 증가시켰으며, 이는 DSTE 처리로 M2형 분극을 억제함으로써 저해되었다. 이상의 결과는 대시호탕이 만성적 스트레스 하에 촉진된 대식세포의 M2형 분극과 이로 인한 암의 전이를 억제할 수 있음을 시사하는 것이다. 본 연구를 통해 향후 스트레스로 인한 기울의 경향이 명확한 암환자에게 대시호탕을 활용할 수 있는 기초적 근거를 제공할 수 있을 것으로 사료된다.
Acknowledgments
본 연구는 한국연구재단의 우수신진연구의 사업비로 수행되었음(No. NRF-2021R1C1C100506211).
References
-
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011;144(5):646-74.
[https://doi.org/10.1016/j.cell.2011.02.013]

-
Wang J, Li D, Cang H, Guo B. Crosstalk between cancer and immune cells: Role of tumor‐associated macrophages in the tumor microenvironment. Cancer Med. 2019; 8:4709-1.
[https://doi.org/10.1002/cam4.2327]

-
Pan Y, Yu Y, Wang X, Zhang T. Tumor-Associated Macrophages in Tumor Immunity. Front. Immunol. 2020;11:583084.
[https://doi.org/10.3389/fimmu.2020.583084]

-
Ovais M, Guo MY, Chen CY. Tailoring Nanomaterials for Targeting Tumor‐Associated Macrophages. Adv Mater. 2019;31(19):e1808303.
[https://doi.org/10.1002/adma.201808303]

-
Sica A, Mantovani A. Macrophage plasticity and polarization: in vivo veritas. J. Clin. Invest. 2012;122:787-95.
[https://doi.org/10.1172/JCI59643]

-
Batty GD, Russ TC, Stamatakis E, Kivimäki M. Psychological distress in relation to site specific cancer mortality: Pooling of unpublished data from 16 prospective cohort studies. BMJ 2017;356:j108.
[https://doi.org/10.1136/bmj.j108]

-
Cui B, Peng F, Lu J, He B, Su Q, Luo H, et al. Cancer and stress: NextGen strategies. Brain Behav. Immun. 2021;93:368-83.
[https://doi.org/10.1016/j.bbi.2020.11.005]

-
Cole SW, Sood AK. Molecular pathways: Beta-adrenergic signaling in cancer. Clin. Cancer Res. 2012;18:1201-6.
[https://doi.org/10.1158/1078-0432.CCR-11-0641]

-
Melhem-Bertrandt A, Chavez-Macgregor M, Lei X, Brown EN, Lee RT, Meric-Bernstam F. et al. Beta-blocker use is associated with improved relapse-free survival in patients with triple-negative breast cancer. J. Clin. Oncol. 2011;29:2645-52.
[https://doi.org/10.1200/JCO.2010.33.4441]

- Parada-Huerta E, Alvarez-Dominguez T, Uribe-Escamilla R, Rodriguez-Joya J, Ponce-Medrano JD, Padron-Lucio S, et al. Metastasis Risk Reduction Related with Beta-Blocker Treatment in MexicanWomen with Breast Cancer. Asian Pac. J. Cancer Prev. 2016;17:2953-7.
-
Udumyan R, Montgomery S, Fang F, Almroth H, Valdimarsdottir U, Ekbom A, et al. Beta-Blocker Drug Use and Survival among Patients with Pancreatic Adenocarcinoma. Cancer Res. 2017;77:3700-7.
[https://doi.org/10.1158/0008-5472.CAN-17-0108]

-
Freire BM, de Melo FM, Basso AS. Adrenergic signaling regulation of macrophage function: do we understand it yet? Immunother. Adv. 2022;2(1):ltac010.
[https://doi.org/10.1093/immadv/ltac010]

-
Grailer JJ, Haggadone MD, Sarma JV, Zetoune FS, Ward PA. Induction of M2 regulatory macrophages through the β2-adrenergic receptor with protection during endotoxemia and acute lung injury. J. Innate. Immun. 2014;6(5):607-18.
[https://doi.org/10.1159/000358524]

-
Qin JF, Jin FJ, Li N, Guan HT, Lan L, Ni H, et al. Adrenergic receptor β2 activation by stress promotes breast cancer progression through macrophages M2 polarization in tumor microenvironment. BMB Rep. 2015;48(5):295-300.
[https://doi.org/10.5483/BMBRep.2015.48.5.008]

- Kim SC, Kim SH, Noh SH, Park SD, Kim SK, Seo BI, et al. Formulas of Oriental Medicine. Seoul: Younglim press; 2003.
- Kim HH, Yeo WH, Cho HJ. Effects of DaeSiHo-Tang extract on Hypertension and Arterial Contraction. Korean J. Ori. Med. Physiol. Pathol. 2005;19(6):1573-9.
- Park SD, Yoon BK. Effects of Daesihotang and its component groups on diabetes, free radical and antioxidative defense system in alloxan induced diabetic rats. Korean J. Orient. Med. Prescription 2001;9(1):289-317.
- Kim CH, Kweon YM, Lee YT, Park SD. The preventive effect of Daeshiho-tang on liver damage induced by acetaminophen in the rats. Korean J. Orient. Med. Prescription 2004;12(2):139-54.
- Song MY, Kim EK, Kong JC, Lee JH, Ryu DG, Kwon KB, et al. Inhibitory Effect of Daesiho-tang(Dachaihu-tang) Extracts on High-fat Diet-induced Obesity. J. Korean Med. Rehabil. 2008;18(3):41-9.
-
Hussain A, Yadav MK, Bose S, Wang JH, Lim D, Song YK, et al. Daesiho-Tang Is an Effective Herbal Formulation in Attenuation of Obesity in Mice through Alteration of Gene Expression and Modulation of Intestinal Microbiota. PLoS One 2016;11(11):e0165483.
[https://doi.org/10.1371/journal.pone.0165483]

- Lim DW. The Effect of Daeshiho-tang(DS) on Hepatocellular Carcinogenesis Induced by Diethylnitrosamine(DENA) in Rats. Doctoral Thesis at Dongshin University. 2011.
-
Mantovani A, Biswas SK, Galdiero MR, Sica A, Locati M. Macrophage plasticity and polarization in tissue repair and remodelling. J. Pathol. 2013;229:176-85.
[https://doi.org/10.1002/path.4133]

-
Tugal D, Liao X, Jain MK. Transcriptional control of macrophage polarization. Arterioscler. Thromb. Vasc. Biol. 2013;33(6):1135-44.
[https://doi.org/10.1161/ATVBAHA.113.301453]

- The Textbook Compilation Committee of Pathology of Korean Medicine. Pathology of Korean Medicine. Seoul: Hanimunhwasa; 2019.
-
Rőszer T. Understanding the Mysterious M2 Macrophage through Activation Markers and Effector Mechanisms. Mediators Inflamm. 2015;2015:816460.
[https://doi.org/10.1155/2015/816460]

-
Xia T, Zhang M, Lei W, Yang R, Fu S, Fan Z, et al. Advances in the role of STAT3 in macrophage polarization. Front. Immunol. 2023;14:1160719.
[https://doi.org/10.3389/fimmu.2023.1160719]

-
Duan LF, Xu XF, Zhu LJ, Liu F, Zhang XQ, Wu N, et al. Dachaihu decoction ameliorates pancreatic fibrosis by inhibiting macrophage infiltration in chronic pancreatitis. World J. Gastroenterol. 2017;23(40):7242-52.
[https://doi.org/10.3748/wjg.v23.i40.7242]

-
Xu X, Cui L, Zhang L, Yang L, Zhuo Y, Li C. Saikosaponin d modulates the polarization of tumor-associated macrophages by deactivating the PI3K/AKT/mTOR pathway in murine models of pancreatic cancer. Int. Immunopharmacol. 2023;122:110579.
[https://doi.org/10.1016/j.intimp.2023.110579]

-
Park SH. The Tuber Extract of Pinellia ternata (Thunb.) Brei Suppresses Cancer Cell Migration by Regulating Tumor-associated Macrophages. Korean J. Ori. Med. Physiol. Pathol. 2022;36(1):1-6.
[https://doi.org/10.15188/kjopp.2022.02.36.1.1]