양춘사 추출물이 HepG2 세포에서 콜레스테롤 합성에 미치는 효과
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
Dried fruits of Amomum villosum Lour. have been used an korean medicine to treat digestive diseases for a long time. It has been reported that Amomum villosum extracts(AVE) have effects for diabetes and steatosis in experimental models. But we did not find the report about the cholesterol synthesis inhibition effects of AVE. The objective of this study is to clarify the inhibitory effect of AVE against oleic acid and glucose-induced hypercholesterolemia in HepG2 cells. The results show that AVE had a significant inhibitory effect against oleic acid and glucose-induced cholesterol accumulation. Those effects seem to be caused by inhibition of AVE on oleic acid and glucose-induced decrease of HMG CoA reductase, which is the rate-limiting enzyme for cholesterol biosynthesis in liver. It is believed that the results of this study can provide basic data for the drug and functional food development of hypercholesterolemia treatments.
Keywords:
Amomum villosum, Hpercholestrolemia, HMG CoA reductase, Drug, Functional food서 론
이상지질혈증(dyslipidemia)은 혈장 총콜레스테롤, 저밀도 지방 단백질 콜레스테롤(low density lipoprotein cholesterol, LDL 콜레스테롤) 혹은 중성지방이 상승하는 경우나 고밀도 지방 단백질 콜레스테롤(high density lipoprotein cholesterol, HDL 콜레스테롤)이 감소하는 경우를 포함하여 혈장 중 지질대사에 이상이 생긴 경우로1) 동맥경화성 심혈관질환의 위험도를 증가시키는 주요한 요인2)이다. 서구화된 식생활과 운동 부족 등 다양한 요인으로 그 유병률이 점차 증가하는 추세를 보이는데 2021년도 보건복지부 통계에 따르면 만성질환 중 고혈압 유병률은 26.8%, 당뇨 유병률은 9~11% 수준으로 유지하여 증감 폭이 크지 않으나 고콜레스테롤혈증(hypercholesterolemia) 유병률은 통계를 조사하기 시작한 2005년의 8%를 기점으로 매년 증가하여 2019년 18.6%를 기록하였다3). 다양한 원인에 의한 고콜레스테롤혈증 및 이상지질혈증의 증가는 향후 이를 경감시키는 기능성식품이나 한약제제 개발에 대한 수요 증가로 이어질 것으로 보인다.
한의학에서는 이상지질혈증의 원인을 고량후미(膏粱厚味)나 과음으로 인한 비위손상(脾胃損傷), 정신적 요인으로 인한 기혈운행실조(氣血運行失調), 선천적으로 비만하여 “肥人多痰濕”하거나 간신부족(肝腎不足)하여 대사가 원활하지 못해 발생하는 것으로 보고 각 변증(辨證)에 맞춰 조습화담(燥濕化痰), 활혈화어(活血化瘀), 소간해울(疎肝解鬱), 자신양간(滋腎養肝)의 치법으로 치료하였다4). 또한 한약재를 이용하여 이상지질혈증에 대한 단미제나 복합제의 효과를 규명하기 위한 현대적 실험 연구가 보고되고 있다5).
본 연구에서 활용한 사인(砂仁)은 한의학적으로 방향화습약(芳香化濕藥)에 해당하며 생강과에 속한 다년생초본인 양춘사(Amomum villosum Lour.) 또는 해남사의 성숙한 과실로 화습개위(化濕開胃), 온비지사(溫脾止瀉), 이기안태(理氣安胎)의 효능이 있다6). 주성분은 borneol, camphor, bornyl acetate, limonene 등이며6,7) 위점막 혈류증가를 통한 위액분비 촉진과 위궤양 억제, 항염증, 항균 효과가 약리학적으로 밝혀져 위장질환에 흔히 사용된다7,8). 또한 실험적으로 기억력감퇴에 대한 개선 효과9)와 항당뇨 효과10-13), 간섬유화 억제 효과14,15), 뼈 성장 촉진16) 효과가 보고되었으며 항비만 효과17)가 있는 것으로 밝혀졌다.
이에 저자는 혈중 지질과 관련된 당뇨, 비만에 대한 양춘사의 개선 효과를 바탕으로 양춘사 추출물의 in vitro 콜레스테롤 합성억제 효과 및 기전을 조사하여 유의한 결과를 얻었기에 보고하는 바이다.
재료 및 방법
1. 양춘사 추출물 제조
본 연구에 사용된 양춘사는 ㈜광명당제약(Ulsan, Korea)에서 구입하여 사용하였으며 원광대학교 한의과대학 본초학 교실에서 진품을 확인하였다. 양춘사 100g을 3차 증류수 900㎖에 3시간 가열하여 환류 추출 후 여과하고 남은 용액을 감압시켜 농축, 건조하여 양춘사 9.25 g의 추출물을 얻어 냉장 보관하였다.
2. 세포 배양
인간 간암 세포주인 HepG2는 한국세포주은행(Seoul, Korea)에서 분양받아 사용하였다. 10% fetal bovine serum(FBS), 4mM L-glutamine, 100units/㎖ penicillin, 100㎍/㎖ streptomycin, 250ng/㎖ amphotericin B가 포함된 Dulbecco′s Modified Eagle′s Medium(DMEM) 배지로 배양하였고, Phosphate buffered saline(PBS), Typsin/EDTA solution을 사용하여 계대 배양하였다. 37℃, 5% CO2 조건의 incubator에서 배양하였다. Fasting media는 FBS가 없는 DMEM 배지를 사용하였고, inducing media는 1% FBS가 포함된 DMEM 배지를 사용하였다. 세포 배양에 사용한 배지 및 시약은 Gibco (CA, USA)에서 구입하였다.
3. 처리 약물 제작
Simvastatin (TCI, Tokyo, Japan)은 에탄올과 0.1N NaOH를 이용하여 활성화시켰고 PBS를 이용하여 희석하여 비교 약물로 사용하였다. 시험군에 처리한 약물은 양춘사 추출물을 PBS에 희석하여 사용하였으며 0.45㎛ 필터로 여과한 후 사용 배지를 이용하여 최종 농도를 simvastain 20uM, 양춘사 추출물 100, 200, 400㎍/㎖로 처리하였다.
4. 고콜레스테롤 유발
10% FBS가 포함된 DMEM 배지를 이용하여 HepG2 세포주를 5×105 cells/well의 농도로 6 well plate에 24시간 동안 배양한 후, 4시간 동안 fasting media로 교체하였다. 정상 대조군에는 1% FBS가 포함된 DMEM 배지를, 나머지 군에는 고콜레스테롤 유발 배지를 넣고 비교 약물 및 시험 약물도 각 최종 농도로 맞춰 주었다. 고콜레스테롤 유발 배지는 에탄올과 0.01M의 NaOH를 이용하여 oleic acid를 희석하고, 4% Bovine serum albumin (BSA)가 포함된 distilled water(DW)와 1% FBS가 포함된 DMEM 배지에 glucose와 희석된 oleic acid를 희석하여 10mM glucose, 700uM oleic acid로 제작하여 16시간 동안 다양한 농도의 양춘사 추출물과 함께 처리하였다. 고콜레스테롤 유발 배지에 사용한 모든 시약은 Sigma(MO, USA)에서 구입하였다.
5. 세포 독성 시험
10% FBS가 포함된 DMEM 배지를 이용하여 HepG2 세포주를 2×104 cells/well의 농도로 96 well plate에 24시간 동안 배양한 후, 양춘사 추출물 및 simvastatin을 각각의 농도로 처리하여 24시간 동안 배양하였다. 약물에 대한 세포 생존율은 Dogenbio (Seoul, Korea)의 WST 시약인 EZ-cytox kit를 사용하여 측정하였다.
6. 세포 내 총 콜레스테롤 함량
HepG2 세포에 양춘사 추출물과 glucose 및 oleic acid를 16시간 동안 처리한 후 세포 용해물을 취하였다. 세포내 총 콜레스테롤 함량은 아산제약(Seoul, Korea)의 총 콜레스테롤 측정 키트를 사용하여 측정하고 BCA protein assay kit (Thermo Fisher, CA, USA)로 단백질량을 정량하여 단백질 농도에 따라 계산하였다.
7. Oil Red O staining
HepG2 세포에서 배지를 제거하고 PBS를 이용하여 세척한 후 10% formalin으로 고정하였다. PBS와 60% isopropanol을 이용하여 formalin을 세척한 후, 정제수로 희석한 Oil Red O 용액으로 염색하고 DW를 이용하여 세척하였다. 세포에 염색된 Oil red O를 100% isopropanol에 용해시켜 microplate reader (Molecular Devices, USA)로 500nm 파장에서 흡광도를 측정하여 염색된 양을 정량 비교하였다. 이 과정에 사용한 모든 시약은 Sigma (MO, USA)에서 구입하였다.
8. Total RNA 분리 및 Real Time PCR
세포 내 RNA는 TRIzol reagent (Invitrogen, CA, USA)를 이용하여 분리하였고, 분광광도계(IMPLEN GmbH, Munich, Germany)에서 흡광도를 측정하여 정량하였다. RNA로부터의 cDNA 합성은 1㎍ total RNA와 Prime Script reagent kit (Takara, Tokyo, Japan)을 이용하여 진행하였다. Real Time PCR은 cDNA, primer sequences (Table 1), Power SYBR Green PCR master Mix (Applied Biosystems, CA, USA)를 이용하여 수행하였다. 발현된 각각 유전자의 mRNA양은 Real-time PCR systems (Applied Biosystems, CA, USA)를 이용하여 GAPDH에 대한 상대적인 양으로 계산하였다.
9. Western blot
세포 내 단백질은 protease inhibitor, phosphatase inhibitor (Millipore, Darstadt, Germany)를 포함한 RIPA lysis buffer (Thermo Fisher, CA, USA)를 사용하여 분리하였다. BCA protein assay를 이용하여 분리한 단백질을 정량하고 단백질 양이 동일하도록 검체를 제작하였다. 20㎍의 단백질을 sodium Dodecyl sulfate-polyacrylamide(SDS-PAGE) gel에 분주하고 전기영동시켜 분리하였다. Gel 내부에 크기별로 분리된 단백질은 PVDF membrane (GE Healthcare Life Sciences, Buckinghamshire, UK)에 이동시켰다. 각각의 membrane은 5%의 skim milk (BD Difco, NJ, USA)를 사용하여 2시간 동안 블로킹하였고, 1차 항체는 1㎍/㎖를 1 : 2000으로 희석하여 4℃에서 밤새 반응시켰다. 이때 사용한 항체 중 β-Actin Antibody(Cat. #: sc8432), sterol regulatory element-binding protein 2 (SREBP-2)(Cat. #: sc13552) Antibody, HMG-CoA reductase (HMGCR)(Cat. #: sc271595) Antibody는 Santa Cruz Technology (CA, USA)로부터 구입하였다. 2차 항체는 1 : 2000으로 희석하여 실온에서 1시간 동안 반응시키고 ECL kit (Millipore, Darstadt, Germany)와 image analyzer (EZ-Capture ST, Tokyo, Japan)를 사용하여 단백질 발현량을 확인하였다. 이때 2차 항체로 사용한 Goat Anti-Mouse IgG H&L (HRP), Goat Anti-Rabbit IgG H&L (HRP)는 Abcam (Cambridge, UK)에서 구입하였다. 단백질 발현량은 β-actin 및 정상군을 기준으로 비교하였다.
10. 통계 분석
모든 데이터는 평균 ± 표준편차로 표시하였으며 SAS software(ver. 9.3, SAS Institute Inc., Cary, NC, USA)의 one-way analysis of variance (ANOVA)를 이용하여 유의성 5% 이내에서 검증하였다.
결 과
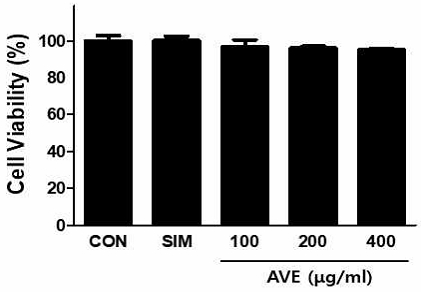
1. 양춘사 추출물의 세포 독성 효과
양춘사 추출물(amomum villosum extracts, AVE)과 simvastatin(SIM)이 세포 독성에 미치는 효과를 조사하기 위하여 20uM SIM과 100, 200, 400㎍/ml 양춘사 추출물을 HepG2 세포에 48시간 처리한 후 세포 생존율에 미치는 영향을 조사하였다. 그 결과 대조군과 비교하여 모든 군에서 세포 독성은 나타나지 않았다(Fig. 1).
2. 양춘사 추출물의 콜레스테롤 합성 억제 효과
실험적으로 유도된 콜레스테롤 합성증가에 대한 양춘사 추출물(amomum villosum extracts, AVE)의 효과를 조사하기 위하여 800uM oleic acid와 10mM glucose (OAG군)가 포함된 배지에 다양한 농도의 양춘사 추출물을 16시간 동안 처리한 후 세포 내 총콜레스테롤 양을 조사하였다. 그 결과 대조군의 총콜레스테롤 함량은 5.56 ± 1.97mg/100mg protein이었으나, OAG군에서는 23.71 ± 3.22g/100mg protein으로 나타나 유의하게 증가하였다(p<0.01). 그러나 100, 200, 400㎍/ml 양춘사 추출물을 처리한 군의 총콜레스테롤 농도는 각각 16.58 ± 1.82, 14.96 ± 1.48, 12.78 ± 2.29mg/100mg protein으로 OAG군과 비교하여 유의하게 감소하였으며, 양성 대조군으로 사용한 simvastatin(SIM)군의 13.67 ± 1.23 mg/100mg protein과 유사하였다(Fig. 2).
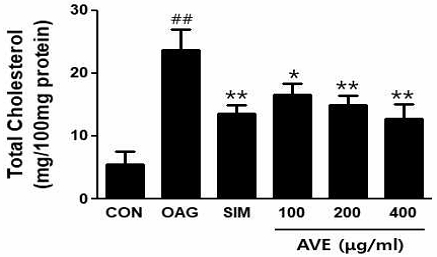
Effects of Amomum villosum extracts (AVE) on total cholesterol concentrations in HepG2 cells. Cells were treated with 800uM oleic acid and 10mM glucose in the presence of various concentrations of AVE for 16 h. Total cholesterol concentrations were analyzed as follows in material and methods. Values are means ± SD; n=5. ##p<0.01 vs. CON, *p<0.05, **p<0.01 vs. OAG (800uM oleic acid + 10mM glucose). CON; control, SIM; 20uM simvastatin.
3. 양춘사 추출물의 중성지방 합성 억제 효과
양춘사 추출물(amomum villosum extracts, AVE)의 중성지방 합성억제 효과를 조사하기 위하여 800uM oleic acid와 10mM glucose (OAG군)가 포함된 배지에 다양한 농도의 양춘사 추출물을 16시간 동안 처리한 후 세포 내 중성지방의 양을 조사하였다. 그 결과 대조군에 비해 OAG군의 중성지방의 양은 유의하게(p<0.01) 증가하였고, 양춘사 추출물을 처리한 군의 중성지방의 양은 OAG군과 비교하여 유의하게 감소하였으나, 양성대조군인 simvastatin(SIM)군과 비교하여 감소 효과는 낮았다(Fig. 3).
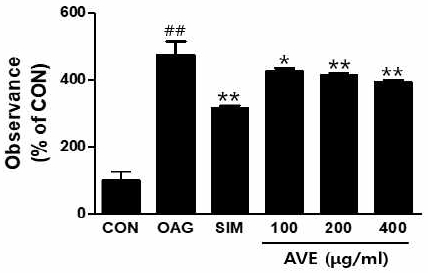
Effects of Amomum villosum extracts (AVE) on lipid concentrations in HepG2 cells. Cells were treated with 800uM oleic acid and 10mM glucose in the presence of various concentrations of AVE for 16 h. Total lipid concentrations were analyzed by using Oil Red O stain. Values are means ± SD; n=5. ##p<0.01 vs. CON, *p<0.05, **p<0.01 vs. OAG (800uM oleic acid + 10mM glucose). CON; control, SIM; 20uM simvastatin.
4. 양춘사 추출물의 콜레스테롤 합성 관련 단백질 발현에 대한 효과
양춘사 추출물(amomum villosum extracts, AVE)의 콜레스테롤 합성 관련 유전자로 알려진 Sterol regulatory element binding protein(SREBP)-2와 HMG-CoA reductase(HMGCR) 단백질 발현에 대한 효과를 조사하기 위하여 800uM oleic acid와 10mM glucose (OAG군)가 포함된 배지에 다양한 농도의 양춘사 추출물을 16시간 동안 처리한 후 세포 내 단백질을 수집하여 발현량을 조사하였다. 그 결과 대조군에 비해 OAG군의 SREBP-2와 HMGCR 발현량은 유의하게 증가하였으나, 양춘사 추출물을 처리한 군의 관련 단백질의 발현량은 양성대조군인 simvastatin(SIM)군과 비슷하게 억제되었다(Fig. 4).
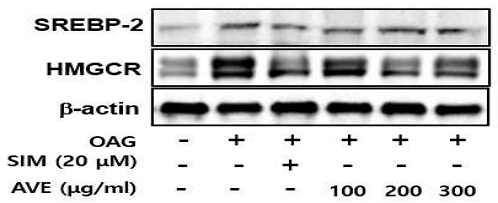
Effects of Amomum villosum extracts (AVE) on cholesterol synthesis-related protein expressions in HepG2 cells. Cells were treated with 800uM oleic acid and 10 mM glucose in the presence of various concentrations of AVE for 16h. Protein expressions were analyzed by Western blotting. SIM; 20uM simvastatin. SREBP-2; Sterol regulatory element binding protein-2, HMGCR; HMG-CoA reductase, OAG; 800 uM oleic acid + 10mM glucose.
5. 양춘사 추출물의 콜레스테롤 합성 관련 mRNA 발현에 대한 효과
양춘사 추출물(amomum villosum extracts, AVE)의 콜레스테롤 합성 관련 유전자로 알려진 sterol regulatory element binding protein(SREBP)-2와 HMG-CoA reductase(HMGCR) mRNA 발현에 대한 효과를 조사하기 위하여 800uM oleic acid와 10mM glucose(OAG군)가 포함된 배지에 다양한 농도의 양춘사 추출물을 16시간 동안 처리한 후 세포 내 mRNA 발현량을 조사하였다. 그 결과 대조군에 비해 OAG군의 SREBP-2와 HMGCR mRNA 발현량은 유의하게(p<0.01) 증가하였으나, 양춘사 추출물을 처리한 군의 관련 mRNA 발현량은 유의하게 감소하였다(Fig. 5).
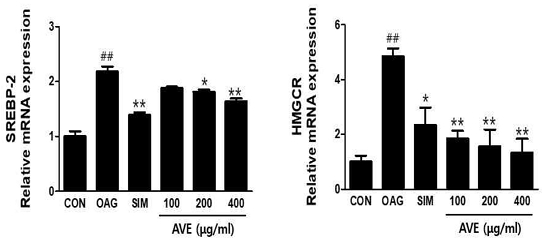
Effects of Amomum villosum extracts (AVE) on cholesterol synthesis-related mRNA expressions in HepG2 cells. Cells were treated with 800uM oleic acid and 10 mM glucose in the presence of various concentrations of AVE for 16h. mRNA expressions were analyzed by Real time OCR. Values are means±SD; n=5. ##p<0.01 vs. CON, *p<0.05, **p<0.01 vs. OAG (800uM oleic acid + 10mM glucose). CON; control, SIM; 20uM simvastatin. SREBP-2; Sterol regulatory element binding protein-2, HMGCR; HMG-CoA reductase.
고 찰
인체 생명 활동에 있어 콜레스테롤은 필수적인 지질로1) 세포막이나 스테로이드 호르몬, 담즙산 등의 구성 성분으로 사용된다2). 소수성인 지질 성분은 혈장에 녹아 운반되기 위해 아포지단백(apolipoprotein)과 결합해 지단백(lipoprotein)을 형성하고 상대적인 밀도에 따라 chylomicron, VLDL(very low density lipoprotein), IDL(intermediate density lipoprotein), LDL(low density lipoprotein), HDL(high density lipoprotein)로 구분된다18). 가장 밀도가 낮은 chylomicron은 섭취한 지질을 장에서 흡수하여 운반하는 역할을 하며 지질 비중이 단백질 비중보다 현저히 높고 VLDL, IDL, LDL, HDL 순으로 점차 단백질 대비 지질의 비율이 낮아지면서 밀도는 높아진다. 임상에서 진단과 치료에 흔히 쓰이는 것은 LDL과 HDL로서 LDL은 콜레스테롤 함유량이 상대적으로 높고 말초로 콜레스테롤을 운반하는 역할을 하기 때문에 동맥경화성 심혈관 질환의 위험도를 증가시키는 요인이 되고 HDL은 말초에서 잉여 콜레스테롤을 흡수하여 간으로 운반하기 때문에 반대로 위험도를 감소시키는 요인이 된다1,2,18-20). 이러한 지질대사과정에 장애가 생겨 혈청 총콜레스테롤, 중성지방 혹은 LDL이 상승하거나 HDL이 감소하는 경우를 포괄하여 이상지질혈증이라 일컫는다.
본 연구에서 양춘사 추출물은 불포화 지방산의 일종인 oleic acid와 glucose에 의한 총 콜레스테롤과 지방의 증가를 유의하게 억제하였다 (Fig. 2 & 3). 최근 김 등은 양춘사 추출물이 in vivo 실험조건에서 고콜레스테롤 식이에 의한 간과 혈액에서 중성지방과 콜레스테롤의 증가를 유의하게 억제한다고 보고하였다21). 본 연구에서 양춘사 추출물은 간암 세포주인 HeG2 세포에서 in vitro 고콜레스테롤과 고지방 유도 조건에서 콜레스테롤 합성을 유의하게 억제하였다. 이러한 결과는 김 등이 보고한 논문21)의 결과를 in vitro 조건에서 유사하게 재현한 결과로 사료 된다. 이는 양춘사 추출물은 in vitro, in vivo 고콜레스테롤 병태 모델에서 동일하게 콜레스테롤과 지방의 합성에 유의한 억제 효과가 있음을 시사한다.
이상지질혈증의 치료에 사용되는 약물에는 HMG CoA 환원효소(HMG CoA reductase, HMGCR) 억제제, fibrate, 담즙산 수지, 콜레스테롤 흡수 억제제, 나이아신이 있다1,2,20). HMGCR는 HMG CoA가 mevalonic acid로 변환되는 반응을 촉진하여 콜레스테롤 생합성의 주요 단계에 관여하는데, 스타틴은 이러한 HMGCR을 경쟁적으로 억제하여 콜레스테롤 생합성을 감소시키는 것이다18). 스타틴은 간의 콜레스테롤 합성을 저해하여 혈중 콜레스테롤을 간으로 유입시켜 혈중 LDL 콜레스테롤을 감소시키고 중성지방과 HDL 수치 개선에도 효능을 보이며19,20), 경구제로 1일 1회 복용하는 간단한 투약법으로 약물 순응도도 좋기 때문에1) 이상지질혈증의 일차 선택제로 권장된다. 그러나 이상지질혈증 유병률이 증가3)하면서 스타틴 처방 빈도 또한 점차 늘어날 가능성이 있으므로 약물에 대한 이상 반응과 부작용도 간과할 수 없다. 흔한 부작용으로는 소화불량, 두통, 피로감, 근육통1,19)이 있으며 심각한 경우 간독성과 근육독성이 보고된 바 있다22). 최근 서양에서 당뇨가 없는 45세 이상의 성인 9535명에 대해 15년간 추적 관찰을 실행한 연구에 의하면 스타틴 복용이 공복 혈당과 인슐린 저항성을 증가시킨다고 보고 되었다23). 이러한 스타틴의 부작용을 완화 시키면서 혈중 콜레스테롤을 낮춰주는 연구가 많이 발표되고 있다24-26).
본 연구에서 양춘사 추출물은 HepG2 세포에서 병태적으로 유발한 HMGCR 단백질 및 mRNA 발현을 유의하게 억제하였다(Fig. 4 & 5). 양춘사 추출물의 HMGCR 발현의 억제는 전체 콜레스테롤 pool을 관장하는 간의 콜레스테롤 함량의 증가를 의미하며, 이는 혈중 콜레스테롤의 간으로의 유입을 증가시키는 결과를 초래한 것으로 사료 된다. HMGCR은 간에서 콜레스테롤 함량이 감소하였을 때 전사인자인 SREBP2 증가로 인해 발현이 증가하는 것으로 알려져 있다18). Fig. 4 & 5에서 양춘사 추출물은 지방산과 포도당에 의한 SREBP2 단백질과 mRNA 발현의 증가를 유의하게 억제하였다. 이러한 결과는 양춘사 추출물이 간에서 HMGCR의 발현을 억제하고 이는 SREBP2에 의해 매개되는 것을 시사한다.
이상의 결과를 종합하면, 지방산과 포도당으로 유발한 고콜레스테롤 in vitro 병태 모델에서 양춘사 추출물은 간에서 콜레스테롤 합성을 억제시키는 효과를 나타냈으며, 그 기전을 살펴보면 간에서 SREBP-2 발현 감소로 인한 콜레스테롤 합성를 주관하는 주요 효소인 HMGCR 발현 억제가 관여함을 나타낸다. 이러한 양춘사 추출물의 콜레스테롤 합성억제 효과가 statin류의 항콜레스테롤 제제와 유사함을 의미하며, 향후 본 연구를 근거로 항콜레스테롤 효과에 대한 양춘사 추출물의 임상 연구가 시행된다면 이상지질혈증을 예방하거나 치료할 수 있는 후보물질 중 하나가 될 것으로 사료 된다.
결 론
본 연구는 HepG2 세포에서 지방산과 포도당으로 유발된 콜레스테롤 합성 증가에 대한 양춘사 추출물의 억제 효과 및 기전을 연구하여 아래와 같은 결과를 얻었다. 양춘사 추출물은 지방산과 포도당으로 인한 콜레스테롤과 지방 합성증가를 유의하게 억제하였으며, 그 기전에 SREBP-2와 HMGCR 발현 억제가 관여하였다. 이상의 결과는 양춘사 추출물이 간에서 콜레스테롤 합성을 억제하는데 효과가 있으며 향후 고콜레스테롤 혈증의 예방제 및 치료제 개발의 후보물질이 될 수 있음을 시사한다.
Acknowledgments
본 연구는 2020년도 중소벤처기업부의 중소기업기술개발사업지원에 의한 연구임 (Project No. S2853447).
References
- Jameson JL, Fauci, AS, Kasper DL, Hauser SL, Longo DL, Loscalzo J. Harrison's Principles of Internal Medicine, 20th edition. New York:McGraw-Hill Education. 2018:2889-91, 2900-902.
- Goldman Lee, Andrew I. Schafer. Goldman-Cecil Medicine, 25th edition. Philadelphia, PA. Elsevier Saunders. 2016:1389-97.
- Korea Centers for Disease Control and Prevention. Korea Health Statistics 2018: Korea National Health and Nutrition Examination Survey (KNHANES Ⅶ-3). 2019:26-7.
- Seon IC. Drug research and development tend to hyperlipidemia. Journal of Hawhwa Medicine. 2009;18(2):1-12.
- Hong YK, Kim SS, Shin MK, Kim JJ. Review of Korean Medical Treatment in Hyperlipidemia - Focusing on Treatment of Korean Herbal Medicine. Korean J. Oriental Physiology & Pathology. 2010;24(1):9-14.
- Herbology Editorial Committee of Korean Medicine. Herbology. Seoul. Younglinsa. 2020:331-2.
-
Pharmacology Editorial Committee of Korean Medicine. Korean Pharmacology. Seoul. Shinil Books. 2015:749-50.
[https://doi.org/10.1016/S0014-2999(15)00088-6]

-
Sizhuo Suo, Yunfeng Lai, Meng Li, Qirui Song, Jing Cai, Jing Zhao, et al. Phytochemicals, pharmacology, clinical application, patents, and products of Amomi fructus. Food and Chemical Toxicology. 2018;119:31-6
[https://doi.org/10.1016/j.fct.2018.05.051]

- Choi BY, Jung IC, Lee SR. Effects of Amomum villosum (AMV) Extract on the Alzheimer's Disease Model. Korean J. Oriental Physiology & Pathology. 2006;20(1):43-51.
- Lee JH, Jhao ZL, Cho NP, Park BH, Kwon KB, Rho HW. Study on the Antidiabetic Effect of Amomum xanthioides Extract. Korean J. Oriental Physiology & Pathology. 2007;21(2):468-73.
- Rho HW, Lee JN, Koo BS, Zhao ZL, Park JW, Kim HR. Therapeutic Effect of Amomum xanthoides Extract on Experimental Diabetes Induced by Alloxan. Diabetes and Metabolism journal. 2002;26(2):126-33.
-
Park BH, Park JW. The protective effect of Amomum xanthoides extract against alloxan-induced diabetes through the suppression of NF-κB activation. Experimental and Molecular Medicine. 2001;33(2):64-8.
[https://doi.org/10.1038/emm.2001.12]

-
Kim HR, Antonisamy P, Kim YS, Lee G, Ham HD, Kwon KB. Inhibitory effect of Amomum villosum water extracts on α-glucosidase activity. Physiological and Molecular Plant Pathology. 2022;117;101779.
[https://doi.org/10.1016/j.pmpp.2021.101779]

-
Shanhong Lu, Ting Zhang, Wen Gu, Xingxin Yang, Jianmei Lu, Ronghua Zhao, et al. Volatile Oil of Amomum villosum Inhibits Nonalcoholic Fatty Liver Disease via the Gut-Liver Axis. BioMed Research International. 2018; 3589874:16.
[https://doi.org/10.1155/2018/3589874]

-
Wang JH, Shin JW, Choi MK, Kim HG, Som CG. An herbal fruit, Amomum xanthoides, ameliorates thioacetamide-induced hepatic fibrosis in rat via antioxidative system. Journal of Ethnopharmacology. 2011;135(2):344-94.
[https://doi.org/10.1016/j.jep.2011.03.026]

-
Lee SH, Kim JY, Kim H, Park SK, Kim CY, Chung SY, Chang GT. Amomum villosum induces longitudinal bone growth in adolescent female rats. Journal of Traditional Chinese Medicine. 2012;32(3):453-8.
[https://doi.org/10.1016/S0254-6272(13)60054-0]

-
Kim HR, Antonisamy P, Kim YS, Kwon YG, Ryu DG, Lee YR, Lee G, Ham HD, Kwon KB. Amomum villosum Lour. fruit extract ameliorates high-fat diet-induced body mass gain and adipogenic pathways in C57BL/6 mice. Journal of King Saud University–Science. 2021;33:101473
[https://doi.org/10.1016/j.jksus.2021.101473]

- Champe PC, Harvey RA, Ferrier DR. Lippincott's Illustrated Reviews: Biochemistry, 4th edition. Philadelphia. LWW. 2008:219-37.
- Harvey RA, Clark MA, Finkel R, Rey JA, Whalen K. Lippincott's Illustrated Review:Pharmacology, 5th edition. Seoul. Shinil books. 2012:265-75.
- Edmunds MW. Introduction to Clinical Pharmacology. Seoul. Hyunmoonsa. 2018:213-8.
-
Kim YS, Kim HR, Antonisaym P, Lee YR, Lee G, Jung HJ, Kwon KB. Amomum villosum Lour. Fruit extract mitigates hyperlipidemia through SREBP-2/LDLR/HMGCR signaling in high-cholesterol diet-fed mice. Journal of King Saud University – Science. 2022;24:102230.
[https://doi.org/10.1016/j.jksus.2022.102230]

- Choi HJ, Park JN. Management of Risk of Statin Therapy. Korean Journal of Family Medicine. 2004;25(10):713-20.
-
Ahmadizar F, Ochoa-Rosales C, Glisic M, Franco OH, Muka T, Sticker BH. Associations of statin use with glycaemic traits and incident type 2 diabetes. Br J Clin Pharmacol. 2019;85:993-1002.
[https://doi.org/10.1111/bcp.13898]

- Choi SH, Son CG, Kim JM, Seol IC. Study for Trends of Antihyperlipidemic Studies using Herbal Plants. Korea j. Orient. Int. Med. 2010;31(3):448-56.
- Lee SK, Lee SS, Baek JW, Lee SJ, Kim KH. Effect of CRATAEGII FRUCTUS on Sarum Lipid in High Cholesterol Diet Induced Hyperlipide Rats. Journal of Society of Preventive Korean Medicine. 2003;7(2):13-22.
- Kim HC, Kim HW, Cho SI, Kim YS, Lee JS, Kwon JN, et al. Effects of Salviae miltiorrhizae Radix(SMR) on Serum Lipid Level in Hyperlipidemic Rats. Kor. J. Herbology. 2007;22(4):239-45.