태극삼의 장기투여가 인지기능향상과 기억력증진에 미치는 영향
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
To investigate effects of cognitive function improvement whether against Taegeuk ginseng on scopolamine-induced memory impairment in rats. All experiments were conducted in three groups: the control group (CTR), the scopolamine 0.4mg/kg (SCP), and the scopolamine (SCP+T) treated with Taegeuk ginseng 100 mg/kg. Taegeuk ginseng 100 mg/kg daily was orally administered for one month and treated with scopolamine was only for 7 consecutive days on the Morris water maze task. 3 weeks after oral administration of Taegeuk ginseng, subjects were performed the Morris water maze test for 8 days and then the open-field exploration test which to assessed for cognitive function improvement. After behavioral testing, subjects were sacrificed and microdissected brains for neurochemical analysis. In the cognitive-behavioral test, long-term administration of Taegeuk ginseng improved spatial navigation learning task compared with the impeded by scopolamine treatment. In neurochemistry, the expression of the synaptic marker PSD95 (postsynaptic density protein 95) was increased in the hippocampus compared to the scopolamine group. Also, brain-derived neurotrophic factor (BDNF) expression was significantly increased in the taegeuk ginseng administration group. These data suggested that long-term administration of taegeuk ginseng might improve cognitive-behavioral functions on hippocampal related spatial learning memory, and it was correlated with neurotropic and synaptic reinforcement. In conclusion, treatment with taegeuk ginseng may positive outcome on learning and memory deficit disorders.
Keywords:
Postsynaptic density protein 95 (PSD95), Brain-derived neurotrophic factor (BDNF), Scopolamine, Morris water maze, Rat, Exploration, Spatial navigation learning, Cognitive function서 론
21세기 이후 우리 사회는 기대 수명이 증가함과 동시에 고령화사회 진입에 따른 여러 가지 의료적 문제에 직면하게 되었다. 특히, 치매와 알츠하이머병의 유병률은 지속해서 증가하여 2019년 959,001명에 달하였고 그에 따른 의료비도 16조 5천억 원까지 증가하였다1). 일반적으로 인지기능은 아동기부터 성인기에 이르기까지 점차 증가하고, 성인기의 어느 시점에서 정점에 이른 후 노년기로 갈수록 감소하기 시작한다2). 따라서 고령사회를 넘어 초고령화 사회를 앞둔 우리 사회에서 인지기능과 기억력 증진에 관한 관심은 지속해서 증가하고 있으며, 관련 연구의 중요성 또한 주목받고 있다.
한편, 고령인구의 증가는 식품의 질적 향상과 영양학적 증진과는 별개로 건강기능식품에 관한 관심과 수요를 증가시켰으며, 현대인에게 건강기능식품은 매우 중요한 부분이 되고 있다3). 그 결과 우리나라 건강기능식품 관련 산업은 2011년 이후 연평균 약 7.4% 성장하였다. 그중에서도 인삼 관련 제품은 약 40%의 점유율을 차지하고 있다4).
인삼은 여러 아시아 국가에서 2,000년 이상 건강 증진 및 치료를 위해 전통적으로 사용되어 왔다. 주로 백삼과 홍삼의 형태로 가장 많이 사용되며, 백삼은 인삼을 말린 뒤 사용하고, 홍삼은 쪄서 말린 형태를 말한다5). 인삼에는 진세노사이드(ginsenosides), 플로이아세틸렌 (ployacetylenes), 페놀화합물 (phenolic compounds) 등을 포함하고 있다. 이중 진세노사이드는 인지활동에 중요한 활성 물질로 알려져 있다6).
가공하지 않은 인삼은 수분 함량이 75%에 달해 수삼이라고 불린다. 수삼은 수일 이상 신선하게 저장하기 힘들어, 유통 과정에서 변질의 위험이 있어 오래전부터 수삼을 가공하고 보존성을 유지하는 방법들이 생겨났으며, 그 가공 방법에 따라 백삼, 홍삼, 태극삼 등으로 불린다. 수삼을 열풍으로 말린 형태를 백삼, 증기 등으로 쪄서 말린 것을 홍삼이라고 하며, 이들은 각각 수삼에 비하여 인삼의 주요 생리활성 물질인 진세노사이드가 증가하는 것으로 알려져 있다33). 현재까지 인삼의 성분분석 및 약리 효능 연구들은 주로 수삼, 백삼, 홍삼 등에 한정되어 있었으며, 태극삼에 관련된 연구는 희소하였다34).
인삼의 인지기능과 기억력 개선 기전으로는 심혈관 및 뇌혈류 증가, 신경보호 효과, 혈당강하 효과에 의한 2차 효과, 신경전달물질 조절 등이 있다7). 홍삼이 인지기능 향상에 긍정적인 영향을 미친다는 사실은 다양한 동물실험과 임상실험을 통해서도 알려져 있다8). 그러나 지금까지 인지기능 향상을 위한 인삼에 함유된 생리활성 성분들의 특정한 뇌 부위에 관한 연구는 미비한 실정이다. 특히 새로운 형태의 인삼 가공품인 태극삼이 인지기능 향상에 미치는 영향은 아직 확인되지 않았다.
본 연구에서는 홍삼의 기억력 개선 효과 연구를 기초로 하여 태극삼의 기억력 개선 효과의 여부를 확인하고, 신경보호 및 시냅스 강화 관련 단백질 발현을 측정함으로써 중추신경계 작용기전에 대하여 알아보고자 하였다.
재료 및 방법
1. 실험 동물
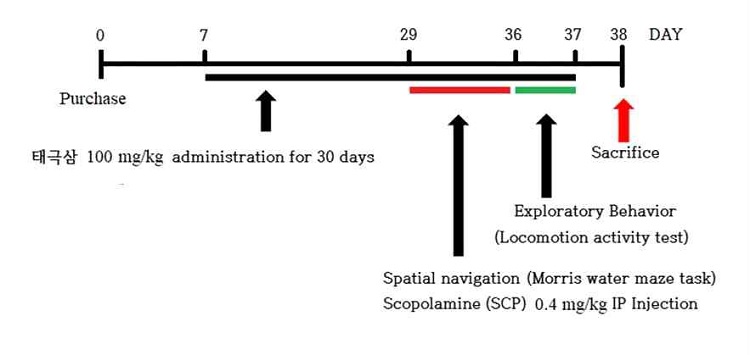
실험 동물은 7주령 수컷 Sprague-Dawley (SD) 흰쥐를 구입하여(SamTaco Co. Osan, Korea) 사용하였다. 흰쥐들은 조절된 사육 환경(12 h Light/Dark cycle, 실온 22 ± 2℃, Humidity < 65%)에서 일주일 동안 적응시킨 후 실험에 사용하였다. 실험군 구분은 실험 개시일 측정한 체중을 기준으로 라틴제곱법(Latin square method)에 의해 4개의 그룹으로 나누었다. 8주령 흰쥐를 대조군(CTR), 스코폴라민 단독 투여군(SCP, 0.4 mg/kg, IP injection) 및 스코폴라민과 태극삼 투여군 (SCP+T, 100 mg/kg, 30일 동안 매일 경구 투여)으로 나누었다. 스코폴라민은 수중미로를 이용한 공간지각 학습 검사 동안 8일간 투여하였다. 본 연구는 생명윤리법과 실험동물사용에 관한 윤리지침을 준수하였으며 원광대학교 실험동물윤리위원회의 승인 (#WKU 16-49)을 받고 수행되었다.
2. 실험재료
태극삼(Taegeuk ginseng) 시료는 진안에서 재배된 4년근 인삼을 원료로 하여 (재)진안홍삼연구소에서 깨끗이 세척한 인삼을 증삼기에서 1회 증삼하고 건조하여 태극삼을 제조하였다. 태극삼의 사포닌 함량은 g당 Rg1: 1.81 mg, Rb1: 3.12 mg, Rg3: 0.07 mg으로 측정되었다.
3. 모리스 수중미로 실험(Morris water maze test)
수중미로 실험을 통해 실험 동물의 인지기능 강화 및 공간지각 능력을 측정하였다. 총 8일의 실험 기간 중 7일은 훈련기간(training session)으로 훈련기간이 끝난 후 증명실험(probe test)로 진행하였다. 실험장비는 직경 180 cm, 높이 60 cm 크기의 원통형 스테인리스탱크에서 진행되었고 사분면 중 한 구획에 아크릴로 만든 도피대(escape platform)를 고정하고 표면은 수면 아래 1 cm에 잠기도록 하여 표면에서 보이지 않도록 설계하였다. 훈련기간 동안 실험 동물은 하루에 4회씩 4곳의 다른 방면에서 입수 위치를 달리하여 60초 동안 수영하여 도피대를 찾게 하였고, 도피대를 찾은 경우와 찾지 못한 경우 모두 15초 동안 도피대에 머물도록 하여 공간지각에 대한 학습이 이루어지도록 배려하였다. 도피대에 도달하는 시간은 Video tracking 장치(Ethovision VI, Noldus Co., Spain)을 사용하여 기록하고 측정하였다. 수중미로 학습에 대한 증명실험은 모리스 수중미로 실험 8일차에 도피대를 제거한 후 새로운 입수장소에서 1회 시행하였으며 60초 동안 진행하였다. 수중미로 실험 진행 30분 전에 스코폴라민 (0.4 mg/kg, I.P. injection)을 투여하였다. CTR군은 태극삼 투여군과 동일한 부피의 주사용 생리식염수(water for injection)을 복강 내 투여하였다.
4. 탐색행동검사(Open-field test)
실험동물의 상황 인지 및 불안 행동을 측정하기 위하여 개방공간 탐색행동 검사를 수행하였다. 사각형의 아크릴 상자(45 x 45 cm) 안의 열린 공간에 실험동물을 노출시킨 뒤 5분 동안 탐색행동을 관찰하였다. 탐색행동상자에는 적외선 센서가 x 및 Y축에 2.54 cm 간격으로 장착되어 있었으며, 실험동물들의 행동은 활동모니터(Activity Monitor ENV-520; Med Association Inc., VT, USA)를 사용하여 측정하였다.
5. 단백질발현 측정(Western blot analysis)
행동 실험 후에 실험동물의 뇌내 단백질발현을 측정하기 위해 실험동물을 희생시킨 후 뇌를 적출하고 미세 해부하여 해마 부위를 분리하였다. 분리된 해마는 차가운 PBS로 두 번 세척한 뒤, Lysis buffer (50 mM HEPES, 150 mM NaCl, 1% 데옥시콜레이트, 1 mM EDTA, 1 mM PMSF 및 1 μg/ml 아프로티닌, pH 7.4)에 넣어 용해하였다. 이후 얼음 위에서 1시간 동안 시료를 배양한 후, 조직을 4℃에서 10,000 rpm으로 30분 동안 원심분리하고 상층액을 분리 수집하였다. 상층액의 단백질 농도는 Bradford 방법을 사용하여 결정하였다. Western blot 분석을 위해 동일한 양의 단백질을 10% 또는 15%의 SDS-PAGE gel 에서 전기영동 시킨 후, PVDF membrane으로 옮겼다. 이후 PVDF membrane을 PBS에 녹인 5% 탈지유로 90분 동안 blocking 하고, PBST로 세척하였다. Immunoblot은 PSD95 단백질을 인식하는 특정항체(PSD95 antibody, abcam, London)를 사용하여 분석하였다. 그런 다음 PVDF membrane을 PBST로 세척하고 1시간 동안 이차 항체(Anti-rabbit IgG, cell signaling, Boston, MA, USA)로 처리하였다. 최종적으로 ECL 키트(Millipore Co., Beillerica, MA, USA)를 사용하여 단백질을 화상이미지분석기 (Chemiluminescence Analyzer, Vilber Lourmat, France)를 이용하여 분석하였다.
6. 통계 분석
행동 실험 결과는 평균(mean) ± 표준오차(standard error)로 표기하였으며, 실험군 당 n = 6 이상이 되도록 하였다. 해마 조직을 이용한 신경화학 실험은 3회 수행되었으며 결과는 평균(mean) ± 표준편차(standard deviation)로 표시하였다. 일원 분산 분석(analysis of variance; ANOVA)을 사용하여 그룹 간의 데이터를 비교하였고, 통계적으로 유의미한 차이가 발생했을 때 사후 검정(post-hoc test)은 Fisher’s PLSD을 이용하여 분석하였다. 유의성은 p < 0.05로 설정하였다. 통계분석에는 GraphPad Prism 4.0 (GraphPad Software, San Diego, CA, USA)를 사용하였다
결 과
1. 수중미로 학습 검사
수중미로 실험은 해마 의존성 장기 기억과 공간 기억을 평가하는데 널리 사용되는 실험이다9). 실험동물이 도피대까지 찾아가는 데까지 걸리는 평균탈출시간(mean escape latency)를 측정한 결과, 훈련기간의 초기에는 CTR군 43.13 ± 4.26, SCP군 47.01 ±3.77, SCP+T군은 52.38 ± 3.06 이다(F(2, 69) = 1.553, p = 0.219). 그러나 CTR군과 비교하여 SCP군과 SCP+T군은 훈련시기(training session) 3일차까지 차이가 없다가 4일차에 CTR군 21.08 ± 3.11, SCP군 36.00 ± 4.78, SCP+T군 33.08 ± 4.28으로 CTR군에 비해 스코폴라민을 투여 받은 나머지 실험군의 탈출시간이 지연됨을 관찰하였다(F(2, 69) = 3.685, p = 0.302). SCP군은 CTR군에 비해 4일차 이후에도 지속적으로 탈출시간이 유의하게 지연되었으나, SCP+T군은 SCP 그룹과 달리 스코폴라민 투여에 의해 유도된 탈출시간 지연현상이 극복되는 경향을 관찰되었으며, 6일차에는 SCP군에 비해 유의한 차이가 관찰되었다(F(2, 63) = 8.572, p = 0.0005, Fig. 2).
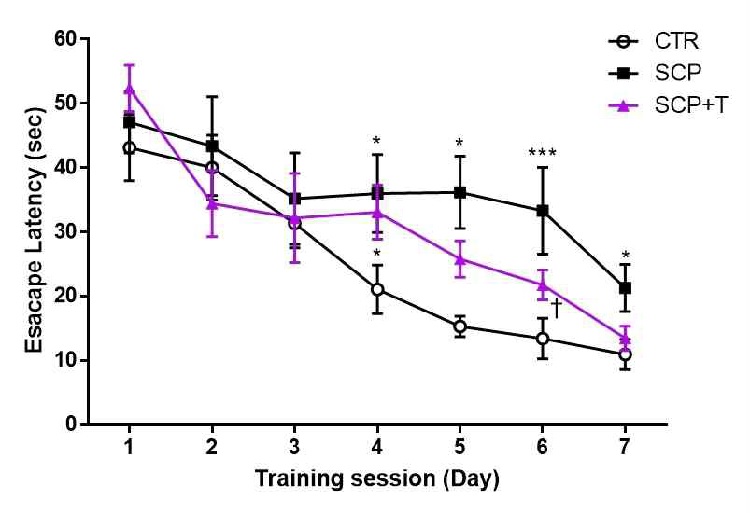
Measurement of the mean escape latency on training session in Morris water maze task. Data are expressed as the mean ± S.E.M. (n = 6), * p < 0.05, *** p < 0.001 vs. the CTR group, † p < 0.05 vs. the SCP group by ANOVA (post-hoc test by Fisher's PLSD).
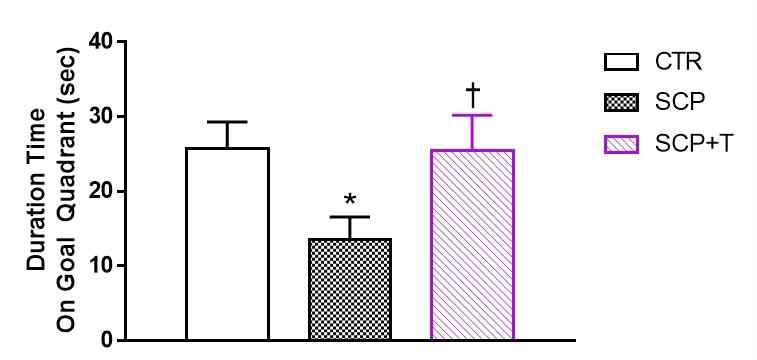
훈련기간 이후 검증실험에서 도피대가 있던 영역을 찾아가는 횟수(Frequency on plat form)는 SCP군에서 다른 그룹보다 현저하게 감소된 모습을 보였다. SCP+T군은 CTR군과 유사한 결과를 보였다. (CTR (2.167±0.703), SCP (0.333±0.211), SCP+T (2.667±0.615), F(2, 15) = 4.939,p = 0.0225)) (Fig 3). 또한 도피대가 있던 사분면에 머무는 시간(Duration time on Goal quadrant)을 측정한 결과 역시 SCP군에서 다른 군들에 비하여 감소하였으며, CTR군과 SCP+T군에서는 비슷한 시간을 보였다. ((CTR(25.667±3.612), SCP (13.500±3.096), SCP+T (25.500±4.689), F(2, 15) = 3.273, p = 0.0661)) (Fig 4). 이를 통해 SCP+T군에서 SCP군에 비하여 도피대가 있던 자리를 기억하여 그 주변을 찾아가고, 머무르는 시간이 증가함을 확인할 수 있었다.
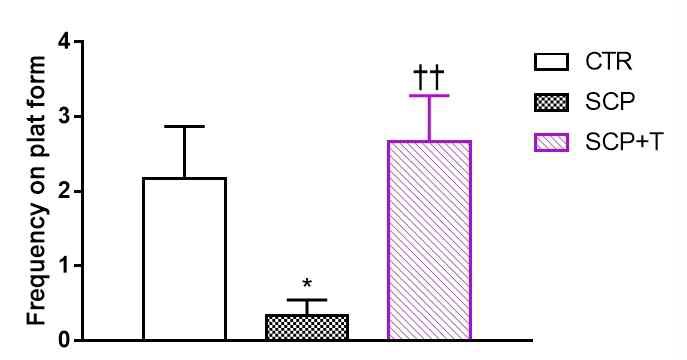
Measurement of the accurately crossing frequency on plat form exist area in the probe test after training session in Morris water maze test. Data are expressed as the mean ± S.E.M. (n = 6), * p < 0.05 vs. the CTR group, †† p < 0.01 vs. the SCP group by ANOVA (post-hoc test by Fisher's PLSD).
2. 보행활동도 행동 검사
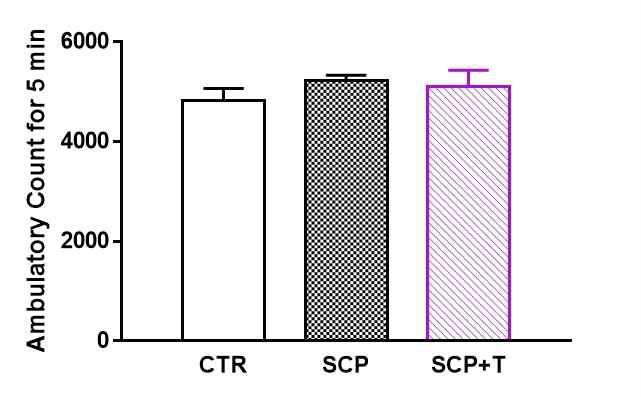
탐색행동 검사를 통해 보행활동도를 측정하였다. 태극삼의 장기간 경구 투여가 scopolamine에 의한 기억 상실 모델에서 탐색행동 및 불안에 영향을 미치는지 여부를 확인하기 위해 open-field test를 진행하였다. 흰쥐는 새로운 환경에서 상황학습을 위해 탐색행동을 하며, 이 때 관찰되는 보행 수(locomotive activity)를 측정하여 탐색행동의 정도를 확인할 수 있다. 실험결과 5분 동안의 총 보행활동도는 CTR군 4,818.2 ± 247.8, SCP군 5,223.3 ± 114.2, SCP+T군 5,149.3 ± 305. 4로 관찰되었으며, 실험군 사이에는 보행 횟수에 유의미한 차이는 보이지 않았다(Fig. 5).
3. 해마에서 신경화학적 검사
행동검사를 마친 흰쥐를 희생시킨 후 적출된 되에서 해마를 분리하여 시냅스 형성과 기능에 중요한 역할을 하는 세포내 구조 단백질인 PSD95와 신경기능 조절인자로서 신경회로의 구축과 기능발달 및 기억형성에 중요한 역할을 하는 것으로 알려진 BDNF를 측정하였다. 해마에서 PSD95 단백 발현은 SCP군에서 감소되었고, SCP+T군에서는 증가되는 것이 관찰되었다(Fig. 6A). 해마에서 BDNF 단백 발현은 CTR군에 비해 SCP군은 변화가 없었으나, SCP+T군에서는 SCP군에 비해 증가를 확인할 수 있었다(Fig. 6B).
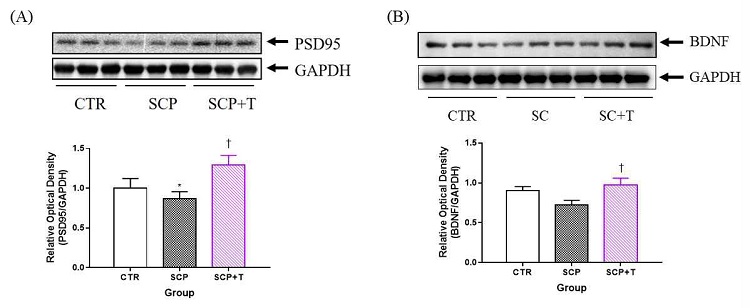
Representative pictures of Western-blot images and measurement of relative optical densitometry of PSD95 (A) and BDNF (B) in hippocampus of the long-term treatment with taegeuk ginseng rat brain. Data are expressed as the mean ± S.D., * p < 0.05 vs. the CTR group, † p < 0.05 vs. the SCP group by ANOVA (post-hoc test by Fisher's PLSD).
고 찰
현재 우리나라의 고령인구 증가 추세는 가속화되고 있으며, 2017년 우리나라 65세 이상 노인인구는 약 725만여 명으로 전체 인구의 14%를 넘어서면서 고령사회(aged society)가 되었고, 2026년에는 고령인구 분초가 21% 이상인 초고령 사회에 진입할 것으로 전망되고 있다10). 우리나라뿐만 아니라 2030년에는 세계적으로 34개 국가에서 초고령 사회에 진입할 것으로 전망되고 있다. 이에 노화와 관련하여 나타나는 퇴행성질환들에 대한 사회적 관심이 증가하고 있다.
고령화는 알츠하이머병이나 치매 등 인지능력 및 기억력 저하를 유발하는 신경퇴행성 질환들의 가장 강력한 위험인자이다11). 치매의 발생률은 63세 이상에서 그 이하 보다 약 3배 높으며, 75세에는 다시 2배, 84까지는 1.5배로 증가된다고 보고되었다12). 결과적으로 65세 이상 노인에서 유병률은 약 10%에 이를 것으로 전망된다1). 따라서 고령화가 가속화되고 있는 현시점에서 노인인구에서 발병되는 인지기능 저하 및 기억력 장애와 관련하여 의료적 문제, 사회적비용 증가, 삶의 질 저하 등의 문제가 지속해서 증가할 것으로 예상된다. 기억력의 감소는 삶의 질을 현저히 감소시키는 것으로 인식되는데, 이는 진행된 질환에서뿐만 아니라 경도인지장애 등 질병의 초기부터 삶의 질은 급격히 저하되는 것으로 알려져 있다13).
노인에서 나타나는 신경퇴행성 질환의 치료약물의 부작용과 관련해서 지속적으로 문제가 제기되고 있는데, 현재 임상에서 사용 중인 알츠하이머 치매의 대표적인 치료제로는 아세틸콜린분해효소 억제제(Acetylcholinesterase inhibitor)인 Donepezil, Rivastigmine, Galantamine 등과 흥분성 아미노산인 글루타메이트(glutamate)의 이온통로 수용체인 NMDA 수용체 길항제(antagonist)인 Memantine 등이 주로 사용되고 있다. 하지만 이들 약제는 구토, 설사, 소화불량, 식욕저하, 현기증, 초조, 마비, 어지럼증 등의 부작용이 빈번히 발생한다고 보고되었다14,15). 또한 부가적인 증상조절을 위한 항우울제, 항정신병약물 및 항경련제 등도 입마름(xerostomia), 변비(constipation), 기립성 저혈압(orthostatic hypotension) 등의 부작용뿐만 아니라 심장마비와 같은 치명적인 부작용을 초래할 가능성이 있다. 치매의 특성상 노인환자의 비중이 매우 높기 때문에 이와 같은 부작용들은 더욱 심각한 문제를 초래할 수 있다.
한편, 기대 수명이 점차 증가함에 따라 삶의 질에 관련한 관심과 함께 건강식품에 대한 욕구도 증가하고 있다. 특히 인삼은 2000년 전부터 동양권 국가들에서 사용되고 왔으며, 당뇨병을 비롯한 대사질환, 순환기계질환, 악성종양 및 육체적, 정신적 작업 수행 능력증진 등에 대한 여러가지 효능 등이 알려져 있다고 보고되었다16). 또한 인삼의 학습과 기억력 향상에 대한 효과도 여러 연구들에서 입증되고 있다.
동물 실험에서 인삼추출물 투여가 기억 증진 효과에 있어서 모든 단계를 향상시켰다고 보고되었으며17), 인삼 투여는 학습 및 기억 증진효과로 기억장애 회복에 효과적이라고 보고되었다18). 다른 연구에서 인삼의 효능은 기억능력을 향상시킬 뿐만 아니라 주관적 삶의 질과 기분을 향상시킨다고 보고되었다19). 인삼의 효능을 나타내는 주요 활성성분으로는 인삼사포닌이 제시되고 있는데 타 식물사포닌과 구별하기 위하여 ginsenoside라고 불리며, 지금까지 약 30여 종의 ginsenoside가 분리되어 그 화학구조가 밝혀져 있다20). 그러나 다양하게 나타나는 ginsenoside는 인삼을 홍삼이나 백삼 등으로 가공하는 과정에서의 처리 방법에 따라 각기 다른 종류의 ginsenoside가 활성화된다. 현재까지의 연구들은 주로 인삼을 쪄서 말린 형태인 홍삼과 원료 그대로 건조시킨 백삼에 주로 한정되어 있었다21). 본 연구의 목적은 새로운 인삼 가공식품인 태극삼의 인지기능과 기억력 향상에 미치는 영향을 확인하는 것이다.
본 연구에서는 스코폴아민(scopolamine) 투여에 의한 장기 기억장애 실험동물에서 태극삼을 장기간 투여한 후 인지기능 향상효과를 살펴보기 위해 인지행동 실험을 공간지각 학습검사인 수중미로 검사와 상황학습 및 불안 상태 측정을 위한 개방공간 탐색활동 검사를 시행하였다. 또한 공간 기억에서 중추적 역할을 하는 것으로 알려진 해마에서 신경망 강화와 관련된 PSD95의 발현과 신경회로의 구축 및 기능발달과 관련된 BDNF의 신경화학적 검색을 하였다.
실험에 사용된 스코폴아민은 무스카린성 콜린성 수용체 길항제(muscarinic cholinergic receptor antagonist)로서 기억력 저하 및 인지능력 감퇴에 대한 연구에서 사용되는 실험동물 모델에 널리 사용되고 있다. 스코폴아민 투여는 콜린성 신경전달의 차단과 콜린성 기능 이상과 함께 인지능력의 저하가 관찰된다고 보고되었다22). 이는 알츠하이머 환자의 해마와 대뇌피질에서 choline의 재흡수와 acetylcholine의 합성이 감소하는 것과 유사한 효과를 나타내게 된다.
수중미로 검사에서 스코폴아민만 단독 투여한 실험군(SCP)은 7일간의 훈련기간(training session) 동안 도피대(escape platform)를 찾아가는데 걸리는 탈출시간(escape latency)감소가 저해되는 것이 관찰되었으나, 태극삼을 투여 받은 실험군(SCP+T)은 지속적으로 평균탈출시간이 감소하여 마지막 7일 째에는 대조군(CTR)과 대등한 결과 값을 나타냈다(Fig. 2). 탈출시간의 감소는 장기 기억과 관련된 공간 지각 학습 능력을 나타낸다고 여겨지며, 이러한 결과는 태극삼의 장기 투여가 장기 기억 향상에 효과적임을 시사한다. 훈련 기간 후에 1회성으로 판정하는 검증 검사(probe test)에서 다시 한 번 명확하게 입증되었는데, 도피대가 있었던 위치를 정확하게 찾아가는 횟수(crossing frequency)와 사분면에 머무르는 시간(dwelling time in goal quadrant)은 실험동물이 도피대의 위치를 기억하는지 여부를 나타내며, 두 결과 모두 태극삼을 투여한 SCP+T군에서 스코폴아민만을 투여한 SCP군보다 유의하게 높게 관찰되었다(Fig. 3).
개방공간에 노출시켰을 때 보이는 탐색행동검사에서는 스코폴아민만을 투여한 SCP군, 태극삼을 함께 투여한 SCP+T군, 그리고 대조군(CTR) 사이에서 유의한 차이가 관찰되지 않았다. 이는 장기간 태극삼의 투여는 상황 학습과 불안에 영향을 미치지 않았다는 것을 시사한다. 즉, 약물을 장기 투여했을 때의 안정성을 확인할 수 있었다. 다만 상황학습과 불안이 반드시 탐색활동의 저하 혹은 증가와 연관되는 것은 아니기 때문에 안정성에 대해서는 추가적인 연구가 필요할 것으로 생각된다.
중추신경계에 존재하는 뇌-유래 신경세포성장인자(BDNF)는 neurotrophin family에 속하는 내인성 이합체 단백질(dimeric protein)로 신경성장인자(nerve growth factor; NGF)의 일원이다23). BDNF는 중추 및 말초 신경계의 유지와 발달에 관여하며, 신경독성 인자로부터 신경세포를 보호하고, 신경전달물질의 조절이나 신경가소성에서 중요한 역할을 하는 것으로 알려져 있다24). 이와 관련하여 BDNF와 신경학적 질환의 연관성이 여러 연구 들에서 보고되었으며, 알츠하이머 역시 BDNF 유전자의 다형성과 관련이 있음이 보고되었다25). 본 연구에서 태극삼의 장기투여는 공간지각 학습과 장기기억에 관여하는 해마에서 BDNF 단백 발현을 증가시키는 것으로 나타났다(Fig. 6B). 이는 홍삼을 이용한 다른 연구와 유사한 결과를 보여주었다35).
PSD95는 시냅스후 세포막에 매우 가깝게 위치하여 존재하는 구조 단백질로써 시냅스의 형성과 기능, 가소성 조절 및 신경망 강화와 관련하여 중요한 역할을 차지하고 있다26). BDNF와 마찬가지로 여러 연구들에서 PSD95의 발현과 신경학적 질환들의 연관성이 보고되었다. 발달중인 뇌의 해마에서 PSD95의 발현이 억제될 경우 장기간의 기억력 손상이 발생한다고 보고되었다27). 또한 PSD95 단백질 수준이 감소되었음을 인지장애가 있는 피험자의 해마에서 관찰하여 PSD95가 알츠하이머 및 기억상실에 관련되었다고 보고되었다28). 해마 신경세포에서 PSD95의 과발현은 글루타메이트성 시냅스의 성숙을 유도할 뿐만 아니라 시냅스 후 클러스터링, 글루타메이트 수용체의 활성 및 시냅스 전 말단의 성숙을 유도하여 시냅스 안정화 및 신경가소성에서의 역할을 수행하는 것으로 보고되었다29,30). 즉, PSD95의 증가는 기억력 향상과 관련이 있으며, 본 연구에서도 태극삼을 투여한 군에서 PSD95 발현의 증가가 관찰되었다. 이는 홍삼을 이용한 다른 연구에서도 비슷한 결과를 보였다31).
본 연구의 실험결과를 종합해 보면, 태극삼의 장기간 투여는 인지기능 향상과 기억력 증진에 효과가 있음을 확인할 수 있었다. 태극삼을 포함한 식품 및 건강보조제는 노화와 관련한 인지기능 및 기억력 감퇴에 대해 효과적일 수 있으며, 이를 이용하여 부작용을 최소화한 새로운 약제의 개발 가능성이 있음을 보여주었다. 이와 관련한 연구들도 활발히 이루어지고 있으며, Park등은 인삼성분을 포함한 경옥고가 콜린성 기능 장애로 인한 기억력 감소 상태를 개선시킬 수 있다고 보고하였고36), Chang등은 인삼열매추출물의 학습 및 기억손실 개선효과를 입증하여 천연물 신소재 개발의 가능성을 보고하였다37).
다만 알츠하이머 등 인지기능 저하와 기억력 감소를 나타내는 질환들의 병인은 단일한 기전이라기보다는 amyloid 축적, 단백질의 과인산화, 신경전달물질의 이상, 산화적 손상, 염증반응, 신경영양인자 결핍 등 다양한 요소들이 복합적으로 작용하게 된다32). 따라서 태극삼의 정확한 효능 및 기억력 개선 효과의 기전을 알기 위해서는 추가적인 연구가 필요할 것으로 생각된다.
결 론
본 연구는 태극삼의 장기투여가 인지능력 및 기억력 향상 효과를 실험적으로 규명하기 위하여, 스코폴아민 투여로 기억력 손상을 유도한 동물모델 실험을 시행하였다. 수중미로 학습검사 결과 태극삼은 스코폴아민으로 손상된 기억력을 회복하는데 도움이 되는 것을 확인하였다. 또한 태극삼은 해마에서 BDNF와 PSD95 단백의 발현을 증가시켰고, 실험동물에서 상황학습과 불안에 영향을 미치지 않았다. 결과적으로 태극삼의 장기 투여는 인지기능향상과 기억력 증진에 효과를 나타낼 수 있으며, 태극삼을 포함한 식품 및 건강보조제는 노화와 관련한 인지기능 및 기억력 감퇴에 대해 효과적일 수 있음을 시사한다.
Acknowledgments
본 연구는 한국연구재단의 지원을 받았음. (NRF-2020R1I1A3072383)
References
- Korean dementia observatory 2020, National Institute of Dementia, 2020.
-
TUCKER-DROB, Elliot M. Cognitive aging and dementia: a life-span perspective. Annual review of developmental psychology, 2019;1:177-96.
[https://doi.org/10.1146/annurev-devpsych-121318-085204]

-
Szakály Z, Szente V, Kövér G, Polereczki Z, Szigeti O. The influence of lifestyle on health behavior and preference for functional foods. Appetite. 2012;58(1):406-13.
[https://doi.org/10.1016/j.appet.2011.11.003]

- Korea Rural Economic Institute Policy Research Report, Korea Rural Economic Institute, 2019;7:1-115.
-
Baek NI, Kim DS, Lee YH, Park JD, Lee CB, Kim SI. Ginsenoside Rh4, a genuine dammarane glycoside from Korean red ginseng. Planta Med. 1996;62(1):86-7.
[https://doi.org/10.1055/s-2006-957816]

-
Xiang YZ, Shang HC, Gao XM, Zhang BL. A comparison of the ancient use of ginseng in traditional Chinese medicine with modern pharmacological experiments and clinical trials. Phytother Res. 2008;22(7):851-8.
[https://doi.org/10.1002/ptr.2384]

-
Wang LC, Wang B, Ng SY, Lee TF. Effects of ginseng saponins on beta-amyloid-induced amnesia in rats. J Ethnopharmacol. 2006;103(1):103-8.
[https://doi.org/10.1016/j.jep.2005.07.010]

-
Jin SH, Park JK, Nam KY, Park SN, Jung NP. Korean red ginseng saponins with low ratios of protopanaxadiol and protopanaxatriol saponin improve scopolamine-induced learning disability and spatial working memory in mice. J Ethnopharmacol. 1999;66(2):123-9.
[https://doi.org/10.1016/S0378-8741(98)00190-1]

-
Morris R. Developments of a water-maze procedure for studying spatial learning in the rat. J Neurosci Methods. 1984;11(1):47-60.
[https://doi.org/10.1016/0165-0270(84)90007-4]

- Yoon JJ. Korea's Aging and Medical Industry. The Korean Institute of Electrical Engineers. 2018;67(1):34-8.
-
Lee CN, Park KW. Risk Factors of Dementia. Journal of Korean Diabetes. 2012;13(3):129-32.
[https://doi.org/10.4093/jkd.2012.13.3.129]

-
Gao S, Hendrie HC, Hall KS, Hui S. The relationships between age, sex, and the incidence of dementia and Alzheimer disease: a meta-analysis. Arch Gen Psychiatry. 1998;55(9):809-15.
[https://doi.org/10.1001/archpsyc.55.9.809]

-
Mitchell AJ, Kemp S, Benito-Le ́on J, Reuber M. The influence of cognitive impairment on health-related quality of life in neurological disease. Acta Neuropsychiatrica. 2010;22(1):2-13.
[https://doi.org/10.1111/j.1601-5215.2009.00439.x]

-
Ali TB, Schleret TR, Reilly BM, Chen WY, Abagyan R. Adverse Effects of Cholinesterase Inhibitors in Dementia, According to the Pharmacovigilance Databases of the United-States and Canada. PLoS One. 2015;10(12):e0144337.
[https://doi.org/10.1371/journal.pone.0144337]

-
Matsunaga S, Kishi T, Iwata N. Memantine monotherapy for Alzheimer's disease: a systematic review and meta-analysis. PLoS One. 2015;10(4):e0123289.
[https://doi.org/10.1371/journal.pone.0123289]

-
Nam KY. Clinical Applications and Efficacy of Korean Ginseng. Journal of Ginseng Research, 2002;26(3):111-31.
[https://doi.org/10.5142/JGR.2002.26.3.111]

-
Zhang JT, Qu ZW, Liu Y, Deng HL. Preliminary study on antiamnestic mechanism of ginsenoside Rg1 and Rb1. Chin Med J (Engl). 1990;103(11):932-8.
[https://doi.org/10.1016/0014-2999(90)94602-T]

-
Yamaguchi Y, Haruta K, Kobayashi H. Effects of ginsenosides on impaired performance induced in the rat by scopolamine in a radial-arm maze. Psychoneuroendocrinology. 1995;20(6):645-53.
[https://doi.org/10.1016/0306-4530(95)00008-C]

-
KENNEDY DO, REAY JL, SCHOLEY AB. Effects of 8 weeks administration of Korean Panax ginseng extract on the mood and cognitive performance of healthy individuals. Journal of Ginseng Research. 2007;31(1):34.
[https://doi.org/10.5142/JGR.2007.31.1.034]

- Jeong HC, Hong HD, Kim YC, Rho J, Kim KT, Cho CW. The research trend of ginseng processing technology and the status of ginseng industry. Food Science and Industry. 2012;45(4):59-67.
- Kim ST, Jang JH, Kwon JH, Moon KD. Changes in the Chemical Components of Red and White Ginseng after Puffing. Korean J. Food Preserv. 2009;16(3):355-61.
-
Oh JH, Choi BJ, Chang MS, Park SK. Nelumbo nucifera semen extract improves memory in rats with scopolamine-induced amnesia through the induction of choline acetyltransferase expression. Neurosci Lett. 2009;461(1):41-4.
[https://doi.org/10.1016/j.neulet.2009.05.045]

-
Hyman C, Hofer M, Barde YA, et al. BDNF is a neurotrophic factor for dopaminergic neurons of the substantia nigra. Nature. 1991;350(6315):230-2.
[https://doi.org/10.1038/350230a0]

-
Murer MG, Yan Q, Raisman-Vozari R. Brain-derived neurotrophic factor in the control human brain, and in Alzheimer's disease and Parkinson's disease. Prog Neurobiol. 2001;63(1):71-124.
[https://doi.org/10.1016/S0301-0082(00)00014-9]

-
Tsai SJ, Hong CJ, Liu HC, Liu TY, Hsu LE, Lin CH. Association analysis of brain-derived neurotrophic factor Val66Met polymorphisms with Alzheimer's disease and age of onset. Neuropsychobiology. 2004;49(1):10-2.
[https://doi.org/10.1159/000075332]

-
Petersen JD, Chen X, Vinade L, Dosemeci A, Lisman JE, Reese TS. Distribution of postsynaptic density (PSD)-95 and Ca2+/calmodulin-dependent protein kinase II at the PSD. J Neurosci. 2003;23(35):11270-8.
[https://doi.org/10.1523/JNEUROSCI.23-35-11270.2003]

- Wang SQ, Fang F, Xue ZG, Cang J, Zhang XG. Neonatal sevoflurane anesthesia induces long-term memory impairment and decreases hippocampal PSD-95 expression without neuronal loss. Eur Rev Med Pharmacol Sci. 2013;17(7):941-50.
-
Sultana R, Banks WA, Butterfield DA. Decreased levels of PSD95 and two associated proteins and increased levels of BCl2 and caspase 3 in hippocampus from subjects with amnestic mild cognitive impairment: Insights into their potential roles for loss of synapses and memory, accumulation of Abeta, and neurodegeneration in a prodromal stage of Alzheimer's disease. J Neurosci Res. 2010;88(3):469-77.
[https://doi.org/10.1002/jnr.22227]

-
El-Husseini AE, Schnell E, Chetkovich DM, Nicoll RA, Bredt DS. PSD-95 involvement in maturation of excitatory synapses. Science. 2000;290(5495):1364-8.
[https://doi.org/10.1126/science.290.5495.1364]

-
Taft CE, Turrigiano GG. PSD-95 promotes the stabilization of young synaptic contacts. Philos Trans R Soc Lond B Biol Sci. 2013;369(1633):20130134.
[https://doi.org/10.1098/rstb.2013.0134]

-
Zhao H, Li Q, Zhang Z, Pei X, Wang J, Li Y. Long-term ginsenoside consumption prevents memory loss in aged SAMP8 mice by decreasing oxidative stress and up-regulating the plasticity-related proteins in hippocampus. Brain Res. 2009;1256:111-22.
[https://doi.org/10.1016/j.brainres.2008.12.031]

- Jung TY, Jeong WC, Park JH. Therapeutic Potential of Jeongjihwan for the Prevention and Treatment of Amnesia. Journal of Physiology & Pathology in Korean Medicine. 2011;25(1):37-47.
-
Han JS, Lee GS, Tak HS, Kim JS, Ra JW, Choi JE. Change of Neutral Ginsenoside Contents in Red and Fresh Ginseng (Panax ginseng C. A. Meyer) by Hydrolysis. Korean J. Medicinal Crop Sci. 2014;22(1):23-31.
[https://doi.org/10.7783/KJMCS.2014.22.1.23]

- Choi JE, Nam KY, Li X, Kim BY, Cho HS, Hwang KB. Changes of Chemical Compositions and Ginsenoside Contents of Different Root Parts of Ginsengs with Processing Method. Korean J. Medicinal Crop Sci. 2010;18(2)118-25.
-
Kim DH, Kwak KH, Lee KJ, Kim SJ, Shin YC, Chun BH, et al. Effects of Korea Red Ginseng Total Saponin on Repeated Unpredictable Stress-induced Changes of Proliferation of Neural Progenitor Cells and BDNF mRNA Expression in Adult Rat Hippocampus. J. Ginseng Res. 2004;28(4)94-103.
[https://doi.org/10.5142/JGR.2004.28.2.094]

- Park EK, Han KH, Heo JH, Kim NK, Bae MH, Seo YH, et al. Effects of Ginseng Sprout extract and modified Kyung-Ok-Ko on scopolamine-induced cognitive impairment in mice. Journal of Agricultural, Life and Environmental Sciences. 2019;31(3):151-9.
- Jang SK, Ahn JW, Jo BR, Kim HS, Kim SJ, Sung EA, et al. Double-processed ginseng berry extracts enhance learning and memory in an Aβ42-induced Alzheimer’s mouse model. KOREAN J. FOOD SCI. TECHNOL. 2019;51(2):160-8.