골다공증의 한방 복합 처방 및 단일 본초에 대한 국내 연구 고찰 : 2013년 이후 발표된 국내 연구를 중심으로
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
The purpose of this study was to investigate the effect of single herbal medicines and Korean herbal medicine complex prescriptions for osteoporosis in Korea. We targeted studies published in domestic journals from January 1, 2013 to April 1, 2021. For domestic databases, RISS, NDSL, OASIS, DBpia, KISS, KISTI, and Korean Traditional Knowledge Portal were used. Words such as "osteoporosis", "herbal medicine", "herbal combination prescription" and "herbal" were combined and searched. A total of 32 studies were selected. Among them, 8 studies were conducted exclusively for animal studies, 18 studies were conducted on cell experiments, and 6 studies were conducted on both animal and cell experiments. There were 18 studies using a single herb and 14 studies using a combination of Herbal medicine. As a result of the investigation of a single herb, it was found that 補陽藥 was most widely used, and it was found that it was mainly used in the herbal combination prescription, mainly for 補陽藥, 補氣藥, and 補陰藥. Studies in animal experiments revealed significant results mainly in bone mineral density, serological indicators, and morphological indicators of bone tissue. In the study of cell experiments, the effects were found in factors related to the differentiation of osteoclasts and inhibitors of inflammation. Through the results of this study, we are able to confirm the effective single herbal medicines and herbal medicine complex prescriptions for the treatment of osteoporosis, and it is expected that they will contribute to clinical treatment.
Keywords:
Osteoporosis, Herbal, Herbal complex prescription, Herbal medicine서 론
골다공증은 골질량이 감소하여 약해진 뼈로 인해 골절이 발생할 확률이 높아지는 전신 근골결계 질환이다1). 인체 내에서 골 조직은 조골세포의 골생성과 파골세포의 골흡수 작용이 서로 균형을 이루고 있는데, 다양한 원인에 의해 이 균형이 깨져 파골세포의 골흡수가 더 많아지게 되면 골다공증과 같은 골질환을 유발하게 된다2).
실외 활동 부족 등으로 인한 비타민D 결핍, 급격한 노령화 사회로 인한 노령 인구 증가 등 여러 가지 원인으로 인해 골다공증 유병률은 해마다 증가하고 있는데, 건강심사평가원의 통계에 의하면 2016년 골다공증으로 진단받은 환자의 수는 85만 4천215명, 2017년 90만 6천 631명, 2018년 97만 2천196명, 2019년 107만 9548명으로 갈수록 증가 추세에 있다3). 이에 비해 골다공증을 주소증으로 한방진료를 받기 위해 한방 의료기관에 내원하는 환자 수는 2017년 1763명, 2018년 1744명, 2019년 1515명으로 골다공증 전체 환자 수의 0.1%가 안되는 실정이다3,4).
골다공증의 치료는 1차적으로 부족해진 칼슘, 비타민D 제제를 섭취하거나, 적극적인 약물치료로는 대표적인 골흡수 억제제인 비스포스포네이트(bisphophonate) 제제가 사용되고 있다5). 이러한 강력한 골흡수 억제 기능을 가진 비스포스포네이트 계열의 약은 복용 시 속쓰림, 구토 등 위장관계 질환을 유발할 가능성이 있어서 현재 골다공증의 치료는 이러한 부작용을 보완한 RANKL 억제제인 데노수맙(denosumab) 또는 조골세포의 골생성만을 표적으로 하는 부갑상선 호르몬 치료제와 같이 인체의 미치는 부작용은 최소화 하며, 조골세포의 골생성 기능을 유도하는 방향으로 연구되고 있다6,7).
골다공증에 대한 국내 연구는 한방 복합처방 및 단일 본초의 개별 실험연구들을 위주로 진행되고 있다8). Kim 등8)은 2000년 이후부터 2009년까지 발표된 논문을 대상으로 골다공증 연구에 사용된 한방 처방 및 본초에 대한 연구들을 정리하여 발표하였고, Seo 등9)은 2003년부터 2012년까지의 국내 논문을 대상으로 하여 골다공증 치료에 대한 국내 연구의 경향을 발표 한 바 있다. 한편, Kim10) 등은 골다공증 동물모델에서 국내에서 이루어진 약침치료에 한정하여 연구들을 종합하여 고찰한 바 있다. 이 세 가지 연구 이외에 현재 2021년 04월까지 골다공증의 한약치료에 대한 국내 연구의 경향을 밝힌 연구가 없어 이에 본 저자는 골다공증의 한방처방 및 개별 본초의 효과에 대한 국내 실험 논문들을 종합 분석함으로써 골다공증 연구 경향과 한방 치료를 위한 기초 자료를 제공하고자 한다.
연구방법
1. 자료 검색
자료 대상은 2013년 01월 01일부터 2021년 04월 01일까지 국내에서 출판된 논문을 대상으로 하였다. 국내 문헌 검색을 위하여 학술연구정보서비스(RISS), 과학기술정보통합서비스(NDSL), 오아시스 전통의학포털(OASIS), DBpia, 한굴학술정보(KISS), 과학기술학회마을(KISTI), 한국전통지식포탈 총 7개의 데이터 베이스를 활용 하였다. (골다공증) AND (한약 or 한방처방 or 본초)로 검색하였으며, 검색식은 각 데이터 베이스의 형식에 맞추어 사용하였다. 논문의 제목과 초록을 검토하여 골다공증의 한방 복합처방 또는 단일 본초와 관련된 실험 연구만을 선별하였다. 선별한 논문을 대상으로 전체 원문을 검토하여 골다공증에 대한 한방처방 또는 개별 본초의 효과에 대한 연구만을 선별하였다.
2. 자료 선정 및 제외 기준
2013년 01월 01일부터 2021년 04월 01일까지 국내에서 출판된 골다공증에 대한 한방 복합처방 또는 단일 본초에 대한 연구는 임상연구, 동물실험, 세포실험 등을 모두 포함하였으며, 실험연구의 형태가 아닌 연구는 제외하였다. 동물 실험 연구의 경우 한약을 경구 투여한 경우, 약침주사를 투여한 경우, 복강 내로 투여한 경우 등 모든 방법의 연구를 포함 하였으며, 각 실험 연구들은 최소 1가지 이상의 평가도구를 사용하여 효과를 판단할 수 있는 경우에만 연구를 포함하였다.
결 과
1. 연구 선정
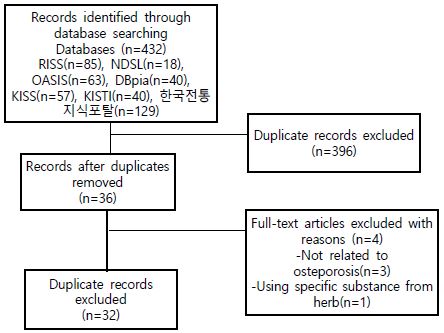
국내 데이터 베이스 검색 결과 RISS에서 85편, NDSL에서 18편, OASIS에서 63편, DBpida에서 40편, KISS에서 57편, KISTI에서 40편, 한국전통지식포탈에서 129편이 검색되었다. 검색된 총 432편의 연구 중에서 중복된 396편을 제외한 36편의 연구를 선정하였다. 36편의 연구에 대하여 모두 원문을 검토한 결과 직접적으로 골다공증과 관련된 연구가 아닌 경우 3편, 한약재에서 추출한 특정한 성분만을 대상으로 시행한 연구 1편을 제외하고 총 32편의 연구가 선정되었다(Fig. 1).
2. 연구 분석
선정된 총 32편11-42)의 연구는 2013년부터 2020년까지 다양하게 출판되었는데 2013년에 4편11-14), 2014년에 6편15-20), 2015년에 3편21-23), 2016년에 2편24-25), 2017년에 5편26-30), 2018년에 3편31-33), 2019년에 6편34-39), 2020년에 3편40-42)의 연구가 출판되었다. 선정된 32편의 연구 중 동물 실험연구가 8편19,20,25-27,31,33,38)이었고, 세포실험 연구가 18편11-18,21,24,28-30,32,34,39-41), 동물실험과 세포실험을 모두 시행한 연구가 6편22,23,35-37,42)이었다.
연구에 사용된 한방 처방을 단일 본초 연구와 한방복합처방 연구로 분류하는데, 단일 본초를 이용한 연구가 18편11-13,15,17,18,20,25,28,32-38,40,41), 한방복합처방을 이용한 연구가 14편14,16,19,21-24,26,27,29-31,39,42)이었다(Table 1, 2).
연구 유형은 크게 동물 실험연구와 세포 실험 연구로 나뉘었는데, 8편19,20,25-27,31,33,38)의 연구에서 동물만 이용한 실험 연구를 하였으며, 6편22,23,35-37,42)의 연구에서는 동물실험과 세포실험을 모두 분석하였다. 8편19,20,25,26,33,36,38,42)은 난소 절제 후 골다공증을 유발한 암컷 Sprague Dawley rats을 이용하였고, 나머지 2편27,31)은 난소 절제 후 골다공증을 유발한 암컷 생쥐(Mice)를 이용하였다. 4편22,23,35,37)의 연구에서는 수컷 생쥐(Mice)를 이용하여 골다공증을 유발하였다.
한편, 세포 실험은 총 18편11-18,21,24,28-30,32,34,39-41)에서 시행하여 보고하였고, 그 중 13편12,13,15,17,18,21,28-30,34,39-41)은 파골세포(Osteoclast)를 이용한 실험이었고, 4편14,16,24,32)은 조골세포(osteoblast)와 파골세포(osteoclast) 분화 모두를 관찰한 실험이었다. 동물실험과 세포실험을 모두 시행한 연구는 총 6편22,23,35-37,42)이었다(Table1, 2).
(1) 단일 본초
단일 본초를 대상으로 한 18편11-13,15,17,18,20,25,28,32-38,40,41)의 연구 중에서 각 연구에 사용된 단일 본초가 겹치는 경우는 없었으며, 다양한 약물들이 골다공증 연구에 사용되었음을 확인하였다. 연구로 사용된 단일 본초의 주된 경향성을 알아보기 위하여 本草學 교과서43)를 기준으로 한 목차를 참고하여 단일 본초들을 분류해보았다. 총 23개의 단일 본초가 활용되었으며 補陽藥이 7종으로 가장 많은 비율을 차지하였고, 平肝熄風藥과 溫裏藥은 각각 2종으로 그 다음을 차지하였다. 본초학 교과서에서 분류되지 않은 약재 1종은 미분류로 기재하였다(Table 3).
(2) 한방 복합처방
총 14편14,16,19,21-24,26,27,29-31,39,42)의 연구에서 14개의 복합처방이 이용되었고, 72개의 개별 본초가 사용되었는데 가장 높은 빈도로 사용된 본초는 熟地黃(6회), 當歸(6회), 人蔘(5회), 白朮, 川芎, 生薑, 牛膝(각 4회) 순이었다(Table 4). 단, 각 처방에 補助制로써 調和諸藥의 목적으로 사용된 甘草는 빈도 계산에서 제외하였다.
동물 실험만을 대상으로 한 연구 8편19,20,25-27,31,33,38), 세포 실험만을 대상으로 한 연구 18편11-18,21,24,28-30,32,34,39-41), 동물실험과 세포실험을 모두 시행한 연구 6편22,23,35-37,42)으로 분류하여 각 연구에서 사용된 평가 도구들을 분석하고 그 결과를 정리하였다(Table 5, 6, 7).
파골세포의 분화 억제 또는 조골세포의 활성화라는 골다공증 억제 및 치료의 대표적인 두가지 작용 기전에 따라 선정된 연구들을 분류하였다. 파골세포의 분화를 억제하여 골의 재흡수 기전을 억제함을 밝힌 연구는 21편12,13,15,17-23,26,28-31,34,36,39-42), 조골세포의 분화를 촉진하여 골의 재형성 기전을 밝힌 연구는 1편11), 두가지 기전 모두에 대하여 가능성을 제시한 연구는 6편14,16,24,32,35,37)이었다(Table 8).
선정된 연구들의 원문을 검토하여 골다공증의 기전에 대한 한의학적 변증에 따라 각각 腎虛, 瘀血, 氣血兩虛, 風寒濕으로 나누어 분류하였다. 腎虛로 유발된 골다공증에 대한 연구가 14편11-13,15,17,18,20-23,33,34,37,38)으로 가장 많았고, 風寒濕으로 유발된 골다공증에 대한 연구가 4편19,35,41,42), 氣血兩虛로 유발된 골다공증에 대한 연구가 3편16,24,26), 瘀血에 대한 연구가 1편29)이었다(Table 9).
고 찰
골다공증은 뼈가 약해져서 작은 충격에도 부러지기 쉬운 상태를 의미하며 주로 폐경기 여성과 노인들에게서 다발하는 질환이다44). 2019년 대한골대사학회에서 발표된 자료에 의하면 국내 50세 이상 성인의 골다공증 유병률이 22.4%에 달하며, 50세 이상 성인의 50%에서 골감소증이 나타날 정도로 높은 유병률을 보여 골다공증을 조기에 예방하고 적절한 시기에 치료하는 것이 매우 중요하다45). 이러한 골다공증은 골절이 발생하지 않는 이상 무증상이기 때문에 환자들이 이를 인지하여 치료하고 예방하기가 쉽지 않다.
골다공증의 치료는 지금까지 대표적인 골흡수억제제인 비스포스포네이트 제제를 중심으로 진행되어 왔고, 최근 들어서는 비스포스포네이트와는 다른 기전으로 골흡수를 억제하는 데노수맙과 조골세포의 골형성 자체를 촉진하는 부갑상선호르몬 제제인 teriparatide가 국내 건강보험에 도입되면서 치료의 트렌드가 변화하고 있다46).
한의학에서도 단일 본초 또는 한방복합 처방으로 골다공증 치료의 가능성을 밝힌 개별 실험연구들은 많지만 아직 이를 실제 임상 단계에서 그 효과를 다룬 연구는 미비한 실정이다. 본 연구는 이러한 개별 실험 연구들의 결과를 분석하여 현재 한의학에서 골다공증 치료제로써 연구되고 있는 본초 및 한방처방은 어떤 것이 있는지 살펴보고, 골다공증에 대한 한방치료의 흐름을 파악하여 나아가 임상 진료에서도 도움이 될 만한 근거 자료의 수집 목적으로 수행되었다.
골다공증에 대한 국내 연구들을 고찰한 연구는 Seo 등9)이 2003년 이후부터 2012년까지의 국내에서 발표된 논문들을 대상으로 고찰한 바 있고, Kim 등10)은 약침 치료에 한정하여 국내에서 이루어진 동물실험 연구 결과들을 정리한 바 있다. 이 연구들은 모두 2012년 이전의 연구 결과들을 대상으로 한 논문들로, 2013년 이후부터 2021년 4월 1일 까지 발표된 총 32편의 골다공증 치료에 대한 개별 실험 결과들을 종합하여 고찰한 연구는 전무한 실정이다. 따라서 본 연구는 앞서 발표된 연구들 이후부터 현재까지 진행되고 있는 골다공증의 한방치료에 대해 분석하고 알아보아 골다공증의 한방치료에 대한 최신 경향을 파악하고자 한다.
선정된 총 32편 중 동물실험 연구가 8편19,20,25-27,31,33,38)이었고, 세포실험 연구가 18편11-18,21,24,28-30,32,34,39-41), 동물실험과 세포실험을 모두 시행한 연구가 6편22,23,35-37,42)이었다. 세포 실험의 경우 18편11-18,21,24,28-30,32,34,39-41) 중 파골세포의 분화와 관련된 연구는 13편12,13,15,17,18,21,28-30,34,39-41)이었고, 파골세포 분화와 조골세포의 생성 둘 다를 관찰한 연구는 4편14,16,24,32)이었다. Seo 등9)의 연구에 따르면 2010년대 까지는 대부분 난소절제를 유발한 동물 실험 모델을 위주로 연구들이 이루어 졌다면, 본 연구 결과를 통해 2013년 이후에는 세포실험의 비중이 늘어난 것을 알 수 있었는데, 이는 현재 골다공증 치료의 방향이 파골세포의 분화 억제와 조골세포의 생성에 초점을 맞추고 있는 흐름과 일치하였다.
총 32편의 연구에 사용된 중재를 분석한 결과 단일 본초 연구 총 18편에서 총 23개의 단일 본초가 사용 되었다. 本草學 교과서를 근거하여 각 본초들을 분류하였는데 益智仁(Alpiniae Oxyphyllae Fructus), 川續斷(Phlomis umbrosa Turcz), 巴戟天(Morindae Radix), 肉蓯蓉(Cistanchis Herba Aqueous), 鹿茸(Cervi Parvum Cornu), 鹿角(Cervi Cornu), 鹿角膠(Cervi Cornus Colla)로 補陽藥에 속하는 본초들이 가장 많이 사용되었다. Kim 등8)의 연구에 따르면 2000년 이후부터 2009년까지 국내 연구들을 살펴보면 補陽藥의 비중이 압도적으로 많았는데, 이는 한의학에서 腎主骨하여 골다공증 또한 골대사 질환으로써 腎陽과 腎陰의 부족의 관점에서 접근하였음을 알 수 있었다. 2013년 이후에 淸熱藥, 平肝息風藥, 祛風濕藥, 理氣藥, 溫裏藥, 活血祛瘀藥 등 다양한 분류에 속하는 본초들을 대상으로도 골다공증의 효과를 밝히기 위한 연구들이 진행되고 있음을 확인할 수 있었다.
한방 복합 처방 내에 사용된 본초의 빈도를 분석해보았는데 熟地黃(Rehmanniae Radix Preparata), 當歸(Angelicae Gigantis Radix), 人蔘(Ginseng Radix Alba) 등이 많이 사용된 것으로 보아 補益藥에 속하는 위주의 약물들이 많이 연구되고 있음을 알 수 있었다. 골다공증의 병인을 虛證의 관점에서 출발하여 인체의 저하된 기능을 陰血을 보충해주는 관점으로 골다공증의 치료에 접근하였음을 알 수 있었다.
골다공증의 효과를 알아보기 위해 각 연구에서 사용된 측정 지표들을 분석하였는데, 동물실험연구에서는 골밀도(BMD), 혈청학적 지표, 여성호르몬인 progesterone과 estrogen, 골조직 형태계측학적 지표 들이 활용 되었다.
골밀도(BMD)항목에서 통계적으로 유의한 결과를 보인 연구는 6편27,31,33,35,36,38)이었다. 혈청학적 지표로는 혈청 내 골교체율 의미하는 지표인 ALP항목에서 유의한 효과를 밝힌 연구는 9편11,14,16,24,27,31,32,38,42)이었고, 골 생성 지표인 Osteocalcin 항목에서 효과를 밝힌 연구는 9편20,25,27,31,32,35,37,38,42)이었다. 혈청 내 Ca2+ 항목은 3편26,31,38)의 연구에서, P 항목은 3편26,31,38)에서 효과를 밝혔다. 골조직 형태계측학적 지표인 BV/TV, Tb. N, Tb. Th 등에서 효과를 밝힌 연구는 총 5편22,23,26,31,36)이었다. 이러한 연구들 통해 한방처방 및 단일 본초가 골밀도 수치를 유의하게 개선시켜 골다공증을 예방하고, ALP, Osteocalcin 등과 같은 혈청학적 지표의 유의한 변화, 골소주의 두께, 개수 등 골조직 형태계측학적으로도 유의한 결과를 통해 폐경기 여성에서 에스트로겐 결핍으로 유발된 골다공증에 그 효과를 활용해 볼 수 있는 가능성을 제시하였다.
세포 실험 연구에서는 골흡수에 관여하는 표지자인 TRAP의 활성을 억제한 결과는 20편12-18,21-24,28-30,32,34,36,39-41)에서 그 효과를 밝혔고, 파골세포와 관련된 인자들의 유의한 감소를 밝혔는데 파골세포 분화 인자인 C-Fos의 억제를 밝힌 연구는 15편12,13,15,17,18,22-24,28,29,30,34,36,39,41), NFATc1 인자의 억제를 밝힌 연구는 17편12,14,16-18,21-24,28-30,34,36,39-41), 파골세포의 성장과 관련된 Cathepsin k 인자의 억제를 밝힌 연구는 14편12,14,16,17,21,24,28-30,34,36,39-41)이었다. 이 외에도 P38, JNK, AKT 등과 같이 파골세포의 분화와 관련된 다양한 유전 및 조직학적 지표의 억제를 다양한 연구들에서 밝혔다. 또한, COX-2, iNOS의 발현을 감소시켜 파골세포 분화를 억제하는 기전을 밝힌 연구14,16,21,28,30,34,42)들도 있었다. 파골세포의 분화에 영향을 끼치는 다양한 인자에 대해 특정 인자와 한약의 상관관계를 밝히기 위한 연구들이 활발하게 진행되고 있음을 알수 있었고, 골다공증에 관여하는 파골세포의 분화를 억제하고 조골세포의 활성을 촉진시키는 치료제로써의 본초 및 한약의 가능성을 기대할 수 있었다.
골다공증의 치료 방향은 크게 두가지로, 파골세포의 골흡수를 억제하는 방법과 조골세포의 활성화를 촉진하여 골의 재형성을 유도하는 방법으로 나뉜다. 본 분석에서 선정된 연구들을 살펴보면 파골세포의 기전에 대한 효과를 밝힌 연구가 21편12,13,15,17-23,26,28-31,34,36,39-42)으로 압도적으로 많음을 확인 할 수 있었다. 현재까지도 가장 많이 골다공증 치료제로 쓰이고 있는 비스포스포네이트와 같은 골흡수억제제는 장기간 복용시 발현 될 수 있는 부작용에 대한 우려로 인해, 현재 골다공증 치료약제에 대한 연구의 흐름은 인체의 부작용을 최소화 할 수 있는 치료제를 개발하기 위해 조골세포의 분화를 촉진과 관련된 기전을 밝히는 방향으로 나아가고 있다.
한편, 장기간 복용시에도 부작용이 적으면서 인체의 저하된 근원적인 기능을 회복시켜 골다공증의 예방 및 억제에 기여할 수 있다는 측면에서 본 연구는 지금까지 진행된 본초 및 한방처방에 대한 골다공증 치료에 대한 가능성을 제시하였다. 본 연구를 수행하면서 각각의 연구들에서 골다공증 억제에 유의함을 밝힌 한약 또는 본초의 어떤 특정 약리학적 성분이 그 역할을 하였는지 기전에 대해 명확하게 밝힌 연구는 없었는데 실제 임상에서 치료제로써의 나아가기 위해서는 기전을 밝힐 수 있는 관련 연구들이 활발히 진행되어야 할 것으로 사료된다.
골다공증의 병리기전에 대하여 한의학적 변증으로 분석해보았는데 腎主骨하여 腎기능이 뼈의 생장 대사와 밀접한 관련이 있어 골대사의 기능장애인 골다공증 역시 腎陰虛證, 腎陽虛證으로 인해 약해진 筋骨을 補腎하는 치법을 통해 근원되는 腎의 기능을 활성화 시켜 근골을 강하게 하여 골다공증의 발현을 억제하였다는 기전으로 해석한 연구가 14편11-13,15,17,18,20-23,33,34,37,38)으로 가장 많았다. 한편, 골다공증을 風寒濕證으로 변증한 4편19,35,41,42)의 연구는 인체 내에 風寒邪氣가 침범하여 통증을 유발한다는 實證의 관점으로 골다공증으로 뼈 자체가 약화되어 파생될 수 있는 골질환의 통증을 제어한다는 측면에서 치료제로써의 가능성을 제시한 것으로 판단된다. 瘀血證의 관점에서 분석한 1편29)의 연구는 골다공증으로 인해 파생된 골다공증성 골절에 골절의 초기치료로써 凝滯된 氣血로 인해 발생한 瘀血을 活血化瘀 하는 치료제로써의 가능성을 제시하였고 생각된다. 즉, 골다공증을 유발하게 되는 원인을 한의학적으로 생각하였을 때, 瘀血, 風寒濕邪와 같은 實證에 의한 것과 腎虛, 氣血兩虛와 같은 虛證에 의한 것으로 나뉠 수 있다. 앞서 언급한 내용처럼 지금까지의 연구는 대부분 腎虛 병리기전의 관점에서 대부분의 실험연구가 이루어 진 것을 알 수 있다. 골다공증을 유발할 수 있는 한방변증의 기전이 다양한 만큼 앞으로의 연구는 다각도로 골다공증의 예방 및 치료에 관한 접근이 필요할 것으로 사료된다.
본 연구를 통해 골다공증 치료에 활용할 수 있는 한방처방, 단일 본초의 가능성을 확인할 수 있었다. Kim 등10)에 따르면 대부분 지금까지 연구된 골다공증에 대한 한방치료의 연구는 난소적출로 유발된 estrogen 결핍성 골다공증 연구들이 거의 다수인 것을 알 수 있다. 하지만 골다공증을 유발하는 원인은 폐경기 여성의 estrogen 결핍 뿐만 아니라, 노화, 비타민D 결핍 등 여러 가지 원인에 의해 발생할 수 있기 때문에 다양화된 골다공증에 대한 한의학적 치료의 접근이 필요할 것으로 사료된다. 이러한 동물 및 세포 실험 연구의 결과들을 임상 연구로 나아가기 전단계에서 유의한 지표로 활용될 수 있기 때문에, 지금까지 발표된 국내의 실험 연구 결과들을 종합하여 정리하는 연구가 필요하다고 생각하며, 본 연구가 그 역할을 할 수 있을 것으로 기대한다.
결 론
선정된 총 32편의 연구를 대상으로 골다공증의 한방처방 및 단일 본초의 치료에 대한 논문들을 분석하여 아래와 같은 결론을 얻었다.
골다공증 연구에 사용된 처방 및 본초를 분석한 결과 단일 본초를 이용한 연구가 18편이었고 한방처방을 이용한 연구가 14편이었다.
골다공증 연구의 유형을 분석한 결과 동물실험만 시행한 연구가 8편, 세포실험연구만 시행한 연구가 18편이었고, 동물실험과 세포실험을 모두 시행하여 그 효과를 밝힌 연구는 6편이었다.
사용된 단일 본초와 한방 복합처방에 대하여 분석한 결과 단일 본초는 주로 補陽藥이 가장 많이 활용되었음을 알 수 있었고, 한방 복합처방에서도 補陰藥, 補血藥, 補氣藥과 같은 補益藥 위주의 본초들이 활용된 것을 알 수 있었다.
골다공증에 대한 작용 기전을 살펴보았을 때, 파골세포의 분화를 억제하여 골흡수를 억제하는 효과를 밝힌 연구는 21편이었고, 단독으로 조골세포의 분화를 촉진하여 골재형성을 유도하는 효과를 밝힌 연구는 1편, 두 가지 기전 모두에 대하여 그 효과를 밝힌 연구는 6편이었다.
골다공증의 한의병리학적 기전에 대하여 밝힌 연구들을 그 기전에 따라 분류하였는데 腎虛證으로 본 연구가 14편으로 가장 많았고, 風寒濕證 4편, 氣血兩虛證 3편, 瘀血證 1편 이었다.
이러한 연구 결과를 종합하여 살펴 볼 때 개별 본초 및 한방복합처방의 골다공증에 대한 개선효과를 기대할 수 있을 것으로 사료되며, 이러한 유의한 개별 실험연구의 결과들을 임상 연구로 이어나가기 위한 과정에서 더 많은 노력이 필요할 것으로 판단된다.
Acknowledgments
This study was supported by the Ministry of Education, Science and Technology (NRF-2021R1A2C2013483).
References
-
Shin HK, Lee JW, Song SC. Perioperative Medical Treatment to Improve Surgical Outcomes: Management of Osteoporosis. J Korean Orthop Assoc. 2019;54(1):18-23.
[https://doi.org/10.4055/jkoa.2019.54.1.18]

- The Korean Orthopaedic Association. Orthopaedics. The 7th Edition; Seoul: Choi Shin, 2013.
- Health Insurance Review & Assessment Service [Internet]. 2020 December [cited 2020 December 1). Available from: http://opendata.hira.or.kr/op/opc/olapMfrnIntrsIlnsInfo.do, .
-
Ahn, JH, Cho YE, Kim JH, Lee SH, Kang JW, LEE JD. Patients' Perceptions of Korean Medicine Treatment for Osteoporosis in a Clinical Trial of an Osteoporosis Herbal Medicine Drug: A Qualitative Study. J. Int. Korean Med. 2017;38(2):201-16.
[https://doi.org/10.22246/jikm.2017.38.2.201]

-
Oh HK. Medical Treatment of Osteoporosis/Prevention of Falls. J Korean Fract Soc. 2018;31(4):165-71.
[https://doi.org/10.12671/jkfs.2018.31.4.165]

-
Chun SW. Pharmacological treatment of osteoporosis. J Korean Med Assoc. 2019;62(10):542-50.
[https://doi.org/10.5124/jkma.2019.62.10.542]

-
Choi HS. Management of Osteoporosis in the Elderly. Korean J Clin Geri. 2019;20(2):46-51.
[https://doi.org/10.15656/kjcg.2019.20.2.46]

- Kim MB, Kim SS, Chung SH. A Literature Review of Herbal Medicines on Osteoporosis Studies - Reviewing Articles Published after Year 2000. 2010;20(1):91-107.
- Seo MS, Kim HC, Choo WJ et al. The Review on the Study of Osteoporosis in Korean Medicine Journals. The Journal of Korean CHUNA Manual Medicine for Spine & Nerves. 2013;8(2):67-78.
-
Kim JM, Choi SM, An HD. Effects of the Pharmacopuncture in Animal Models for Treatment of Osteoporosis: A Review of Animal Study Reports Published in Korea. 2016;26(2):75-83.
[https://doi.org/10.18325/jkmr.2016.26.2.75]

-
Im KJ, Choi KH, Jung EH, Yoo DY. The Effect of Dried Roots of Rehmannia glutinoss Extract on Osteoblast in Rat Fetus Calvarial Cells. J Korean Obstet Gynecol. 2013;26(3):33-43.
[https://doi.org/10.15204/jkobgy.2013.26.3.033]

- Baek JM, Kim JY, Lee MS, Jeung WJ, Moon SY, Jeon BH, Oh JM, Choi MK. Inhibition Effect of Taxilli Ramulus Extract on Osteoclast Differentiation and Bone Resorption. Korean J. Oriental Physiology & Pathology 2013;27(4):431-6.
-
Baek JM, Park JH, Song JH, Park SN, Jeong WJ, Moon SY, Lee CH, Choi MK, Kim JJ, Oh JM, Jang SJ. The Effects of Phlomis umbrosa turcz on Osteoclast Differentiation. Korean Association of Physical Anthropologists. 2013;26(3):115-23.
[https://doi.org/10.11637/kjpa.2013.26.3.115]

-
Je YM, Yoo DY. Effects of Dokhwalgisaengtang-gami Water Extract on Osteoclast Differentiation and Osteoblast Function in RANKL-induced RAW 264.7 cell. J Korean Obstet Gynecol. 2013;26(2):1-16.
[https://doi.org/10.15204/jkobgy.2013.26.2.001]

-
Jang HJ, Hwang DS, Lee JM, Lee CH, Lee KS, Jang JB. Osteoclast Differentation of Polygoni Cuspidati Radix Extracts Effects and Mechanism of Inhibition Studies. 2014;27(1):17-27
[https://doi.org/10.15204/jkobgy2014.27.1.017]

-
Choi KH, Yoo DY. The Effect of Guibi-tang Water Extract on Osteoclast Differentiation and Osteoblast Proliferation. J Korean Obstet Gynecol. 2014;27(3):12-27.
[https://doi.org/10.15204/jkobgy.2014.27.3.012]

-
Yoon KH, Baek JM, Kim JY, Kwak SC, Cheon YH, Jeon BH, Lee CH, Choi MK, Oh JM, Lee MS, Kim JJ. Inhibitory Effect on RANKL-Induced Osteoclast Differentiation by Water Extract of Zizyphus Jujuba Mill. Korean J. Oriental Physiology & Pathology. 2014;28(1):29-34.
[https://doi.org/10.15188/kjopp.2014.02.28.1.29]

-
Jung GE, Kim JY, Kim JH, Han SY, Kim YK. Effect of Co-administration of Aconiti Lateralis Preparata Radix and Cinnamomi Cortex on Osteoclast Differentation. Kor. J. Herbology 2014;29(2):61-7.
[https://doi.org/10.6116/kjh.2014.29.2.61]

- Kum CJ, Cho CY, Lim JM, Song DU, Kim JH, Lee BN, Jung HS. Effects of Yoohyangheukho-dan on Osteoporosis Induced by Ovariectomy in Rats. Journal of Korean Medicine Rehabilitation. 2014;24(3):29-37.
-
Kim JH, Kim JS. Effects of Lycii Fructus and Lycii Folium Extracts on Osteoporosis in Ovariectomized Rats. J Korean Soc Food Sci Nutr. 2014;43(1):24-9.
[https://doi.org/10.3746/jkfn.2014.43.1.024]

- Ju IH, Lee EK, Hwang GS, Chong MS. Journal of Society of Preventive Korean Medicine. 2015;19(2):135-44.
-
Lee JJ, Jo SH, Park MC, Jo EH. Inhibitory Effects of Yongbu-tang on Osteoclast Differentiation and Bone Resorption. The Acupuncture. 2015;32(3):27-40.
[https://doi.org/10.13045/acupunct.2015036]

-
Kim SJ, Lee JJ, Kim JH, Jo SH, Park MC, Jo EH. Inhibitory of Ssangbohwan on Osteoclast Differentiation and Bone Resorption. The Acupuncture. 2015;32(3):69-81.
[https://doi.org/10.13045/acupunct.2015040]

-
Jung EH, Yoo DY. Effects of Kanghwalsokdan-tang Gamibang Water Extract on Osteoclast Differentiation and Osteoblast Proliferation. J Korean Obstet Gynecol. 2016;29(2):66-82.
[https://doi.org/10.15204/jkobgy.2016.29.2.066]

- Lee MJ, An BK, Jung HK, Lee KH, Kim AH, Lee HJ, Jang JH, Sim MO, Kim TM, Kim MS, Seong TG, Woo KW, Cho JH, Kim JC, Cho HW. The Anti-osteoporosis Effects of Cassia tora L. Seed Ethanol Extract in Ovariectomized Rats. 2016;47(4):333-42.
-
Cho CY, Kim EY, Kim DH, Kim MB, Kim SB, Yang KJ, Sohn YG, Jung HS. Effects of Bia-hwan on the Ovariectomized Rat Model of Osteoporosis. Journal of Korean Meidicine Rehabilitation. 2017;27(2):19-27.
[https://doi.org/10.18325/jkmr.2017.27.2.19]

- Lee SH, Kim DC. Aqueous Extracts of Jibaekjihwang-tang Ameliorate Ovariectomy-induced Climacterium Symptoms in Mouse. 2017;30(2):16-36.
-
Choi YK, Hwang GS. Effects of Gardeniae Jasminoides on RANKL-induced Osteoclastogenesis and Bone Resorption. J. Int. Korean Med. 2017;38(6):1035-48.
[https://doi.org/10.22246/jikm.2017.38.6.1035]

- Jang SB, Yoo DY, Yoo JE. Effects of Hyeolbuchugeo-tang on Osteoclast Differentiation and bone Resorption. J Korean Obstet Gynecol. 2017;30(4):1-17.
-
Ahn MY, Lim HH. Effect of Sochungryong-tang Extract on Osteoclast Differentiation and Bone-pit Formation. J Korean Med. 2017;38(3):59-72.
[https://doi.org/10.13048/jkm.17025]

- Cho SY, Kim DC. Ani-osteoporotic Activity of Gojineumja Aqueous Extracts on the Ovariectomized Mice. J Korean Obstet Gynecol. 2018;31(4):16-38.
- Jung JI, Lee HS, Kim HJ, Kim YM, Kim SH, Yoo DJ, Kim EJ. Anti-osteoporotic Activity of Mixed Herbal Extract Involving Platycodon Grandiflorum Root in Osteoblastic MC3T3-E1 and Osteoclastic RAW 264.7 cells. J Korean Obstet Gynecol. 2018;31(4):1-15.
-
Park HI, Lee KH. Comparison of the Effects of Deer Antler, Old Antler, and Antler Glue on Osteoporosis in Ovariectomized Rats. J Acupunct Res. 2018;35(1):21-7.
[https://doi.org/10.13045/jar.2018.00031]

-
Park JS, Lim HH. Effects of Pyrola japonica Extracts on Osteoclast Differentiation and Boen Resorption. Journal of Korean meidicine Rehabilitation. 2019;29(2):135-47.
[https://doi.org/10.18325/jkmr.2019.29.2.135]

-
Kim HH, Ahn SH, Park SY. Effects of Bombycis Corpus on Male Osteoporosis. J Physiol & Pathol Korean Med. 2019;33(1):56-62.
[https://doi.org/10.15188/kjopp.2019.02.33.1.56]

-
Eom JW, Kim JH, Kim MS, Kim SW, Shin HJ, Jung HS, Sohn YJ. Forsythiae Fructus Extract Inhibits RANKL-Induced Osteoclast Differentiation and Prevent Bone Loss in OVX-Induced Osteoporosis Rat. Korean Journal of Acupuncture. 2019;36(2):115-26.
[https://doi.org/10.14406/acu.2019.008]

-
Kim HJ, Ahn SH, Park SY. The Effects of Alpiniae Oxyphyllae Fructus on Osteoporosis and Muscle Dystrophy of Male Mice. J. Int. Korean Med. 2019;40(1):1-12.
[https://doi.org/10.22246/jikm.2019.40.1.1]

- An TEB, Kim DC. Selection of the Fittest Anti-osteoporotic Mixed Compositions Consist of Morindae Radix and Cistanchis Herba Aqueous Extracts on Ovariectomized Mice. J Korean Obstet Gynecol. 2019;32(3):1-19.
-
Jang SS, Ryu HS, Jeon CY, Hwang GS. Effects of Hansu-Daebowon on RANKL-induced Osteoclast Differentiation and Bone Loss in Mammal Model. J. Int. Korean Med. 2019;40(1):58-69.
[https://doi.org/10.22246/jikm.2019.40.1.58]

- Cho HS, Lee BY, Lee WK, Lee JH, Park DJ, Choi CI, Jin MH, Roh SS, Ju YS. The effects of a Mixture of puerariae Flos Extract and Citri Unshius Pericarpium Extract on Estrogenic Activities and Osteoclastogenesis. Kor. J. Herbol. 2020;35(3):1-8.
-
Yang KJ, Kim JH, Kim MS, Ryu GH, Moon JH, Lee HI, Jung HS, Sohn YJ. Gentianae Macrophyllae Radix Water Extract Inhibits RANKL-Induced Osteoclastogenesis and Osteoclast Specific Genes. Korean Journal fo Acupuncture. 2020;37(2):63-75.
[https://doi.org/10.14406/acu.2020.002]

-
Yun GW, Lee H. Effect of Cheongawongagam Extract on the Ovariectomized Rat Model of Osteoporosis. J Physiol & Pathol Korean Med. 2020;34(1):14-23.
[https://doi.org/10.15188/kjopp.2020.02.34.1.14]

- Herbology Editorial Committee of Korean Medicine schools. Boncho-hak. Seoul : Publication Younglimsa. 2004.
- The Korean Orthopaedic Association. Orthopaedics. The 7th Edition. Seoul:Choi Shin. 2013:251-68.
- Korean Society for Bone and Mineral Research. Osteoporosis and Osteoporotic Fracture Fact Sheet 2019, 1st ed. Seoul: Korean Society for Bone and Mineral Research, 2019; 5-6.
-
Jeong JH, Shin JY. Treatment Patterns of Osteoporosis and Factors Affecting the Prescribing of Bone-forming Agents: From a National Health Insurance Calims Database. Korean J Clin Pharm. 2021;31(1):27-34.
[https://doi.org/10.24304/kjcp.2021.31.1.27]