유방암세포에서 LATS1/2 활성에 의한 당귀 추출물의 항암효과
Ⓒ The Society of Pathology in Korean Medicine, The Physiological Society of Korean Medicine
Abstract
The Hippo-YAP signaling pathway is critical for cell proliferation, survival, and self-renewal in both Drosophila and mammals. Disorder of Hippo-YAP pathway leads to tumor development, progression and poor prognosis in various cancers. YAP/TAZ are the key downstream effectors of the Hippo pathway and they can be inhibited through LATS1/2, core kinases in the Hippo pathway, mediated phosphorylation. In this study, we investigated the effect of Angelica gigas Nakai extract (AGNE) on Hippo-YAP/TAZ pathway. First, ANGE induced YAP/TAZ phosphorylation and dissociation of the YAP/TAZ-TEAD transcription complex. By qRT-PCR, we found that ANGE inhibits the expression of YAP/TAZ-TEAD target gene, CTGF and CYR61. In addition, the transcriptional activity of YAP/TAZ was not suppressed significantly in LATS1/2 double-knockout (DKO) cells by ANGE compared to LATS1/2 wild-type (WT) cells, which means AGNE inhibits YAP/TAZ signaling through direct action on LATS1/2. Further, it was confirmed that AGNE-induced activation of LATS1/2 inhibited the migration potential of the vector-expressing cells by suppressing YAP/TAZ activity. The reduced migration potential was restored in active YAP-TEAD expressing cells. Taken together, the results of this study indicate that ANGE downregulates YAP/TAZ signaling in cells through the activation of LATS1/2.
Keywords:
Angelica gigas, YAP, LATS1/2, Hippo Pathway, Cancer서 론
Hippo Pathway은 처음 초파리의 세포 분열과 세포사멸에 중요한 역할을 하고 있는 종양 억제 신호경로 중에 하나로 밝혀졌으며 이를 구성하고 있는 초파리의 유전자들은 인간의 유전자와 70%정도 유사성을 지니며 진화적으로 잘 보전되어 있다1,2). Hippo pathway는 세포주기를 정지시키고 세포사멸을 통제함으로써 세포의 성장과 증식, 분화, 상처 재생 그리고 종양의 성장을 조절한다3-5). 초파리의 Hippo pathway 구성요소로 핵심인산화 효소인 Hippo (Hpo)와 Warts (Wts)가 있으며, 이 단백질들의 활성을 유도하는 결합단백질인 Salvador (Sav)과 Mob as tumor suppressor (Mats) 가 존재한다. 이들은 세포막으로부터 핵까지 신호전달경로를 통해 네트워크를 이루고 있다. 하위전사보조인자인 Yorkie (Yki)와 전사인자인 Scalloped (Sd)등은 상위의 Hippo signaling에 의하여 인산화됨으로써 활성이 조절된다6-9).
포유류에서 Hpo와 Sav의 상동체인 mammalian STE20-like protein kinase1 (MST1)와 Sav의 결합으로 자가인산화가 유도되며, Wts의 상동체인 Large tumor suppressor1/2 (Lats1/2)를 인산화시킨다10). 또한 Lats1/2와 MOB kinase activator1A/B (MOB1) 복합체는 Yki의 상동체인 Y-associated protein (YAP)과 WW Domain-containing Transcription Factor (TAZ)를 인산화 시킴으로써 세포질에 머물게 한다. 인산화된 YAP과 TAZ은 14-3-3 protein과 복합체를 형성한 뒤 세포질에서 분해되며, 핵 내의 전사인자인 TEAD family와의 결합이 저해되어 전사활성을 돕지 못하게 된다. 하지만 Hippo pathway가 억제되면 YAP과 TAZ는 활성화되어 핵 내로 이동하게 되며 Sd와 상동체인 TEA domain family members (TEADs) 뿐만 아니라 다양한 전사인자들과 복합체를 이루고 다양한 유전자 발현을 일으켜 세포의 성장을 촉진하고 세포 사멸을 억제한다9,11).
Hippo pathway의 조절에 문제가 생기거나 과도하게 YAP/TAZ의 활성이 증가될 경우 다양한 질병을 초래하며 그 중에서도 암의 발달과 진행에 핵심 조절인자로 밝혀졌다12,13). Hippo pathway를 조절하는 약물 또는 조절인자를 발굴하고자 많은 연구들이 진행되고 있으며, 이들의 상관관계를 이해함으로써 Hippo pathway 활성 조절을 통한 항암치료의 새로운 치료전략으로서 가능성을 제시할 수 있을 것이다.
참당귀 (Angelica gigas Nakai; AGN) 추출물은 다양한 coumarin 유도체, 페놀성 화합물 및 flavonoids 함유하고 있으며 14-17), 혈액 순환을 개선하고 혈압을 낮추며 항산화, 항염증 뿐만 아니라 다양한 암세포에 항암효능이 있는 것으로 보고되고 있다18-24).
본 연구에서는 이러한 효능이 보고된 AGN Extract (AGNE)가 Hippo-YAP pathway에 어떠한 영향을 미치는지 연구하였고, AGNE가 Lats1/2를 활성화시킴으로써 YAP 활성을 감소시키는 것을 확인하여 보고하는 바이다.
재료 및 방법
1. 세포 배양 및 생존율 측정
본 실험에 사용한 인간배아신장 (HEK) 세포인 HEK293A, HEK293T, MST1/2 DKO HEK293A, LATS1/2 DKO HEK293A 세포주들은 DMEM에 10% FBS, 50 units의 penicillin과 50 ㎍/㎖의 streptomycin를 첨가하여 배양하였고, 인간유방암 MDA-MB-231 세포는 RPMI에 10% FBS, 50 units의 penicillin과 50 ㎍/㎖의 streptomycin를 첨가하여 배양하였다. 모든 세포는 37℃, 5% CO2 조건의 습윤 incubator에서 배양하였다. 세포 생존율 측정은 EZ-Cytox를 이용하여 제조사의 프로토콜을 따라 450 ㎚에서 측정하였다. 실험 과정을 간단히 기술하자면 blank는 DMEM 200 ㎕와 EZ-Cytox 10 ㎕를 섞어 사용하였다. 세포는 96 well plate에 1 X 106 cells/plate 세포의 수로 분주하고 다양한 농도의 AGNE를 처리하여 12시간 동안 CO2 incubator에서 반응시킨 후 microplate leader기로 450 ㎚ 흡광도에서 측정함으로써 세포 생존율을 관찰하였다.
2. Angelica 추출물 제조
참당귀 (Angelica gigas Nakai)는 국립원예특작과학원(NIHHS)으로부터 제공받았다. 동결건조된Angelica gigas 10 ㎎을 1 ㎖의 에탄올에 현탁 한 후 0.45 ㎛ syringe filter로 여과하여 -20℃에 보관하면서 실험에 사용하였다.
3. 시약 및 항체
일차 항체인 Anti-YAP (14074), YAP/TAZ (8414), phospho-YAP (4911), LATS1 (3477), LATS2 (5888), MST2 (3952)은 Cell Signaling Technology, Inc. (Beverly, MA, USA)에서 구입하였다. Anti-TEF-1 (No. 610922)와 anti-MST1 (No. 611052)는 BD Transduction Laboratories (Lexington, KY, USA)에서 구입하였다. Anti-Vinculin (V9131)은 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하였다. Immunoprecipitation의 control에 사용한 normal rabbit IgG는 Santa Cruz Biotechnology, Inc. (Santa Cruz, CA, USA)에서 구입하였다. 이차 항체인 rabbit IgG HRP (NA934)와 mouse IgG HRP(NA931)는 GE Healthcare에서 구입하였다.
4. High performance liquid chromatography (HPLC) 분석
High performance liquid chromatography (HPLC) 기기는 Agilent1260 Infinity II with a A ZORBAX Eclipase Plus C18 (4.6 x 250 ㎜, 5 ㎛, 95 Å, Agilent, USA) (Agilent Technologies, Inc., Santa Clara, CA, USA) 칼럼을 사용하였다. 분석에 사용된 이동상으로 용매A (0.1% phosphoric acid)와 용매B (acetonitrile)을 사용하여 0.8 ㎖/min의 유속으로 시료 10 ㎕를 주입하여 분석하였으며, 분리하는 동안 칼럼 온도는 35℃로 유지되었고 용출액의 광학 밀도를 330 ㎚에서 관찰하였다.
5. Western blot
AGNE에 의한 YAP의 인산화 발현 정도를 관찰하기 위하여 6 well plate에 HEK293A cell을 8 x 106 cells/plate의 개수로 분주하였다. CO2 조건의 습윤 incubator에 12시간 배양한 후 AG 50 ㎍/㎖와 100 ㎍/㎖을 12시간 처리하고 단백질은 1X Protein sample buffer (40% glycerol, 8% SDS, 20% β-mercaptoethanol, 0.2 M Tris pH 6.8, 0.04% bromophenol blue)를 이용하여 분리시킨 뒤 100℃에서 5분간 변성 시켰다. 이후 단백질을 15 ㎕ loading 하여 SDS-PAGE한 다음 gel을 PVDF membrane에 transfer시킨 후 5% skim milk로 1시간 동안 blocking 하였다. 후에 primary antibody와 함께 4℃ rocker에서 overnight하여 반응시켰다. 다음날 TBS-T로 3회 세척 한 후 HRP가 결합된 secondary antibodies와 상온에서 1시간 반응을 시키고, TBS-T로 3회 세척 한 후 ECL solution을 이용하여 band를 확인하였다.
6. Immunoprecipitation (IP)
HEK293A 세포를 90 ㎜ culture dish에 8 X 105 cells/plate의 개수로 분주하여 실험을 진행하였다. 다음날, 배지에 50 ㎍/㎖의 AGNE를 6시간 처리하고 mild lysis buffer (10 mM Tris pH 7.5, 2 mM EDTA, 100 mM NaCl, 1% NP-40, 50 mM NaF, 1 mM NaVO4, protease inhibitor)를 이용하여 lysis하였다. Lysis된 세포들을 4℃에서 13,000 rpm으로 원심분리한 후에 상층액만 normal IgG (sc-2027) 항체와 anti-YAP/TAZ (8418S) (Beverly, MA, USA) 항체를 넣어 2시간 동안 4℃에서 incubation시킨 후 magnetic bead를 넣어 1시간 동안 4℃에서 incubation하고 샘플들을 mild lysis buffer로 3회 세척 하였다. 다음으로 sample buffer를 넣고 100℃ heat block에서 5분간 변성시키고 western blot을 통해 band를 분석하였다.
7. Luciferase reporter assay
12 well plate에 HEK293A 세포를 1 X 106 cells/plate로 분주하여 실험을 진행하였다. 12시간 incubation 후, Gal4-TEAD4, 5 x upstream activation sequence (UAS)-luciferase reporter, Renilla, Flag-YAP2를 과발현하였다. 6시간 incubation 후, 배지를 바꾸고 AGNE를 농도별 (50 ㎍/㎖, 100 ㎍/㎖)로 배지에 처리하여 12시간 incubation하고 well당 150 ㎕의 chemiluminescent lysis buffer (1.7%의 1 M KH2PO4, 18.3%의 1 M K2HPO4, 1 mM dithiothreitol (DTT), 1 mM phenylmethyl sulfonyl fluoride (PMSF))를 혼합하여 세포를 lysis하였다. Luciferase activity는 Dual-Glo luciferase assay system (E2940)을 Promega (Madison, WI, USA)로부터 구입하여 제조사의 프로토콜을 따라 측정하였다.
8. RNA 분리 및 real-time quantitative polymerase chain reaction (qRT-PCR)
Total RNA는 RNeasy Mini Kit (Quiagen, Germantown, MD, USA)를 이용하여 제조사의 방법에 따라 추출하였다. RNA의 농도는 NanoDrop 분광광도계를 이용하여 측정한 후, cDNA는 reverse transcriptase (Promega, Madison, WI, USA), random hexamers (Takara Bio Inc, Shiga, Japan)과 합성에 필요한 시약을 포함하여 total RNA의 1 ㎍의 양을 계산하여 cDNA를 합성하였고, specific primer를 이용하여 real time PCR 방법을 통하여 cDNA를 증폭하였다. Real time PCR은 SYBR Green PCR master mix (KAPA Biosystem, Woburn, MA, USA)를 이용하여 제조사의 프로토콜을 따라 실험을 진행하였다. PCR에 사용된 primer는 다음과 같다.
HPRT, 5’-AGAATGTCTTGATTGTGGAAGA/ACCTTGACCATCTTTGGATTA-3’;
CTGF, 5’-CCAATGACAACGCCTCCTG/TGGTGCAGCCAGAAAGCTC-3’;
CYR61, 5’-AGCCTCGCATCCTATACAACC/TTCTTTCACAAGGCGGCACTC-3’.
9. SRB (Sulforhodamine B) assay
96 well plate에 3 X 103 cells/well을 분주하고 24시간을 incubation하였다. 다음날, 농도별로 AGNE를 처리하고 반응시켜 day1과 day5를 SRB assay를 통해 흡광도를 측정함으로써 세포 증식을 관찰하였다. 실험 방법을 간략히 기술하면 다음과 같다. 세포가 분주된 plate에 세포를 고정하기 위하여 100 ㎕의 10% TCA solution (T0699)을 분주하고 1시간 동안 차광하여 4℃에서 incubation을 시킨다. Fixation이 끝나면 distilled water로 3-5번 세척을 반복한다. 이 후 0.4% SRB solution (230162)을 80 ㎕ 분주하고 30분 동안 차광하여 RT에서 incubation시키고 0.1% acetic acid (695092)로 3-5번 세척한다. 세척 한 뒤 1시간 동안 말린 후 150 ㎕의 Tris base solution (77-86-1)을 넣어 inverting하면서 1시간 반응시킨다. 반응이 끝나면 microplate leader기로 450 ㎚에서 흡광도를 측정한다. 모든 시약은 Sigma-Aldrich (St. Louis, MO, USA)으로부터 구매하였다.
10. Retrovirus infection과 stable cell line 제작
HEK293T 세포를 사용하여 retrovirus를 만든 후에 5 ㎍/㎖의 polybrene (Millipore Co., Beillelica, MA, USA)를 이용하여 MDA-MB-231 세포 stable cell line을 제작하였다25). 후에, 2 ㎎/㎖의 G418을 이용하여 저항성 있는 세포만을 선별하였다.
11. Wound healing assay
6 well plate에 MDA-MB-231 세포를 1 X106 cells/plate로 분주하고 배양하여 세포가 약 80% 정도 찼을 때 Scar™scratcher (SPL, South Korea)를 이용하여 wound를 만들고 debris를 제거하기 위해 PBS로 plate를 세척 해주었다. 이 후 배지에 10 ㎍/㎖의 AGNE를 처리하여 8시간마다 세포의 이동능력을 phase contrast microscope (OLYMPUS 1X71 DP controller, Tokyo, Japan)를 이용하여 촬영하였으며, 사진 이미지 프로세서 소프트웨어인 ImageJ로 분석하여 이동거리를 측정하였다.
결 과
1. HPLC 분석
HPLC-UV 분석을 통해 AGNE 추출물의 신규 구성 성분을 알아보기 위해 HPLC를 사용하였다. AGNE을 ethanol과 distilled water에 각각 환류한 추출물의 분석 결과, ethanol에 환류한 AGNE 추출물에서 Decursin이 retention time 38.623분에 검출이 되었고, 또한 AGNE ethanol 추출물에서 Decursin이 28.05 ㎎/g을 차지하는 것을 확인하였다. 이 후 실험은 DW에 비해 값이 높은 AGNE ethanol 추출물을 사용하였다(Fig. 1A). 다음은 Decursin의 화학 구조를 나타내고 있다(Fig. 1B).
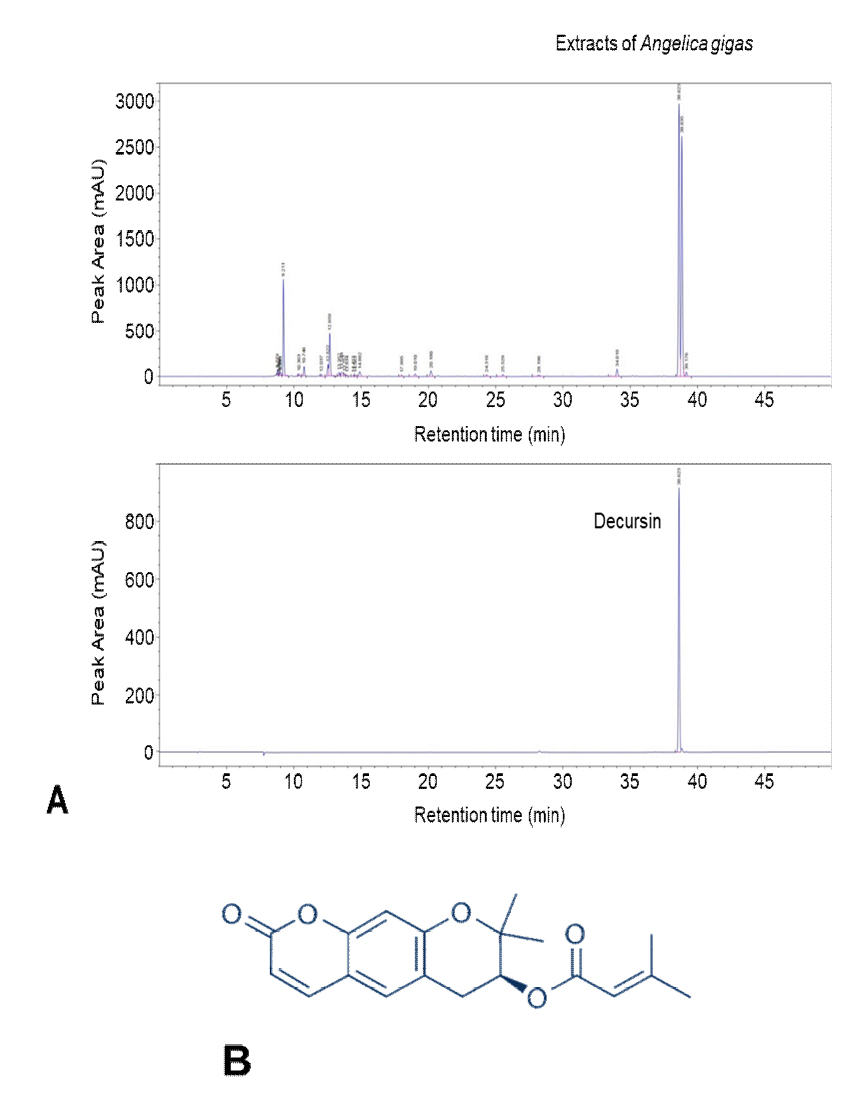
Flavonoid profiles and toxicity activity in leaves of Angelica gigas Nakai. (A) Comparative high-performance liquid ultraviolet (HPLC-UV) chromatograms of Angelica gigas ethanol extracts and Decursin in the standard solution. Decursin was detected ranging from 38 to 40 min. AGNE contained 28.05 ㎎/g of Decursin. (B) The chemical structure of Decursin isolated form ANGE.
2. AGNE가 YAP 활성에 미치는 영향
AGNE가 세포 생존율에 어떤 영향을 미치는지 살펴보고자 EZ-Cytox를 이용하여 세포 생존율을 조사하였다. 그 결과, 세포 생존율이 100 ㎍/㎖에서 미약하게 감소하는 것을 확인하였다(Fig. 2A). Hippo signaling pathway가 활성화되면 상위 조절인자들인 MST1/2와 LATS1/2 kinases 또한 활성화가 되면서 YAP을 인산화시킨다. LATS1/2에 의해 YAP이 인산화가 될 경우 YAP은 불활성화 상태가 되어 TEAD 전사인자와 상호작용하지 못하고 세포질에 남아 14-3-3 단백질과 결합되거나 유비퀴틴화되어 프로테아좀 분해가 된다. AGNE가 Hippo signaling pathway의 중요한 전사보조인자인 YAP의 인산화에 어떠한 영향을 미치는지 확인하기 위해 AGNE 50 ㎍/㎖과 100 ㎍/㎖을 시간 별로 처리한 후 phos-tag gel assay와 phospho-YAP(S127)에 대한 western blot을 시행하였다. 조사 결과 시간 별로 AGNE를 처리하였을 경우 YAP의 인산화가 눈에 띄게 시간 의존적으로 증가하였다(Fig 2B). YAP은 전사인자로 알려진 TEAD와 복합체를 형성함으로써 표적유전자의 발현을 유도하게 되는데 AGNE가 YAP과 TEAD의 상호작용에 미치는 영향을 조사하기 위해 immunoprecipitation (IP)실험을 수행한 결과, AGNE가 YAP과 TEAD의 복합체 형성을 저해하는 것을 확인하였다(Fig. 2C). 또한 YAP과 결합하여 이들의 oncogenic 효능을 유도하는 것으로 잘 알려진 TEAD의 전사 활성을 측정하고자 luciferase assay를 진행하였고 AGNE 50 ㎍/㎖가 100 ㎍/㎖을 12시간 처리한 결과, TEAD의 전사 활성이 두드러지게 감소하는 것을 확인하였다(Fig. 2D).
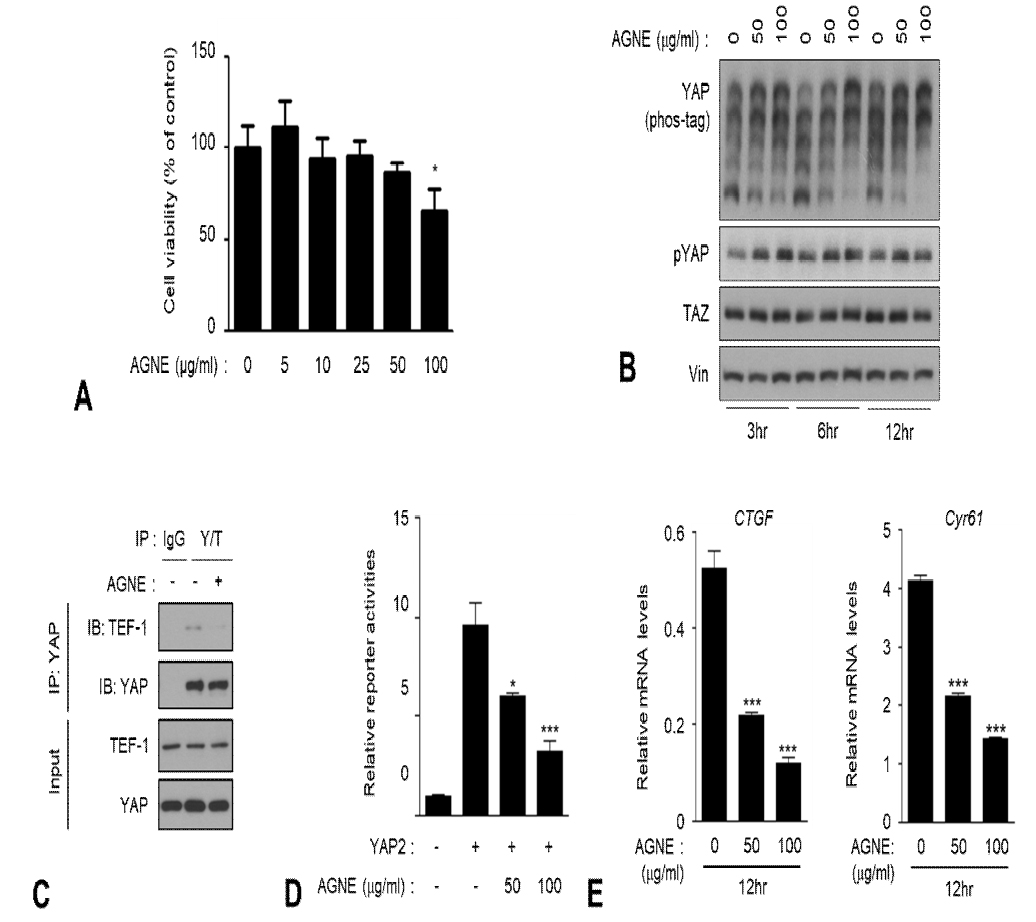
AGNE inhibits YAP activity via phosphorylation and inhibits its transcriptional activity. (A) We treated the indicated amount of AGNE to HEK293A cells for 24 h. Cell viability was measured by EZ-Cytox kit according to the protocol of the manufacturer. Cell viability was significantly decreased in the AGNE treated cells at concentrations higher than 50 ㎍/㎖. (B) AGNE increased YAP phosphorylation. HEK293A cells were treated with various natural compounds (50 ㎕/㎖) for 6 h. Dimethyl sulfoxide (DMSO) was used as a control treatment. Phosphorylated YAP proteins were detected using a phos-tag gel. Vinculin used as a loading control. (C) AGNE disrupts YAP-TEAD interaction. HEK293A cells were treated with AGNE (50 ㎍/㎖) for 6 h. Endogenous YAP/TAZ was immunoprecipitated, and the co-precipitated TEAD1 was detected by western blot. (D) AGNE reduces YAP mediated TEAD-luciferase reporter activity. HEK293A cells were co-transfected with 5 X UAS-luciferase reporter, Gal4-TEAD4, Renilla, and with or without Flag-YAP2. HEK293A cells were treated with AGNE as indicated concentrations (50 and 100 ㎍/㎖). one-way analysis of variance (ANOVA) were performed to calculate a p-value using GraphPad software (La Jolla, CA, USA) and considered at *P < 0.05, **P < 0.01, and ***P < 0.001. (E) AGNE decreases mRNA level of YAP target genes (CTGF, CYR61). HEK293A cells were treated with indicated concentrations (50 ㎍/㎖ and 100 ㎍/㎖) of AGNE for 12 h before harvesting. mRNA levels of CTGF and CYR61 were determined using qRT-PCR (error bars represent ± SD from n=3 per group). *p < 0.05, **p < 0.01, and ***p < 0.001; One way ANOVA.
YAP이 탈인산화가 될 경우 핵 내로 유리되어 세포 증식과 관련된 주요한 전사인자인 TEAD가 서로 상호작용하게 되고 YAP target gene의 발현이 증가한다. 하지만 억제작용을 하는 AGNE는 YAP dependent gene인 connective tissue growth factor (CTGF)와 cysteine-rich angiogenic inducer 61 (CYR61)의 mRNA level을 감소시켰다(Fig. 2E).
따라서 AGNE가 YAP을 인산화시키고 YAP-TEAD 상호작용을 방해하며 YAP 활성을 억제시켜 YAP target gene인 CTGF와 CYR61의 mRNA level 감소를 유도하였다.
3. Hippo core kinase에 미치는 영향
YAP의 인산화에 가장 결정적인 역할을 하는 것은 Hippo signaling pathway의 상류에 존재하는 MST1/2와 LATS1/2 kinase이다. 본 연구에서는 AGNE가 core kinase인 MST1/2와 LATS1/2에 어떤 영향을 미치는지 살펴보고자 wild type (WT)과 MST1/2 double-knockout (DKO)세포에 AGNE를 12시간 처리하여 YAP dependent gene의 mRNA level을 조사하였고 그 결과 MST1/2 WT과 DKO 세포에서 모두 CTGF와 CYR61의 mRNA level이 감소함을 관찰하였다(Fig. 3A). 반면 LATS1/2 DKO 세포에서는 WT 세포에 비해 이들 유전자의 mRNA level을 감소시키지 않았으며, 두 세포를 비교하였을 경우 발현양의 차이가 유의성 있게 두드러졌다(Fig. 3B). 이 결과를 통해 AGNE가 Hippo signaling pathway에 중요한 kinase인 LATS1/2에 의존적으로 작용한다는 것을 시사한다.
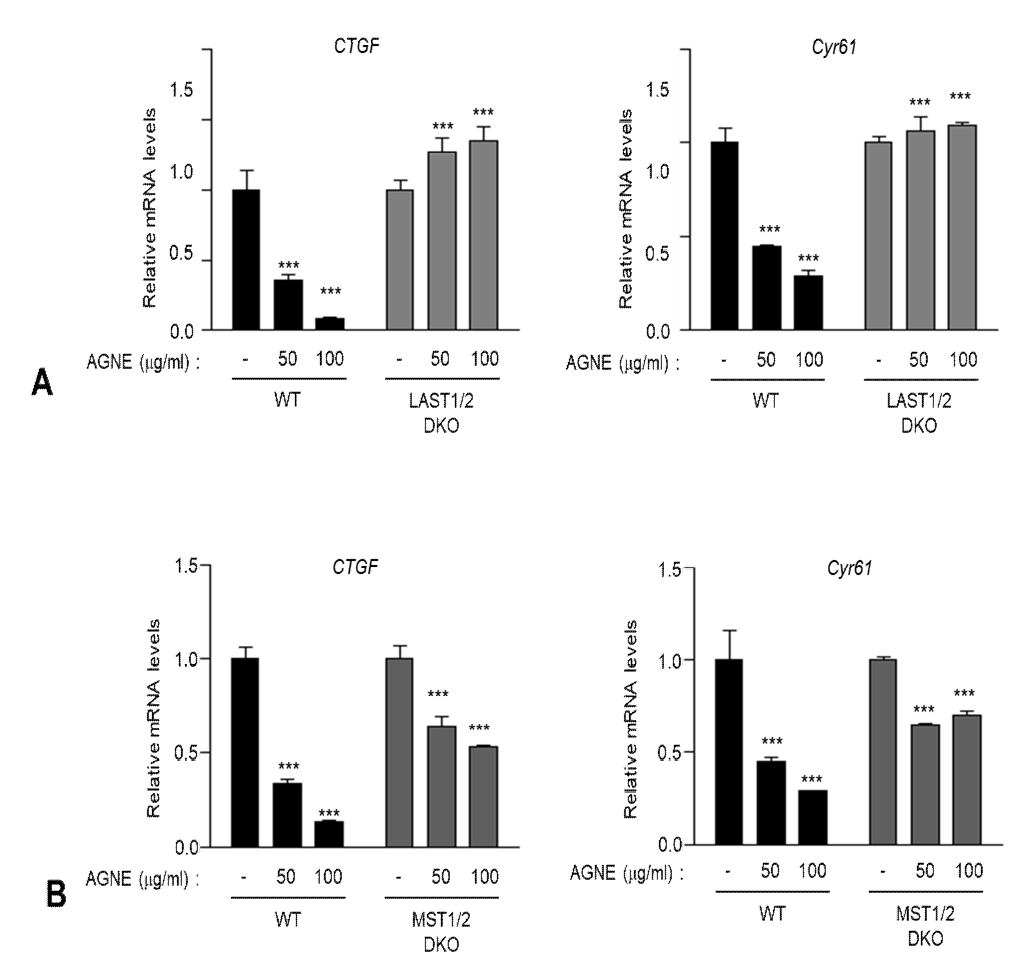
AGNE suppressed YAP target genes in a LATS1/2-dependent manner. (A) LATS1/2 Wild type (WT) and double-knockout (DKO) HEK293A cells were treated with AGNE for 12 h, and then mRNA levels of CTGF and CYR61 were measured using qRT-PCR. (B) MST1/2 Wild type (WT) and double-knockout (DKO) HEK293A cells were treated with AGNE. After 12 h, mRNA levels of CTGF and CYR61 were measured using qRT-PCR (error bars represent ± SD from n=3 per group). *p < 0.05, **p < 0.01, and ***p < 0.001; one-tailed t-test.
4. 유방암 세포에서 AGNE에 의한 세포증식 및 이동 능력 확인
Hippo signaling pathway가 억제되면 YAP이 활성화되어 TEAD 전사인자와 결합함으로써 세포 성장 및 증식, 종양의 성장 조절에 관여하게 되는데 AGNE가 유방암 세포주인 MDA-MB-231 세포주에서 증식을 억제시키는지 조사하였다. 그 결과, AGNE의 농도가 높아질수록 MDA-MB-231 세포주에서 세포 증식이 억제되는 것을 관찰하였다(Fig. 4A). 다음으로 virus infection을 통해 YAP-TEAD fusion 단백질을 안정적으로 발현시키는 MDA-MB-231 세포주를 만들어 western blot으로 발현을 확인하였고 qRT-PCR 분석으로 활성화 YAP-TEAD를 발현하는 세포주에서 YAP-TEAD의 표적유전자의 mRNA가 증가함을 확인하였다(Fig. 4B). 이로써 stable 세포주가 구축됨을 의미한다. 구축한 stable 세포주에 AGNE 50 ㎍/㎖을 처리함에 따라 vector control 세포주에서 YAP dependent gene (CTGF, Cyr61)의 mRNA level이 현저하게 감소하였고 반면에 YAP constitutive active form의 세포주에서는 mRNA level이 덜 감소되었다(Fig. 4B). Wound healing assay를 통하여 AGNE이 유방암 세포주에서 세포 증식 억제에 미치는 영향을 확인하고자 실험을 진행하였다. Vector control 세포주와 YAP constitutive active form인 stable 세포주를 24시간 배양한 6 well plate에 scratcher를 이용하여 scratch를 낸 후 AGNE를 10 ㎍/㎖ 처리 후 8시간, 18시간, 24시간 후 wound area를 측정하였다. 그 결과 control vector 세포에 AGNE를 처리한 결과 wound area의 회복이 느린 반면, constitutive active 세포에서는 AGNE의 처리가 wound area의 회복을 억제시키지 못하였음을 확인하였다(Fig. 4D). 따라서 본 실험에서 수행한 연구 결과를 통하여 AGNE가 MDA-MB-231 유방암 세포주의 세포 이동을 억제하고 있음을 확인하였다.
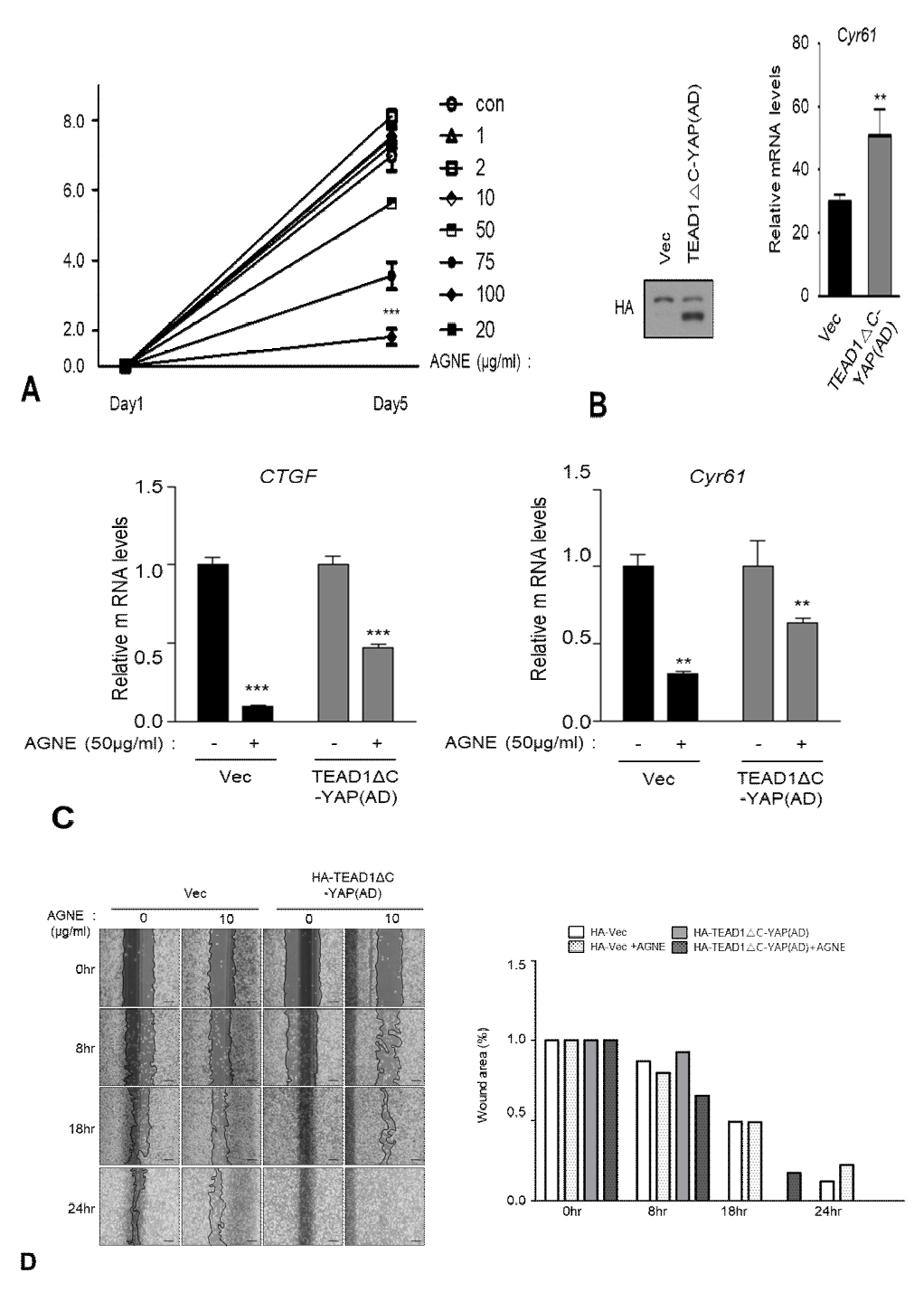
Constitutively active YAP-TEAD rescues AGNE-induced inhibition of cancer cell growth. (A) MDA-MB-231 cells were treated as indicated concentrations-dependent manner. Cell proliferation was measured by SRB assay. Cell proliferation was significantly decreased by AGNE treatment. (B) TEAD1ΔC-YAP(AD), a fusion of the TEAD DNA-binding domain with the YAP transactivation domain, was stably expressed in MDA-MB-231 cells. Expression of HA-pPGS (vector control) and HA-TEAD1ΔC-YAP(AD) was confirmed using western blot, and the mRNA level of Cyr61 was confirmed using qRT-PCR. (C) AGNE was treated 50 ㎍/㎖ 12 h each of stable cell lines. (error bars represent ± SD from n=3 per group). (D) The cell motility of MDA-MB-231 cells expressed with pPGS-HA (vector control) or TEAD1ΔC-YAP(AD) were treated with AGNE at 10 ㎍/㎖. Inhibition of YAP activity by AGNE reduces wound healing of MDA-MB-231 cells.
고 찰
여러 유형의 암에서 Hippo-YAP pathway의 중요성이 부각되면서 현재의 암 치료 연구는 Hippo-YAP 신호 전달 경로의 조절에 초점을 맞추고 있다13,26). Hippo pathway는 핵심 인산화 효소인 MST1/2와 LATS1/2와 oncoprotein 역할을 하는 YAP, TAZ 등 많은 단백질로 구성되어 있으며, 이미 많은 연구들을 통해 Hippo pathway가 세포의 성장, 증식, 분화 및 사멸를 조절하는 중요한 신호전달기전이라는 것이 밝혀졌다10,26). 다양한 암에서 YAP/TAZ의 과도한 활성화 및 발현 변화도 보고되고 있으며 YAP/TAZ로 인한 전사활성은 종양의 형성과 전이 및 항암제 내성획득에 중요한 역할을 하는 것으로 보인다4,13). 또한 YAP/TAZ를 과발현시키면 줄기세포의 특성을 유도하며, 종양의 cancer-stem-cell fraction에서 활성화되어 있다27-29). 따라서 최근 주목받고 있는 Hippo pathway를 활성화시킴으로 YAP/TAZ의 활성을 조절하는 약물은 항암제로서의 효과를 기대할 수 있을 것이다.
최근 임상 연구를 통해 천연 화합물의 약리학적 또는 생물학적 효과 및 의약 용도에 대한 이해가 향상됨에 따라 질병 치료제로서의 상당한 가능성이 높아지고 있다4). 참당귀의 주성분은 다양한 지용성의 coumarin과 수용성의 polysaccahride을 포함하고 있으며, coumarin의 주요 활성성분은 decursin과 decursinol angelate이다15,23,24). 이 외에도 휘발성 방향 성분인 nonane, α-pinene, camphene, 2-methyloctane, lomatin, 2-furanmethanol, seselin, guaiacol, butyrolactone 등이 함유되어 있다16,17). 이전의 연구들에 따르면 AGNE는 항염증, 항산화 효능 뿐만 아니라 항암효과가 보고된 AGNE를 포함한 다양한 천연물이 최근 암발생 억제 경로로 주목받고 있는 Hippo pathway에 미치는 영향을 알아보기 위해 본 연구진은 YAP의 인산화를 측정하는 phos-tag gel mobility shift assay 수행하였다. 그 결과 AGNE가 YAP의 인산화를 가장 우수하게 유도하였기에 다음의 실험들을 진행하였다.
먼저 AGNE이 세포생존율에 미치는 영향을 조사한 결과 100 μg/ml 이상의 농도에서 세포생존율이 감소하는 것을 확인하였다(Fig. 1). YAP의 인산화를 측정하는 phos-tag gel mobility shift assay을 활용하여 ANGE가 Hippo-YAP signaling을 조절하는 능력의 정도를 조사하기 위해 HEK293A에 AGNE를 처리한 후 YAP의 인산화를 확인한 결과 50 μg/ml과 100 μg/ml의 농도에서 YAP의 인산화가 증가되는 것을 확인하였다(Fig. 2B). AGNE에 의한 YAP의 인산화가 전사인자인 TEAD의 결합에 미치는 영향을 알아보기 위해 상호결합을 확인한 결과 AGNE를 처리함에 따라 YAP과 TEAD의 복합체 형성이 저해되었으며(Fig. 2C) 이러한 복합체 형성의 감소가 전사활성 및 표적유전자의 발현에 어떠한 영항을 미치는지 알아보기 위해 lucifease reporter assay (Fig. 2D)와 RT-qPCR (Fig. 2E) 수행하였다. 그 결과 AGNE에 의해 감소된 YAP에 의존적인 TEAD 전사활성은 YAP과 TEAD의 표적유전자인 CTGF와 Cyr61 의 mRNA을 감소시키는 것을 확인할 수 있었다.
다음으로 AGNE이 Hippo pathway의 핵심조절자인 MST1/2와 LATS1/2에 미치는 영향을 확인하고자 LATS1/2와 MST1/2이 knockout된 세포주에서 CTGF와 Cyr61 mRNA양을 확인하였다 (Fig. 3A and B). YAP 인산화를 직접 조절하는 LATS1/2를 발현하는 WT 세포에서는 AGNE에 의존적으로 YAP-TEAD 표적유전자의 발현이 감소되는 것을 확인할 수 있었다. 하지만 LATS1/2 KO 세포에서는 AGNE가 YAP-TEAD 표적유전자의 발현을 저해하지 못하였다 (Fig. 3A). 이는 AGNE이 YAP의 인산화 및 활성을 조절하는 능력이 LATS1/2 활성에 의존적인 경로를 따르고 있음을 시사한다. 다음으로 LATS1/2 상위 조절자인 MST1/2 WT 세포주와 KO 세포주를 사용하여 AGNE에 의한 YAP-TEAD 표적유전자 발현을 확인한 결과, MST1/2 WT과 KO 세포주에서 YAP-TEAD 표적유전자의 발현이 비슷하게 감소하였다 (Fig. 3B). 이러한 결과는 AGNE가 MST1/2 비의존적으로 YAP-TEAD 전사활성을 저해하고 표적유전자의 발현을 감소시키는 것을 보여주었다.
마지막으로 MDA-MB-231 유방암 세포주에서 AGNE는 YAP/TAZ dependent gene인 CTGF와 CYR61의 발현을 현저히 감소시킨 반면, LATS1/2에 영향을 받지 않는 YAP-TEAD fusion 단백질을 발현시킨 유방암 세포주에서는 CTGF와 CYR61의 발현 억제능력이 훨씬 미약했다 (Fig. 4C). 또한 같은 유방암세포주에서 AGNE의 처리는 wound area의 회복을 저해시킨 반며, constitutive active한 YAP-TEAD fusion 단백질을 발현시킨 유방암 세포주에서는 AGNE에 의한 wound area의 회복 저해 능력이 감소하였다 (Fig 4D). 이렇게 ANGE가 MDA-MB-231 세포의 이동을 억제하는 능력이 constitutively active한 YAP을 발현시켰을 경우 감소한 것은 ANGE가 YAP의 인산화와 불활성화를 유도하여 MDA-MB-231 세포의 증식과 이동을 억제하였음을 나타낸다.
세포의 증식과 암의 진행에 있어서 최근 주목받고 있는 세포 내 신호전달과정 중 하나가 Hippo-YAP signaling 경로이다. 본 연구에서는 AGNE가 YAP의 인산화를 잘 유도함으로써 유방암세포의 성장과 이동을 억제하는 능력이 있음을 확인하였다. AGNE는 YAP의 상위 신호전달 경로인 Hippo와 LATS1/2를 인산화시킴으로써 활성화시켰고 이어서 YAP/TAZ를 인산화시켰다. 이러한 결과에서 AGNE는 전형적인 Hippo signaling을 활성화시키는 효능이 있으며, 이를 통한 유방암세포의 성장과 이동을 억제함으로써, 유방암의 발달과 성장을 억제시킬 수 있는 잠재력이 있음을 확인하였다. Hippo-YAP 신호 전달 경로에 대한 AGNE의 효과가 명확해짐에 따라, AGNE를 사용하여 관련 동물 모델에서 유사한 억제 효과를 확인함과 아울러, 항암제 내성 세포에서 병용투여함으로써 전임상 연구를 수행해 나간다면 암의 진행을 억제하고, 약재내성을 극복할 수 있는 후보물질로 개발할 수 있을 것을 기대한다.
References
-
Dong J, Feldmann G, Huang J, Wu S, Zhang N, Comerford SA, et al. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell. 2007;130(6):1120-33.
[https://doi.org/10.1016/j.cell.2007.07.019]

-
Pan D. The hippo signaling pathway in development and cancer. Developmental cell. 2010;19(4):491-505.
[https://doi.org/10.1016/j.devcel.2010.09.011]

-
Harvey KF, Zhang X, Thomas DM. The Hippo pathway and human cancer. Nature reviews Cancer. 2013;13(4):246-57.
[https://doi.org/10.1038/nrc3458]

-
Johnson R, Halder G. The two faces of Hippo: targeting the Hippo pathway for regenerative medicine and cancer treatment. Nature reviews Drug discovery. 2014;13(1):63-79.
[https://doi.org/10.1038/nrd4161]

-
Mo JS, Park HW, Guan KL. The Hippo signaling pathway in stem cell biology and cancer. EMBO reports. 2014;15(6):642-56.
[https://doi.org/10.15252/embr.201438638]

-
Chan EH, Nousiainen M, Chalamalasetty RB, Schafer A, Nigg EA, Sillje HH. The Ste20-like kinase Mst2 activates the human large tumor suppressor kinase Lats1. Oncogene. 2005;24(12):2076-86.
[https://doi.org/10.1038/sj.onc.1208445]

-
Camargo FD, Gokhale S, Johnnidis JB, Fu D, Bell GW, Jaenisch R, et al. YAP1 increases organ size and expands undifferentiated progenitor cells. Current biology : CB. 2007;17(23):2054-60.
[https://doi.org/10.1016/j.cub.2007.10.039]

-
Hao Y, Chun A, Cheung K, Rashidi B, Yang X. Tumor suppressor LATS1 is a negative regulator of oncogene YAP. The Journal of biological chemistry. 2008;283(9):5496-509.
[https://doi.org/10.1074/jbc.M709037200]

-
Zhao B, Ye X, Yu J, Li L, Li W, Li S, et al. TEAD mediates YAP-dependent gene induction and growth control. Genes & development. 2008;22(14):1962-71.
[https://doi.org/10.1101/gad.1664408]

-
Yu FX, Guan KL. The Hippo pathway: regulators and regulations. Genes & development. 2013;27(4):355-71.
[https://doi.org/10.1101/gad.210773.112]

-
Piccolo S, Dupont S, Cordenonsi M. The biology of YAP/TAZ: hippo signaling and beyond. Physiological reviews. 2014;94(4):1287-312.
[https://doi.org/10.1152/physrev.00005.2014]

-
Hansen CG, Moroishi T, Guan KL. YAP and TAZ: a nexus for Hippo signaling and beyond. Trends in cell biology. 2015;25(9):499-513.
[https://doi.org/10.1016/j.tcb.2015.05.002]

-
Plouffe SW, Hong AW, Guan KL. Disease implications of the Hippo/YAP pathway. Trends in molecular medicine. 2015;21(4):212-22.
[https://doi.org/10.1016/j.molmed.2015.01.003]

-
Son SH, Park KK, Park SK, Kim YC, Kim YS, Lee SK, et al. Decursin and decursinol from Angelica gigas inhibit the lung metastasis of murine colon carcinoma. Phytotherapy research : PTR. 2011;25(7):959-64.
[https://doi.org/10.1002/ptr.3372]

- Wan YQ, Liu YX, Guo L, Wan XF. [Determination of trace elements in danggui blood-supplementing decoction by ICP-AES]. Guang pu xue yu guang pu fen xi = Guang pu. 2007;27(1):160-4.
-
Kim MR, Abd El-Aty AM, Choi JH, Lee KB, Shim JH. Identification of volatile components in Angelica species using supercritical-CO2 fluid extraction and solid phase microextraction coupled to gas chromatography-mass spectrometry. Biomedical chromatography : BMC. 2006;20(11):1267-73.
[https://doi.org/10.1002/bmc.696]

-
Kim MR, Abd El-Aty AM, Kim IS, Shim JH. Determination of volatile flavor components in danggui cultivars by solvent free injection and hydrodistillation followed by gas chromatographic-mass spectrometric analysis. Journal of chromatography A. 2006;1116(1-2):259-64.
[https://doi.org/10.1016/j.chroma.2006.03.060]

-
Heo BG, Chon SU, Park YJ, Bae JH, Park SM, Park YS, et al. Antiproliferative activity of Korean wild vegetables on different human tumor cell lines. Plant foods for human nutrition. 2009;64(4):257-63.
[https://doi.org/10.1007/s11130-009-0138-8]

-
Choi HS, Seo HS, Kim SR, Choi YK, Shin YC, Ko SG. Anti-inflammatory and anti-proliferative effect of herbal medicines (APR) in RAW264.7 cells. Molecular medicine reports. 2014;9(5):1569-74.
[https://doi.org/10.3892/mmr.2014.2033]

-
Jang JY, Kim J, Cai J, Kim Y, Shin K, Kim TS, et al. An ethanolic extract of Angelica gigas improves atherosclerosis by inhibiting vascular smooth muscle cell proliferation. Laboratory animal research. 2014;30(2):84-9.
[https://doi.org/10.5625/lar.2014.30.2.84]

-
Cho JH, Kwon JE, Cho Y, Kim I, Kang SC. Anti-Inflammatory Effect of Angelica gigas via Heme Oxygenase (HO)-1 Expression. Nutrients. 2015;7(6):4862-74.
[https://doi.org/10.3390/nu7064862]

-
Ku SK, Kim H, Kim JW, Kang KS, Lee HJ. Ameliorating effects of herbal formula hemomine on experimental subacute hemorrhagic anemia in rats. Journal of ethnopharmacology. 2017;198:205-13.
[https://doi.org/10.1016/j.jep.2017.01.010]

-
Kim JY, Yoon YD, Ahn JM, Kang JS, Park SK, Lee K, et al. Angelan isolated from Angelica gigas Nakai induces dendritic cell maturation through toll-like receptor 4. International immunopharmacology. 2007;7(1):78-87.
[https://doi.org/10.1016/j.intimp.2006.08.017]

- Yim D, Singh RP, Agarwal C, Lee S, Chi H, Agarwal R. A novel anticancer agent, decursin, induces G1 arrest and apoptosis in human prostate carcinoma cells. Cancer research. 2005;65(3):1035-44.
-
Mo JS, Meng Z, Kim YC, Park HW, Hansen CG, Kim S, et al. Cellular energy stress induces AMPK-mediated regulation of YAP and the Hippo pathway. Nature cell biology. 2015;17(4):500-10.
[https://doi.org/10.1038/ncb3111]

-
Mo JS. The role of extracellular biophysical cues in modulating the Hippo-YAP pathway. BMB reports. 2017;50(2):71-8.
[https://doi.org/10.5483/BMBRep.2017.50.2.199]

-
Cordenonsi M, Zanconato F, Azzolin L, Forcato M, Rosato A, Frasson C, et al. The Hippo transducer TAZ confers cancer stem cell-related traits on breast cancer cells. Cell. 2011;147(4):759-72.
[https://doi.org/10.1016/j.cell.2011.09.048]

-
Xin M, Kim Y, Sutherland LB, Murakami M, Qi X, McAnally J, et al. Hippo pathway effector Yap promotes cardiac regeneration. Proceedings of the National Academy of Sciences of the United States of America. 2013;110(34):13839-44.
[https://doi.org/10.1073/pnas.1313192110]

-
Bartucci M, Dattilo R, Moriconi C, Pagliuca A, Mottolese M, Federici G, et al. TAZ is required for metastatic activity and chemoresistance of breast cancer stem cells. Oncogene. 2015;34(6):681-90.
[https://doi.org/10.1038/onc.2014.5]